INTRODUCCIÓN
La criptococosis es una enfermedad producida por levaduras encapsuladas que afecta a los humanos y a los animales 1 y se adquiere por la inhalación de los propágulos infectantes de las especies de Cryptococcus sp, principalmente C. neoformans y con menor frecuencia C. gattii2,3. De manera excepcional, también hay reportes de transmisión iatrogénica 4, zoonótica 5 y traumática 6. En la actualidad estos dos agentes etiológicos se distinguen por sus características fenotípicas y genotípicas 7: En el estudio de LCR es necesario solicitar el cultivo para tipificar el criptococo con el color azul cobalto en agar azul de bromotimol de canavanina glicina (CGB), además de la clasificación fenotípica . El C. gattii asimila la glicina, pero es resistente a la canavanina y cambia el color del medio debido a una alteración del pH cuando la creatinina se degrada en amonio 8. El C. neoformans afecta en especial a los pacientes inmunosuprimidos, mientras que el C. gattii lo hace más con los inmunocompetentes 9. La habilidad del C. gattii de desarrollar la enfermedad en los individuos con sistemas inmunes completamente funcionales parece venir de su capacidad para una rápida replicación en los fagocitos, antes que la respuesta inmune adaptativa pueda ser activada 10.
El C. neoformans tiene una distribución global y el C. gattii se encuentra en áreas tropicales o subtropicales, pero la emergencia de brotes por cepas virulentas en áreas templadas de Norteamérica y norte de Europa sugiere una distribución global 9,10. Este hongo se encuentra en forma abundante en la excreta de aves, en especial en los excrementos de las palomas salvajes, que puede ser la principal fuente de infección de las áreas urbanas densamente pobladas. Además, el C. neoformans y el C. gattii también pueden sobrevivir y replicarse en las amebas de vida libres y en los gusanos del suelo 10.
La infección inicial se localiza en el pulmón y a partir de allí se disemina a otros órganos, con una especial preferencia por el cerebro 11. La infección ocurre ya sea por diseminación primaria, o por reactivación de una infección latente 3.
En personas con compromiso pulmonar primario, la infección suele ser asintomática o mínimamente sintomática, pero se puede establecer una infección latente con levaduras viables por varios años dentro de los fagolisosomas 12. La respuesta inmune a la infección por criptococo involucra principalmente a células T ayudadoras y citoquinas, el factor de necrosis tumoral (FNT), el interferon gamma y la interleucina 2, y produce una inflamación granulomatosa 13. Las infecciones del sistema nervioso central (SNC) por Cryptococcus sp se presentan como meningoencefalitis 3; muy rara vez se manifiestan como lesiones granulomatosas llamadas criptococosis 11.
EPIDEMIOLOGÍA
Antes de la pandemia de VIH/SIDA, la criptococosis se consideraba una infección poco frecuente, pero en la década de 1970 esta micosis ya era reconocida por estar asociada con pacientes con neoplasias, trasplante de órganos, con algunos tratamientos inmunosupresores o con otras condiciones de inmunosupresión 12.
La criptococosis es una de las causas más comunes de meningitis, aún más frecuente que Streptococcus pneumoniae o Neisseria meningitidis14. En una serie de casos entre el 2015 y el 2016, en 29 pacientes adultos con sospecha de meningitis en el hospital El Tunal (Bogotá) 15, a 17 de ellos se les hizo el diagnóstico de meningitis, de los cuales 12 tuvieron criptococosis meníngea, lo que representó el 70,5 % de los casos atendidos en un año 6.
En el mundo, la criptococosis meníngea (CM) es muy frecuente y afecta en especial a los pacientes infectados por VIH con conteos bajos de CD4, así como a individuos sometidos a terapia inmunosupresora 16. Se estima que cada año se diagnostican en el mundo un millón de casos de CM, que es la responsable de más de 600 000 muertes 17. El África subsahariana tiene la mayor carga, con un estimado anual de 162 500 casos; Latinoamérica es la tercera región del mundo más afectada por esta entidad, con un estimado anual de 5300 casos 18. En el mundo, la meningitis por criptococo es responsable del 15 % de las muertes relacionadas con VIH/SIDA 18.
La mayoría de los estudios publicados sobre CM son del África subsahariana, el sur y el sureste asiático, mientras que los datos de Latinoamérica son escasos 19.
El Grupo Colombiano para el Estudio de la Cripto-cocosis estimó para Colombia, por medio de encuestas, una incidencia promedio anual de 2,4 casos por millón de habitantes en la población general y 3-3,3 casos por cada mil pacientes VIH positivos 2,20. Para el área de Bogotá, Cundinamarca y Boyacá se calcula una incidencia promedio anual de 3,2 casos por millón de habitantes en la población general y 3,1 casos por mil en pacientes VIH positivos 2. La criptococosis no es una enfermedad de notificación obligatoria en el país, lo cual explica por qué existe tan poca información sobre su incidencia en los grupos de mayor riesgo 2.
MANIFESTACIONES CLÍNICAS
La historia natural de la criptococosis no está todavía completamente clara, pero numerosos estudios publicados señalan que existen diferencias entre las especies y las variedades de acuerdo con el tipo de hospedero y el daño orgánico resultante. En la mayoría de los pacientes con factores predisponentes prevalece C. neoformans, mientras que C. gattii afecta principalmente a hospederos inmunocompetentes 2.
El C. neoformans y el C. gattii tienen una gran predilección por los pulmones y el SNC, esta levadura se puede diseminar e infectar la mayoría de los órganos en los pacientes severamente inmunocomprometidos. Entre tales infecciones se encuentra la infección cutánea, que es la tercera manifestación más común 12.
En cuanto a las manifestaciones clínicas, los pacientes con criptococosis del SNC presentan: cefalea, alteración del estado mental, fiebre, náuseas, vómito, deterioro visual, deterioro auditivo, parálisis del sexto nervio craneal (con frecuencia por aumento de la presión de apertura de líquido cefalorraquídeo (LCR)) y signos de irritación meníngea 3,12. Los síntomas se desarrollan en un periodo de varias semanas, en algunas ocasiones los pacientes se presentan con síntomas más agudos, o bien sin síntomas característicos como la cefalea 12.
La pérdida visual se asocia con la presencia de lesiones asociadas con criptococosis en la neuroimagen, así como la ceguera con aumento de presión intracraneana 21.
DIAGNÓSTICO
La enfermedad por criptococo puede ser diagnosticada por cultivo, microscopía de LCR o por detección de antígeno de criptococo 17.
En general, el análisis del LCR muestra elevación leve de las proteínas, las concentraciones de glucosa normales o bajas y pleocitosis de predominio linfocitaria. Algunos pacientes infectados por el VIH tendrán muy pocas células inflamatorias en el LCR, pero en la tinción de tinta china se pueden demostrar numerosas estructuras levaduriformes 17. La presión de apertura del LCR suele estar elevada, con presiones ≥ 25 cm H2O en el 60-80 % de los pacientes 17.
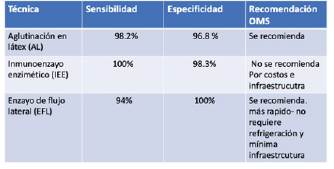
El método más rápido para el diagnóstico de criptococosis meníngea es el examen microscópico directo con coloración de tinta china del LCR y observación de levaduras encapsuladas 12, cuya sensibilidad depende de la carga fúngica, la cual se reporta del 30-50 % en casos no relacionados con VIH/SIDA y del 60-80 % en aquellos casos relacionados con dicha entidad 12,17. El cultivo se considera el patrón de oro para el diagnóstico de la meningitis por criptococo, pero tiene varias desventajas, entre ellas el que los cultivos para los hongos requieren infraestructura de laboratorio, electricidad y personal entrenado, todo lo cual puede no estar disponible en los lugares de bajos recursos. Los cultivos pueden tomar hasta siete días para crecer y necesitan ser incubados hasta por diez días para un conteo cuantitativo confiable 22. Por lo tanto, en la actualidad ante la sospecha de primer episodio de meningitis por criptococo en adultos, adolescentes y niños con VIH, se debe realizar una punción lumbar con la medición de apertura de la presión intracraneana y un examen de detección rápida de antígeno de criptococo (figura 1) 23. Hoy se dispone de tres técnicas de detección de antígeno: aglutinación en látex (AL), con sensibilidad del 98,2 % y especificidad del 96,8 %; inmunoensayo enzimático (IEE), con sensibilidad del 100 % y especificidad del 98,3 %; y ensayo de flujo lateral (EFL), con sensibilidad del 94,0 y especificidad del 100 %. La Organización Mundial de la Salud (OMS) recomienda realizar el EFL y la AL 23. No se recomienda el IEE debido a su costo y los requerimientos de infraestructura del laboratorio. El EFL tiene varias ventajas sobre la AL: que es más rápido (< 10 min), requiere poco entrenamiento para su uso e interpretación, se puede realizar con una mínima infraestructura de laboratorio y no requiere refrigeración (tabla 1) 23,24.
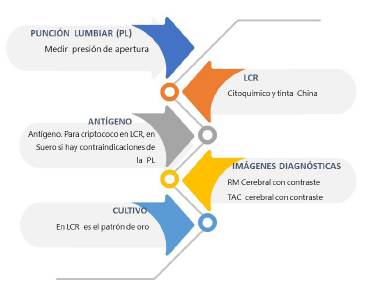
Fuente: elaboración propia
Figura. 1 Diagnóstico en criptococosis meníngea PL: punción lumbar; LCR: líquido cefalorraquídeo; RM: resonancia magnética; Tac: tomografía.
Los pacientes en quienes se encuentre contaminación o no se pueda llevar a cabo la punción lumbar, se recomienda una prueba de antígeno de criptococo en suero o plasma como alternativa diagnóstica, que tiene una sensibilidad mayor al 95 %, un valor predictivo positivo del 92,4 % y un valor predictivo negativo del 99,2 % 23.
Para el diagnóstico de la criptococosis también se usan otros métodos como la histopatología de los tejidos infectados y los métodos serológicos. Los métodos moleculares, aunque disponibles y ampliamente usados en investigación, no son de uso rutinario en la práctica clínica 12.
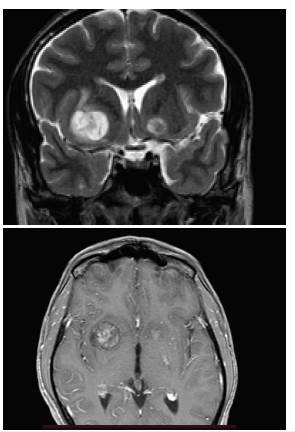
En un gran porcentaje de los pacientes se puede encontrar anormalidades en la neuroimagen asociadas y no asociadas con la meningoencefalitis por criptococo en la resonancia magnética (RM), en comparación con la tomo-grafía cerebral 25. Se describen como hallazgos asociados con la meningoencefalitis por criptococo la dilatación de los espacios perivasculares, los pseudoquistes, las masas intracerebrales, la hidrocefalia, la meningitis y las plexitis coroidea 25. Al comparar la frecuencia de los hallazgos entre pacientes inmunosuprimidos con inmunocompetentes en ambos grupos, el hallazgo más frecuente es el realce leptomeníngeo, seguido de la dilatación de espacios perivasculares con la presencia de material mucoide 26. La presencia de lesiones asociadas con la meningoencefalitis por criptococo en RM se encuentra asociada con predictores de mal pronóstico (figura 2) 27,28.
TRATAMIENTO FARMACOLÓGICO
El tratamiento de la meningitis por criptococo se divide en tres fases: 1 la inducción, 2 la consolidación y 3 el mantenimiento 3,17,22,23,29.
Fase de inducción
El objetivo de la terapia de la inducción es la rápida esterilización del LCR 22. En las guías de manejo de la OMS de marzo del 2018 23 se recomienda como primera línea de tratamiento para la fase de inducción en pacientes con VIH dos semanas de anfotericina B deoxicolato intravenosa (0,7-1,0 mg/kg/día), en combinación con flucitosina oral (100 mg/kg/día) 17,29,30. Los estudios demuestran mayor sobrevida de los pacientes con este esquema de tratamiento 31. En aquellos pacientes con trasplante o en los países de altos ingresos, la primera línea para la inducción es catorce días de anfotericina B liposomal y flucitosina 29,32,33. La anfotericina B liposomal se asocia con menor toxicidad comparada con el deoxicolato estándar 34. En pacientes aparentemente inmunocompetentes la evidencia es escasa; se recomienda como terapia de inducción anfotericina B más flucitosina por cuatro a seis semanas, con una menor duración para pacientes sin complicaciones neurológicas, y esterilidad del LCR a las dos semanas de tratamiento 29.
En las guías más recientes, publicadas por la OMS en el 2018 23, las recomendaciones para la fase de inducción en pacientes con VIH tienen en cuenta los resultados del estudio ACTA 34,35 y el metaanálisis de la colaboración Cochrane 36, en los que se demuestra que una semana de anfotericina B deoxicolato más flucitosina fue la mejor opción para terapia de inducción en escenarios de recursos limitados. Por lo anterior, la OMS recomienda como primera línea para la terapia de inducción en adultos, adolescentes y niños un curso corto de una semana con anfotericina B deoxicolato (1,0 mg/kg/día) y flucitosina (100 mg/kg/día dividida en cuatro dosis al día), seguido de una semana de fluconazol (1200 mg/día para adultos) 23.
Fases de consolidación y mantenimiento
Se recomienda el uso de fluconazol 800 mg/día para adultos por ocho semanas posteriormente a la fase de inducción, después fluconazol 200 mg/día por un año, como mínimo, hasta lograr la reconstitución inmune (figura 3) 18,23,29,30.

Nota: las alternativas al fluconazol incluyen itraconazol 200 mg dos veces al día, voriconazol 200 mg dos veces al día, posaconazol 300 mg al día e isavuconazol 372 mg al día. Fuente: adaptado de 3,18,22,23,29
Figura 3 Esquema de tratamiento en criptococsis meníngea ABLC: complejo lipídico de anfotericina; AmB: anfotericina B; AmBd: desoxicolato de anfotericina B; SNC: sistema nervioso central; VIH: virus de la inmunodeficiencia humana.
En la actualidad se estudian nuevos esquemas terapéuticos en MC para poblaciones con recursos limitados. Este metaanálisis se ocupa de los siguientes tratamientos anti-fúngicos: el régimen A, que comprende la primera semana de anfotericina B más 5-FC, seguida de una semana de fluconazol; el régimen B: la primera semana anfotericina B más fluconazol, seguida de una semana de fluconazol; el régimen C: dos semanas de anfotericina B más 5-flucitosina; y el régimen D: dos semanas de anfotericina B más fluconazol. Con estos esquemas de tratamiento se compara como desenlace la mortalidad y se concluye que el régimen A (una semana de anfotericina B más 5-FC, seguida de una semana de fluconazol) sigue siendo el régimen de inducción más apropiado para el tratamiento de la CM asociada con VIH en entornos de recursos limitados, superior al régimen B (una semana de anfotericina B más fluconazol, seguido de una semana de fluconazol) y al régimen D (dos semanas de anfotericina B más fluconazol) en varios aspectos. Sustituir el régimen B o el D por el régimen C es apropiado en términos de eficacia en entornos con recursos limitados, en los que es probable que 5-flucitosina no esté disponible o no sea asequible 36.
MORTALIDAD: HIPERTENSIÓN ENDOCRANEANA Y OTROS FACTORES PRONÓSTICOS
La mortalidad de la meningitis asociada con VIH permanece alta, en un rango entre el 20 % y el 40 % a las 10 semanas, a pesar de la terapia basada en anfotericina B y el acceso al TAR. La baja respuesta a la terapia antifúngica y el aumento de la presión intracraneal (PIC) son factores que contribuyen a la mortalidad 35,37. Hay varios factores de riesgo para el fracaso del tratamiento y la mortalidad en la meningitis por criptococo asociada con SIDA 19. Los principales factores de riesgo de mortalidad incluyen: edad, carga fúngica, tasa de aclaramiento fúngico, alteración del estado de conciencia, escasa celularidad en el LCR, neuroimagen anormal, PIC inicial elevada, PIC persistentemente elevada, infección diseminada, bajo recuento de CD4, bajo peso y anemia 19,38.
En un estudio de cohorte de 501 pacientes con CM asociada con VIH (38) y en un ensayo clínico de 662 pacientes 35 se encontró una alta mortalidad temprana en pacientes con CM, aun en aquellos pacientes tratados con anfotericina B y flucitosina en escenarios de investigación, con una mediana de tiempo de muerte de trece días tras la admisión. Esto sugiere que las mejores intervenciones tempranas podrían prevenir algunas de dichas muertes 35.
En países de altos ingresos, la mortalidad varía entre el 9 % y el 25 % 19. Un estudio italiano reciente reportó una mortalidad a 30 días de solo un 2,5 % en 40 pacientes con meningitis por criptococo, lo que demuestra que es posible obtener mejores resultados 39. En Latinoamérica, la mortalidad por criptococosis meníngea también es alta, los estudios hospitalarios retrospectivos en Brasil y Argentina encuentran una fatalidad que oscila entre el 30 % y el 63 %. En la mayoría de estos estudios no fue tratada la presión intracraneana 19,40. Un estudio peruano que trató a los pacientes con anfotericina B y manejo agresivo de la presión intracraneana en el escenario de un estudio de investigación, obtuvo una mortalidad del 19 % a las 10 semanas 19.
En Colombia un estudio del Hospital San Juan de Dios de Bogotá reportó 32 casos de criptococosis meníngea, con una tasa de mortalidad del 75 %, 27 pacientes recibieron tratamiento específico, todos con anfotericina B en mono-terapia o en combinación con flucitosina, ketoconazol o fluconazol. De estos individuos 16 fallecieron y 5 no alcanzaron a recibir ningún tratamiento específico. De aquellos que recibieron tratamiento y fallecieron, tres lo hicieron en las primeras dos semanas del diagnóstico (11 %) 11.
El aumento de la PIC es frecuente en la criptococosis meníngea y su manejo es un componente esencial del tratamiento 23,29,30. La PIC elevada (≥ 25 cm H2O) se asocia con una menor supervivencia a corto plazo y una menor respuesta al tratamiento 19, con frecuencia se caracteriza por cefalea, vómito, papiledema, disminución de la agudeza visual, ceguera, parálisis de los nervios craneales (mayor compromiso del VI nervio craneal), confusión, alteración del estado mental y coma 22. Los mecanismos que llevan al desarrollo de la PIC elevada en criptococosis meníngea son muy debatidos, entre ellos se incluyen el bloqueo de las granulaciones aracnoideas y los vasos linfáticos por los poli-sacáridos capsulares del hongo, así como un componente de edema cerebral como parte del proceso inflamatorio 41.
El tratamiento de forma intensiva de la PIC con punciones lumbares seriadas, de acuerdo con un protocolo estricto, se asoció con una reducción significativa de la mortalidad a 30 días, comparada con controles de registros históricos del 46 % vs. el 75 % 42. Un solo estudio estima el efecto directo de la PLT en la mortalidad aguda en una cohorte de individuos infectados por VIH con meningitis por criptococo en Uganda y Sudáfrica 43, donde se evaluó de forma prospectiva una cohorte de 248 pacientes, de los cuales 75 se sometieron al menos a una PLT y 173 no recibieron ninguna PLT, y se registró una mortalidad de 5 (6,67 %) y 31 (17,9 %) individuos en cada subgrupo 43. Rolfes y colaboradores demostraron la importancia del manejo agresivo de la PIC, con un beneficio del 69 % de la supervivencia relativa con al menos una punción lumbar terapéutica, y este beneficio de supervivencia fue independiente de la PIC inicial 22,43. Con estos hallazgos las últimas guías de tratamiento recomiendan la realización de una punción lumbar terapéutica temprana a todos los pacientes con criptococosis, con independencia de la clínica o de la PIC inicial 23.
No se recomienda el uso de otros métodos de disminución de la PIC como la acetazolamida, el manitol o los corticoides 22,23,29. El tratamiento médico y quirúrgico óptimo de la PIC elevada en criptococosis meníngea requiere estudios urgentes adicionales 41.
CRIPTOCOCOSIS Y SÍNDROME DE RECONSTITUCIÓN INFLAMATORIA INMUNE
Debido a la recuperación de la respuesta inmunitaria específica contra el criptococo, o como resultado de una respuesta inflamatoria exagerada del huésped, se puede presentar un deterioro clínico o una nueva presentación de la enfermedad criptocócica se produce por la recuperación de la respuesta inmunitaria específica sobre el criptococo o que da como resultado de una respuesta Inflamatoria exagerada del huésped. El síndrome de reconstitución inflamatoria inmune (C-SIRI) se observa en el VIH, caso en el cual la reversión es impulsada por la terapia antirretroviral (TAR), pero también puede ocurrir después de un trasplante de órganos sólidos, con una incidencia estimada en 4,8 o durante el embarazo.
Se reconocen dos formas distintas de la presentación del C-SIRI, la primera de las cuales produce un C-SIRI "paradójico" luego de iniciar el TAR, y se presenta como un deterioro o recurrencia de la criptococosis en el mismo sitio anatómico, a pesar del éxito del tratamiento. La segunda forma, que se conoce como "enmascarada", ocurre en el 1 % de los pacientes que inician TAR, en quienes no se reconoce la criptococosis antes del inicio del TAR 44.
PATOGÉNESIS
Los pacientes con C-SIRI suelen presentar una gran cantidad de linfocitos T CD4 + circulantes, en particular del subtipo Thl, lo que sugiere un papel crucial de Thl en el desarrollo de la enfermedad, así como una regulación positiva de la producción de citocinas proinflamatorias junto con patologías clínicas de disfunción pulmonar, lesiones del SNC y edema cerebral. Se propone que la secreción exuberante de citocinas, o una "tormenta de citocinas", subyace a C-SIRI (figura 4) 45,46.
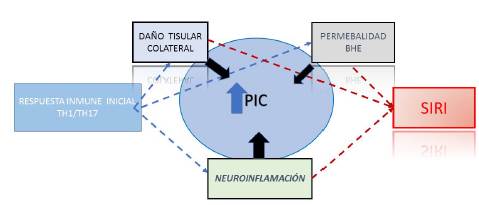
Fuente: adaptado de 46.
Figura. 4 El círculo vicioso de inflamación continua, permeabilidad de la barrera hematoencefálica (BHE) y daño tisular contribuye a un aumento de la presión intracraneal (PIC). Este círculo vicioso ocurre en (a) la respuesta inmune inicial sesgada por T helper tipo 2 (Th2)/Thl7 contra la meningitis criptocócica y (b) síndrome inflamatorio de reconstitución inmune dominante Thl postratamiento (IRIS).
En individuos infectados con VIH, debido al estado de inmunosupresión, la respuesta inicial en la CM es predominantemente tipo 2 T ayudadores (Th2) / Th17, en lugar de Thl. En personas sanas, un perfil Thl / Th17 se asocia con la resolución de la infección criptocócica, mientras que las respuestas con sesgo Th2 en la MC se correlacionan con un aumento de la inflamación, diseminación criptocócica y muerte. Se cree que las respuestas Th1 y Th2 son mutuamente excluyentes: una respuesta con sesgo Th2 inhibe las respuestas protectoras Th1 necesarias para la eliminación eficaz del criptococo. En una respuesta Thl ineficaz, con bajas concentraciones de factor de necrosis tumoral (TNF) en pacientes con MC, el pre-TAR conduce a una presentación ineficaz de antígenos, activación de macrófagos y eliminación de hongos, mientras que se sugiere que la respuesta inmune sesgada de Th2 no protege, además de ser la responsable de la infección no controlada y de la diseminación 46.
MANIFESTACIONES CLÍNICAS
Las manifestaciones clínicas se clasifican en cinco síndromes clínicos asociados con el C-SIRI paradójico y criptococosis asociada con TAR: 1) meningitis, que representa alrededor del 70 % de los casos; 2) lesiones del SNC que ocupan espacio; 3) linfadenopatía, típicamente necrotizante; 4) neumonitis; 5) lesiones de tejidos blandos o masas subcutáneas, típicamente supurativas 44,47.
DIAGNÓSTICO
Se pueden encontrar signos inflamatorios extensos con lesiones granulomatosas o evidencia de necrosis con o sin microorganismos en las tinciones y cultivos. También se elevan las concentraciones de la proteína C reactiva (PCR) e IL 6 que preceden el desarrollo del C-SIRI, en comparación con los individuos tratados con TAR y criptococosis que no experimentan SIRI. En el LCR en personas con C-SIRI paradójico se encuentra un aumento de los leucocitos y presión de apertura del LCR > 25 cm de agua.
La CM-SIRI en la RM cerebral puede ser meníngea o parenquimatosa, pero es más probable que se observe lepto-meningitis focal en una o más convexidades en los patrones de SIRI que en la CM sin SIRI. El SIRI no es evidente en la mayoría de las RM cerebrales, su diagnóstico se realiza por un empeoramiento clínico posterior al tratamiento con TAR en el contexto de un mejor recuento de CD4 + y una enfermedad con mejoría o estable 44,48,49.
LOS FACTORES DE RIESGO EN VIH ASOCIADOS CON SIRI
En la tabla 2 se presentan los factores de riesgo de VIH asociados con SIRI 50.
TRATAMIENTO
En el CM-VIH el balance de los tratamientos antimicóticos y contra el VIH se centra, en primer lugar, en disminuir la carga fúngica aguda, lo que permite la restauración inmunitaria posterior y luego el inicio del TAR. El ensayo Cryptococcal Optimal Antiretroviral Timing (COAT) determinó el momento óptimo para el inicio del TAR como el inicio del TAR después de un retraso de ≥ 5 semanas. Este retraso da tiempo para la restauración del recuento de células T CD4 y el restablecimiento del equilibrio Th1 y Th2/17 (figura 5) 46.
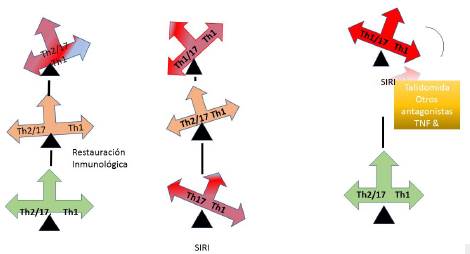
Fuente: adaptado de 46.
Figura 5 Acto de balance: balance inicial de las respuestas inmunitarias T helper tipo 2 (Th2)/Thl7 versus Thl antes de la terapia y (a) tratamiento micótico apropiado y terapia antirretroviral retardada (TAR), que permite la restauración del balance inmunológico antes de la TAR, o (b) restauración inapropiada del equilibrio inmune sesgada por Th1 que da como resultado el síndrome inflamatorio de reconstitución inmune (SIRI). (c) La opción de tratamiento propuesta para la meningitis criptocócica SIRI, el factor de necrosis tumoral (TNF), un antagonista de la talidomida, para resolver el IRIS y restaurar el equilibrio inmunológico.
En algunos países el acceso a los antimicóticos es fácil y se retrasa el inicio del TAR. Además, la prueba del antígeno capsular para criptococo se usa de forma rutinaria antes del inicio del TAR, para evitar las formas subclínicas de la criptococosis y las complicaciones del tratamiento. En otras regiones, como África subsahariana, se observa una alta mortalidad relacionada con MC-VIH, debido al inicio del TAR concomitante con los antifúngicos. El ensayo COAT mostró que el inicio temprano del TAR (una a dos semanas después del inicio del tratamiento antimicótico se asoció con una tasa de mortalidad más alta en comparación con el TAR tardío (el inicio del tratamiento después de las cinco semanas) 51.
El tratamiento actual se basa en la terapia con corticos-teroides inmunosupresores como la dexametasona 52, que tienen la ventaja de ser económicos y fácilmente accesibles en los países en desarrollo, beneficios que son cruciales para la población de personas infectadas por el VIH con MC. Sin embargo, el tratamiento con corticosteroides tiene sus limitaciones por los efectos secundarios importantes. La duración media del tratamiento con corticosteroides es larga, de semanas a meses, en entornos infecciosos.
En la actualidad no existen biomarcadores que se puedan utilizar para reducir el uso de corticosteroides para prevenir exacerbaciones y su uso prolongado puede conllevar muchos efectos secundarios (pérdida acelerada de densidad ósea y osteoporosis, manifestaciones neuropsiquiátricas, necrosis articular aséptica, insuficiencia suprarrenal, efectos gastrointestinales, hepáticos y oftalmológicos, hiperlipidemia, supresión del crecimiento y aumento del riesgo de otras infecciones).
Un ensayo clínico de VIH-CM que probó el tratamiento con dexametasona se detuvo por razones de seguridad, ya que mostró una reducción tardía de la carga fúngica y un aumento de las tasas de discapacidad y mortalidad en las personas tratadas con dexametasona en comparación con aquellas tratadas con placebo, con tasas de mortalidad del 47 % y el 41 %, respectivamente, después de diez semanas de tratamiento, y el SIRI se desarrolló en 13 pacientes. Junto con los corticosteroides sugeridos para tratar la MC, antes de este ensayo, las guías sugerían el uso de glucocorticoides para el tratamiento posterior del SIRI 52. Además, los corticosteroides, como la dexametasona, se dirigen al resultado de IRIS, la inflamación, mientras que no abordan la causa raíz del IRIS en sí, la reacción exagerada de Th1, lo que puede inducir a error al sistema inmunológico y a un deterioro mayor.
Para abordar la necesidad de un agente terapéutico más eficaz dirigido al SIRI en personas infectadas por el VIH con MC, en la actualidad se estudia el papel de los anti-TNF-antagonista para suprimir las respuestas Th1 hiperactivas post-ART. Entre ellos se encuentra el antagonista aplicado en el entorno del VIH-CM, la talidomida, que es segura en pacientes inmunodeprimidos infectados por el VIH. En la clínica, la talidomida es eficaz en pacientes infectados por el VIH que experimentan IRIS tras el inicio del TAR, pero tiene efectos secundarios en algunas poblaciones específicas como las mujeres embarazadas que presentan alteraciones congénitas en sus hijos. Por lo tanto, la talidomida no debe usarse en mujeres embarazadas o que planeen estarlo, ni en las parejas masculinas de dichas personas, ya que el fármaco puede transmitirse en el esperma. En la actualidad, la dosis recomendada de talidomida es de 200 mg por vía oral al día, con una duración del ciclo de tratamiento de seis semanas (42 días), sin superar los 12 ciclos 53.
Otros antagonistas pueden ser útiles para restaurar el equilibrio inmunológico durante el SIRI, como TNF- a anticuerpos monoclonales (p. ej., infliximab) y anticuerpos utilizados para el bloqueo de IL-6 como el siltuximab. Otra opción es la inhibición del receptor de quimiocinas CC 5 (CCR5) para bloquear la migración de monocitos al SNC. Sin embargo, ninguno de los anteriores se encuentra actualmente en ensayos clínicos en un entorno de enfermedad infecciosa VIH-CM 46,54.
DIFERENCIAS ENTRE C. NEOFORMANS VAR NEOFORMANS Y C. NEOFORMANS VAR. GATTII
La cápsula de polisacárido del criptococo tiene cuatro serotipos antigénicos principales, que son la base de una subclasificación del organismo. Estos se conocen como serotipos A-D. El serotipo A se clasifica como C. neoformans var. grubbi, en tanto que el D se clasifica como C. neoformans var. neoformans. Y los serotipos B y C se clasifican como C. neoformans var. gattii. Se ha descrito un serotipo AD que tiene propiedades antigénicas presentes tanto en la cepa A como en la D.
El C. neoformans var. gattii se encuentra generalmente en áreas tropicales y subtropicales. Se considera que es genética y bioquímicamente distinto de C. neoformans var. neoformans. Se encuentra con mayor frecuencia en el sur de Europa, el sur de California, Australia, algunas áreas de África, el sudeste de Asia y América del Sur, y ha causado brotes de meningitis en individuos aparentemente inmuno competentes en la costa oeste de América del Norte. Existe una asociación con el eucalipto rojo del bosque (Eucalyptus camaldulensis y E. tereticorniss). La asociación con la madera en descomposición sugiere una posible existencia endofítica. Afecta principalmente a personas sanas y es poco común en pacientes infectados por el VIH 55.
El Cryptococcus neoformans fue aislado por primera vez del jugo de melocotón por Sanfelice en 1894, en Italia, y recibió el nombre de Saccharomyces neoformans, pero solo hasta 1951 Emmmons lo aisló de la fuente ambiental de C. neoformans del suelo recolectado en Virginia y encontró que el patógeno era abundante en nidos de palomas y excrementos. Se necesitaron casi 40 años más para descubrir la fuente ambiental de C. gattii en los árboles, cuando Ellis informó el aislamiento de cepas del serotipo B deEucalyptus camaldulensis en 1990 en Australia.
Aunque la gran mayoría de los pacientes con criptococosis diseminada están inmunodeprimidos, C. neoformans también causa enfermedad en huéspedes aparentemente normales. La proporción de pacientes "aparentemente normales" versus pacientes inmunodeprimidos es significativamente mayor con la infección por C. gattii. Estos pacientes aparentemente normales podrían tener algún defecto inmunológico desconocido no detectado por las pruebas que se usan con frecuencia en los laboratorios clínicos. La criptococosis causada por el C. gattii es menos frecuente en todo el mundo, alrededor del 20 %, en comparación con el C. neoformans que es del 80 %. Los principales factores de riesgo de la infección por C. gattii siguen sin estar claros 56. Se sugieren varios como el antecedente de contacto con árboles de eucalipto, palomas o factores genéticos del huésped.
La infección por el C. gattii se presenta con frecuencia como una lesión localizada en el pulmón, en el SNC y rara vez en la piel. La CM es la manifestación clínica más grave causada por C. gattii. En algunos entornos, el C. gattii tiende a producir manifestaciones del SNC más graves que el C. neoformans. Las manifestaciones neurológicas más comunes son cefalea, vómito y rigidez del cuello. La hipertensión endocraneana producida por la inflamación meníngea y el edema cerebral tienen una alta mortalidad. Para disminuir la respuesta inflamatoria, en algunos casos se recomienda el uso temprano de dexametasona. También, las punciones lumbares seriadas se deben realizar como un complemento de la terapia antimicótica. Además, el C. gattii tiende a ser resistente a los fármacos antimicóticos, por lo que requiere un tratamiento prolongado y el manejo agresivo del aumento de la presión intracraneal con el drenaje del líquido cefalorraquídeo 57.
Los determinantes de la mortalidad y los resultados están bien descritos en los pacientes inmunodeprimidos infectados por el C. neoformans, pero no están definidos en la infección por el C. gattii. En un estudio más reciente de 86 pacientes, el compromiso inmunológico se asoció con un mayor riesgo de muerte por análisis univariado.
En la CM se debe examinar el LCR en busca de criptococos, a menos que no se pueda realizar una punción lumbar. Asimismo, puede estar indicada la biopsia de otros tejidos afectados. Los hemocultivos positivos indican una enfermedad diseminada, pero se desconoce la frecuencia de recuperación de C. gattii en la sangre. En el estudio de LCR es necesario solicitar el cultivo para tipificar el cripto-coco con el color azul cobalto en agar azul de bromotimol de canavanina glicina (CGB), además de la clasificación fenotípica 57,58.
En el tratamiento de la CM por el C.gattii se recomienda el uso de anfotericina B, 5-flucitosina y fluconazol. El periodo de inducción debe durar al menos seis semanas, con una estrecha monitorización por imágenes para asegurar la mejoría y la resolución. La mayoría de las recaídas se deben a dosis bajas o una duración inadecuada durante la inducción o el mantenimiento 56,58.