INTRODUCCIÓN
La paracoccidioidomicosis (PMC) es una micosis endémica que afecta a diferentes regiones de América Central y América del Sur, con un mayor número de casos reportados en países como Colombia, Venezuela, Brasil y Argentina 1-3. Esta enfermedad es producida por un hongo que pertenece al género Paracoccidioides, el cual tiene un comportamiento dimórfico dependiendo de la temperatura, de modo tal que se puede observar en forma de micelio o de clamidosporas; esta última es su forma infecciosa 4. Su presentación clínica puede ser aguda, subaguda o crónica, y afecta a diversos sistemas como el mucocutáneo, el linfático, el hematopoyético, el pulmonar e incluso el sistema nervioso central (SNC), sobre el cual se pondrá el énfasis 5,6. En la actualidad se considera una enfermedad tropical desatendida y su notificación en Colombia no es obligatoria, por lo que es necesaario conocer su presentación para reconocerla y tratarla adecuadamente.
EPIDEMIOLOGÍA
Los agentes etiológicos relacionados con la PMC son el Paracoccidioides brasiliensis y Paracoccidioides lutzii.. El P. brasiliensis se subdivide en un complejo de especies llamadas S1, PS2 y PS3, las dos primeras distribuidas uniformemente en los países de América del Sur, en tanto que la especie PS3 tiene un vínculo estrecho con aislamientos únicamente en Colombia. El P. lutzii. fue descubierto recientemente y está más relacionado con las áreas centrales de Brasil 7-9.
Los países con mayor número de casos reportados son Brasil y Colombia, seguidos por Argentina y Venezuela 10-12. Se estima que aproximadamente 10 millones de personas podrían estar infectadas. En zonas endémicas la prevalencia podría llegar a ser tan alta como 50-75 % de la población adulta, sin embargo, se estima que solo el 2 % desarrollaría la enfermedad activa 13.
Los datos de Colombia provienen de publicaciones realizadas antes del año 2000, en las cuales se logró identificar que la prevalencia en el país es de 32,4 casos/año, en el periodo 1970-1999 14, con una incidencia de 0,1-2,4 casos por cada 1 000 000 de habitantes al año 15. Con base en esos hallazgos se logró determinar que existen ocho departamentos endémicos, conformados por Antioquia, Santander, Cundinamarca, Meta, Norte de Santander, Caldas, Boyacá y Tolima 15.
La publicación de casos en continentes diferentes de América del Sur y Central se relaciona con personas que habían visitado algún país endémico 10.
Esta enfermedad no solo afecta a los habitantes de zonas rurales, sino también a personas que están en contacto con bosques tropicales, subtropicales, ríos, cultivos de café o tabaco, zonas donde se ha reconocido la presencia de este hongo, el cual habita en el suelo 16,17. Inclusive en algunos animales se ha detectado la infección por este hongo 18-20.
Debe recordarse que en esta región, el movimiento constante de habitantes de zonas rurales a zonas urbanas, por diversos motivos sociales, económicos y políticos, puede hacer que varíe su forma de presentación. En los últimos 10 años, la migración de habitantes de Venezuela hacia diversas zonas de América Latina podría también contribuir a este cambio 1,3.
El compromiso del sistema nervioso central por PMC es poco común, se ha descrito que su presentación puede variar entre el 3,4 % y el 26 % de los pacientes con PMC 21,22. En un estudio publicado en el 2018, realizado en una población de Brasil, la frecuencia de NPMC fue del 6 % y la mayoría de los casos pertenecía a habitantes de zonas rurales 23.
El género desempeña un rol importante en esta micosis: en la población infantil la presentación es igual para ambos sexos, pero en la edad adulta del 75 % al 95 % afecta a los hombres, lo cual podría explicarse por la exposición de los hombres en un mayor porcentaje a labores del campo y de agricultura, así como la teoría de que los estrógenos o progestágenos pudieran tener algún papel protector 10,24,25.
CARACTERÍSTICAS CLÍNICAS SISTÉMICAS
Las manifestaciones clínicas de la PMC pueden ocurrir de forma aguda en menos del 10 % de los casos. La mayoría ocurre meses o años después y puede afectar a cualquier órgano o sistema. El compromiso pulmonar y el de mucosa suelen ser los más comunes 26-28.
Los síntomas sistémicos como malestar general, anorexia y pérdida de peso se observan comúnmente, sin embargo, la fiebre puede no estar presente en todos los pacientes. Con respecto al compromiso pulmonar, la disnea suele ser el síntoma más común, acompañado de tos seca o con producción de moco y en pocos casos hemoptisis 29. Debe tenerse en cuenta que también habrá casos asintomáticos en los cuales solo se encuentre el compromiso pulmonar en la autopsia 30. La presencia de hipofonía de tonos graves o agudos, disfagia y odinofagia son algunos de los síntomas descritos en pacientes con compromiso de mucosa de la vía aérea superior. También se pueden observar lesiones variables como tumefacciones, lesiones infiltrativas, granulomas, úlceras e incluso vegetaciones 31. Este compromiso puede ser muy doloroso y puede llegar a afectar la cavidad oral, la laringe y la orofaringe 32,33.
Entre otros órganos afectados puede destacarse el compromiso cutáneo, con lesiones que comprometen regiones en la cabeza y el cuello en un 47 % y los miembros inferiores en un 21 %, con gran importancia clínica ya que son lesiones susceptibles de biopsia y que pueden facilitar un diagnóstico oportuno. Las linfoadenopatías, la insuficiencia suprarrenal crónica, el dolor abdominal, la emesis, el estreñimiento o diarrea, la anemia y la leucopenia o trombocitopenia son algunas de las otras presentaciones clínicas sistémicas 2,34,35.
CARACTERÍSTICAS CLÍNICAS NEUROLÓGICAS
La neuroparacoccidioidomicosis (NPCM) se presenta entre un 13 % y un 25 % de los paciente con PMC 22,36. Las dos formas de presentación son la meníngea y la pseudotumoral, también llamada granulomatosa (37,38). Esta última es frecuente, se observa en un 90 % de los casos 6,37. Los síntomas más relacionados son cefalea y ataxia por compromiso de la fosa posterior, pero varían dependiendo de la localización anatómica. La clínica de fosa media y anterior consiste en síntomas o signos motores, sensitivos, afasia o disartria, o también hipertensión endocraneana (HTE) progresiva. La presentación meníngea se manifiesta con cefalea y signos meníngeos en forma subaguda o crónica, afectando la base del cráneo, y suele confundirse con meningitis tuberculosa. Las crisis epilépticas se han descrito en el 20 -33 %. Otros síntomas menos frecuentes son parestesias, confusión, signos bulbares o movimientos anormales como temblor 6,37,39. La médula espinal puede estar comprometida, en menos del 5 % de los casos de NPCM, con debilidad en miembros inferiores, nivel sensitivo e incontinencia urinaria y fecal 6. Es importante reconocer que hasta un 21 % de los pacientes con PMC puede debutar con síntomas neurológicos y que aproximadamente un 46 % de los casos los presentará después de que aparezcan los síntomas sistémicos 22.
DIAGNÓSTICO
El hemograma puede presentar leucocitosis y eosinofilia como hallazgo más frecuente, sin embargo la anemia, la leucopenia y la trombocitopenia pueden ser una manifestación del compromiso de médula ósea 6.
Cuando hay sospecha de NPMC es preciso llevar a cabo el estudio del líquido cefalorraquídeo (LCR), el cual puede poner en evidencia hiperproteinorraquia en el 61 % de los casos, o pleocitosis en un 17 %, con predominio de linfocitos e hipoglicorraquia 6,22.
El aislamiento o la visualización por examen directo microscópico es extremadamente infrecuente. Las pruebas serológicas son útiles para la evaluación inicial de pacientes sospechosos y también sirven para realizar un control de la respuesta clínica. Existen varios tipos de pruebas, sin embargo, la más utilizada es la inmunodifusión cuantitativa, la cual se considera una prueba confiable, con datos de sensibilidad del 90 % y especificidad del 100 % 40-42. A pesar de que se encuentran diversos métodos inmunológicos para el diagnóstico de la enfermedad, varios de ellos se demoran, son costosos o imprecisos, además de presentar reacciones cruzadas con otras infecciones fúngicas 2,43.
En el LCR se han hecho pruebas para detectar antígenos específicos como la glicoproteína gp-43, contra la cual se genera una respuesta de anticuerpos anti-gp43 que han sido medidos por Elisa en el LCR. Tales pruebas han sido positivas en el 89 % de las muestras, con sensibilidad del 89 % y especificidad del 100 %, pero pueden darse resultados positivos por reacciones cruzadas en muestras de suero de pacientes con infecciones por histoplasma y aspergilosis 40,44.
Neuroimágenes como la tomografía computarizada (TC) y la resonancia magnética (RM) ayudan al abordaje diagnóstico del paciente con NPMC, sin embargo, los hallazgos en su gran mayoría son variables e inespecíficos, sin una lesión patognomónica, y se observan lesiones granulomatosa similares a otros tipos de infecciones o incluso neoplasias 6. En la TC la lesión que se observa con mayor frecuencia es una imagen hipodensa con realce anular y leve edema circundante (figura 1), y también se pueden observar, aunque en menos ocasiones, lesiones calcificadas con realce en anillo y lesiones multiloculadas. En algunos casos se ha descrito asimismo la presencia de realce suba-racnoideo difuso 37. En la RM se han observado lesiones tipo granuloma con realce de contraste interno y anular, los cuales se localizan las más de las veces en los hemisferios cerebrales, en el cerebelo (figura 2) o el tronco encefálico y con escasa frecuencia en la médula espinal. También se ha descrito hidrocefalia secundaria a NPCM 2,6,45.
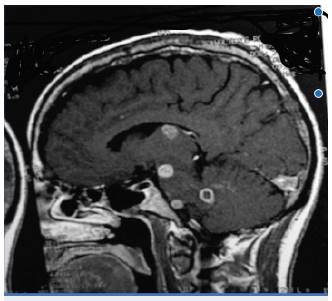
Fuente: 51.
Figura 1 RM cerebral T2 proyección sagital, se observan múltiples lesiones hiperintensas algunas con realce anular
Fuente: 51.
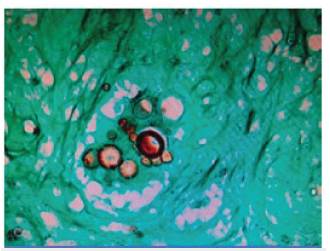
Figura 2 Biopsia de ganglio cervical con tinción de Gomory, se observan múltiples estructuras micóticas en forma de timón de barco y "Mickey Mouse"
El estudio histológico permite confirmar el diagnóstico con una sensibilidad del 97 %, utilizando la tinción de metenamina plata con la evidencia de hongos esporulados con apariencia descrita de "Mickey Mouse" y la forma de "timón" (figura 3) 46.
TRATAMIENTO
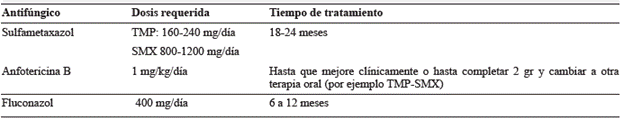
El tratamiento de la PMC puede hacerse con diversos antimicrobianos como la anfotericina B, azoles como ketoconazol, fluconazol, itraconazol o voriconazol, y también las sulfonamidas como el trimetoprim-sulfametoxazol. Sin embargo, para el tratamiento NPMC se ha utilizado con frecuencia el trimetoprim-sulfametaxazol (TMP-SMX) por su facilidad en la administración, penetrancia al sistema nervioso central y baja toxicidad. La anfotericina B se usa en pacientes con enfermedad grave que requieran hospitalización. Los azoles en general no tienen un buen paso de la barrera hematoencefálica, sin embargo, el fluconazol podría ser una opción terapéutica adicional ya que sus características farmacológicas permiten mejores concentraciones en el sistema nervioso central, a diferencia de los otros azoles 47-50. En la tabla 1 se observan las dosis recomendadas y el tiempo en el tratamiento.
No existen ensayos clínicos para el manejo de la NPCM y no se conocen las tasas de respuesta exacta a la terapia, no obstante, en algunas series de casos publicadas se ha observado que la falla terapéutica puede darse hasta en el 25 % de los pacientes tratados. La persistencia de la lesión en la TC después del tratamiento puede verse hasta en un 64 % y la desaparición total hasta en un 36 % de los pacientes 6,22. Algunos casos van a requerir manejo quirúrgico para el tratamiento de la hidrocefalia relacionada con hipertensión endocraneana, granulomas que no mejoran con terapia farmacológica o masas que generen signos y síntomas de compresión 6,22.