INTRODUCCIÓN
La enfermedad de Chagas (tripanosomiasis americana), es una zoonosis potencialmente mortal causada por el parásito Trypanosoma cruzi1, descrita por primera vez por el médico brasileño Carlos Ribeiro Justiniano Chagas en 1909 2. Predomina en áreas rurales de Centro y Suramérica y en el sur de los Estados Unidos 1. La transmisión se da por vectores encontrados principalmente en territorio latinoamericano, transmisión vertical (placentaria, canal del parto o lactancia), trasplante de órganos o consumo de alimentos o bebidas infectados 1,3. La fase aguda puede ser asintomática, presentarse con síntomas generales inespecíficos o con complicaciones como miocarditis o meningoencefalitis 4,5. Las principales complicaciones crónicas incluyen cardiomegalia (con sus patologías asociadas y aumento de riesgo cardiovascular), enfermedad gastrointestinal y, en algunos casos, neuropatía periférica 1,5,6. Los eventos tromboembólicos son frecuentes, el más común es el infarto cerebral. El pronóstico en la fase aguda es favorable, excepto si se presentan complicaciones 4.
EPIDEMIOLOGÍA
La enfermedad de Chagas afecta a millones de personas en áreas endémicas 5,7, aunque la incidencia ha disminuido progresivamente a través de estrategias planteadas por la Organización Panamericana de la Salud (OPS) 7, especialmente la asociada con transmisión por vectores, aun cuando en las regiones amazónicas ha incrementado la transmisión oral 8. En la actualidad, la enfermedad ha cruzado fronteras por las migraciones de Latinoamérica a Europa; se calcula una prevalencia de 4,2 % (IC 95 %: 2,2-6,7) 8. Según la Organización Mundial de la Salud (OMS) 2,6:
15-17 millones de personas son infectadas por la enfermedad de Chagas cada año en América.
Mueren 50 000 personas al año.
Más de 100 millones de personas están en riesgo de infectarse.
Hay aproximadamente 2 millones de mujeres en edad reproductiva infectadas (4-8 % transmitirán la infección al feto vía transplacentaria).
En Colombia, la infección por T. cruzi se ha detectado a lo largo del valle del río Magdalena, en la región del Catatumbo, en la Sierra Nevada de Santa Marta, en los Llanos Orientales y en la Serranía de la Macarena; con mayor prevalencia en Santander, Norte de Santander, Cundinamarca, Boyacá, Casanare, Arauca y en las comunidades de la Sierra Nevada de Santa Marta. Con una prevalencia de 700 000 a 1 200 000 habitantes infectados y 8 000 000 individuos en riesgo de adquirir la infección 7.
FISIOPATOLOGÍA
El T. cruzi es un protozoo flagelado con único núcleo y una organela (kinetoplasto) que da origen a una mitocondria con ADN 3; este anida y se reproduce en los tejidos y circula entre animales silvestres (zarigüeyas, macacos, armadillos) y domésticos, insectos triatominos y el humano. Los vectores más importantes son los triatominos (pitos en Colombia) que se relacionan con el humano en el ambiente intradomiciliario 3,7.
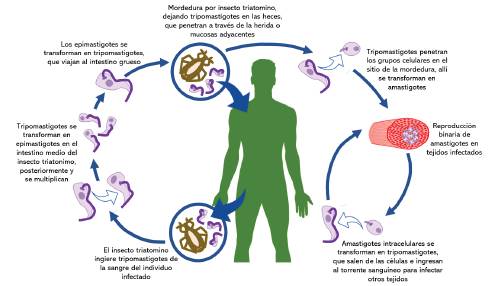
Después de que el parásito ingresa a través de una herida abierta o una membrana mucosa, el tripomastigote infeccioso se introduce en el torrente sanguíneo, transformándose en amastigote, que forma pseudoquistes en células musculares o nerviosas 1,3. Existe predilección por el miocardio o plexo mientérico, donde se replica por fisión binaria 1. En la figura 1 se detalla el ciclo de vida del T. cruzi en vectores y huéspedes vertebrados 3.
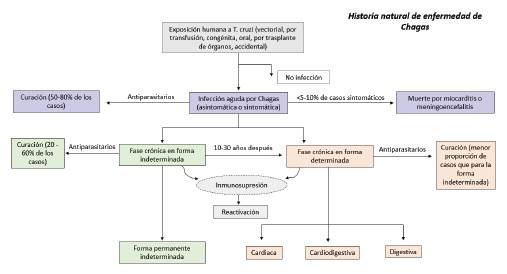
Hay tres fases de la enfermedad: aguda, indeterminada y crónica. Luego de la infección aguda, para establecer una infección de por vida, el T. cruzi evade la respuesta inmune del huésped y, con ello, algunos pacientes permanecen asintomáticos y con niveles bajos de parásitos intracelulares 1. La proliferación y persistencia a largo plazo en el tejido conduce al establecimiento de la enfermedad crónica. Casi el 30-40 % de los pacientes con infección crónica evolucionan de una condición asintomática a formas sintomáticas, incluidas las cardíacas, las digestivas y las cardiodigestivas 9.
FASES Y EVOLUCIÓN CLÍNICA
La fase inicial de la infección dura de cuatro a ocho semanas, en tanto que la fase crónica persiste durante toda la vida del huésped 8. La fase aguda suele ser asintomática o presentarse con un síndrome febril autolimitado. Los síntomas aparecen entre una y dos semanas después de la exposición a los triatominos infectados, o hasta meses después de la transfusión de sangre infectada 8. La muerte ocurre ocasionalmente en esta fase (< 5-10 % de los sintomáticos) como resultado de miocarditis grave, meningoencefalitis, o ambas 10. En pocos pacientes (5-10 %) se ha registrado una progresión directa de la fase aguda a una forma clínica de la enfermedad de Chagas 11. Las manifestaciones agudas se resuelven espontáneamente en el 90 % de los infectados, incluso si la infección no se trata con fármacos tripanocidas. Aproximadamente el 60-70 % de estos pacientes nunca desarrolla una enfermedad clínicamente aparente; estos pacientes tienen la forma indeterminada de la enfermedad de Chagas crónica, que se caracteriza por positividad de anticuerpos contra T. cruzi en suero, un electrocardiograma (EKG) normal y un examen radiológico (Rx) normal de tórax, esófago y colon 8,10. El 30-40 % restante de los pacientes desarrollará posteriormente una forma determinada de enfermedad crónica, es decir, cardíaca, digestiva o cardiodigestiva, por lo general 10-30 años después de la infección inicial 8 (figura 2). La reactivación puede ocurrir en pacientes con infección crónica inmunológicamente comprometidos 8.
Enfermedad de Chagas aguda
Algunas personas sueles ser asintomaticas por presnetar una carga parasitaria baja. La principal sintomatología incluye malestar general, adinamia, fiebre prolongada, hepatoesplenomegalia, adenopatías, edema subcutáneo (localizado o generalizado); en el caso de transmisión por vectores, puede encontrarse chagoma cutáneo en sitio de entrada o de las mucosas oculares (signo de Romaña) 8,12. Si se realiza un EKG, este puede poner en evidencia bloqueo auriculoventricular de primer grado, bajo voltaje en QRS o cambios en la onda T, en tanto que una Rx de tórax puede mostrar grados variables de cardiomegalia 13. Las manifestaciones graves, que incluyen miocarditis, meningoencefalitis y neumonitis, son poco frecuentes, pero tienen un alto riesgo de muerte 8,10.
Enfermedad de Chagas crónica
En esta etapa puede haber total ausencia de signos y síntomas de la enfermedad (fase indeterminada), pero también puede presentarse enfermedad grave y muerte temprana 8. Las manifestaciones clínicas típicas están relacionadas con la afectación patológica del corazón, esófago, colon o una combinación, y se agrupan en tres formas 8,11:
Cardiaca: es la forma más grave y frecuente de la enfermedad de Chagas crónica (20-30 %). Se caracteriza por anomalías del sistema de conducción, bradiarritmias y taquiarritmias, aneurismas apicales, insuficiencia cardíaca, tromboembolismo y muerte súbita. La combinación de bloqueo de rama derecha con bloqueo fascicular anterior izquierdo y la taquicardia ventricular sostenida son típicas de esta forma 8,14. La fibrilación auricular (FA) se presenta en 4-12 % de los pacientes, junto con bradicardia y otras alteraciones de la conducción ventricular 10,15. La falla cardíaca es una manifestación tardía, que suele ser biventricular, de predominio derecho; son frecuentes los embolismos sistémicos de trombos murales, los cuales generan compromiso cerebral, pulmonar, renal y esplénico 8,11. La muerte súbita es la principal causa de muerte en pacientes con compromiso cardíaco por Chagas (2/3 de las muertes) 8.
Digestiva: el megaesófago, el megacolon o ambos se desarrollan en 10-15 % de los pacientes con infección crónica. Los síntomas incluyen disfagia con odinofagia, epigastralgia y desnutrición en casos graves (en relación con megaesófago). El megacolon afecta el segmento sigmoide, recto o colon descendente, y produce estreñimiento, distensión abdominal y obstrucción intestinal por fecaloma o vólvulo sigmoideo 8.
Cardiodigestiva: consiste en la asociación de cardiopatía con megaesófago o megacolon, o ambos. Generalmente, el desarrollo de megaesófago suele preceder a la enfermedad cardíaca y del colon 8.
Los pacientes inmunosuprimidos (VIH o fármacos) pueden experimentar una exacerbación de la infección crónica, con aumento de la parasitemia y la replicación del parásito intracelular 10. En coinfección con VIH las manifestaciones más frecuentes son la meningoencefalitis y las lesiones del sistema nervioso central (SNC) que se asemejan a las de la toxoplasmosis cerebral 8 (tabla 1).
Tabla 1 Manifestaciones clínicas y diagnóstico de formas agudas y crónicas de enfermedad de Chagas
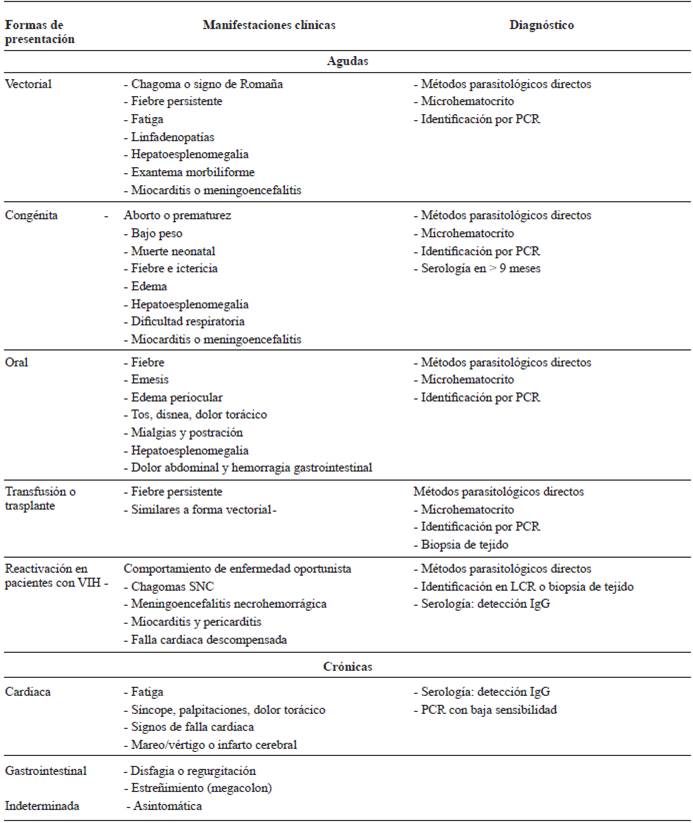
Fuente: modificado de 10.
ENFERMEDAD DE CHAGAS Y SISTEMA NERVIOSO
La enfermedad de Chagas es un factor de riesgo independiente de ataque cerebrovascular (ACV) en países endémicos, en relación con la forma cardíaca; adicionalmente, durante la infección aguda, < 5 % de los pacientes puede fallecer por meningoencefalitis, especialmente pacientes inmunosuprimidos 8,16. La forma congénita se caracteriza por meningoencefalitis en el neonato, microcefalia y calcificaciones cerebrales 16.
El ACV isquémico asociado con la cardiopatía chagásica crónica es frecuente, con reportes del 47,6-87,5 % 17,18, y con recurrencia de 10-15 % 19. La incidencia anual estimada es del 3 % en pacientes con seguimiento a 5,5 años 18, en tanto que la incidencia acumulada de muerte por ACV en cardiopatía chagásica es del 4,8 % en seguimiento a 10 años 18, con mayor riesgo en pacientes con mayor edad (OR 0,96), menor escala Rankin (OR 1,84), déficit cognitivo (OR 0,44), etiología cardioembólica (OR 2,47) y sexo femenino (OR 2,73) 20. Los factores predictores de ACV en cardiopatía chagásica son los aneurismas apicales (OR 2,19) y los trombos en ventrículo izquierdo (OR 2,43) 15. Esta complicación se considera secundaria a hipoxe-mia tras insuficiencia cardíaca congestiva, caída brusca de la tensión arterial sistémica y flujo sanguíneo cerebral, arritmias cardíacas (FA 83 %) 17 y tromboembolismo 6, aunque pueden presentarse asociados con arterioesclerosis de pequeño vaso (66 %) y gran vaso (50 %) 12,13. El ACV en estos pacientes es clínicamente indistinguible de otras causas de ataque cerebrovascular cardioembólico 6,12, aunque está más asociado con transformación hemorrágica (20-25 %) y compromiso más frecuente de arteria cerebral media 19, especialmente en localización parietal, frontal y temporal y núcleos basales 6.
La reactivación de la enfermedad de Chagas crónica (forma nerviosa aguda reactivada), aunque poco frecuente, ocurre en pacientes inmunosuprimidos con neoplasias malignas del sistema hematopoyético-linfoide, luego de trasplante renal, cardíaco y de médula ósea, y pacientes con SIDA 6,16. El hallazgo histopatológico fundamental es la encefalitis nodular en múltiples focos, con un rasgo necrotizante y numerosos amastigotes, al encontrarse la forma pseudotumoral ("chagoma" cerebral) 6,16.
La existencia de una forma nerviosa crónica, de variada sintomatología neurológica, causada directamente por T. cruzi, fue postulada por Chagas en 1911 a partir de la presencia de encefalitis en los casos agudos, sin embargo, esto ha sido debatido. Un estudio histopatológico de cerebros de pacientes con la forma cardíaca crónica mostró la presencia de pequeños nódulos inflamatorios hipocelulares sin parásitos, escasamente distribuidos en el tejido nervioso. Estos cambios inflamatorios relativamente insignificantes se interpretaron como de naturaleza residual; es decir, podrían representar secuelas de la forma aguda. Esta interpretación concuerda con los estudios histopatológicos e inmunohistoquímicos cerebrales experimentales en las fases aguda y crónica, que muestran involución de la microglía, y nódulos que se producen al final de la fase aguda o cuando la infección progresa a la fase crónica 6. La mayoría de los pacientes presenta un examen neurológico normal, pocas alteraciones neurológicas o quejas insuficientes para establecer un diagnóstico sindrómico, hallazgos de líquido cefalorraquídeo (LCR) normales, alteraciones en EKG inespecíficas y ausencia de actividad lesiones en resonancia magnética 6,11.
Adicionalmente, pueden generarse alteraciones en el sistema nervioso periférico (SNP) relacionadas directamente con neuropatía en la fase aguda o crónica (10,17 %), se encuentra reducción en velocidades de conducción sensitivo-motora y de la amplitud del potencial de acción sensitivo 6. También puede presentarse secundaria a toxicidad farmacológica con neuropatía dependiente de la dosis, presente en más del 25 % de los pacientes 5.
DIAGNÓSTICO
Durante la fase aguda el diagnóstico se realiza a través del examen directo de sangre completa o de la capa leucocitaria luego de centrifugar, en el que se visualizan los tripomastigotes 14, con sensibilidad del 68 % en la fase aguda; además, el examen microscópico indirecto (xenodiagnóstico) se puede llevar a cabo en las formas crónicas (positivo luego de 6-8 semanas) y presenta una sensibilidad del 100 % 21.
La identificación de antígenos séricos se asocia con mayor severidad de la miocarditis, al igual que alta carga parasitaria en la enfermedad aguda 14. La cardiomiopatía chagásica se diagnostica con dos pruebas positivas de anticuerpos contra T. cruzi, incluyendo un ensayo por inmunofluorescencia y uno por inmunoabsorción ligado con enzimas (Elisa, del inglés Enzyme-linked immunosorbent assay). Si las pruebas son discordantes se requerirán estudios adicionales; hasta el momento no hay un estudio estándar de oro para el diagnóstico 12,14. La reacción en cadena de la polimerasa (PCR, del inglés polymerase chain reaction) para ADN de T. cruzi se encuentra positiva en el 85,7 %-91,3 % de los individuos con este diagnóstico 14.
Las alteraciones en EKG son prevalentes, por lo que debe realizarse incluso en pacientes asintomáticos para realizar diagnóstico y establecer pronóstico; sus hallazgos se encuentran comprendidos en los criterios diagnósticos establecidos por el Consenso Brasilero de Enfermedad de Chagas asociado con la prueba serológica (tabla 2) 14. El EKG-Holter de 24 horas es útil para el registro de arritmias transitorias, asintomáticas o causantes de síncope, que son frecuentes y algunas potencialmente letales (taquicardia ventricular o bloqueos avanzados transitorios) y que podrían beneficiarse de tratamiento antiarrítmico o dispositivos (marcapasos o cardiodesfibrilador); también es una herramienta que puede servir para la medición indirecta de la función del sistema nervioso autónomo mediante la medición de la variabilidad de la frecuencia cardiaca, alteración que puede documentarse de manera temprana en la cardiomiopatía chagásica por compromiso vagal. Puede llevarse a cabo prueba de esfuerzo, así como escintigrafía miocárdica para establecer anormalidades ventriculares izquierdas y cambios isquémicos, poniendo en evidencia anormalidades microvasculares, disautonomía y áreas de fibrosis miocárdica 10.
Tabla 2 Anormalidades electrocardiográficas típicas y atípicas en cardiomiopatía chagásica según el Consenso Brasilero de Enfermedad de Chagas

Fuente: tomado de 14.
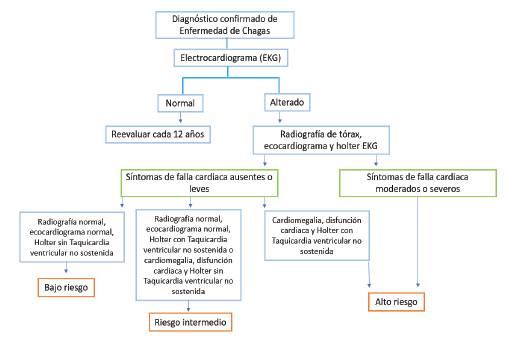
Es necesario un estudio con ecocardiograma (ECG) transtorácico para determinar alteraciones estructurales cardíacas, entre las que se encuentran alteraciones regionales en la contractilidad y aneurismas apicales típicos; la disfunción ventricular sistólica global izquierda es el predictor más fuerte de morbimortalidad en enfermedad de Chagas, con la disfunción asintomática como hallazgo común 10,11. La Rx de tórax es específica para dilatación cardiaca, sin embargo, es poco sensible con bajo rendimiento. En pacientes con anormalidades en ECG TT o Rx de tórax, la elevación del péptido natriuriético atrial (BPN del inglés, brain natriuretic peptide) tiene valor predictivo positivo del 80 % y negativo del 97 % para la detección de pacientes con fracción de eyección del ventrículo izquierda deprimida; el BPN también es un marcador de arritmia ventricular y disfunción diastólica. El ECG transesofágico permite la identificación de fuentes embolígenas con alta certeza, por lo que podría realizarse para definir requerimiento de anticoagulación 10,11. A partir de las manifestaciones clínicas y los estudios básicos se puede estratificar el riesgo de mortalidad a 10 años en bajo (10 %), intermedio (44 %) o alto (80 %) (figura 3) 10,11.
TRATAMIENTO
Terapia antiparasitaria específica
El tratamiento antitripanosómico es claro en la fase aguda, aun a pesar de la probable severidad de los efectos adversos (excepto en gestantes), y tiene efectividad en el 60-85 % de los casos. En la fase crónica podría llevarse a cabo el tratamiento, pero el beneficio de erradicación del parásito es controvertido, excepto en los niños contagiados, respecto a quienes hay consenso para su tratamiento, y el resultado es la negativización de las pruebas serológicas 4,10,11 o la reactivación de la infección 4. En la cardiopatía chagásica no está indicado el tratamiento farmacológico antitripanosómico, ya que no tiene diferencias significativas con respecto a los desenlaces primarios (muerte, paro cardiaco, taquicardia ventricular sostenida, requerimiento de inserción de dispositivos o trasplante, falla cardiaca, tromboembolismo o infarto cerebral) 12,22.
El nifurtimox tiene tasas de curación en fase crónica-indeterminada del 86 % en niños menores de 14 años y del 7-8 % en adultos, con efectos adversos presentes en el 43-97 %, tales como anorexia, náusea fiebre, erupción cutánea, irritabilidad, insomnio, cambios afectivos, parestesias, neuropatía periférica 10. La dosis es de 8-10 mg/ kg/día (hasta 15mg/kg en formas agudas), en 3-4 dosis al día durante 60-90 días 10,11. El benznidazol tiene efectos antiparasitarios para las formas tisulares y circulantes de la infección aguda, con tasas de seroconversión negativa del 58-62 % en casos de seguimiento a 3-4 años 10. La tolerancia es variable (mejor que al nifurtimox), con efectos adversos en el 30-50 % de los pacientes, incluyendo erupción cutánea, intolerancia digestiva, anorexia, cefalea, trastornos del sueño como los más frecuentes; la neuropatía periférica y la depresión de médula ósea tienen una menor presentación 4,10,11. La dosis es de 5-7,5 mg/kg, 2-3 veces al día durante 60 días 10, con dosis de 10mg/kg día en formas agudas o 15 mg/kg en casos de meningoencefalitis. El itraconazol también se ha reportado efectivo para el manejo de infecciones agudas o reactivación de formas crónicas, con dosis de 400 mg/ día durante 60-90 días 11.
El tratamiento de la cardiomiopatía chagásica se basa en el manejo de la falla cardiaca, las arritmias y la prevención de los fenómenos tromboembólicos 10.
El ACV en su fase aguda se trata según la evidencia, con independencia de la etiología probable; la trombolisis intravenosa en pacientes con Chagas se ha considerado segura y puede realizarse según los criterios establecidos 12,16. No hay consenso con respecto a la prevención secundaria de específica de ACV en estos pacientes, sin embargo, el índice IPEC-Fiocruz (Instituto de Pesquisa Evandro Chagas/Fundacao Oswaldo Cruz), que tiene en cuenta edad > 48 años (1 punto), cambios en segmento ST onda T (1 punto), disfunción sistólica (2 puntos) y presencia de aneurisma apical del ventrículo izquierdo (1 punto), recomienda anticoagulación primaria en pacientes con puntajes > 4 12. Sin embargo, este índice no se correlaciona con la etiología del ACV, por lo que deben realizarse todos los estudios de factores de riesgo adicionales tradicionales (por ejemplo, Doppler arterial de cuello) para descartar compromiso no cardioembólico y realizar manejo dirigido 23. En caso de requerir anticoagulación, se recomienda el uso de warfarina; no hay evidencia suficiente del uso de anticoagulantes directos, excepto si hay confirmación de FA no valvular 12. Si se considera anticoagulación, se recomienda iniciarla en los días 1-3-6-12, según el tamaño de la isquemia, para ataque isquémico transitorio, infarto lacunar, infarto moderado o infarto de gran tamaño, respectivamente 24.