INTRODUCCIÓN
En los últimos 20 años el avance en los conocimientos de la fisiopatología de varias enfermedades neurológicas inmunomediadas ha llevado a la investigación y aprobación de múltiples terapias inmunomoduladoras e inmunosupresoras que se han vuelto de uso frecuente en nuestra especialidad. En este contexto, es mejor prevenir que curar. Las estrategias de mitigación de riesgos (EMR) desempeñan un papel importante a la hora de prevenir o diagnosticar de forma temprana las complicaciones infecciosas que se puedan derivar del uso de estos medicamentos.
Para tener EMR, debe reconocerse que hay riesgo de infecciones específicas relacionadas con terapias modificadoras de la enfermedad (TME) y los posibles factores de riesgo que se han identificado para su desarrollo. Estos factores de riesgo podrían incluir, entre otros, la edad, el sexo, las comorbilidades de los pacientes, el tratamiento previo -como quimioterapia y otras inmunoterapias-, el índice de masa corporal, entre otros.
El objetivo de esta revisión es, de forma esquemática, representar cuáles son los mecanismos de acción de las diferentes terapias disponibles, el riesgo de infecciones en los pacientes que se encuentran recibiendo estos tratamientos y qué exámenes y evaluaciones se deben realizar para minimizar este riesgo.
EVALUACIÓN DE RIESGO EN PACIENTES INMUNOCOMPROMETIDOS
Múltiples estudios han proporcionado información útil sobre los riesgos relativos de infección entre los TME estudiados mediante la utilización de evidencia en la vida real (EVR). Por ejemplo, informes previos relacionados con la artritis reumatoide y otras enfermedades autoinmunes neurológicas han sugerido un mayor riesgo de infección y tasas de mortalidad con hipogammaglobulinemia después del tratamiento con rituximab. Además, un estudio informó que el tratamiento prolongado con rituximab en pacientes con trastorno del espectro de neuromielitis óptica (ENMO) se asoció con hipogammaglobulinemia y posiblemente con riesgo aumentado de infección. También están surgiendo observaciones similares en pacientes con esclerosis múltiple (EM) tratados con rituximab y ocrelizumab. Esto es particularmente relevante y pertinente ya que las terapias anti-CD20 que agotan las células B se utilizan cada vez más como tratamiento a largo plazo en pacientes con esclerosis múltiple (EM) recaída remisión (ocrelizumab y rituximab) y EM primaria progresiva.
Con la aprobación de natalizumab para su uso en EM se encontró la asociación de esta terapia con un aumento en el riesgo de leucoencefalopatía multifocal progresiva (LMP), especialmente en pacientes con antecedente de exposición previa al virus JC y con tratamiento de más de dos años. A partir de esta complicación se logró desarrollar una estrategia de mitigación de riesgo para poder determinar qué pacientes tenían mayor riesgo y también una estrategia de diagnóstico temprano para mejorar el pronóstico de los pacientes que desarrollan esta complicación 1. También se han reportado casos de LMP en el periodo postcomercialización de dimetilfumarato. El riesgo de esta infección, al parecer, se relaciona con una mayor edad y la presencia de linfopenia menor de 500 células de forma sostenida por más de seis meses 2.
Con fingolimod las infecciones oportunistas más frecuentemente reportadas son las relacionadas con las infecciones de la familia del herpes 3, pero también se han reportado casos de criptococosis meníngea y diseminada 4.
Con respecto a las infecciones oportunistas en mayor proporción relacionadas con el uso de alemtuzumab, en los estudios se reportó un aumento en el riesgo de reactivación de herpes, pero además un mayor riesgo de infecciones por Listeria y E. coi. El riesgo de infecciones en general es mayor durante los primeros dos años después de los ciclos de tratamiento, pero disminuye a partir del tercer año 5.
Por otro lado, en una revisión reciente de linfopenia y TME en EM, se encontró que la asociación entre linfopenia e infecciones oportunistas no está clara para la mayoría de los DMT actuales. Sin embargo, todavía preocupa el riesgo potencial de infección conferido naturalmente por estos agentes inmunosupresores e inmunomoduladores administrados por largos periodos, especialmente a la luz de los informes sobre linfopenia prolongada asociada con TME y LMP, entre otras infecciones oportunistas y riesgo de neoplasias.
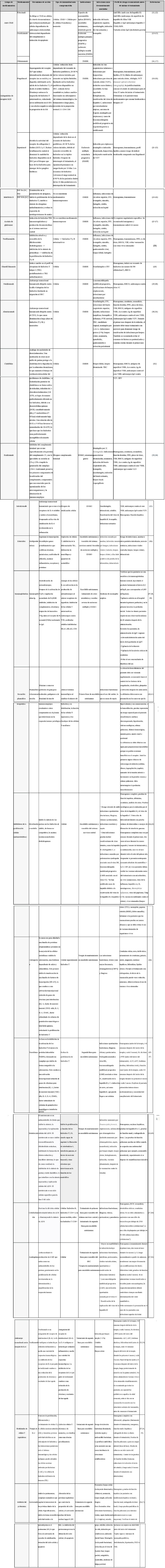
En la tabla 1 se esquematizan los medicamentos usados con frecuencia en enfermedades autoinmunes del sistema nervioso central (SNC), las infecciones frecuentemente asociadas con su uso y la minimización de riesgos inherentes a cada terapia Tabla 1.
PERFIL DE INMUNIZACIONES EN PACIENTES CON ESCLEROSIS MÚLTIPLE
La inmunización mediante vacunación es una de las herramientas más efectivas en la actualidad para prevenir enfermedades infecciosas potencialmente graves y mortales. Las personas con EM también corren el riesgo de adquirir infecciones prevenibles gracias a la vacunación acertada, ya sea debido a inmunización incompleta, o bien por ausencia de esta. En las últimas dos décadas, gran número de estudios han demostrado la ausencia de un vínculo causal entre la vacunación y la aparición o recaída de la EM 6. La evidencia disponible sugiere que la hepatitis B, el virus del papiloma humano, la influenza, el tétanos, la difteria, la tos ferina, la poliomielitis, el bacilo Calmette-Guérin (BCG), la fiebre tifoidea, la encefalitis transmitida por garrapatas o las vacunas MMR no aumentan el riesgo de desarrollar EM 7. Así mismo, en la actualidad no existe evidencia de un mayor riesgo de exacerbación de la EM después de vacunación contra hepatitis B, tétanos, encefalitis transmitida por garrapatas o vacunas contra la influenza. Una posible excepción la constituye la vacuna viva atenuada contra la fiebre amarilla, en la que una serie de casos demostró recaídas en 5/7 personas con EM posteriormente a esta inmunización 8, sin embargo, se requieren estudios con mejores métodos para concluir esta premisa.
Se recomienda fuertemente que las personas con EM tengan revisado y actualizado su estado de inmunización tan pronto como sea posible después de establecer el diagnóstico de EM, con el fin de prevenir retrasos futuros en el inicio inmunoterapias. En este contexto, pacientes con TME y aquellos con peor discapacidad son no solo más susceptibles a la infección, sino también al riesgo de mayor morbilidad y mortalidad en relación con algunas infecciones que pueden prevenirse 9.
Las TME pueden influir sobre la respuesta inmune a las vacunas y la seguridad de estas. Aunque no hay mayores preocupaciones sobre vacunación en personas en tratamiento con interferón β, existen consideraciones para los demás medicamentos 10.
El momento óptimo para cualquier vacunación debe basarse en un juicio clínico sobre la necesidad relativa de una protección rápida y la respuesta probable a la vacunación, dependiendo específicamente del impacto de las TME sobre el efecto de la inmunización.
Por ejemplo, las vacunas inactivadas idealmente deben administrarse al menos dos semanas antes de iniciar inmunosupresores de mantenimiento y terapias de reconstitución inmunológica. Terapias anti CD20, particularmente ocrelizumab, tuvieron una atenuada respuesta humoral a la vacunación contra el tétanos, el neumococo y la influenza estacional al compararse con otras TME.
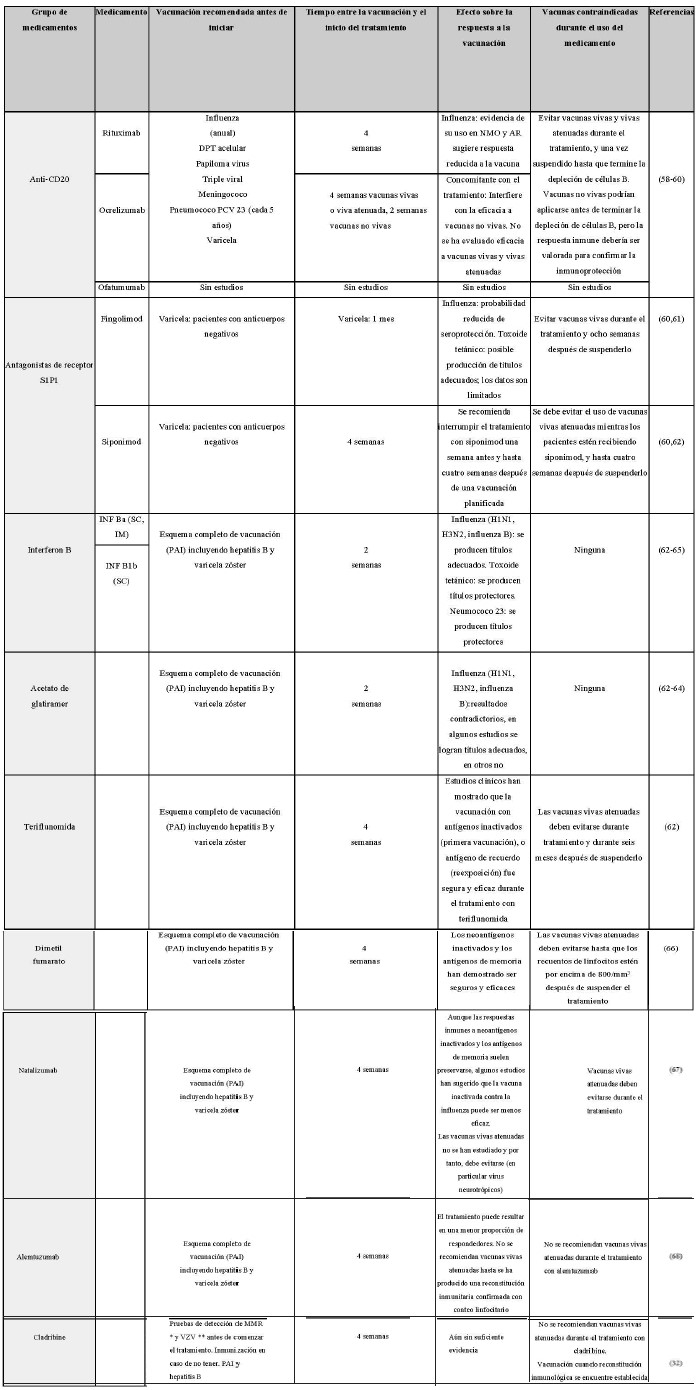
Debido al riesgo de enfermedades transmitidas por vacunas, los virus vivos atenuados como MMR, varicela-zóster virus (VZV) y la vacuna contra la fiebre amarilla generalmente deben ser administradas por lo menos con cuatro semanas de antelación para iniciar de manera segura la inmunosupresión. En la tabla 2 se encuentran las recomendaciones actuales de vacunación con respecto a TME en EM, ajustadas al programa de inmunización colombiano (Tabla 2).
CONCLUSIÓN
En la actualidad se dispone de tratamientos que han demostrado modificar el curso de varias enfermedades autoinmunes del sistema nervioso. Conocer el mecanismo de acción de estas terapias y sus potenciales efectos adversos, sobre todo infecciosos, nos permitirá escoger la mejor terapia para nuestro paciente, pero además utilizar una EMR adecuada, con el fin de realizar una vigilancia activa y un diagnóstico temprano de posibles complicaciones.