Un estudio británico basado en los registros médicos de 269.070 adultos mayores de 65 años mostró que, ajustando por otras variables, el diagnóstico previo de demencia es un factor de riesgo importante para ser hospitalizado por la enfermedad por coronavirus 2019 (covid-19) (OR = 3,07, IC 95%: 1,71-5,50) 1. En otro estudio, que incluyó a 20.133 pacientes hospitalizados por la covid-19 en 208 hospitales del Reino Unido, la demencia tambén se asoció con una mayor mortalidad, con un OR superior al de la obesidad, la diabetes o la hipertensión 2. Además, la alteración de la conciencia, incluido el delirium, es común en casos graves de la covid-19 3,4. El genotipo Apoliproteína E (ApoE) estaría así asociado tanto con la demencia como con el delirium 5.
ApoE es una proteína transportadora de lípidos que se expresa abundantemente en la mayoría de las neuronas del sistema nervioso central (SNC) 6, de la cual se pueden distinguir varias isoformas principales: ε2, ε3 y ε4. Se observan seis fenotipos como resultado de dos polimorfismos de un solo nucleótido en las posiciones de los aminoácidos 112 y 158 (figura 1). Los cambios de aminoácidos podrían alterar la carga y la estabilidad de la proteína, e inducir de tal modo funciones fisiológicas distintas. Se ha estimado que el alelo ApoE ε3 está presente en el 79 % de la población, mientras que la ApoE ε4 se encuentra en el 13 % y la ApoE ε2 en el 7 % 7. El alelo ApoE ε4, generalmente considerado deletéreo, es un factor de riesgo significativo para la enfermedad de Alzheimer y también se asocia con enfermedad cardiovascular aterosclerótica 6.
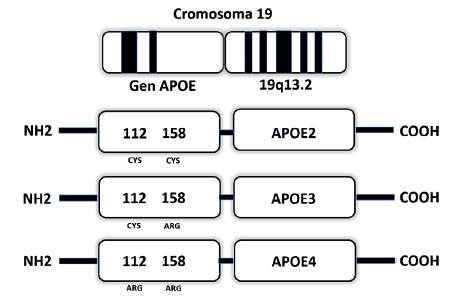
Fuente: Elaboración propia. 7
Figura 1: Representación esquemática de los dominios estructurales y funcionales de las isoformas de Apolipoproteína E humana.
La ApoE participa en la salida de colesterol celular de los tejidos hepáticos y no hepáticos, el transporte de colesterol y la eliminación de los restos de lipoproteínas en el plasma 8. La proteína se asocia principalmente con partículas de lipoproteínas de muy baja densidad (VLDL) ricas en triglicéridos para mediar el suministro de lípidos extrahepáticos y, en segundo lugar, con partículas de lipoproteínas de alta densidad (HDL) para el transporte inverso del colesterol, un proceso que transfiere el exceso de colesterol de los tejidos no hepáticos al hígado para su excreción. La liberación de lípidos a las células por VLDL está mediada por la unión de ApoE a los receptores de lipoproteínas de baja densidad de la membrana, seguida de endocitosis de lipoproteínas mediada por receptores 9.
Las isoformas de ApoE afectan de manera diferencial los niveles de colesterol intracelular y circulante. Un metaaná-lisis confirmó que los portadores del alelo ApoE ε4 tienen niveles más altos de colesterol plasmático que los individuos con el genotipo ε3/ ε3 9. Varios estudios observacionales han mostrado que la gravedad de la covid-19 se asocia con una reducción de HDL sérica, lo que indica defectos en la vía de transporte inverso del colesterol responsable de la homeostasis de los lípidos en los tejidos periféricos 10). En este sentido, en la covid-19 se ha observado una acumulación pulmonar anormal de macrófagos cargados de lípidos. El colesterol intracelular también se acumula con la edad en varios tejidos, incluidos los neumocitos 11, lo que se correlaciona con un aumento de la gravedad de la enfermedad en el adulto mayor 9).
Para investigar la contribución relativa del genotipo ApoE al riesgo de desarrollar la covid-19 grave, Kuo y colaboradores analizaron datos de casos de la cohorte del Biobanco del Reino Unido 3,5, los individuos se clasificaron por genotipo ApoE y se registró el número de pruebas para covid-19 positivas para cada grupo. Los autores encontraron que los individuos homocigotos para ApoE ε4, con independencia de demencia preexistente, enfermedad cardiovascular o diabetes tipo 2 tenían más probabilidades de dar positivo en la prueba de la covid-19 y, por lo tanto, de una enfermedad grave, en comparación con aquellos individuos homocigóticos para ApoE ε3 5. También, informaron que en los individuos homocigóticos para ApoE ε4 se observaba un aumento de cuatro veces en la mortalidad después de dar positivo en relación con homocigóticos para ApoE ε3. Estos datos sugieren que el genotipo homocigotos ApoE ε4 representa un riesgo significativo para el desarrollo de la covid-19 grave, así como para la muerte después de la infección 3.
También se ha descrito que la ApoE modula importantes respuestas inmunitarias innatas, determinantes para la inflamación. Por ejemplo, los individuos que albergan ApoE ε 4 exhiben niveles plasmáticos significativamente más altos de citocinas proinflamatorias (IL 6 y TNFα) después de la exposición intravenosa con la endotoxina bacteriana, lipopolisacárido (LPS) 12. Un sello distintivo de la infección por la covid-19 es la inflamación aberrante como resultado de una respuesta inmunitaria disfuncional. Kuo y colaboradores ilustraron una asociación entre los casos graves de la covid-19 y el genotipo homocigotos ApoE ε4, con independencia de las comorbilidades; es plausible que la ApoE module la gravedad de la covid-19 mediante la regulación de las vías proinflamatorias, de una manera dependiente del genotipo 3.
Asimismo, ha surgido la inquietud con respecto al potencial de efectos neurodegenerativos crónicos después de la infección por la covid-19. Se ha descrito que el alelo ApoE ε4 exacerba la inflamación en el SNC después de factores estresantes que imitan la infección en la periferia de LPS 3. Además, los individuos portadores del alelo ApoE ε4 exhibieron una ruptura acelerada de la barrera hematoencefálica 13,14. Por lo tanto, esto no solo suscita preocupación, por una inflamación exacerbada en la periferia que contribuye a una tormenta de citocinas durante la infección, sino también el potencial de un mayor riesgo de neurodegeneración a largo plazo en aquellos pacientes infectados que tienen el alelo ApoE ε4.
Además de la enfermedad de Alzheimer, el alelo ApoE ε4 es considerado un factor de riesgo genético para enfermedad cardiovascular y accidente cerebrovascular; tras la infección con el SARS-CoV-2, la respuesta hiperinflamatoria y la consiguiente disfunción endotelial inician un ambiente procoagulante local, como lo sugieren los microtrombos pulmonares observados en la covid-19. El factor de von Willebrand significativamente elevado, liberado por la activación de las células endoteliales por TNF-α e IL-1β, es solo una característica de la coagulopatía resultante. Utilizando células endoteliales derivadas de células madre pluripotentes inducidas por individuos que albergan genotipo homocigotos ApoE ε4, la disfunción endotelial se ha manifestado previamente por un aumento de la unión de plaquetas y una mayor expresión del factor de von Willebrand, lo que promueve una condición pro-trombótica 15,16.
La infección por la covid-19 representa una amenaza para el SNC, dado que la neuroinflamación es una característica universal en una variedad de enfermedades neurodegenerativas. Por consiguiente, los efectos longitudinales de la infección por la covid-19 en los portadores de ApoE ε4, que exhiben respuestas neuroinflamatorias exacerbadas, pueden conducir a un riesgo mayor de desarrollar complicaciones. Se necesitan nuevos estudios para dilucidar una asociación entre ApoE ε4, inflamación e infección por la covid-19, y para caracterizar los mecanismos biológicos subyacentes a este vínculo. La comunidad de investigadores debe considerar estos estudios, porque si existe una asociación, millones de portadores de ApoE ε4 en todo el mundo deben tomar precauciones adicionales para evitar el desarrollo de una enfermedad devastadora y potencialmente mortal.














