INTRODUCCIÓN
La demencia por cuerpos de Lewy (DCL) es la segunda demencia neurodegenerativa más frecuente, después de la enfermedad de Alzheimer (EA). Esta enfermedad progresiva se caracteriza por demencia, fluctuaciones en la cognición, alucinaciones visuales, trastorno de la conducta del sueño REM y parkinsonismo 1. Su diagnóstico oportuno es de gran relevancia dado que, pese a que tiene un perfil de síntomas y un curso clínico diferente al de otras demencias, en muchos casos se subdiagnostica o se clasifica erróneamente como EA o demencia por enfermedad de Parkinson (DEP) 2. Por otra parte, la DCL abarca síntomas motores y psiquiátricos que explican por qué la alteración funcional, la morbilidad y la sobrecarga al cuidador son más frecuentes que en la EA y en otras demencias. Adicionalmente, las alteraciones de la marcha en la DCL representan una característica diferencial en la aproximación diagnóstica de esta enfermedad neurodegenerativa 1,3.
Se ha propuesto que las alteraciones de la marcha en el adulto mayor pueden tener una base compartida tanto musculoesquelética como del sistema nervioso. El compromiso de la marcha se ha considerado un predictor importante de varios desenlaces, como caídas, deterioro cognitivo, discapacidad, deterioro en la calidad de vida, hospitalización y mortalidad 4,5. Las alteraciones en la frecuencia y la longitud de los pasos junto con otras fluctuaciones en el patrón de la marcha no deben ser ignoradas ni consideradas normales en el proceso de envejecimiento 6, debido a que pueden ser indicadores de presencia y severidad de una enfermedad neurodegenerativa 7.
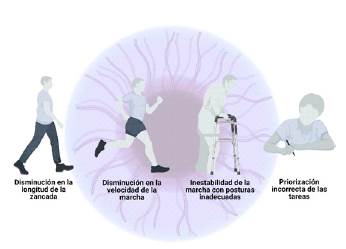
De igual manera, los pacientes con DCL caminan más lento, dan pasos más cortos y tienen características de la marcha más variables comparados con quienes padecen de EA 8. En la DCL se encuentra una disminución en la velocidad de la marcha como característica general, pero adicionalmente a esto se aprecia menor longitud de las zancadas, aumento del tiempo para establecer una postura adecuada y aumento del tiempo de apoyo doble 7,9-11. La evidencia sugiere que las alteraciones de la marcha varían entre los subtipos de deterioro cognitivo leve, su análisis podría ser útil como un marcador clínico para el diagnóstico temprano 4.
Esta revisión pretende describir y ampliar la información disponible sobre las características de las alteraciones de la marcha asociadas con DCL.
METODOLOGÍA DE BÚSQUEDA
Se llevó a cabo una revisión de la literatura sobre la relación entre las alteraciones de la marcha y la DCL. Se seleccionaron los siguientes parámetros de búsqueda mediante el buscador Scopus: ((falls and dementia and gait and (evaluation or analysis))). Los datos se ordenaron según relevancia y se obtuvieron 267 resultados. Adicionalmente, se llevó a cabo una búsqueda de literatura en el motor de búsqueda PubMed, introduciendo los términos (gait and lewy-body-disease), y no se utilizaron otros filtros. No se empleó un filtro que excluyera literatura a partir de un año en específico, ya que no es mucha la evidencia reciente con respecto a este tema. Con esta búsqueda se obtuvieron 139 resultados, los cuales, a partir de ambas búsquedas, se ordenaron según su relevancia para la elaboración de este artículo. Tras eliminar los artículos duplicados de los resultados de las búsquedas y aquellos que consideramos no pertinentes para esta revisión, después de hacer una verificación manual de sus parámetros, se obtuvo un total de 55 artículos que se tuvieron en consideración para la elaboración del presente escrito. La selección de artículos no se realizó de manera sistemática, dado que el objetivo de este trabajo fue hacer una revisión narrativa acerca de los cambios en la marcha asociados con la demencia por cuerpos de Lewy.
Entre los artículos seleccionados se encuentran múltiples parámetros usados para determinar las alteraciones de la marcha, incluyendo: presencia de signos motores, duración de zancada, velocidad de marcha, "priorización incorrecta", congelamiento de la marcha, tiempo de balanceo, ritmo, tiempo de soporte doble, coeficiente de variación del tiempo de zancada, coeficiente de variación de longitud de pasos y variabilidad de la marcha 12-15, de los cuales la zancada y la duración tienen una mayor especificidad para DCL 13. Además, existen diferentes pruebas para evaluar la marcha y predecir el riesgo de caídas, como: "Timed Up and Go test" (TUG), "Berg Balance Scale" (BBS), "Performance-Oriented Mobility Assessment", "Stops Walking When Talking" (SWWT) y el "Dual-Task Paradigm" o paradigma de doble tarea 14,16-19.
EPIDEMIOLOGÍA DE LA DEMENCIA CON CUERPOS DE LEWY
La DCL se reconoce como una causa común de demencia, la cual afecta hasta el 5 % de la población general adulta mayor, siendo responsable de hasta el 30 % de todos los casos de demencia 2,20. Su incidencia estimada va del 0,1 % hasta el 3,8 % por año en la población general, con un promedio de 0,87 personas/año 1. Su prevalencia aumenta con la edad, al igual que en otras demencias, y la edad promedio de presentación son los 75 años 21. Sin embargo, su subdiagnóstico es frecuente y se calcula que aproximadamente el 50 % de los casos solo se diagnostican post mortem 2.
FACTORES DE RIESGO PARA DEMENCIA POR CUERPOS DE LEWY
Los factores de riesgo en el desarrollo de DCL se superponen en cierta medida con los descritos en la enfermedad de Parkinson y en la enfermedad de Alzheimer. Dentro de los factores no asociados directamente con alteraciones genéticas se encuentran la edad avanzada 22, el sexo masculino 22-24, la historia familiar de demencia 25, el sedentarismo 26, la deficiencia de vitamina E 26, la depresión 23,27, la hipertensión, la diabetes mellitus y la hiperlipidemia 28. Se han descrito además mutaciones en los genes SNCA, LRRKA, Interleucina-1, APOEe4, SLARB2 y GBA, siendo estas dos últimas unas de las mutaciones responsables del inicio de la enfermedad en edades tempranas 26,29-36.
En relación con la presencia de factores protectores, un estudio retrospectivo mostró que el consumo de cafeína y el antecedente de cáncer se asocian con una menor probabilidad de DCL, en comparación con grupo control, con excepción del cáncer de piel no melanoma 23. De la misma manera, Berge y colaboradores encontraron que la presencia del alelo de la apolipoproteína E2 se asocia no solo con un riesgo reducido de desarrollar DCL (OR 0,4; IC 0,3-0,8, p = 0,004), sino también con un retraso de 4 años en el inicio de la enfermedad (p = 0,01, prueba U de Mann-Whitney) 37.
Recientemente, se ha encontrado una asociación entre niveles elevados de fósforo sérico y mayor riesgo de enfermedad de Alzheimer, demencia vascular y DCL en personas menores de 60 años. Aun así, los resultados del estudio no establecieron causalidad y dentro de sus limitaciones se encuentra el hecho de que estos resultados no son extrapolables a otras poblaciones diferentes a las del estudio 38. Asimismo, se ha considerado que la exposición a pesticidas, la lesión cerebral traumática y el antecedente de melanoma son posiblemente factores de riesgo para DCL, en forma similar a lo descrito en la enfermedad de Parkinson 39. Hasta el día de hoy no se han reportado ni se han evaluado cambios en el patrón de la marcha o antecedentes de caídas repetitivas como factores predictores o de riesgo para el desarrollo de DCL.
CRITERIOS DIAGNÓSTICOS CLÍNICOS DE LA DEMENCIA CON CUERPOS DE LEWY
El diagnóstico de la DCL es complejo, teniendo en cuenta que durante el curso de la enfermedad su presentación clínica puede superponerse junto con otras enfermedades neurodegenerativas 40. No obstante, se han hecho estudios para comparar los perfiles cognitivos de personas con DCL y EA en los que se ha encontrado que los patrones de discapacidad cognitiva son diferentes, especialmente los relacionados con la atención, la memoria episódica y las funciones ejecutivas 41.
Algunas de las características más importantes y diferenciales de la DCL son las alucinaciones visuales complejas, las fluctuaciones en la atención, el trastorno de la conducta del sueño REM y el parkinsonismo 42. Sin embargo, deben tenerse en cuenta otras particularidades en su presentación y diagnóstico diferencial. La presentación de algunos signos y síntomas puede depender de la aparición de demencias concomitantes como la EA de comienzo tardío, la cual se encuentra presente en un 80 % de las DCL, dado que ambas comparten una base fisiopatológica 21. Se debe tener en cuenta que el Mini-Mental State Examination (MMSE) y el Montreal Cognitive Assessment Test (MOCA) no son exámenes que permitan discriminar entre los diferentes subtipos de demencias. Sin embargo, es posible distinguir alteraciones en habilidades como la copia del dibujo, dibujar un reloj, calcular o deletrear palabras al revés, que pueden ser cambios sugestivos de DCL, mientras que la aparición temprana de alteraciones en la orientación y la memoria de corto plazo son más sugestivas de EA 43.
Para sintetizar un poco lo mencionado, el último informe de consenso del consorcio de la DCL define múltiples criterios para el diagnóstico clínico de esta enfermedad. En primer lugar, se considera que como criterio esencial para el diagnóstico de DCL está la demencia. Como características clínicas principales de la DCL se pueden observar cognición fluctuante con compromiso notorio sobre la atención y el estado de alerta, alucinaciones visuales recurrentes (las cuales, como se ha mencionado, típicamente son bien formadas y detalladas), alteraciones del sueño REM y parkinsonismo. Otras características clínicas que pueden apoyar el diagnóstico, ya que pueden ocasionalmente acompañar los síntomas cardinales de DCL, son la sensibilidad severa a fármacos antipsicóticos, inestabilidad postural, caídas a repetición, síncope u otros episodios transitorios de pérdida del estado de conciencia, disfunciones autonómicas severas (ortostatismo, incontinencia urinaria y fecal, etc.), hiposmia, delirios sistematizados, apatía, ansiedad y síntomas depresivos. Si se tiene el criterio esencial de demencia, además de dos características clínicas principales, es válido hacer un primer diagnóstico clínico de DCL 1.
ALTERACIONES EN LA MARCHA Y CAÍDAS EN LA DEMENCIA POR CUERPOS DE LEWY Y DIFERENCIA CON ALTERACIONES EN OTROS TRASTORNOS NEUROCOGNITIVOS
Las alteraciones en la marcha en trastornos neurodegenerativos son frecuentes, Allali y colaboradores describen la presencia de alteraciones de la marcha clínicamente significativas en el 93 % de los pacientes con demencia por enfermedad de Parkinson, 79 % de pacientes con demencia vascular, 75 % de pacientes con DCL y 25 % de pacientes con EA 4. Menz y colaboradores encontraron que al adoptar una marcha más conservadora, los adultos mayores reducen la magnitud de las aceleraciones experimentadas por la cabeza y la pelvis al caminar, lo cual corresponde quizá a un mecanismo compensatorio para mantener el equilibrio ante la presencia de cambios fisiológicos relacionados con el envejecimiento; de manera específica, menor fuerza en miembros inferiores 44. No obstante, en este estudio se incluyeron adultos mayores con un bajo riesgo de caídas, y el riesgo de presentar este desenlace no es equivalente al compararse con sujetos que padecen de algún tipo de demencia.
Las caídas representan el 62 % de las 2,7 millones de lesiones no fatales reportadas en los servicios de urgencias en Estados Unidos, según un estudio realizado en el año 2001 45. Además, se estima que entre el 5 % y el 10 % de las caídas causa lesiones significativas como trauma craneoencefálico severo, laceraciones profundas o fracturas 45. En pacientes con demencias diferentes a la EA, se observa que la frecuencia de un antecedente de caídas es hasta dos veces mayor al compararse con pacientes sin ningún tipo de demencia, mientras que los pacientes con EA tienen una prevalencia similar de caídas previas a los adultos mayores sanos. Este número aumentado de caídas en pacientes con demencia distinta a la EA es consistente con los resultados de estudios previos, en los que se reportó una mayor prevalencia de lesiones asociadas con caídas en pacientes con DCL (10,7 %) que con EA (1,1 %) 46. En otro estudio se reportó que hubo caídas múltiples en el 37 % de los pacientes con DCL en comparación con un 6 % de pacientes con EA 47.
Si se observan estos estudios, se podría decir que existe un grado de correlación importante entre DCL y caídas. Considerando que las caídas son una de las principales causas de lesiones y muertes accidentales asociadas con las demencias y el alto gasto de recursos que supone la demencia para la sociedad, las caídas y sus complicaciones representan una carga socioeconómica bastante considerable para los sistemas de salud 48. Es válido suponer que el análisis de la marcha representaría un importante marcador en las estrategias de prevención de estas enfermedades de alto costo y algunas de sus complicaciones derivadas.
Es de suma importancia prestar atención a las alteraciones en la marcha reportadas por el paciente o sus acompañantes y observarlas en el examen físico 4. Dentro de la valoración de la marcha se puede apreciar que la marcha lenta con signos parkinsonianos se asocia tanto a DCL como a cualquier otro tipo de demencia, especialmente de tipo no Alzheimer 12. Aun así, es importante resaltar que los individuos con demencias no debido a EA o demencia vascular experimentan un deterioro de funcionalidad física más rápido comparado con pacientes con EA y sin problemas cognitivos 12. Otro estudio en el que se hizo un monitoreo continuo de la marcha con sensores usados en el cuerpo evidenció que en la DCL varían más la zancada y la velocidad en comparación con pacientes con EA y controles 13.
Los pacientes con enfermedad de Parkinson (EP) priorizan primero la tarea sugerida y después establecen una postura adecuada; esta característica denominada wrong prioritization, o "priorización incorrecta" 14 también puede observarse en la DCL asociada con el paradigma del dual-task en el paciente con trastorno neurocognitivo mayor. Los pacientes cognitivamente estables con EP tienen una priorización similar a la encontrada en adultos mayores sanos, lo que parece demostrar que la priorización incorrecta que se le da a una tarea sugerida se relaciona con el grado de deterioro cognitivo 14. Por otra parte, se han relacionado dominios cognitivos específicos con un aumento en la variabilidad de la marcha y el enlentecimiento de esta, especialmente en las tareas que requieren una mayor demanda cognitiva en adultos mayores y pacientes con EA y EP 14. Adicionalmente, el congelamiento de la marcha, se ha asociado con una mayor progresión de la alteración cognitiva 14.
En los pacientes con DCL amnésica se presentó mayor compromiso en el tiempo de balanceo y variabilidad de duración de zancada en comparación con aquellos con DCL no amnésica. Al mismo tiempo, quienes presentan DCL amnésica tienen peor desempeño en ritmo y variabilidad en la marcha cuando se les compara con controles y sujetos con DCL no amnésica 15. Este mismo estudio de Taylor y colaboradores sugiere que los patrones de marcha más lentos y variables se relacionan con un aumento en el riesgo de caídas en adultos mayores con deterioro cognitivo. En este estudio se calcularon seis variables relacionadas con la marcha: velocidad (centímetros por segundo), longitud de zancada (cm), ritmo (pasos por minuto), tiempo de soporte doble (segundos), coeficiente de variación del tiempo de zancada (%) y coeficiente de variación de la longitud de pasos (%). En comparación con los pacientes que no tuvieron múltiples caídas, los que sufrieron caídas a repetición tuvieron velocidades de marcha y longitudes de zancada menores y mayor variabilidad en la longitud de sus pasos. También es notorio que los pacientes con múltiples caídas tomaban más medicamentos, presentaban más problemas cardíacos y registraban mayores diagnósticos de hipertensión y peores puntajes en la Escala de Deterioro Global (GDS) que el grupo que no tuvo múltiples caídas 15. Adicionalmente, la DCL incrementa el riesgo de caídas por una combinación de parkinsonismo, deterioro cognitivo y disfunción autonómica 49.
HALLAZGOS RADIOLÓGICOS EN LA DEMENCIA CON CUERPOS DE LEWY
Adicionalmente al cuadro clínico y los cambios en alteraciones cognitivas sugestivos de DCL, la resonancia magnética (RMN) permite evaluar algunos patrones de atrofia cerebral que pueden manifestarse durante el curso de la enfermedad 43. La presencia de cuerpos de Lewy suele iniciar en los bulbos olfatorios y progresa hacia la sustancia nigra, el sistema límbico y el neocórtex 21. Los hallazgos de pacientes con demencia en una RMN son las más de las veces inespecíficos: atrofia cerebral generalizada y lesiones en la sustancia blanca 43. Algunos autores reportan que la atrofia en el putamen y en la materia gris mesopontina se asocia más con DCL que con EA 50,51, sin embargo, las estrategias usadas para predecir el desarrollo de DCL con base en hallazgos por imágenes de RMN permanecen en elaboración.
IDENTIFICACIÓN DE LAS ALTERACIONES DE LA MARCHA
Verghese y colaboradores encontraron que la presencia de alteraciones en la marcha en adultos mayores sin diagnóstico de demencia es un predictor significativo del riesgo de desarrollo de demencia, en especial la que no se debe a EA 8. Además, recientemente se han utilizado pruebas cuantitativas para evaluar la marcha e identificar cambios que puedan ser predictores de caídas. Se ha sugerido que los cambios en las características de la marcha de personas con demencia también podrían medirse como desenlaces 8; no obstante, para que esto fuera posible haría falta definir los cambios mínimos de la marcha relevantes en el contexto clínico 16. Dentro de las pruebas desarrolladas y estudiadas en los últimos años para evaluar la marcha y predecir el riesgo de caídas en adultos mayores, se encuentran el Timed Up and Go test (TUG), el Berg Balance Scale (BBS) y el Performance-Oriented Mobility Assessment 16-18. También puede ser de utilidad evaluar el desempeño en el Dual-Task con el fin de valorar la atención orientada a la marcha y a una tarea cognitiva 4. Los resultados del TUG han tenido una buena correlación con el nivel de movilidad y han permitido evaluar otras características como el balance de la marcha y el riesgo de caídas entre los adultos mayores evaluados 17. Otra prueba que se puede realizar es el BBS, que permite evaluar balance estático y dinámico en la marcha 18. Fritz y colaboradores encontraron que el número de caídas en la última semana se correlacionó con puntajes altos en el TUG test en pacientes con DCL (r = 0,46: p = 0,04) 9 y que las personas con DCL tuvieron resultados más pobres de balance en el BBS comparados con pacientes con EA y EP (p < 0,05) 9.
Otra herramienta que debe explorarse es un signo descrito como Stops Walking When Talking (SWWT), que puede presentarse cuando se le pide al paciente que hable con un compañero mientras camina. Tiene una especificidad del 95 % pero una sensibilidad del 48 %, un valor predictivo positivo del 83 % y un valor predictivo negativo del 76 % en la población adulta mayor. No es una herramienta específica para la evaluación del paciente con DCL o con otro tipo de demencia, incluso se ha documentado dificultad replicando resultados del SWWT al comparar pacientes adultos mayores frágiles con pacientes con EP. Sin embargo, se ha evidenciado que la incapacidad de mantener una conversación al caminar es un predictor de caídas a futuro en el paciente adulto mayor 19 y ha permitido explorar el ya mencionado paradigma dual-task para valorar las interacciones entre cognición, marcha y riesgo de caídas.
También se ha estudiado la relación entre alteraciones en funciones ejecutivas y caídas. Estudios previos han encontrado asociaciones entre caídas y cambios en la sustancia blanca en adultos mayores, principalmente a nivel frontal y periventricular, regiones que pueden explicar la asociación existente entre función ejecutiva y riesgo de caídas en adultos mayores 52,53. Se han usado índices de funciones ejecutivas, proporcionados por una batería computarizada de tests neuropsicológicos (NeuroTrax Corp, Newark, NJ) y una prueba llamada Trail Making Test B; estos índices pueden ser utilizados como marcadores o predictores de caídas en adultos mayores sin deterioro cognitivo evidente. Herman y colaboradores encontraron que bajos índices de funciones ejecutivas en adultos mayores sin deterioro cognitivo evidente o antecedente de caídas aumentan el riesgo de cualquier caída hasta 3 veces 54. Adicionalmente, una revisión sistemática de 27 estudios prospectivos de cohorte, con al menos un año de seguimiento en adultos mayores sanos, encontró que los déficits en funciones ejecutivas se asocian con un mayor riesgo para cualquier tipo de caída (OR: 1,44, I C 95 %: 1,20-1,73) y caídas asociadas con lesiones graves 55.
Finalmente, desde hace algunos años se ha empezado a usar la prueba Dual-Task Paradigm para evaluar la interacción entre marcha y cognición 14, lo que ha permitido documentar que los sujetos sanos que caminan y hacen otra tarea simultáneamente reducen la velocidad de la marcha y tienen mayor variabilidad en la longitud y el tiempo de zancada. Con relación a este hallazgo, se ha documentado que los sujetos con EA o deterioro cognitivo leve disminuyen la velocidad de la marcha mientras hablan o realizan pruebas de fluidez semántica. Asimismo, en sujetos con EP también se observó disminución de la coordinación bilateral, de la velocidad de la marcha y de la fluidez verbal, por lo cual se concluyó que, a diferencia de los sujetos jóvenes, los adultos mayores priorizaron tareas motoras sobre las cognitivas 14 (figura 1).
CONCLUSIONES
Dentro de los estudios revisados observamos que existe una relación entre DCL y caídas en el adulto mayor. Existe información que sugiere que los cambios en la marcha y las pruebas de desempeño podrían tener utilidad clínica como factores asociados con esta enfermedad, así como con las caídas en adultos mayores. También parece existir una variación característica entre los parámetros de la marcha y los subtipos de demencia, lo cual podría darles valor como marcadores para su diagnóstico temprano. Se necesitan estudios que evalúen de forma más específica patrones de la marcha que puedan identificarse como marcadores de riesgo para el desarrollo de DCL y que permitan proponer intervenciones terapéuticas, como también prevenir las caídas en las personas en riesgo.