INTRODUCCIÓN
La LDM es una enfermedad de almacenamiento lisosomal, de herencia autosómica recesiva, que causa desmielinización progresiva del sistema nervioso central y periférico. En la mayoría de los casos se debe a mutaciones en el gen ARSA, que codifica para la enzima arilsulfatasa-A, o el gen PSAP, que codifica para la prosaposina. Ambas mutaciones dan como resultado la acumulación de metabolitos tóxicos; en particular, de sulfátidos, a nivel del sistema nervioso y los órganos viscerales 1.
Se ha reportado una prevalencia de la enfermedad de entre 1:40.000 y 1:160.000 en diferentes poblaciones. La frecuencia de los portadores de la mutación está entre 1:100 y 1:200. La mayoría de los datos proviene de poblaciones europeas y norteamericanas. Los hombres y las mujeres se ven afectados en igual proporción y no existen diferencias en la supervivencia según el sexo 2.
Se pueden distinguir tres formas de la enfermedad según la gravedad y la edad de aparición: infantil tardía, cuando se presenta entre los 1-2 años; juvenil, cuando debuta entre los 3-16 años; y adulta, cuando aparece a partir de los 16 años 3. A su vez, la LDM del adulto puede tener 2 presentaciones clínicas, una de predominio motor (síndrome cerebeloso piramidal) y otra con predominio de síntomas neuropsiquiátricos, siendo frecuente el debut con cambios comportamentales y demencia 4. Debido a esto, es frecuente que sea diagnosticada erróneamente como una demencia de inicio precoz o un trastorno esquizofrénico 1.
Presentación del caso
Se trata de una paciente de 33 años, sin antecedentes patológicos de importancia, perteneciente a una comunidad indígena con endogamia familiar reportada. Acudió a consulta externa de neurología por un cuadro clínico de aproximadamente 10 años de evolución que inició con cambios comportamentales dados por irritabilidad, labilidad emocional, apatía, abulia y conductas autolesivas. Posteriormente, presentó deterioro del lenguaje que progresó hacia mutismo, disminución de la fuerza muscular de predominio en miembros inferiores, con subsecuente evolución hacia incapacidad para la marcha, presencia de movimientos involuntarios en miembros superiores e incontinencia de esfínteres, con dependencia completa para las actividades básicas de la vida diaria al momento de la consulta.
Al examen físico, se encontró apática, abúlica, con afasia global, conductas de utilización y presencia de reflejos de liberación frontal (glabelar y trompa). Además, se evidenció hiperreflexia generalizada, respuesta plantar extensora bilateral, espasticidad en miembro inferior derecho, temblor fino en extremidades y distonías generalizadas, con incapacidad para la marcha y requerimiento de silla de ruedas.
Se realizó RM cerebral simple bajo sedación, en la cual se halló atrofia cortical difusa con hiperintensidad de la sustancia blanca, de predominio frontal bilateral, simétrica y confluente (figura 1). Con base en los hallazgos clínicos e imagenológicos, se solicitó actividad de la arilsulfatasa A, que reportó un valor de 10 μg/ml (valor normal: 25 μg/ ml), confirmándose así el diagnóstico clínico de LDM. Con posterioridad, se solicitó valoración por genética clínica, que solicitó a su vez secuenciación del gen ARSA para LDM, la cual demostró c.G979A (p.G327S) en estado homocigoto, y esto confirmó el diagnóstico molecular de LDM al tratarse de una patología de herencia autosómica recesiva.
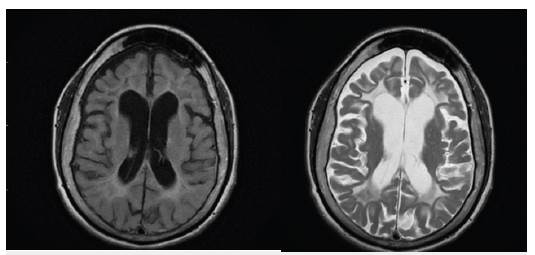
Fuente: Archivo de la historia clínica del paciente.
Figura 1 Secuencias Flair y T2, donde se encuentra una atrofia marcada para la edad de la paciente, además se encuentra un compromiso de la sustancia blanca predominio periventricular, predominio bifrontal simétrico, compatible típico en pacientes con leucodistrofias.
DISCUSIÓN
La presentación clínica de la LDM del adulto se caracteriza por pérdida paulatina de las funciones motoras finas y gruesas, asociada con una disminución marcada de la función cognitiva, lo que puede conducir a muerte prematura. Suele iniciar con psicosis, deterioro cognitivo y polineuropatía, seguido de marcha espástica-atáxica y disfunción vesical. También puede encontrarse ceguera cortical y atrofia del nervio óptico 1. La progresión de los síntomas está condicionada principalmente por 2 factores: la edad de comienzo de la enfermedad y las características de los primeros síntomas (cognitivos, motores o mixtos). En comparación con la forma infantil tardía, la LDM del adulto presenta una tasa de progresión más lenta. Adicionalmente, se ha observado que esta es más rápida cuando el debut es con síntomas motores, asociados o no con síntomas cognitivos 5,6.
La gran mayoría de los casos de LDM del adulto se producen por mutaciones en el gen ARSA, las cuales conducen a deficiencia de la enzima arilsulfatasa A, que es la responsable del primer paso en la ruta de degradación del esfingolípido 3'-O-sulfogalactosilceramida, también conocido como sulfátido. Los sulfátidos constituyen aproximadamente un 4 % de toda la mielina en el sistema nervioso, cuya importancia radica en que envuelve los axones en forma de espiral y garantiza el aislamiento eléctrico y la conducción rápida del impulso saltatorio. Cuando existe deficiencia de la arilsulfatasa-A por mutaciones en el gen ARSA, los sulfátidos no se pueden degradar, por lo que se acumulan y ocasionan fallos en el proceso de mielinización que a su vez resultan en los diversos síntomas neurológicos que caracterizan a esta patología. En la actualidad se han identificado más de 110 mutaciones en el gen ARSA que pueden causar LDM, siendo más frecuentes las de tipo missense. Los pacientes que son homocigotos para los alelos que no permiten la síntesis de la ARSA funcional siempre padecen la forma más severa de la enfermedad infantil-tardía. Muchos pacientes con LDM del adulto son homocigotos para alelos que permiten la expresión de bajas cantidades de la enzima que prolongan el proceso de acumulación de sulfátidos y, por tanto, explican el inicio tardío y la progresión más lenta de los síntomas 7.
El diagnóstico de la LDM del adulto suele ser complejo, ya que a menudo se confunde con esquizofrenia u otros tipos de trastornos mentales, lo que retrasa el inicio del tratamiento. En la actualidad, el diagnóstico se sospecha a partir de las manifestaciones clínicas y los hallazgos típicos en la RM cerebral (desmielinización progresiva a nivel de la sustancia blanca central y periventricular), y se confirma con la demostración de deficiencia en la actividad enzimática ARSA en fibroblastos cutáneos o leucocitos, o con la secuenciación del gen ARSA que confirme una mutación en el mismo. Otros enfoques, como la determinación del nivel de sulfátidos en plasma y orina empleando espectrometría de masas, la determinación cuantitativa de metabolitos en tejidos mediante espectroscopia de resonancia magnética y la evaluación del tamaño del nervio periférico con el uso de ultrasonido pueden brindar información para diagnóstico y evaluación de la efectividad del tratamiento MLD 8.
Hasta la fecha no existe tratamiento curativo para la LDM. Se ha demostrado que algunos pacientes con la forma juvenil de la enfermedad podrían beneficiarse de trasplantes de médula ósea, mientras que otros con LDM del adulto podrían beneficiarse de trasplantes alogénicos de células madre hematopoyéticas, que enlentecen la progresión de la enfermedad cuando se inician en las primeras etapas de esta. También se ha estudiado la efectividad de la administración directa al sistema nervioso de vectores virales que codifican para el gen ARSA, y se han obtenido resultados conflictivos. En pacientes en fase presintomática de la enfermedad o con síntomas tempranos, la combinación de terapia génica y trasplante autólogo de células madre hematopoyéticas ha mostrado resultados prometedores y continúa en estudio. Entre las medidas sintomáticas disponibles, se encuentran los fármacos antiepilépticos en caso de crisis, los relajantes musculares, la fisioterapia y el tratamiento antiinflamatorio con inmunoglobulina intravenosa. Este manejo ayuda a aliviar los síntomas, pero no modifica la velocidad de progresión de la enfermedad 8.
La paciente reportada debutó con alteraciones cognitivas progresivas y posteriormente presentó alteraciones motoras y disfunción vesical. El diagnóstico se sospechó a partir del cuadro clínico y el hallazgo típico en la RM cerebral de hiperintensidad de la sustancia blanca periventricular de predominio frontal, bilateral y confluente. Se confirmó con la detección de actividad deficiente de la ARSA y secuenciación del gen, con evidencia de mutación en estado homocigoto. Difiere de otros casos que han sido reportados en la literatura, debido a que presentó una progresión relativamente rápida de los síntomas, a pesar de haber debutado con síntomas cognitivos y en la edad adulta, cuando suele ser más leve. Ha acudido a rehabilitación con fisioterapia, sin lograr modificación de la calidad de vida y los síntomas motores, posiblemente debido al inicio tardío de esta. En la actualidad, es dependiente para la realización de todas las actividades básicas de la vida diaria.
CONCLUSIÓN
La leucodistrofia metacromática del adulto es una enfermedad poco conocida cuyo diagnóstico suele realizarse de manera tardía, lo que dificulta el abordaje integral del paciente. A pesar de que aún no se ha encontrado una terapia modificadora de la progresión de la enfermedad, el manejo adecuado de los síntomas puede mejorar de manera significativa la calidad de vida de los pacientes. Además, permite brindar de manera oportuna la asesoría genética pertinente, dado el tipo de herencia y el riesgo de recurrencia. Debido a esto, es importante dar a conocer la patología para que pueda ser reconocida de manera temprana, diagnosticada oportunamente y tratada desde un aspecto multidisciplinario e integral.














