INTRODUCCIÓN
El aumento progresivo y sostenido del envejecimiento poblacional mundial, unido a varios factores de riesgo cardiovascular, ambientales y relacionados con estilos de vida, ha puesto de manifiesto un variado número de problemas médicos y retos en salud pública, entre los que se encuentran la enfermedad cerebrovascular (ECV) y las demencias, incluida la enfermedad de Alzheimer (EA). Se trata de temas que se encuentran unidos entre sí, no solo por factores de riesgo como la hipertensión arterial (HTA) y la diabetes mellitus (DM), sino también por su causalidad, fisiopatología y por condiciones como el deterioro cognitivo y la demencia de origen vascular.
La ECV está conectada intrincadamente con la EA. La ECV aumenta el riesgo de desarrollar trastornos demenciales como la EA, deterioro cognitivo vascular (DCV) y demencia vascular (DV) 1,2. Se reporta que cerca del 50 % del riesgo de EA se de deriva de los factores de riesgo cardiovascular tradicionales 3, los cuales a su vez están epidemiológicamente asociados con DCV y DV
La ECV constituye la tercera causa de muerte en el mundo, además de ser considerada una de las principales causas de discapacidad adquirida en personas adultas, incluyendo formas graves de limitación en el funcionamiento 4-7. Engloba un conjunto de condiciones que comparten alteraciones del flujo sanguíneo cerebral global, cortical o subcortical del sistema nervioso central (SNC), lo cual lleva a un inadecuado funcionamiento focal o generalizado del tejido cerebral 8,9.
En personas mayores de 60 años, la ECV se reporta como la segunda causa de muerte 10. Se calcula que alrededor de un 60 % de las personas que han experimentado una ECV presentarán deficiencias menores, y entre 30 % y 40 % una deficiencia grave, incluida la demencia, por lo que se le considera la principal causa de discapacidad no secundaria a traumatismo en personas adultas en el mundo 10-12.
En el transcurso del infarto cerebral, de pequeña o gran extensión cortico-subcortical, las células atravesarán diversas fases de falla sináptica, de membrana y de integridad nuclear que, de no restaurarse del flujo sanguíneo, ocasionarán la muerte neuronal, y según su magnitud, mayor lesión vascular, pudiendo causar DCV o DV. El DCV puede ocurrir hasta en el 60 % de las personas, con la capacidad de evolucionar al espectro de la demencia vascular esporádica: demencia multiinfarto, demencia por infarto estratégico y demencia por enfermedad isquémica de pequeñas arterias 10.
El DCV se caracteriza por la afectación de funciones mentales superiores, especialmente la atención, y, secundariamente a la ubicación de la lesión vascular, se podrán presentar manifestaciones psiquiátricas como depresión 13, ansiedad, síntomas psicóticos e insomnio 10.
El propósito de este trabajo es hacer una revisión narrativa del deterioro cognitivo de origen vascular y del espectro de la demencia vascular esporádica, para ofrecer información y datos clínicos con énfasis neurocognitivo que permitan su caracterización y ser útil en la práctica clínica, teniendo presente aspectos de epidemiología, fisiopatología, manifestación clínica y características imagenológicas.
MATERIALES Y MÉTODOS
Se llevó a cabo una búsqueda de la literatura en bases de datos como Google Académico, Scielo, Elsevier, Medigraphic, Ebsco, Research Gate, Scopus y Medline. Los términos de búsqueda utilizados fueron: "Enfermedades cerebrovasculares", "Accidente cerebrovascular", "Demencia vascular", "Deterioro cognitivo vascular" e "Infarto cerebral". Los criterios de elegibilidad fueron: revisiones de tema y artículos originales publicados en revistas indexadas en los últimos 15 años, publicados en inglés o español, e investigaciones en humanos. Se excluyeron aquellas publicaciones que no cumplieran con los criterios de búsqueda, que no se encontraran en revistas indexadas, y cuyo año de publicación superara los 15 años, exceptuando en relación con el año de publicación aquellos artículos que correspondieran a la publicación original de un tema médico específico.
ENFERMEDAD CEREBROVASCULAR E INFARTO CEREBRAL: ASPECTOS GENERALES
La ECV se explica como un suceso agudo o grave con diversos signos clínicos de perturbación de la función cerebral global o específica/focal, con la presencia de síntomas que pueden persistir hasta 24 horas o más, y que pueden llevar a la muerte 4,14-16.
Dentro del espectro de la ECV, la forma que tiene una alta morbimortalidad, incluyendo deficiencias permanentes que originan discapacidad, es el infarto cerebral o ataque cerebrovascular (ACV). El riesgo de experimentar un ACV es más frecuente en la edad adulta, se incrementa con el envejecimiento, pero puede presentarse en adultos jóvenes 11,12.
Existen factores de riesgo que aumentan la probabilidad de experimentar un ACV. Entre los no modificables se encuentran la edad, el sexo, la etnia y la genética. Entre los modificables, fundamentales para la intervención, están la hipertensión arterial (HTA), la diabetes mellitus (DM), las cardiopatías, la dislipidemia, el sedentarismo, la dieta, la obesidad, el síndrome metabólico, el consumo de alcohol, el abuso de sustancias y el tabaquismo 4,14-16, el estrés, la contaminación ambiental y las alteraciones en el patrón de sueño 17.
Fisiopatológicamente, el ACV se clasifica en isquémico y hemorrágico. El ACV isquémico, agudo o de varios episodios, se caracteriza por una trombosis de un vaso arterial cerebral, capaz de generar deficiencias estructurales y funcionales en determinadas regiones del encéfalo 8,10,18. Las particularidades clínicas dependerán de la parte o región cortical, subcortical o cortico-subcortical tributaria del territorio vascular comprometido 17,19.
El ACV hemorrágico se presenta por la ruptura de un vaso sanguíneo, con una acumulación o extravasación de sangre en el parénquima cerebral o en el espacio subaracnoideo 8. Las manifestaciones clínicas dependen del lugar del encéfalo donde se presente el sangrado, así como del volumen del hematoma, la presencia de complicaciones y la etiología 20.
En cuanto a la incidencia, el ACV isquémico es más frecuente que el hemorrágico. Alrededor de un 70 % a 85 % es isquémico 19, tanto en adultos mayores como en jóvenes, y su prevalencia es mayor en países desarrollados 11,12,21. En alrededor del 43 % de los pacientes con ictus de etiología aterotrombótica, un evento isquémico transitorio puede preceder a un ACV isquémico capaz de generar discapacidad 22.
Se han encontrado diferentes fallas cognitivas posteriores a un ACV, según el lado comprometido: a) en ACV izquierdo suele presentarse recuerdo inmediato pobre, con dificultades en el reconocimiento y el aprendizaje, sin embargo, su retención está intacta y muestra una alteración en la codificación de la información 23. Como estrategia de compensación, tienden a apoyarse más en la memoria de trabajo y a utilizar diferentes regiones del hemisferio izquierdo 23; b) en ACV derecho se encuentran, gracias a la repetición, mejoras en los diferentes modos de recuerdo a lo largo del tiempo, aunque, posiblemente por problemas de codificación, su desempeño continúa siendo deficiente 24. De manera compensatoria, se benefician de la práctica y repetición de información importante, como también del uso de estrategias para favorecer la codificación 24.
Junto con el rendimiento cognitivo, es importante tener en cuenta el factor emocional en pacientes que han experimentado un ACV, puesto que cerca de 15 millones de personas en el mundo post-ACV tienen riesgo de desarrollar depresión 25. Además, se reporta que el 31 % de las personas que sobreviven a un ACV sufre depresión en cualquier momento hasta 5 años después.
Según el mecanismo de oclusión, en el infarto cerebral puede hablarse de ateroesclerosis de grandes vasos, enfermedad de pequeños vasos 26, embolismo cardíaco, además de otras causas no comunes o indeterminadas, siendo la ateroesclerosis de grandes vasos el mecanismo más frecuente 27,28.
La aterosclerosis de grandes vasos o aterosclerosis extra-craneal afecta la bifurcación carotídea, la porción proximal de la carótida interna y el origen de las arterias vertebrales 27. La enfermedad de pequeños vasos abarca el infarto lacunar, la leucoaraiosis y los microsangrados 29. El infarto lacunar es el más conocido y explica aproximadamente el 25 % de los infartos cerebrales 27. El embolismo cardíaco representa alrededor del 20 % al 30 % de las isquemias cerebrales 30. El infarto cardioembólico es un infarto cuyo tamaño suele ser medio o grande, y su topografía suele ser cortical 17.
RELACIÓN FISIOPATOLÓGICA ENTRE HIPERTENSIÓN ARTERIAL Y DIABETES CON EL DETERIORO COGNITIVO Y DEMENCIA VASCULAR
Existe una íntima relación entre el sistema cerebrovascular y el tejido nervioso que influye en el desarrollo, el mantenimiento y la integridad neuronal. Los factores de riesgo vascular pueden llevar a una disfunción de los tejidos que recubren los vasos sanguíneos, lo que puede causar alteración neurovascular, aumento en la permeabilidad de la barrera hematoencefálica y trombosis neurovascular, aspectos claves en las lesiones cerebrales detrás de DCV y DV 31.
En la figura 1 se muestra una síntesis de varios factores implicados en el mecanismo según el cual los factores de riesgo tipo HTA y DM llevan a deterioro cognitivo y demencia. Nótese que hay factores que son comunes.
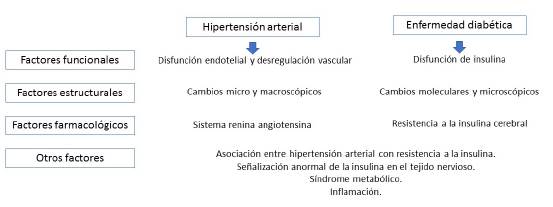
Fuente: elaboración propia.
Figura 1 Síntesis de posibles mecanismos que vinculan la hipertensión arterial y la enfermedad diabética con el deterioro cognitivo y la demencia
Los factores funcionales de la HTA conducen a una respuesta hiperémica alterada, en la que se ve afectada la regulación del flujo sanguíneo cerebral y se presenta hipotensión arterial relativa (p. ej., dificultades en el descenso de la presión arterial nocturna), lo cual se asocia con un menor aclaramiento del β amiloide producido en el tejido nervioso. En los factores estructurales de la HTA sobresale la leucoaraiosis, el aumento en la concentración de placas neuríticas y ovillos neurofibrilares, más atrofia cerebral. Además, la HTA tiene factores farmacológicos entre los cuales la angiotensina II inhibe la liberación de acetilcolina, en tanto que la estimulación de los receptores AT 2 del sistema renina-angiotensina se relacionan con efectos neuroprotectores 2,32.
Los factores funcionales y farmacológicos en la DM, centrados en las alteraciones de la señalización y del funcionamiento de la insulina, llevan a niveles efectivos de insulina en el tejido nervioso más bajos y presencia de glicación avanzada de productos finales, aspectos que se asocian con producción inadecuada de acetilcolina. Adicionalmente, se debe tener presente que la enzima encargada de la degradación de insulina se encuentra funcionalmente relacionada con la degradación de β amiloide cerebral 2.
DETERIORO COGNITIVO VASCULAR Y DEMENCIA VASCULAR ESPORÁDICA
El último Consenso para la Clasificación del Deterioro Cognitivo Vascular (VICCCS, por sus siglas en inglés) señala que el término demencia se refiere a un deterioro lento y progresivo de al menos un dominio cognitivo cuya severidad compromete la autonomía de la persona, lo que afecta su vida diaria y cuyo principal factor de riesgo es el envejecimiento. Adicionalmente, asociaciones americanas y canadienses han propuesto un segundo requisito a tener en cuenta para diferenciar la gravedad del deterioro cognitivo menor o mayor, y es la presencia en imágenes de alguna enfermedad cerebrovascular 31.
Entre un 30 % y un 40 % de las personas con ECV experimentan deficiencias graves, asociadas con discapacidad física o deterioro cognitivo, las cuales involucran pérdidas o disminuciones en el rendimiento en una o varias de las funciones mentales superiores 10.
El deterioro cognitivo puede clasificarse en trastorno neurocognitivo menor y trastorno neurocognitivo mayor; en algunos casos, el déficit leve puede evolucionar hasta demencia, lo cual supone un déficit persistente en las funciones mentales que afecta el desempeño de la persona en su vida diaria 10,26,33,34.
El DCV y el DV se originan por lesiones vasculares o circulatorias en el parénquima cerebral 35. Se reporta que después de tres meses de haber experimentado una ECV, un 20 % a 30 % de los pacientes serán diagnosticados con demencia y entre 10 % y 35 % con deterioro cognitivo 10,36,37.
La DV es el segundo tipo de demencia más frecuente, luego de la enfermedad de Alzheimer 38,31, su evolución es escalonada a medida que se van presentando ataques isquémicos transitorios o infartos cerebrales 39. Alrededor del 10 % de los pacientes que han tenido un ACV tenían demencia con anterioridad, el 10 % desarrolla una demencia al poco tiempo de su primer ACV, lo cual varía debido a características clínicas y a la gravedad vascular, y cerca del 33 % desarrollará demencia tiempo después de un ACV recurrente 31,40. Con relación a la tasa poblacional, la probabilidad de desarrollar demencia se puede acelerar en alrededor de 25 años en el caso de desarrollar un ACV grave, 4 años en el caso de un ACV menor y 2 años en el caso de un ataque isquémico transitorio 31.
El DCV puede tener origen familiar o esporádico. El subtipo familiar más común se denomina arteriopatía cerebral autosómica dominante con infartos subcorticales y leucoencefalopatía (CADASIL), causada por una mutación genética en el gen Notch3 41. El subtipo esporádico se puede clasificar de acuerdo con su etiopatogenia, en demencia multiinfarto, por infarto estratégico y por enfermedad isquémica de pequeñas arterias 10,41.
La neuropatología de la DV es heterogénea: desde hemorragias e infartos hasta lesiones hipóxico-isquémicas globales. Lesiones en la sustancia blanca con o sin pérdida axonal se pueden presentar en casos de DV, pero no es exclusivo de esta, al igual que en la atrofia cortical y en la esclerosis hipocampal se pueden presentar casos de hipoxia focal o difusa 31.
La DV tiene varios subtipos, de acuerdo con los cuales en el proceso diagnóstico de alguna de estas no se requiere la presencia exclusiva de amnesia, puesto que se ha observado mayor deterioro en funciones ejecutivas y velocidad de procesamiento, además de dificultad en cuanto a evocación de lista de palabras y contenido visual 31.
DEMENCIA MULTIINFARTO
La demencia multiinfarto o post-ictus involucra varios infartos a lo largo del tiempo 42,43. Es la más común de las demencias vasculares 44, y se presenta por la oclusión arterial cerebral de vasos arteriales grandes o pequeños, así como arteriolas 43, lo cual ocasiona la destrucción del parénquima cerebral, por lo que no puede ser ligada a un solo vaso o a un grupo de vasos específicos. Su inicio es agudo, su evolución es progresiva y sus periodos intermedios de estabilización, junto a los periodos de empeoramiento, suelen coincidir con nuevos infartos 45. A medida que aparecen nuevas isquemias e infartos cerebrales, progresa el deterioro neurocognitivo y disminuye la independencia funcional. Es frecuente que su causa sea la aterosclerosis que afecta a vasos sanguíneos grandes tanto intra como extracraneales, con trombosis o émbolos locales 42,44,46.
No se ha determinado el número de episodios isquémicos necesarios para que se desarrolle un déficit cognitivo marcado 47, sin embargo, un menor rendimiento cognitivo y un mayor riesgo de demencia se ven correlacionados con la extensión y el número de los territorios afectados 48.
Las consecuencias cognitivas pueden presentar un inicio abrupto y precoz 40, y no se consideran uniformes, pero sí acumulativas 10, y dependen, en gran parte, de la localización de los infartos 40,44. Según su localización, puede producir afectaciones en los dominios de lenguaje, función ejecutiva, visuoespacial o perceptiva, cálculo y memoria 45,49, así como la atención, alteraciones conductuales y afectivas, más compromiso de la marcha 38. A más infartos, la mayoría de las funciones cognitivas se deterioran, siendo así evidente la demencia 44.
Es común que se presenten signos neurológicos focales como hemiparesia, hemianopsia, síndrome sensitivo, entre otros 45, los cuales pueden presentar una recuperación completa o parcial. Antes del deterioro cognitivo, se puede observar trastornos urinarios y de marcha 44.
En relación con el diagnóstico por neuroimágenes, se encuentran reducciones regionales parcheadas del flujo sanguíneo cerebral en la distribución de ambas arterias cerebrales medias; asimismo, se observan áreas con un daño marcado y otras sin daño alguno, donde se ven involucradas, de manera bilateral, estructuras como el tálamo y la corteza frontal y temporal circundante 44,47) a regiones perisilvianas. Estos infartos se visualizan como áreas hipodensas en la tomografía computarizada y como áreas hiperintensas en la resonancia magnética 44.
DEMENCIA POR INFARTO ESTRATÉGICO
El mecanismo vascular se da por la obstrucción de pequeños vasos o vasos de mediano calibre, por embolismo o trombosis, que disminuyen el flujo sanguíneo de forma sostenida, lo cual ocasiona infartos localizados que comprometen la corteza y la sustancia blanca subyacente 50 en sitios con gran conectividad que regulan funciones ejecutivas y comportamiento 43.
Puede ocurrir por microinfartos en el hipocampo o en los núcleos paramedianos del tálamo 51) y su inicio puede ser agudo o con déficit escalonado de las funciones ejecutivas. Los déficits cognitivos dependerán de la región cerebral afectada, de la siguiente manera 44,46,52,53: a) prefrontal subcortical, que puede ser el 51 % de los casos, se afectará la función ejecutiva; b) región hemisférica izquierda, alrededor de un 36 % de los casos, se presentarán afasias o síndrome de Gerstman; c) región hemisférica derecha, 15 % de los casos, se presentarán agnosias, heminegligencia y aprosodias; d) formación del hipocampo, 22 % de los casos, se presentarán amnesias y trastornos emocionales; y e) región occipitotemporal, alrededor del 6 % de los casos, afectará el procesamiento y las asociaciones visuales.
Cuando el infarto se ubica en el giro angular del hemisferio dominante causa el síndrome de Gerstmann, caracterizado por agnosia digital, confusión en la lateralidad del cuerpo, discalculia y disgrafía, además de alexia, hemianopsia visual, heminegligencia izquierda grave y afasia anómica 44,54.
El infarto talámico o de otros sitios subcorticales estratégicos puede ser uni o bilateral en el territorio de las arterias paramedianas, en el núcleo dorsomedial o en los núcleos intralaminares, y esto ocasiona amnesia vascular talámica, con predominio de déficit en la memoria anterógrada declarativa a largo plazo, asociada con trastornos conductuales como desorientación, agitación, agresividad y apatía, hasta déficit disejecutivo conocido como demencia talámica. En caso de infarto extenso con ubicación tuberotalámica en el hemisferio dominante, se reporta la presencia de anomia, afasia y acalculia. Cuando la lesión afecta el lado no dominante se presenta deterioro en la memoria visual 44,55.
En algunos casos, la única manifestación será la demencia, que se enfoca inicialmente como una enfermedad neurodegenerativa 44. Los déficits cognitivos, además de variables, ocasionalmente son regresivos, y se dan por abulia, apatía, hipomodulación y falta de iniciativa, por lo que pueden ser confundidos con un trastorno depresivo o adaptativo 50.
Las lesiones se encuentran principalmente en el hipocampo, en el tálamo medial, en el núcleo caudado o el giro del cíngulo posterior 48,56; también se reportan en la circunvolución angular, en el prosencéfalo basal, en el núcleo putamen y en el territorio de la arteria cerebral anterior 40.
DEMENCIA POR ENFERMEDAD ISQUÉMICA DE PEQUEÑAS ARTERIAS
La demencia por enfermedad isquémica de pequeñas arterias incluye lesiones corticales y subcorticales secundarias a infartos lacunares, lesiones difusas en la sustancia blanca y lesiones en la enfermedad de Binswanger. Se caracteriza por déficit en la velocidad de procesamiento de la información y alteraciones en las funciones ejecutivas con preservación de la memoria episódica 10.
Sus causas se relacionan con la edad, hipertensión arterial y angiopatía amiloide cerebral 44, con predominio de arteriosclerosis e infartos lacunares 57. Es común que se dé por lesiones subcorticales, sin embargo, hay casos esporádicos con pequeños infartos corticales. Estas lesiones se encuentran en pequeñas arterias perforantes y arterias terminales 42. Es común que se vean afectadas las arterias pequeñas como las arteriolas, las vénulas y los capilares en la profundidad de los hemisferios cerebrales 44.
Es característico que las personas con este tipo de demencia presenten trastornos en la marcha, en el humor, en la conducta y en el control de esfínteres. Estos signos pueden ser leves, pero a medida que progresa la enfermedad, se comienza a evidenciar la demencia, junto con incapacidad para caminar, caídas frecuentes y síntomas comportamentales como apatía y depresión, incontinencia urinaria y signos motores extrapiramidales 44.
Las lesiones implicadas en el deterioro cognitivo secundario a este tipo de demencia se pueden apreciar de manera combinada, y se clasifican en tres tipos: lesiones isquémicas de la sustancia blanca, infartos lacunares y hemorragias. En las tres presentaciones se espera que la enfermedad progrese, y se considera un trastorno potencialmente mortal y discapacitante 44.
Lesiones isquémicas de la sustancia blanca
En la RM se pueden observar áreas convergentes, situadas bilateral y simétricamente en la sustancia blanca hemisférica periventricular o subcortical. En la tomografía computarizada se observan áreas hipodensas alrededor de los cuernos frontal y occipital de los ventrículos laterales, que se encuentran a menudo extendidas a la sustancia blanca frontal subinsular y de los centros semiovales. Para nombrar estas lesiones, en 1986 Hachinski et al. 58 introdujeron el término de leucoaraiosis.
Es común que los cambios de la sustancia blanca ocurran en el sistema arterial, no obstante, también se puede producir un engrosamiento de las paredes de las venas periventriculares y de las vénulas por depósito de colágeno. Es posible, asimismo, que el engrosamiento aumente con la edad, y el riesgo es aún mayor cuando existe leucoaraiosis. Este engrosamiento puede inducir isquemia crónica o edema en la sustancia blanca profunda, lo cual conduce a la pérdida capilar y a efectos más generalizados en los hemisferios cerebrales 57.
Se reporta una asociación de la leucoaraiosis con el declive cognitivo y funcional. Generalmente, en las lesiones periventriculares hay un mayor deterioro que si la lesión es profunda 44.
Infartos lacunares
Estos infartos se pueden presentar de forma cortico-subcortical 57, hacia la corona radiada, los núcleos basales, la cápsula interna, el tálamo y la base de la protuberancia. Se acepta habitualmente que tienen un diámetro máximo de 15 mm, y su localización y confluencia son factores asociados con el deterioro cognitivo 44.
Cuando se presenta como síndrome lacunar, presenta diversas manifestaciones clínicas: hemiparesia motora pura, síndrome sensitivo puro, síndrome sensitivo-motor, hemiparesia atáxica, disartria-mano torpe, o síndrome lacunar atípico. Igualmente, se puede presentar como un ataque isquémico transitorio o como un hallazgo asintomático en la neuroimagen 44.
Hemorragias
Al describirse la enfermedad de pequeño vaso, se ha encontrado que una de sus manifestaciones corresponde a hemorragias cerebrales, las cuales pueden clasificarse como hemorragias grandes o microhemorragias 44.
Es fácil reconocer las lesiones hemorrágicas grandes en las neuroimágenes. Las microhemorragias, por otro lado, se observan como pequeñas áreas de 5 mm, que representan patológicamente un depósito focal de hemosiderina asociado con eventos hemorrágicos previos. El número y la localización de microhemorragias puede ser asociado con disfunción ejecutiva en pacientes con ECV isquémica 44.
RECOMENDACIÓN DE ALGUNOS PARÁMETROS PARA EVALUAR EN IMÁGENES
Las imágenes en el DCV buscan apoyar la descripción de la enfermedad, por tanto, es fundamental especificar el tamaño y la ubicación de las diferentes lesiones. Se deben registrar datos sobre la presencia de grandes o pequeños infartos, así como hemorragias agudas, agrandamiento de los ventrículos y demás patologías halladas 59. Con respecto a la neuroimagen para el diagnóstico de la DV se deben de evaluar medidas centrales como: atrofia cerebral, incluyendo atrofia general, hiperintensidad de materia blanca, número de infartos y tamaño 31. Para tal fin, se considera que la resonancia magnética (RM) tiene un mayor grado de percepción, si se la compara con la tomografía axial computarizada (TAC) 59,60, sobre todo en lesiones pequeñas debido a la edad en la sustancia blanca.
Los microinfartos cerebrales (MIC) se pueden identificar fácilmente a través de una inspección microscópica 61, o utilizando RM de 7 teslas, con la que se pueden distinguir diferentes tipos histopatológicos de MIC intracorticales y agudos, teniendo claro que son altamente heterogéneos. Se reporta que la presencia de uno o dos MIC en muestras limitadas, podría ser un indicio de más lesiones en el resto del cerebro 61.
Tanto los cambios en la sustancia blanca como los MIC se correlacionan fuertemente con el deterioro cognitivo y la demencia, tanto en pacientes con demencia como en ancianos sanos 60-62. De igual manera, se ha encontrado que ciertos factores de riesgo cerebrovasculares tienen una relación directa con estas manifestaciones, entre ellos está la edad, ACV clínicamente silencioso, presentar una presión arterial sistólica alta, ser mujer, antecedentes de tabaquismo e hipertensión, y bajos ingresos económicos 63. Por tanto, estos hallazgos en la RM se podrían tomar como marcadores de alteraciones tempranas 59,60,63.
ASPECTOS NEUROPSICOLÓGICOS
El DCV se puede presentar solo o junto a otras condiciones, pudiéndose encontrar todos los dominios cognitivos afectados. Sin embargo, predominan las fallas en funciones ejecutivas, específicamente en velocidad de procesamiento, memoria de trabajo y atención alternante. Por esto, los protocolos neuropsicológicos deben ser sensibles a diferentes dominios cognitivos, enfatizando en corteza prefrontal 59. En el 2006, el Instituto Nacional de Trastornos Neurológicos y ACV y la Red Canadiense de ACV crearon 3 protocolos, de diferente duración, acordando estándares neuropsicológicos de DCV 59,64.
El protocolo de 60 minutos se enfoca en cuatro dominios cognitivos. El domino ejecutivo-activación busca evaluar lo ejecutivo-cognitivo, lo emocional-autorregulador, y las demás funciones prefrontales. El de lenguaje, se enfoca en la nominación, teniendo en cuenta la fluidez semántica que puede tener un valor discriminativo entre un deterioro cognitivo y un envejecimiento normal, así como entre el Alzheimer y el DCV. En el dominio visuoespacial se evalúan habilidades organizativas y visuo-perceptivas. Para el de memoria-aprendizaje se evalúa el recuerdo inmediato y de corto plazo, considerando la interferencia y el recuerdo con pistas, factores sensibles al DCV. Además, se utilizan cuestionarios para el estado emocional y conductual del paciente, así como su estado premórbido 59.
El protocolo de 30 minutos cuenta con baterías para las funciones cognitivas en general, así como pruebas sensibles al DCV enfocadas en la fluidez verbal, la velocidad de procesamiento y activación, la evocación libre y con claves, así como aspectos emocionales y comportamentales. El de 5 minutos incluye tareas de orientación, memoria y fluidez fonética 59,64. Este último protocolo podría ser útil para identificar de forma temprana personas con alto riesgo de desarrollar demencia luego de un ACV, y así realizar una intervención pertinente 64.
¿SE PUEDE HABLAR DE PREVENCIÓN?
Los procesos y las contribuciones vasculares al deterioro cognitivo se constituyen en factores potencialmente modificables de las demencias 2. Es claro que la promoción de estilos de vida saludable que incluyan la realización de ejercicio y el control de factores de riesgo cardiovascular impacta positivamente en la salud cognitiva, en especial en adultos mayores, en el contexto de envejecimiento cognitivo 65.
Los aspectos terapéuticos de intervención en el caso del DCV necesitan enfocarse no solo en el tratamiento antidemencial, sino también en los problemas y los factores de riesgo cerebrovasculares subyacentes, buscando una recuperación funcional del paciente. Esto incluye el manejo de los síntomas, los factores de riesgo y las aproximaciones de terapia no farmacológica enfocada en la prevención de la progresión del deterioro cognitivo 66.
En la literatura se promueve construir una adecuada reserva cerebral, en la cual se incluyen factores como la densidad neuronal y sináptica, más la reserva cognitiva, que permite el empleo eficiente de los recursos cerebrales existentes y el mantenimiento de la red neuronal que puede actuar como un factor protector en cuanto a retardar o prevenir la progresión del DCV a DV 66. El reto está planteado: salud cerebral y vitalidad cognitiva 2.
CONCLUSIONES
La ECV es una causa importante de deficiencias neuro-cognitivas y discapacidad adquirida en la población adulta.
El deterioro cognitivo en personas con ECV involucra pérdidas o disminución en el rendimiento en una o varias funciones mentales superiores. En ciertos casos, el deterioro cognitivo evoluciona hasta la demencia, donde un déficit permanente en las funciones mentales afecta de manera importante el desempeño y el funcionamiento de la persona.
El deterioro cognitivo vascular puede tener un origen familiar o esporádico, el subtipo familiar más común se denomina Cadasil, y el subtipo esporádico se clasifica en demencia multiinfarto, demencia por infarto estratégico y demencia por enfermedad isquémica de pequeñas arterias.
La demencia multiinfarto o post-ictus involucra varios infartos a lo largo del tiempo. A medida que aparecen nuevas isquemias e infartos cerebrales, progresa el deterioro neurocognitivo y disminuye la independencia funcional. Sus consecuencias cognitivas no se consideran uniformes, pero sí acumulativas.
La demencia por infarto estratégico se produce por infartos o hemorragias ubicadas en áreas específicas corticales o subcorticales que regulan las funciones ejecutivas y del comportamiento. Las áreas cerebrales que la explican (infartos ubicados en) son: región prefrontal subcortical, formación del hipocampo, núcleo dorsomedial o intralaminares del tálamo, región tuberotalámica, giro angular, núcleo putamen o caudado y región occipitotemporal.
La demencia por enfermedad isquémica de pequeñas arterias incluye lesiones corticales y subcorticales tipo infartos lacunares, lesiones difusas en la sustancia blanca y lesiones en la enfermedad de Binswanger. Se caracteriza por déficit en la velocidad de procesamiento de la información y alteraciones en las funciones ejecutivas con preservación de la memoria episódica, con un curso insidioso y progresivo.














