INTRODUCCIÓN
El ataque cerebrovascular (ACV) es una lesión neurológica y una emergencia médica que induce daños en el tejido cerebral. Según el estudio de carga mundial de enfermedad realizado en el 2019, es la segunda causa de muerte en el mundo y la segunda enfermedad responsable de años de vida ajustados a la discapacidad (AVAD) entre 1990 y el 2019 1. Asimismo, en la estadística vital del Departamento Administrativo Nacional de Estadística (DANE), la enfermedad cerebrovascular (ECV) representó la segunda causa de muerte en Colombia durante el 2018 2, lo que demuestra la importancia de asegurar una apropiada intervención y así evitar las distintas complicaciones derivadas de estos eventos.
A partir de ello, la prevención primaria y secundaria han tomado fuerza, lo cual se ve reflejado en diferentes estudios de ACV que indican que a una mayor disminución de colesterol de baja densidad (C-LDL) hay una reducción proporcional de la enfermedad. Los fármacos a los que se les atribuye esta acción hipolipemiante son las estatinas, que bajan los niveles de colesterol total (CT) y C-LDL 3. Asimismo, la literatura señala que las estatinas son útiles en la reducción de ACV 4 y muestran que en comparación las altas dosis reducen el riesgo de eventos en mayor medida que las dosis estándar 5. La presente revisión narrativa de la literatura tiene la intención de sintetizar la más importante evidencia disponible sobre los niveles de C-LDL, los hipolipemiantes y su relación con ACV, como estrategia de difusión de la información en nuestra población.
FISIOPATOLOGÍA
Los lípidos son biomoléculas orgánicas que actúan como sustratos energéticos que se almacenan en forma de triglicéridos en el tejido adiposo 6. Entre ellos, el colesterol requiere lipoproteínas que permitan su distribución hacia tejidos periféricos. Aquellas de importancia médica son de alta densidad (HDL) y de baja densidad (LDL). Esta última, en condiciones patológicas, hace parte de la formación de la placa aterosclerótica.
La aterosclerosis es una condición inflamatoria en respuesta a una lesión producida por acumulación de placa en las arterias 7. En condiciones fisiológicas, las células endoteliales son impermeables y producen moléculas antitrombóticas y vasodilatadoras e impiden la adhesión leucocitaria 8. El daño inflamatorio genera disfunción endotelial y acumulación de C-LDL en la placa, la cual puede sangrar o romperse y ocluir una arteria (figura 1) 7,9,10.
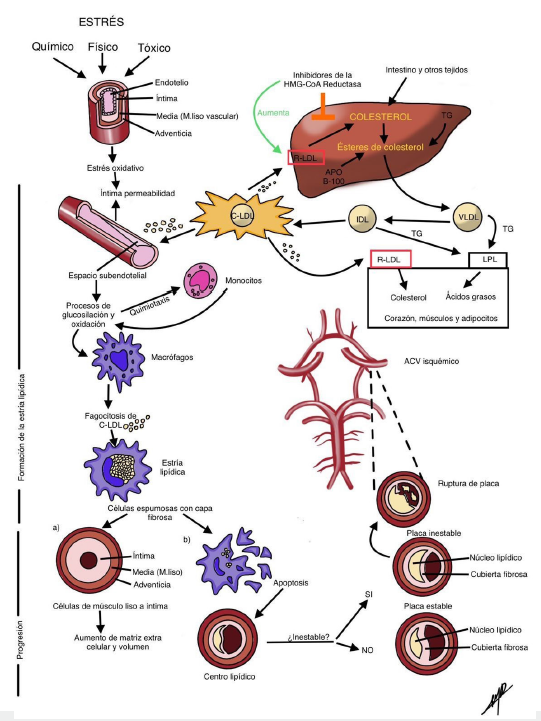
TG: triglicéridos; C-LDL: colesterol de proteínas de baja densidad; IDL: proteínas de densidad intermedia; VLDL: proteínas de muy baja densidad; RLDL: receptor de C-LDL; LPL: lipoproteína lipasa. Fuente: elaboración propia.
Figura 1 Fisiopatología de la placa aterosclerótica. En el primer estadio patológico, la capa íntima aumenta su permeabilidad y permite el ingreso y la acumulación de C-LDL en el espacio subendotelial, exponiéndose a modificaciones químicas (oxidación y glucosilación) que emiten señales quimiotácticas a monocitos. Cuando estos llegan al tejido endotelial disfuncional lo atraviesan y se diferencian en macrófagos que activan los genes de factor tisular, citoquinas y metalopro-teinasas, entre otros, y llevan a la fagocitosis de C-LDL. Los macrófagos y las células de músculo liso dan origen a las células espumosas, las cuales se encuentran rodeadas por una capa fibrosa compuesta de matriz rica en colágeno y son precursoras de las placas de ateroma. El segundo estadío patológico consiste en la progresión de la placa que se da por medio de la señalización de las células espumosas hacia células del músculo liso vascular que migran desde la capa media hasta la íntima, produciendo más matriz extracelular e incrementando el volumen de la lesión. Posteriormente, se produce apoptosis de estas células, lo que origina un centro rico en lípidos o núcleo lipídico, de forma tal que cuando el núcleo lipídico es pequeño y tiene una cubierta fibrosa gruesa se considera estable, es decir, tiene menos probabilidades de romperse. Ante la inestabilidad del núcleo, se derivan una serie de eventos que llevan al rompimiento de la placa y se muestran dependientes de la interacción entre las propiedades trombogénicas de la placa y fibrinolíticas de la sangre. Una rotura de la placa o hemorragia en el interior de esta puede derivar en oclusión de una arteria cerebral.
Con base en el comportamiento de los lípidos, la terapia hipolipemiante ha ganado fuerza en prevención de ACV 11. Esta se realiza principalmente con estatinas que inhiben la función catalítica de la hidroximetilglutaril-CoA reductasa, enzima limitante en la biosíntesis hepática del colesterol 12. Como resultado, disminuyen la concentración intracelular del colesterol y generan un aumento en la expresión de receptores de C-LDL en los hepatocitos, facilitando con ello su endocitosis 12. Además, tienen efectos pleiotrópicos antiinflamatorios, antitrombóticos y vasoactivos, así como acciones neuroprotectoras que pueden afectar el tamaño del infarto 4,13.
HIPOLIPEMIANTES DE USO PARA TRATAMIENTO DE ACV
El manejo preventivo principal de ACV se realiza mediante el uso de hipolipemiantes asociados con antia-gregantes o con anticoagulantes. La reducción de ACV se ha evidenciado en estudios para prevención primaria como el Jupiter 14 o el CARDS 15, con rosuvastatina y ator-vastatina, respectivamente. En un metaanálisis, las estatinas para prevención tanto primaria como secundaria mostraron una reducción significativa en eventos primarios (RR 0,81; p < 0,0001), una reducción de 18 % en todos los eventos de ACV (p < 0,0001) y del 13 °% en ACV fatal (p = 0,10) 16. En las guías más recientes de la ACC/AHA (2021) se recomienda rosuvastatina de 40 mg y atorvastatina de 80 mg 17 (tabla 1).
Tabla 1 Generalidades en manejo de estatinas y metas de LDL
*ACV: ataque cerebrovascular, AIT: ataque isquémico transitorio, IAM: infarto agudo de miocardio.
Fuente: elaboración propia
Las indicaciones para iniciar la terapia intensiva incluyen pacientes menores de 75 años con hipercolesterolemia, historia de ACV isquémico, comorbilidades y niveles superiores a 100 mg/dl C- LDL. Además, asociado con el uso de estatinas, se recomiendan cambios en el estilo de vida 18 (tabla 1). Conviene señalar que la terapia intensiva también está recomendada en caso de eventos agudos 19, así como en prevención secundaria, donde se ha visto una reducción del 16 °% de los eventos a dosis de 80 mg de atorvastatina 20 (tabla 1). Esto se ha demostrado con una reducción significativa en ACV recurrente (RR 0,84;p = 0,03) 16, siendo una de las recomendaciones principales en las guías de la European Stroke Organization (2019) para prevención de eventos secundarios (grado 1A) 21.
Por su parte, la terapia combinada con ezetimibe ha demostrado duplicar el efecto de las estatinas 20. En la guía de manejo de hiperlipidemia del American College of Cardiology / American Heart Association (2018), se recomienda su uso en pacientes que no toleran altas dosis de estatinas, reducción de C-LDL menor al 50 % o niveles que permanecen sobre 70 mg/dL 18.
Asimismo, nuevas terapias han demostrado resultados en la reducción del riesgo de ACV. En este sentido, los estudios FOURIER y ODYSSEY, que usan iPCSK9 (inhibidores de la PCSK9, serina proteasa que degrada receptores de C-LDL) encontraron una reducción de eventos primarios con evolocumab (HR 0,85; p = 0,001) y alirocumab (HR = 0,85; p = 0,001), respectivamente 22-24. El estudio OSLER encontró que la dosis máxima de evolocumab (420 mg una vez al mes) redujo el riesgo de eventos cardiovasculares, con efectos mayores en caso de niveles basales de C-LDL más elevados 25. Sin embargo, los iPCSK9 no se emplean de primera línea debido a costos elevados y a la ausencia de estudios de larga data que recomienden su uso (efectos adversos no claros). Según sociedades de aterosclerosis en los Estados Unidos y en Europa, están indicados en pacientes con: (a) enfermedad cardiovascular ateroesclerótica que hayan recibido terapia máxima combinada de estatina con ezetimibe y con C-LDL superior a 70 mg/dl; (b) hipercolesterolemia familiar homo y heterocigota con terapia máxima de estatina con ezetimibe y C-LDL superior a 70; y (c) intolerantes a las estatinas después del uso con ezetimibe con C-LDL superior a 100 o bajo criterio clínico 23.
MANEJO DE LÍPIDOS EN PREVENCIÓN PRIMARIA
Las estatinas han sido uno de los avances más importantes en prevención de ACV recientemente. Amarenco y Labreuche señalan que por cada 1 mmol/L (39 mg/dL) de disminución de C-LDL, baja el riesgo relativo de ACV un 21 % (IC95 % 6,3-33,5; p = 0,009) 16. Esta terapia se indica para pacientes en grupos de riesgo de ACV primario que se caracterizan por un C-LDL ≥ 190 mg/dL, como también en pacientes con valores de C-LDL entre 70 y 189 mg/ dL entre 40-79 años, con diabetes mellitus o con riesgo de desarrollar enfermedad cardiovascular aterosclerótica De la sigla en inglés ASCVD > 7,5 % 19.
La reducción del riesgo se evaluó también en el metaanálisis Colesterol Treatment Trialists (CTT), en el que se vio una reducción de C-LDL de 38 mg/dL, con disminución del riesgo de ACV de 17 % (OR 0,85; IC95 % 0,78-0,92; p < 0,001) 26, mientras que otras intervenciones como la dieta (OR 0,92; p = 0,562) y el uso de fibratos (OR 0,98; p = 0,788) no fueron estadísticamente significativos 27. Una reducción significativa de C-LDL genera un menor riesgo de ACV, por lo cual la European Stroke Organization (ESO) recomienda una vigilancia regular de los niveles de colesterol, buscando qué niveles de colesterol total (CT) > 150 mg/dl sean manejados con cambios en el estilo de vida (recomendación grado A) y estatinas (recomendación grado A) 21.
MANEJO DE LÍPIDOS EN PREVENCIÓN SECUNDARIA
El riesgo de ACV isquémico es mayor después del evento agudo, por lo menos el 80 % de los eventos recurrentes pueden ser prevenidos mediante modificaciones de dieta, ejercicio, terapia antiplaquetaria/anticoagulante, antihipertensivos y estatinas 28,29. Diferentes estudios han demostrado que la administración de hipolipemiantes es relevante, ya que la suspensión del medicamento en fase aguda o su falta de administración posteriormente al evento se pueden asociar con peores resultados en pacientes con ACV isquémico 30. En el estudio de Montaner et al., el uso de simvastatina entre 3 y 12 horas inmediatamente después del evento isquémico se asoció con mejoría a 3 días, lo que sugiere un mecanismo rápido de fibrinólisis 31. Igualmente, Cappellari et al. reportaron que las estatinas instauradas en las primeras 24 horas post-ACV se asociaron con un buen resultado funcional a 3 meses, e incluso con mejoría neurológica entre las 24 y las 72 horas posteriores al evento, lo que evidencia un posible efecto de las estatinas en las primeras 24 horas posteriores a una trombolisis 13.
En un metaanálisis de pacientes con ACV isquémico y AIT se asoció el uso de estatinas con una reducción en el riesgo absoluto de ACV isquémico (OR 0,81) y AIT (OR 0,75), sin modificar eventos con rabdomiólisis, mialgia o aumento en creatinina quinasa (CPK) 29. Por ende, se puso en evidencia la utilidad de la reducción de C-LDL y la seguridad de estos medicamentos. Sin embargo, tanto las pruebas de perfil lipídico como el tratamiento con hipolipemiantes varían de manera significativa entre hospitales (p = 0,001) 32. En un registro de 16 hospitales se presentó una asociación negativa para la toma de un perfil lipídico en pacientes con edad avanzada (p = 0,002), historia de fibrilación auricular (p = 0,002) y pobre pronóstico (p = 0,001). De estos, solo el 31,2 °% recibió terapia hipolipemiante de egreso 32, lo que pone de manifiesto una escasez de pruebas para catalogar el perfil lipídico y el uso de tratamiento de prevención secundaria en pacientes con ACV/AIT, además de que se expone la necesidad de prevención de eventos recurrentes, resaltando así la atención de pacientes de alto riesgo.
Entre otros estudios, destaca el de Prevención de Ataque Cerebrovascular con Reducción Agresiva de Niveles de Colesterol (SPARCL), un estudio controlado y aleatorizado que buscó poner en evidencia si el tratamiento con atorvastatina 80 mg reduce el ACV en pacientes con diagnóstico reciente de ACV/AIT reciente vs. placebo 33. Se estudiaron 4.731 pacientes que presentaron ACV o AIT de 1-6 meses antes del estudio y de los cuales 576 experimentaron un nuevo episodio en los 4,9 años siguientes 4,34,35. Se realizó un tratamiento con atorvastatina 80 mg/día, en el que se buscaba una reducción > 50 °% en C-LDL con respecto a los valores de base. En dicho estudio se encontró que las estatinas afectan el riesgo de ACV, con un mayor número de pacientes libres de eventos con atorvastatina (p < 0,001) 4. Además, en cuanto a los resultados posteriores al evento, los aleatorizados con atorvastatina tuvieron una menor recurrencia y mejores distribuciones en el resultado de la presentación de ACV a 90 días 4. De esta forma, se observó la reducción de todos los eventos (p < 0,001) y una tendencia a una menor severidad posterior al evento (p = 0,0647) según la escala Rankin 4.
En un análisis secundario del SPARCL se encontró que los pacientes que más se beneficiaban tenían las mayores reducciones de C-LDL 29. Consecuentemente, en SPARCL a 5 años hubo una reducción de C-LDL de 56 mg/dL con atorvastatina, hasta un nivel medio de 73 mg/ dL y un 16 °% de reducción en ACV no fatal y fatal 19. Según los hallazgos y las indicaciones, la ESO establece que en prevención secundaria de ACV se recomiendan estatinas para ACV no cardioembólico, siendo esta una evidencia de grado A 21 e instaurando la relevancia de usar hipolipemiantes a altas dosis como medida de prevención de ACV recurrente (tabla 1).
Otro análisis de SPARCL buscó si había un efecto entre el tratamiento con estatinas, la reducción de ACV y las etiologías del primer evento isquémico, y encontró que la tasa de recurrencia o eventos de AIT a 5 años fue de 8,2 °%, mientras que la tasa de eventos en enfermedad de grande vaso fue de 15,9 °% 34, reiterando así menores tasas de recurrencia en eventos transitorios. Este análisis indica que la atorvastatina a 80 mg vs. placebo es igualmente eficaz en los diferentes subtipos de ACV y AIT. Adicionalmente, en el Estudio de Intervención de Factores de Riesgo Múltiple se identificó la relación entre los niveles de colesterol y subtipos de ACV, y se vio una relación dosis-respuesta entre el colesterol y el riesgo de ACV isquémico, como también una relación inversa entre los niveles de colesterol y el ACV hemorrágico 16.
METAS DE C-LDL
La dislipidemia es uno de los factores de riesgo más relevantes de ACV, pues la modificación de C-LDL representa un tratamiento efectivo que reduce significativamente el riesgo de ACV recurrente (RR: 0,84) 28,36. En el estudio multicéntrico de Wang et al., la tasa para lograr metas de C-LDL con hipolipemiantes fue de 31,1 %, que fue significativamente mayor al 13 °% del grupo sin la terapia (OR 3,045; IC 95 °% 2,456-3,810; p < 0,0001). De esta forma, el manejo hipolipemiante fue el mayor predictor para metas de C-LDL, en tanto que los principales factores negativos fueron: sexo femenino, ser fumador actual e historia de dislipidemia 28.
Las metas de C-LDL han representado un tema controversial, se han establecido objetivos estándar de menos de 100 mg/dL, terapias que buscan lograr menos de 70 mg/dL, y se ha evaluado la opción de tratamientos aún más intensivos. Un ensayo clínico Treat Stroke to Target de 2.860 pacientes con ACV isquémico y AIT comparó entre metas de C-LDL menores a 70 mg/dL y otro con metas entre 90 y 110 mg/dL 37. El promedio de C-LDL obtenido por grupo fue de 96 mg/ dL para los pacientes con metas de 90-110 mg/dL y de 65 mg/dL para el grupo que buscaba niveles menores. Este último incluso logró disminuir el riesgo relativo de evento cardiovascular mayor hasta un 25 % con respecto al primer grupo 37,38. Por otro lado, un metaanálisis de 26 estudios de CTT identificó una media de reducción ponderada al año de 20 mg/dL, lo cual puso en evidencia que al realizar un tratamiento intensivo se reducía de forma significativa el 15 °% de los eventos cardiovasculares mayores (IC 95 % 11-18; p < 0,0001), incluyendo un 16 °% de ACV isquémico (IC 95 % 5-26; p = 0,005), en comparación con terapias menos intensivas. Así, se logró que por cada 1 mmol/L (38,1 mg/dL) de reducción se alcanzara una disminución de riesgo proporcional al 22 %. Subsecuentemente, una reducción de 77- 116 mg/ dL de C-LDL implicó una baja en el riesgo entre 40 y 50 %, sin aumentar el riesgo de miopatía 39,40. Estos hallazgos sugieren que el objetivo principal para los pacientes con alto riesgo de eventos vasculares oclusivos debería ser lograr la mayor reducción posible del C-LDL, enfatizando que el riesgo de una complicación dada por la terapia hipolipemiante es mínimo.
En cuanto a los objetivos generales en prevención secundaria registrados en SPARCL, el control óptimo se definió con C-LDL menor a 70 mg/dL (tabla 1), valores de C-HDL superiores a 50 mg/dL, triglicéridos menores a 150 mg/dL y presión arterial inferior a 120/80 mmHg 35. En un análisis post-hoc se encontró que una reducción mayor al 50 %% en C-LDL tenía mayor beneficio que en aquellos pacientes que no presentaban cambios o aumentaban los valores. De la misma manera, los valores de C-HDL y triglicéridos también mostraron ser predictivos para el resultado de ACV y eventos cardiovasculares mayores secundarios. Adicionalmente, aquellos que presentaron valores por encima de la media de C-HDL (> 48 mg/dL) y valores de presión arterial sistólica inferiores a la media (< 138 mmHg) en los primeros 6 meses, también tuvieron reducciones significativas. De tal forma, en el estudio se determinó que el efecto reductor se daba de forma aditiva y mostraba significancia al reducir los valores de C-LDL, triglicéridos, presión arterial y lograr un C-HDL elevado 35.
CONSIDERACIONES ADICIONALES
La reducción exagerada del colesterol total ha sido ampliamente debatida, habida cuenta que los hipolipemiantes han mostrado aumentar el riesgo de eventos hemorrágicos 41. En un estudio se encontró que una disminución de CT a menos de 160 mg/dl se asocia con un riesgo de ACV hemorrágico, su severidad y un aumento de mortalidad en los siguientes 3 meses en pacientes con IMC menor a 22 kg/m2 (OR 4,11; IC 95 % 1,71-9,86) 42. Asimismo, Zhang et al. encontraron en una población china que concentraciones menores a 70 mg/dl de C-LDL se relacionan con ACV hemorrágico (HR ajustado 1,56; IC 95 % 1,04-2,33), por lo que se recomienda que en pacientes con valores de C-LDL mayores a 130 mg/dl que buscan alcanzar metas, los niveles de esta lipoproteína se concentren entre 70 y 90 mg/dl para evitar el riesgo de dicho evento, relacionado con bajos niveles de C-LDL en hipertensión arterial no controlada (HR ajustado 1,56; IC 95 % 1,04-2,33) 43.
Por otro lado, Dowlatshahi et al. asociaron el uso previo de estatinas con menor riesgo de presentar una hemorragia intracraneal grave, en comparación con aquellos pacientes sin uso anterior 44,45 (tabla 2). Además, Pan et al. demostraron que al iniciar el tratamiento durante un periodo de hospitalización por hemorragia intracraneal la mortalidad disminuye, reduciendo hasta el 50 % de muertes en los próximos 3 meses (p < 0,001) 46, mientras que descontinuar su uso empobrece el pronóstico y aumenta la mortalidad en los siguientes 30 días. No obstante, en SPARCL y en otros estudios se sugiere que el uso de estos fármacos aumenta la incidencia de hemorragia intracraneal, lo cual puede relacionarse con altas dosis 45,47. En pacientes con fibrilación auricular posterior a isquemia cerebral aguda el uso de estatinas disminuyó el riesgo de hemorragia intracraneal 48. Además, otro estudio documentó que el riesgo de hemorragia intracraneal aumenta en prevención secundaria, pero no en prevención primaria 49, sin embargo, la reducción del riesgo de ACV isquémico en prevención secundaria excede el riesgo de hemorragia intracraneal.
Tabla 2 Consideraciones especiales con el uso de estatinas. Relaciones con otras patologias
Fuente: elaboración propia
RELACIONES CON OTRAS PATOLOGÍAS
El uso de estatinas en otras patologías subyacentes al ACV puede asociarse con factores desencadenantes o protectores. En un estudio en China se hizo un seguimiento a pacientes con diagnóstico de ACV isquémico sin antecedente de epilepsia, y se evidenció que un tratamiento con estatinas se asoció con un menor riesgo de convulsiones posterior a ACV, ya fueran convulsiones de inicio temprano (OR 0,198; p = 0,009) o tardías (OR 0,273; p = 0,007), sobre todo al emplear dosis intensivas (tabla 2) 50. Adicionalmente, la terapia con estatinas podría ser beneficiosa para disminuir el riesgo de deterioro cognitivo 51,52. En un estudio se encontró que pacientes con manejo previo combinado de estatinas y aspirina tuvieron una menor incidencia de ACV severo y deterioro neurológico (HR 0,68; p < 0,001).
Por otro lado, estudios han descrito que el uso de estatinas es factor de riesgo para desarrollar trastorno depresivo e infección posterior a ACV. Kang et al. identificaron la incidencia a un año de trastornos depresivos asociados con el manejo con estatinas post ACV, mostrando un aumento del riesgo de desarrollar depresión en los meses siguientes al ACV con un HR de 1,65 (p = 0,001) (tabla 2). En cuanto a infección posterior a ACV, se encontró que el uso de esta-tinas previo o en los primeros 3 días después del ACV se relaciona con 4 veces un aumento del riesgo de infección. Los hallazgos descritos previamente son controversiales puesto que existen pocos estudios al respecto que investiguen la relación del uso de estatinas con estas patologías.
CONCLUSIONES
La terapia para reducir el colesterol con estatinas está bien establecida, por ello el manejo del colesterol sérico es un objetivo central para prevenir ACV y eventos cardiovasculares principalmente ateroscleróticos, por lo cual, tanto en pacientes con riesgo o con antecedente de ACV se recomienda el tratamiento hipolipemiante, especialmente de alta intensidad con atorvastatina o rosuvastatina. A partir de esta revisión, se establece un nivel de C-LDL objetivo de menos de 70 mg/dl y, si fuese necesario, añadir ezetimibe con o sin un iPCSK9 para lograr metas. La reducción excesiva de CT sigue siendo controversial, por lo cual se desconoce y deja a discreción médica un límite inferior de C-LDL.














