INTRODUCCIÓN
El espectro de trastornos de neuromielitis óptica (NMOSD) es un grupo de enfermedades desmielinizantes, inflamatorias, autoinmunes, y severas, caracterizadas tradicionalmente por episodios recurrentes de neuritis óptica (NO) y mielitis longitudinal transversa extensa (LETM), entre otros síndromes neurológicos. En cuanto a los datos demográficos, se han evidenciado una mayor incidencia y prevalencia en la región Afrocaribeña, siendo estas de 0,73/100.000 personas/año y 10/100.000 personas, respectivamente. Las tasas más bajas se han descrito en Australia y Nueva Zelanda. Adicionalmente se presenta más en mujeres africanas, entre la tercera y cuarta década de la vida 1-4.
Su fisiopatología se ha explicado por la presencia de anticuerpos inmunoglobulina G (IgG) dirigidos contra los canales de acuaporina 4 (AQP4) presentes en los astrocitos (los cuales contribuyen a la formación de la barrera hematoencefálica), la materia gris de la médula espinal y las regiones periacueductales y periventriculares. Se ha demostrado que la unión del anticuerpo al canal genera endocitosis de este y activación de la cascada del complemento con consiguiente inflamación y daño del tejido, lo que genera ruptura de la barrera hematoencefálica, edema y desmielinización secundaria 1. El diagnóstico del NMOSD actualmente se basa en una serie de criterios establecidos por Wingerchuk et al. en 2015, que incluyen parámetros clínicos, imagenológicos y serológicos. Aunque la presencia de anticuerpos contra AQP4 han permitido un diagnóstico más certero de esta entidad, la presencia de estos no es indispensable, ya que es posible realizar el diagnóstico también en pacientes seronegativos 5.
La instauración de una terapia farmacológica crónica es importante para prevenir las recaídas y disminuir su severidad, dado que estas son la causa directa del declive funcional en los pacientes. Además, se hace especialmente importante ya que hasta 90% de los individuos presentarán una recurrencia después de su primer episodio, principalmente durante el primer año 6.
Los medicamentos más comúnmente utilizados para el tratamiento crónico han sido clásicamente la azatioprina (AZA), micofenolato mofetilo (MFM) y rituximab (RTX) 7-9. No obstante, recientemente se han aprobado nuevas terapias indicadas para NMOSD, tales como inebilizumab, eculizumab y satralizumab. Estos medicamentos han mostrado ser eficaces en la reducción de la tasa de recaídas, en diferentes ensayos clínicos aleatorizados 10.
El objetivo de esta investigación fue realizar un análisis comparativo de la evolución clínica y respuesta al tratamiento con AZA o RTX en un grupo de pacientes con NMOSD en seguimiento en el Instituto Neurológico de Colombia, en Medellín, Colombia.
MATERIALES Y MÉTODOS
Se trata de un estudio observacional, analítico, retrospectivo, fuente secundaria, en el que inicialmente fueron incluidos 69 pacientes con diagnóstico confirmado de NMOSD, según los criterios actualizados por Wingerchuk et al. de 2015 5. Este número correspondía al total de pacientes en la base de datos que se encontraban en tratamiento farmacológico crónico y en seguimiento en nuestro instituto. Se seleccionaron pacientes en seguimiento desde 1988 hasta 2020. Entre estos se encontraban pacientes con estado serológico de anticuerpos contra AQP4 positivos y otros negativos, determinados por inmunofluorescencia indirecta. Luego de aplicar los criterios de inclusión y exclusión, 59 pacientes fueron incluidos en el análisis (Tabla 1). 10 pacientes fueron retirados del estudio al encontrarse sin tratamiento, haberlo suspendido al momento de la recolección de los datos o estar recibiendo terapias inmunosupresoras alternativas a los estudiadas, tales como ciclofosfamida y micofenolato mofetilo (Figura 1). No se tomó como criterio de exclusión la presencia de una posología específica para AZA, por ejemplo, aquella guiada por los niveles de la enzima tiopurinametil-transferasa. Además, la dosis de RTX se mantuvo constante entre todos los pacientes.
Tabla 1 Criterios de inclusión y exclusión
Fuente: Elaboración propia
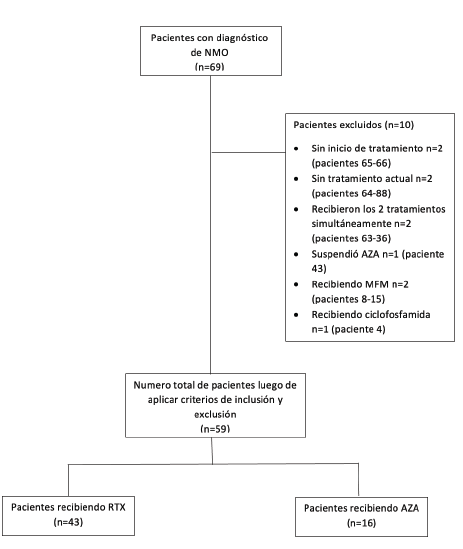
NMO: Neuromielitis óptica. AZA: Azatioprina; RTX: Rituximab; MFM: Micofenolato Mofetilo.
Fuente: elaboración propia.
Figura 1 Algoritmo de selección de población de estudio.
Se calcularon medidas de frecuencia absoluta y relativa para las variables cualitativas. En el caso de las variables cuantitativas se realizaron pruebas de distribución de normalidad de los datos; una vez determinada la distribución se procedió con pruebas paramétricas o no paramétricas. Se realizaron diferencias de medias para muestras de varianzas independientes y diferencias de proporciones. Se utilizó la prueba exacta de Fisher para comparar la diferencia en las proporciones de las variables categóricas entre los grupos. Se utilizó la prueba de Wilcoxon para el cambio en la puntuación del estado funcional. Los principales efectos medidos fueron el número de recaídas con el tratamiento, el tiempo desde el inicio de la terapia hasta la primera exacerbación, el mejoramiento en el estado funcional en base al puntaje en la Escala Expandida del Estado de Discapacidad (en inglés Expanded Disability Status Scale: EDSS), tanto previo al inicio del tratamiento, como posterior a este. Se tomaron datos del puntaje de esta escala a los 6 meses y al año de iniciado el medicamento. De igual manera, se incluyeron otras variables como la adherencia a cada medicamento (definiéndose falta de adherencia como la suspensión del medicamento por más de 15 días), y la presencia de efectos adversos, para los cuales no se determinó un tiempo de seguimiento específico. Entre los efectos secundarios, se midieron principalmente la presencia de leucopenia (para la cual se tomó un valor de leucocitos menor a 4.000 células/ mm3) e infecciones.
RESULTADOS
Se incluyeron un total de 59 pacientes, de los cuales 43 pacientes (73%) se encontraban recibiendo tratamiento con RTX y 16 de ellos (29%) pertenecían al grupo en manejo con AZA. Ambos grupos estaban compuestos predominantemente por pacientes de sexo femenino (88% en el grupo de RTX y 94% en el grupo de AZA), con un promedio de edad similar entre ambos grupos (46 y 45 años respectivamente). Los tiempos de seguimiento y tratamiento entre los grupos de estudio presentaron una amplia heterogeneidad, sin embargo, se tomó como punto de corte un tiempo mínimo de 6 meses desde el diagnóstico y desde el inicio de la terapia crónica. Por otro lado, el estado serológico fue positivo en cerca de 80% de pacientes en ambos grupos de estudio (Tabla 2).
Tabla 2 Características demográficas y clínicas.
| Grupo | AZA | RTX | ||||
|---|---|---|---|---|---|---|
| N | 16 | 43 | ||||
| Sexo n (%) | Femenino 15 (94%) | Masculino 1 (6%) | Femenino 38 (88%) | Masculino 5 (12%) | ||
| Edad al momento del diagnóstico | 44,5±4,4 | 43,0±2,5 | ||||
| Evolución de la enfermedad (meses) | 83,5±17,4 | 97,3±21,3 | ||||
| Tiempo entre inicio de síntomas y diagnóstico (meses) | 49,5 ±13 | 74,0±28,5 | ||||
| Tiempo de tratamiento actual (al momento de recolección de los datos) | 57,2±13,4 | 35,2±4,6 | ||||
| Estado serológico | AQP4-IgG+ (%) 13 (81%) | AQP4-IgG - (%) 2 (13%) | Nd* 1 (6%) | AQP4-IgG+ (%) 33 (80%) | AQP4-IgG - (%) 8 (20%) | Nd* 0 |
| EDSS** previo al tratamiento | 4,5±0,7 | 5,3±0,4 | ||||
| EDSS** posterior al tratamiento | 4,8±0,7 P (0,69) | 4,0±4,2 p (0,02) | ||||
*Nd: No determinado
**EDSS: Expanded Disability Estatus Scale (Escala Expandida del Estado de Discapacidad) AZA: Azatioprina, RTX: Rituximab.
Fuente: elaboración propia
Uno de los objetivos importantes de este estudio fue determinar el número de recaídas totales en cada uno de los grupos de tratamiento. Se encontró un menor número en el grupo que recibió RTX, con una media de 0,6 (DE 0,8), en comparación con una media de 0,7 (DE 1,7) en el grupo que recibió AZA. Además, el tiempo promedio transcurrido entre el inicio del tratamiento y la recaída en el grupo de pacientes tratados con RTX fue de 26 meses vs 23 meses en el grupo de AZA, aunque para ambos análisis las diferencias no fueron estadísticamente significativas (p=0,4). Cabe resaltar que 29 pacientes recibieron al comienzo de su tratamiento con AZA, corticosteroides de manera simultánea. Sin embargo, muchos de estos finalmente terminaron recibiendo RTX como terapia crónica.
Por otro lado, se evaluó la implicación que podrían tener estos dos tratamientos en la recuperación del estado funcional de los pacientes. Dentro de los resultados más relevantes obtenidos se observó una mejoría significativa en el puntaje EDSS en el grupo de pacientes tratados con RTX. En este grupo el puntaje promedio pasó de 5,3 al momento del diagnóstico a 4,0 (p=0,02) luego de 6 meses de tratamiento, e incluso se redujo a 3,8 (p=0,01) luego de un año de estar recibiendo el medicamento. Por otro lado, en el grupo de pacientes tratados con AZA, el puntaje EDSS inicial fue de 4,5 sin cambios a los 6 meses y de 4,8 luego de un año de tratamiento. Esta mejoría en el estado funcional al comparar el puntaje EDSS en el grupo de RTX vs AZA fue estadísticamente significativo para el grupo de RTX (p=0,01) (Figura 2).
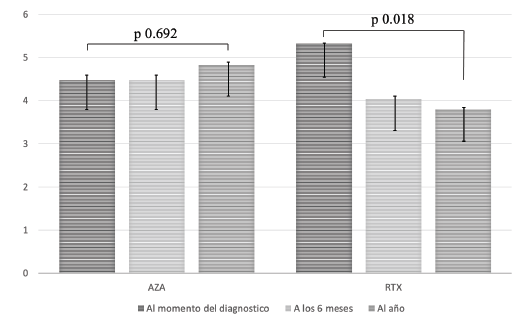
AZA: Azatioprina. RTX: Rituximab.
Fuente: elaboración propia
Figura 2 Escala EDSS al momento del diagnóstico, a los 6 meses y al año, para AZA y RTX
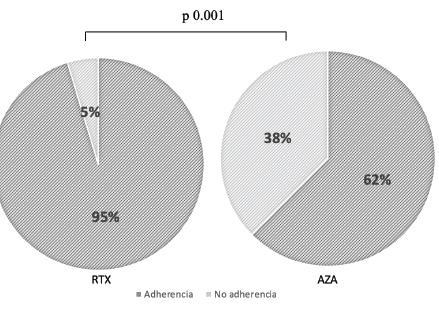
En cuanto al tratamiento farmacológico se identificaron algunas variables, tales como la adherencia al tratamiento, efectos secundarios e infecciones, las cuales demostraron comportarse diferente en ambos grupos. Con respecto a la adherencia al tratamiento, se encontró que 38% de pacientes en el grupo de AZA no eran adherentes al manejo, en comparación a 5% para el grupo de RTX (p<0,001) (Figura 3). Esto puede deberse a una mayor presencia de efectos adversos durante el tratamiento, ya que se reportaron casi el doble de casos de leucopenia en los pacientes tratados con AZA (13%), en comparación con los pacientes que estaban recibiendo RTX (6,97%). Sin embargo, y de manera interesante, esto no se asoció a un aumento en el número de infecciones, encontrándose en el 19% de pacientes en manejo con AZA y 19% de los pacientes en manejo con RTX (Tabla 3). Es importante también resaltar que, aunque al comparar las infecciones promedio en ambos grupos no se hallaron diferencias, se encontró que en los casos más severos, donde los puntajes en la escala EDSS eran altos, la presencia de infecciones fue del 18% en el grupo de tratamiento con AZA, mientras que para el grupo recibiendo RTX este valor solo alcanzó el 5% (p<0.05). Se destaca que en los pacientes en terapia con RTX no se contaban con datos de niveles de IgG, por lo que no se pudo analizar la existencia de una relación entre el número de infecciones y el grado de hipogammaglobulinemia G.
Tabla 3 Eventos adversos
| Grupo | N | Número total de ataques | Recaídas con el tratamiento | Hepato-toxicidad | Infecciones | Leucopenia | Suspensión del tratamiento por efectos adversos |
|---|---|---|---|---|---|---|---|
| AZA | 16 | 2,1±0,5 | 0,7±0,4 | 0 (0) | 3 (19%) | 2 (13%) | 1 (6%) |
| RTX | 43 | 2,7±0,4 | 0,6±0,1 | 1 (2%) | 8 (19%) p (0,72) | 3 (7%) | 4 (9%) |
AZA: Azatioprina; RTX: Rituximab
Fuente: elaboración propia
DISCUSIÓN
El objetivo de este estudio fue realizar un análisis comparativo de la evolución clínica y respuesta al tratamiento con AZA o RTX en una cohorte colombiana con diagnóstico de NMOSD en seguimiento en el INDEC. Se encontró que el manejo crónico con RTX se asoció con un menor número de recaídas en promedio después del inicio de la terapia en comparación con el uso de AZA. Al igual que nuestros resultados, en otros estudios se han encontrado tasas anuales de recaídas (ARR) menores en grupos asignados a esquemas de RTX al compararlos con AZA 10,11. Si bien no es posible realizar una comparación directa entre nuestros indicadores y aquellos de otras investigaciones debido al diseño del estudio, estos resultados sugieren un mayor beneficio respecto a la disminución de las exacerbaciones de la enfermedad en aquellos pacientes que recibieron tratamiento con RTX frente a otras intervenciones.
Entre los pacientes en tratamiento crónico con RTX se encontró un menor número en el promedio de recaídas, en comparación con AZA, al igual que un retardo en la aparición de los síntomas de la primera recaída tras el inicio del fármaco, sin embargo, estos resultados no fueron estadísticamente significativos (p=0,4), por lo que no se puede concluir un beneficio de RTX en este aspecto. Un resultado de importancia que no se tuvo en cuenta en la presente investigación fue el porcentaje de pacientes libres de recaídas después del inicio de cada uno de los tratamientos crónicos, el cual en un estudio se encontró que fue de 67% con el uso de RTX y de 47% con el manejo con AZA 12.
Por otro lado, los resultados obtenidos en este estudio respecto a la mejoría en el puntaje EDSS en el grupo de RTX, se deben probablemente al menor número de recaídas evidenciado tras el inicio de esta terapia en comparación con AZA. En este último grupo, el empeoramiento en el estado funcional puede deberse a que el medicamento no lograba detener el curso natural de la enfermedad, el cual tiende a un empeoramiento progresivo. Este beneficio de RTX en el puntaje de la escala EDSS, se encuentra respaldado por múltiples estudios previos, encontrándose que los pacientes tratados con otras terapias antes del inicio de RTX, tenían mayor compromiso del estado funcional, pero a pesar de esto lograban una estabilización, igual disminución o incluso mejoría significativa en el puntaje de esta escala con el inicio de este medicamento, en comparación con otras medidas farmacológicas 7,13. Cabe aclarar que en este estudio se tuvo en cuenta le mejoría en el estado funcional en base a la escala EDSS, y aunque este influye en la calidad de vida de los pacientes, no es el único determinante de esta, pues también entran en juego otros factores como la fatiga y el componente emocional, los cuales no se tuvieron en cuenta.
Igualmente, otras revisiones han demostrado que el 33-100% de pacientes están libres de recaídas después de 1-5 años de terapia con RTX; sin embargo, se ha visto una correlación importante entre el tiempo de evolución de la enfermedad y el inicio de la farmacoterapia, evidenciándose mejores resultados en el puntaje EDSS con el inicio temprano de esta, especialmente cuando se trata de RTX 9,11.
Al comparar la adherencia al tratamiento entre ambos grupos, se evidenció que esta fue mayor en el grupo de pacientes recibiendo RTX. Esto es concordante con lo descrito en la literatura, en donde se adjudica la baja adherencia al tratamiento con AZA a causas como la pobre tolerancia gástrica. Sin embargo, en el presente estudio, y debido al contexto social en el que se realizó, se encontró que una de las principales causas de la falta de adherencia a AZA era la frecuencia de las dosis (diarias) y los problemas administrativos relacionados con la entrega oportuna del medicamento. En comparación, los pacientes con RTX se beneficiaban de un mayor intervalo entre dosis, y de la aplicación intrahospitalaria del medicamento, por lo cual había más control sobre la administración del medicamento.
En cuanto a la frecuencia de efectos adversos, en el presente estudio casi el doble de pacientes presentó leucopenia en el grupo de AZA, en comparación con los pacientes en manejo con RTX; no obstante, lo anterior no se asoció a un aumento en el número de infecciones. Cabe resaltar el perfil de seguridad del RTX, evidenciado no solo en este estudio, sino también respaldado por hallazgos similares en otras investigaciones, en las que se ha demostrado que el uso de este medicamento sólo se asocia a infecciones en el 9% de los casos y a leucopenia persistente en un 4% 11.
Una de las limitaciones del presente estudio es que, debido a su carácter retrospectivo, se incluyó una población con tiempos de seguimiento y tratamiento muy variables, lo que dificultó la comparación directa de los datos. Sin embargo, se tomó como base un tiempo mínimo de 6 meses desde el diagnóstico e instauración de la terapia crónica para todos los pacientes. Igualmente, y al tratarse de una enfermedad con incidencia baja, se encontró que los pacientes incluidos en la presente investigación no eran "naive", pues habían recibido el medicamento de estudio anteriormente.
Del mismo modo, al analizarse el número total de recaídas posterior al inicio del tratamiento en cada uno de los grupos, y el tiempo transcurrido desde el inicio de la terapia hasta la primera exacerbación, se encontraron beneficios en el grupo de RTX; sin embargo, los hallazgos no fueron estadísticamente significativos. Esto podría explicarse debido al reducido número de pacientes incluidos, dada la baja incidencia de la enfermedad.
CONCLUSIONES
El uso de la terapia inmunomoduladora se ha convertido en el estándar de tratamiento para los pacientes con NMOSD, debido a que esta disminuye el número de las recaídas y con esto se busca evitar la progresión de la enfermedad. El tratamiento con AZA, históricamente, se ha considerado de elección en el manejo crónico de la NSMOD; sin embargo, recientemente el RTX se ha propuesto como la terapia de primera línea dadas sus múltiples ventajas, las cuales son respaldadas por el presente estudio.
En nuestra investigación se encontraron numerosas diferencias entre ambos grupos. Principalmente, al comparar la mejoría en el estado funcional de los pacientes, basado en la escala EDSS, el grupo de RTX tuvo resultados más favorables. Además, no se evidenciaron diferencias en las tasas de infección entre ambos grupos y las tasas de adherencia fueron significativamente mayores para los pacientes en terapia crónica con RTX. Con respecto a los efectos adversos, encontramos tasas de presentación menores a las reportados en la literatura; sin embargo, concuerda con esta en que los pacientes que se encuentran en tratamiento con AZA los presentan con mayor frecuencia; no obstante, en la mayoría de los casos no son lo suficientemente graves para causar un abandono del tratamiento, pero sí una reducción en la adherencia al mismo.
Igualmente, se encontró un menor número de recaídas entre los pacientes que recibieron RTX y un tiempo más prolongado hasta la primera exacerbación después del inicio del tratamiento, pero estos resultados no fueron estadísticamente significativos.
Consideraciones éticas
Este protocolo fue aprobado por el Comité de Investigación e Innovación de la Facultad de Medicina de la Universidad CES, bajo el Acta No. 236 del 12 de mayo de 2020 y se tramitó el aval expedito del Comité Institucional de Ética para Investigación en Humanos al tratarse de un proyecto clasificado como "sin riesgo".