INTRODUCCIÓN
El término "ACV menor" es empleado en la literatura médica para hacer referencia a un evento cerebrovascular isquémico que cursa con síntomas y discapacidad leve. No existe un consenso claro para calificar a un ACV isquémico como menor; sin embargo, la mayoría de las veces se emplea la escala National Institute Health Stroke Scale (NIHSS) utilizando diferentes puntos de corte que generalmente son menores o iguales a cinco 1-3. La mayoría de estos pacientes no reciben tratamiento con trombólisis intravenosa con base en que los síntomas son tan leves que no justifican una terapia con potenciales efectos secundarios 3-7.
Hasta la fecha, el abordaje del ACV menor sigue siendo objeto de controversia. La utilidad de la escala NIHSS en estos pacientes es cuestionada dado que la escala excluye aspectos como la marcha, el equilibrio, la fuerza de la mano, entre otros. Además, algunos ítems pueden tener mayor impacto en la calidad de vida 1,5,7. Se ha descrito que hasta 30% de estos pacientes presentan dependencia funcional 8 y pueden experimentar alteraciones de tipo cognitivo, fatiga y problemas psicosociales 9-11.
En Latinoamérica no existen publicaciones que caractericen el curso clínico del ACV menor agudo y su desenlace.
El objetivo de este estudio fue evaluar el desenlace funcional a 90 días de pacientes con ACV isquémico menor, atendidos en dos hospitales de Bucaramanga, Colombia durante los años 2015 a 2017.
MATERIALES Y MÉTODOS
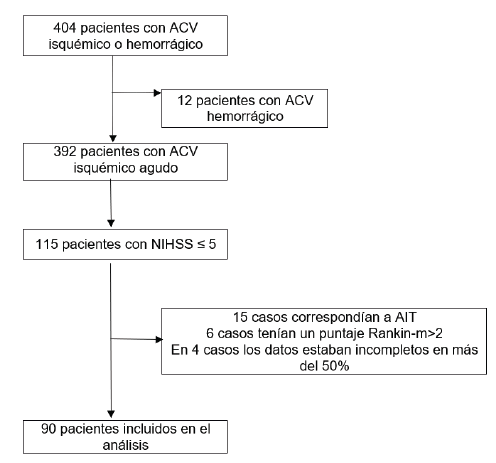
Estudio de cohorte en adultos con ACV isquémico agudo atendidos entre octubre 2015 y diciembre 2017, en dos instituciones de alta complejidad en salud del nororiente colombiano: Hospital Internacional de Colombia FCV y el Hospital Universitario de Santander. Se incluyeron los pacientes que cursaron con ACV menor, definido como aquel déficit neurológico súbito de origen vascular cuya puntuación en la escala NIHSS al ingreso fuera igual o menor a 5 puntos. Se excluyeron los pacientes con funcionalidad previa al evento mayor a 2 puntos según la escala de Rankin Modificada (Rankin-m) o cuyo diagnóstico definitivo fue un ataque isquémico transitorio (AIT). El proceso de selección puede visualizarse en la Figura 1. La valoración inicial, seguimiento y toma de decisiones fue realizada por un neurólogo experimentado y entrenado.
Se realizó un seguimiento pasivo 90 días después del evento, se evaluó el grado de discapacidad empleando la escala Rankin-m y se definió un desenlace clínico desfavorable como un puntaje igual o superior a 3 puntos.
Análisis estadístico: En primera estancia, se realizó un análisis descriptivo de la información. Las variables continuas fueron descritas como medias y desviaciones estándar o medianas acompañadas del primer y tercer cuartil; esto según su distribución verificada a través de la prueba de Shapiro-Wilk. Las v/ariables categóricas fueron descritas como frecuencias absolutas y relativas acompañados de los intervalos de confianza del 95%.
Los pacientes fueron clasificados según la presencia de un desenlace clínico desfavorable a 90 días. Adicionalmente, se realizó un análisis bivariado a través de modelos de regresión binomial simples y ajustados por edad y sexo para cada uno de los factores asociados a un desenlace desfavorable descrito en la literatura (HTA, diabetes mellitus, fibrilación auricular, menopausia, Rankin-m previo al evento, puntaje NIHSS y desglose de ítems, métodos diagnósticos, localización de la lesión). Todas las pruebas estadísticas fueron realizadas a dos colas y se consideró como estadísticamente significativo un valor de p <0,05. El análisis estadístico fue realizado en STATA 14,0 (® Stata Corporation).
Este estudio fue aprobado por el Comité de Ética en Investigación de las instituciones participantes y se obtuvo consentimiento informado de todos los pacientes y/o familiares. Además, se cumplió con toda la normatividad nacional e internacional para la realización de investigaciones en seres humanos.
RESULTADOS
Durante el periodo octubre 2015 a diciembre 2017, se atendieron 390 pacientes con diagnóstico de ACV isquémico agudo, de los cuales 90 (23,07%) correspondieron a ACV menor. La información demográfica y antecedentes de estos pacientes se resume en la Tabla 1. El 81,1% (n=73) tenía un Rankin-m de 0 puntos previo al evento. Los parámetros más afectados de la NIHSS fueron en su orden motilidad de una extremidad en 76 (84,4%), movimiento facial en 49 (43,3%), lenguaje en 34 (37,8%) y estado de conciencia en 18 (20,0%). La mediana del puntaje del Alberta Stroke Program Early CT Score (ASPECTS) al ingreso fue de 9 (Q1:8-Q3:9). Respecto a la estratificación, la fuente embolígena más identificada fue fibrilación auricular en 25 (27,8%), evidenciada en 9,0% (n=8) de los electrocardiogramas iniciales y en 61,1% (n=22/36) de los pacientes a los que se les realizó holter. Solo 2 de los 60 (3,3%) de los pacientes a los que se le realizó doppler carotídeo presentó estenosis clínicamente significativas.
Tabla 1 Características de la población.
HTA: Hipertensión arterial; DM: Diabetes mellitus; FA: Fibrilación auricular; EPOC: Enfermedad pulmonar obstructiva crónica; NIHSS: National Institute of Health Stroke Scale; a. 92 pacientes fueron incluidos, sin embargo, durante el seguimiento fueron perdidos 29 pacientes a los que no se les midió el Rankin-m. b. Prueba U Ji cuadrado para variables categóricas y prueba U de Mann-Whitney o prueba T de Student para variables continúas según la distribución;
Fuente: Elaboración propia
El 23,3% (n=21/90) de los pacientes se encontraba en periodo de ventana al momento de la valoración, solo un paciente cuyo NIHSS al ingreso era de 5 puntos recibió manejo con alteplase endovenoso. La mediana del tiempo de hospitalización fue de 8 días (Q1:4-Q3:13); en 7 casos el evento ocurrió en pacientes hospitalizados en unidad de cuidados intensivos por comorbilidades previas (post-tras-plante, sepsis, enfermedad coronaria, falla cardiaca), estos no fueron incluidos en el cálculo de estancia hospitalaria. Un paciente falleció por shock séptico.
En 63 pacientes (70,0%) fue posible el seguimiento a 90 días; 23 (36,5%) presentaron un puntaje Rankin-m entre tres a seis, un paciente con fibrilación auricular falleció debido a un segundo ACV de mayor severidad. Las características de los pacientes fueron clasificadas según la presencia de discapacidad significativa y se evidenció que los pacientes con discapacidad tenían mayor proporción de antecedente de diabetes mellitus en comparación con los pacientes sin discapacidad (52,2% vs 15,0%, p=0,02). La Tabla 2 muestra los resultados del análisis bivariado; el antecedente de diabetes (RR: 2,50 IC 95%:1,33-4,70) y un puntaje Rankin-m de 2 previo al evento (RR 2,12 IC 95%:1,39-3,24) fueron variables independientemente asociadas a discapacidad significativa después de ajustarse por edad y sexo.
Tabla 2 Análisis bivariado para un desenlace desfavorable (Rankin-m 3-6) a 90 días en la cohorte(n=63)
HTA: Hipertensión arterial; DM: Diabetes mellitus; FA: Fibrilación auricular; NIHSS: National Institute of Health Stroke Scale; ACA: Arteria cerebral anterior; ACM: Arteria cerebral media; ACP: Arteria cerebral posterior; a modelo de regresión binomial crudo; b modelo de regresión binomial ajustado por sexo y edad.
Fuente: los autores
DISCUSIÓN
Los resultados de este estudio evidencian que algo más de una tercera parte de los pacientes que debutan con un ACV menor presenta un puntaje Rankin-m de 3 a 6 puntos a 90 días de seguimiento, lo que se traduce en un desenlace funcional desfavorable. Este valor es concordante con la literatura e incluso, más alto que el 15 a 30% de discapacidad usualmente atribuido a esta población 1,8,12-14; sin embargo, debe tenerse en cuenta que la definición de discapacidad puede variar entre los estudios. El antecedente de DM y un estado funcional previamente comprometido para un Rankin-m de 2 puntos, fueron variables independientemente asociadas con mayor riesgo de discapacidad en la cohorte estudiada.
En la literatura, factores como la edad avanzada 13-17, el sexo femenino 13,14,16, la localización anatómica de la lesión (cápsula interna, puente y corona radiada) 18, aspectos de la NIHSS 1,14-16 e ítems específicos de esta escala 13,17,18, la oclusión de gran vaso 5,6,13,14,17,19, entre otros, han sido asociados con desenlaces desfavorables en los pacientes con ACV menor. La asociación de diabetes y desenlace desfavorable es concordante con estudios previos 14,16,20-22 y se ha considerado que incluso los estados prediabéticos 20,22, son un factor de riesgo independiente en la recurrencia de nuevos eventos isquémicos en pacientes con ACV menor o ataque isquémico transitorio. Se cree que el estado hiperglucémico contribuye al desarrollo de rigidez arterial y disfunción endotelial en estos pacientes, lo que puede favorecer el desarrollo de un nuevo ACV, en especial cuando la etiología es por obstrucción de pequeño vaso 20-22. Un predictor fuerte y constante de desenlace, incluso en ausencia de eventos recurrentes, es la oclusión de gran vaso intra o extracraneal 5,6,13,14,17,19; sin embargo, la medición de dicha variable pudo subestimarse en este estudio tomando en cuenta que los pacientes de la cohorte fueron evaluados mediante doppler de carótidas más no por angiotomografía. Por otra parte, ni el puntaje en la NIHSS total ni ítems específicos se asociaron con discapacidad en este estudio (Figura 2).
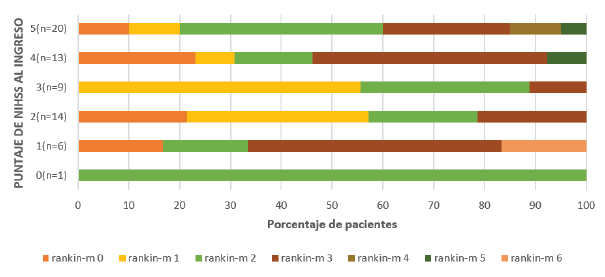
Se compara el puntaje NIHSS al ingreso a las instituciones con el puntaje Rankin-m a 90 días de seguimiento. NIHSS: National Institute of Health Stroke Scale; Rankin-m: Rankin modificado.
Fuente: los autores
Figura 2 Rankin modificado acorde a las categorías del NIHSS basal
Las características socioculturales, así como las relacionadas con el proceso de atención y cuidado del ACV agudo son variables generalmente poco analizadas en la literatura. En Latinoamérica, solo un pequeño porcentaje de estos pacientes reciben atención médica dentro de las primeras horas desde el inicio de los síntomas y la mayoría no son atendidos inmediatamente por neurólogos 23-25.
Existen datos además que evidencian que los pacientes latinoamericanos desarrollan un mayor grado de síndromes motores y de discapacidad post ACV en comparación con los de habla inglesa, diferencias que podrían explicarse por aspectos como la condición socioeconómica y la atención hospitalaria inmediata 25. En esta cohorte solo 23% de la totalidad de eventos cerebrovasculares correspondieron a un ACV menor, valor que es inferior al porcentaje usualmente referido en la literatura 1,2,26,27. Si bien no fue objetivo indagar por los factores asociados a este resultado, los pacientes incluidos fueron atendidos únicamente en centros de referencia, lo que plantea como posibilidad un subdiagnóstico de esta condición por una falta de reconocimiento por parte de los pacientes o el personal médico en la atención primaria inicial.
Se ha planteado que el manejo con rtPA mejora el pronóstico funcional sin incrementar sustancialmente el riesgo de complicaciones en los pacientes con ACV menor en fase aguda 28-30; sin embargo, los resultados han sido heterogéneos 15. El ensayo clínico PRISMS evaluó el beneficio de la trombólisis en ACV menor y déficits considerados no incapacitantes, pese a sus limitaciones, no identificó diferencias significativas en el desenlace funcional a 90 días en aquellos tratados con rtPA versus aspirina 31. Por otro lado, una revisión sistemática y metanálisis más reciente determinó que la trombólisis se seguía asociando con mejor desenlace funcional en esta población de pacientes 32. Las guías AHA/ASA publicadas en 2018 recomiendan la trombólisis en ACV menor solo si el déficit neurológico agudo es considerado incapacitante, como afasia o ataxia 33, otro hallazgo reciente de un estudio retrospectivo sugiere que el potencial efecto benéfico de la trombólisis en ACV menor está significativamente relacionado con el estado funcional premórbido del paciente, siendo mayor en aquellos que presentaban un Barthel menor de 80 7.
Los resultados de este estudio deben interpretarse tomando en cuenta ciertas limitaciones. Quizás las más importantes fueron el tamaño de muestra y las pérdidas ocurridas durante el seguimiento. En segundo lugar, no analizar variables como la clasificación TOAST, la NIHSS al egreso o la recurrencia de nuevos eventos durante el seguimiento, debido a que dichos datos no fueron recolectados. Por último, limitaciones inherentes al diseño observacional, con susceptibilidad a sesgos de selección y de información. Sin embargo, entre sus fortalezas, se realizó una comparación entre los pacientes incluidos en el análisis del desenlace clínico y los perdidos en el seguimiento, descartando diferencias estadísticamente significativas entre las dos poblaciones con respecto a las principales variables relacionadas, lo que descarta sesgos de selección (Tabla 3). Adicionalmente, al excluir pacientes con ataque isquémico transitorio se reconoció al ACV menor como una entidad distinta y se obtuvo una caracterización propia de estos pacientes, evitando potenciales sesgos de información. Esta investigación contribuye al análisis del ACV menor en Latinoamérica, los resultados hacen necesario replantear el concepto de ACV menor, lo cual tiene una implicación pronóstica y terapéutica. Se sugiere individualizar la decisión de trombólisis en estos pacientes, tomando en cuenta distintos aspectos más allá del déficit o del puntaje NIHSS, como la edad, las comorbilidades, el estado funcional previo y el riesgo de sangrado, entre otros. Futuros trabajos deberán enfocarse en evaluar estos aspectos. Para nuestro conocimiento, este es el único estudio realizado en población colombiana.
Tabla 3 Comparación entre Sujetos del Modelo y los Valores Faltantes en Relación con los posibles factores asociados
| Variable | Sujetos que permanecieron y fueron analizados (n=63) | Sujetos perdidos en el seguimiento (n=27) | p-valor |
|---|---|---|---|
| Sexo, mujer | 32(50,8) | 9(33,3) | 0,13* |
| Edad ≥72, años | 26(41,3) | 8(29,6) | 0,30* |
| HTA, (si, %) | 44(69,8) | 19(70,4) | 0,96* |
| DM Tipo 2, (si, %) | 18(28,6) | 5(18,5) | 0,32* |
| FA, (si, %) | 5(7,9) | 6(22,2) | 0,06* |
| Menopausia, (si, %) | 25(78,1) | 4(44,4) | 0,05* |
| Rankin-m previo, (si, %) | 0,45* | ||
| 1 | 8(12,7) | 2(7,4) | |
| 2 | 6(9,5) | 1(3,7) | |
| NIHSS, prom ±DE | 3,4±1,5 | 2,89±1,5 | 0,15** |
| Holter alterado | 19(61,3) | 3(60,0) | 0,96* |
| Doppler carotídeo | |||
| Alterado | 4(9,8) | 1(5,0) | 0,53* |
| ACA | 9(17,3) | 3(12,0) | 0,55* |
| ACM | 31(59,6) | 20(80,0) | 0,08* |
| ACP | 11(21,2) | 3(12,0) | 0,33* |
*Prueba de Ji cuadrado de Pearson; **Prueba T student no pareada.
Fuente: los autores
CONCLUSIÓN
Este estudio identificó que un alto porcentaje de los pacientes con ACV menor presentan un desenlace funcional desfavorable a mediano plazo. El antecedente de DM y un Rankin-m previo de 2, se asociaron de manera independiente con discapacidad; es posible que factores étnicos-raciales y sociodemográficos propios de la población latinoamericana influencien en estos resultados. La decisión de trombolizar a un paciente con ACV menor debe ser individualizada.