INTRODUCCIÓN
En diciembre del 2019 se describieron algunos casos de una neumonía viral grave en la ciudad de Wuhan (China). En febrero del 2020, al microorganismo responsable se le dio el nombre de coronavirus asociado al síndrome respiratorio agudo severo 2 (SARS-CoV-2), y a la enfermedad por el coronavirus 2019 se le llamó covid-19. Rápidamente, fue declarada una pandemia, y a la fecha son millones los infectados y muertos por esta enfermedad en el mundo 1,2. Los síntomas más llamativos se presentan en el sistema respiratorio puesto que el virus requiere el receptor de la enzima convertidora de angiotensina 2 (ECA2) para ingresar al cuerpo. Dicho receptor se expresa de forma abundante en el epitelio respiratorio, así como en el endotelio, por lo cual la invasión de este último permite manifestaciones en otros órganos, como por ejemplo el sistema nervioso central (SNC) 3. Algunas de estas manifestaciones clínicas se conocen como síndrome neurológico asociado a la covid-19, que incluye el accidente cerebrovascular (ACV) de tipo isquémico, la polineuropatía tipo Guillain Barré y una encefalopatía inespecífica 4-7. Este síndrome se ha descrito principalmente en pacientes con factores de riesgo cardiovasculares típicos, de edad avanzada y con presentación grave de la covid-19 8. A continuación, se presenta el caso de una paciente joven sin factores de riesgo cardiovasculares, que adquirió la infección por el SARS-CoV-2 y luego presentó un ACV isquémico.
CASO CLÍNICO
Mujer de 44 años, mestiza, con historia de angioedema por quinolonas y uso de anticonceptivos orales desde hacía 2 años. Consultó al hospital local por 2 días de disnea y tos seca, sin otra manifestación. Se reportó prueba antigénica positiva para infección por SARS-CoV-2 y fue remitida a nuestra institución por hipoxemia progresiva. Al examen físico presentaba 26 respiraciones por minuto, saturación de oxígeno en límite inferior -a pesar de oxígeno por Venturi al 50 %- y crépitos en ambas bases pulmonares; sin alteración en otros signos vitales, ni otros hallazgos anormales en el resto de la evaluación.
En los paraclínicos de ingreso se reportó: leucocitos: 15.520 células por mililitro (cels/mL); neutrófilos: 13.600 cels/mL; linfocitos: 1.000 cels/mL; plaquetas: 558.000 cels/mL; proteína C reactiva (PCR): 4,43 miligramos por decilitro (mg/dL, rango de normalidad inferior a 1 mg/dL); velocidad de sedimentación globular: 120 milímetros por hora (mm/h, rango de normalidad inferior a 20 mm/h); ferritina: 275 nanogramos por litro (ng/L, unidad de referencia 10-291 ng/mL); lactato deshidrogenasa: 315 unidades por litro (U/L, unidad de referencia 120-246 U/L); dímero D: 0,41 mg por litro (mg/L, rango de normalidad inferior a 0,5 mg/dL); y troponina I: 20 picogramos por mililitro (pg/ mL, rango de normalidad inferior a 39 pg/mL).
No hubo alteración en las pruebas de función renal, hepáticas o de la coagulación. En los gases arteriales iniciales se reportó equilibrio ácido base y una relación de la presión arterial de oxígeno sobre fracción inspirada de oxígeno (PaO2/FiO2) de 96 milímetros de mercurio (mmHg). En el electrocardiograma de superficie se evidenció taquicardia sinusal leve y patrón de Mcginn White completo. Se realizó una angiotomografía de tórax que descartó tromboembolismo pulmonar agudo y se describió patrón de vidrio esmerilado bilateral sugestivo de neumonía viral (Figura 1).
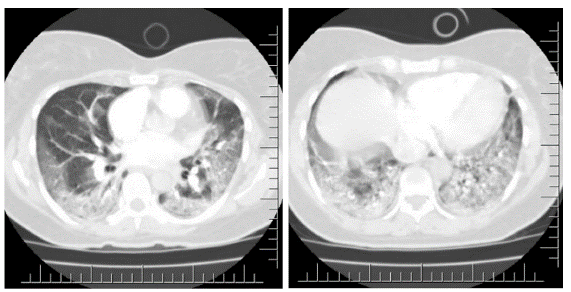
Fuente: imagen tomada de repositorio de la institución con aval por familia y la institución.
Figura 1 Angiotomografía de tórax, fase arterial. Ventana para pulmón con corte a nivel de T4 (imagen A) y T6 (imagen B). No hay evidencia de opacidades en arterias pulmonares, se evidencia opacidad en patrón de vidro esmerilado de distribución bilateral y periférica compatible con neumonía viral, no hay consolidaciones clásicas ni líquido pleural
Se confirmó infección por SARS-CoV-2 con prueba molecular y se descartó coinfección por influenza A e influenza B con pruebas antigénicas. Se consideró covid-19 de gravedad moderada por grado de hipoxemia y se hospitalizó, tras lo cual se inició manejo con prednisolona de 35 mg vía oral cada día, ivermectina 70 gotas vía oral dosis única y tromboprofilaxis con enoxaparina subcutánea 60 mg/día. Al día siguiente la paciente fue ingresada a la unidad de cuidados intensivos (UCI) por deterioro de la oxigenación y requirió terapia con cánula nasal de alto flujo y aumento en la dosis de enoxaparina a 1 mg/kg cada 12 horas subcutánea (dosis de anticoagulación) de acuerdo con el protocolo institucional.
No se administraron antibióticos porque la sospecha de sobreinfección bacteriana era baja, ni tampoco terapia inmunomoduladora puesto que no hacía parte del protocolo institucional. En los siguientes días la paciente presentó mejoría de la oxigenación y toleró una disminución de la FiO2. No se solicitó control de dímero D, ferritina ni LDH, pero sí de PCR que ascendió hasta 22 mg/d. En el día 7 desde el inicio los síntomas respiratorios, la paciente presentó un súbito deterioro del estado neurológico dado por disartria, parálisis facial central izquierda, hemiparesia izquierda y depresión del estado de alerta. Se realizó tomo-grafía axial computarizada (TAC) de cráneo simple y se encontraron signos tempranos de isquemia en territorio de la arteria cerebral media derecha (ACMD) y edema cerebral hemisférico derecho (Figura 2).
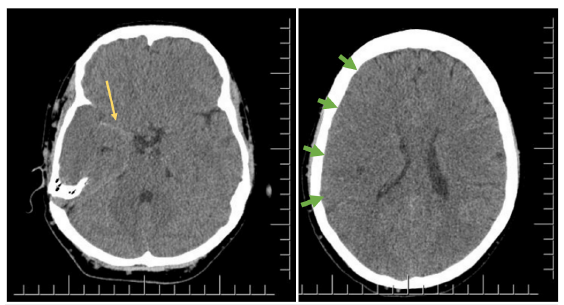
Fuente: imagen tomada de repositorio de la institución con aval por familia y la institución.
Figura 2 Tomografía de cráneo simple, día 1 del accidente cerebrovascular. A. Signo de la arteria cerebral media derecha hiperdensa (flecha amarilla). B. Pérdida de los surcos cerebrales e hipodensidad cortico-subcortical hemisférica derecha (línea verde corta) y colapso del ventrículo lateral derecho (línea blanca) sugestivo de edema cerebral hemisférico derecho.
Se consideró que la paciente cursaba con ACV isquémico grave, con una puntuación de ACV del Instituto de Salud Nacional de los Estados Unidos (NIHSS) de 30 puntos (puntuación mínima 0, puntuación máxima 42) y un puntaje de tomografía temprana en ACV de Alberta (ASPECTS) de 4 puntos (puntaje de 0 a 10). No se realizó trombólisis sistémica porque la paciente estaba anticoagulada, ni trombectomía mecánica por la gravedad del evento. Se suspendió anticoagulación, se inició esteroide parenteral y ventilación mecánica invasiva, según protocolo institucional. Horas más tarde presentaba anisocoria por lo que se sospechó edema cerebral maligno y fue llevada a craniectomía descompresiva.
Al día 9 de iniciados los síntomas se hizo control tomo-gráfico y se observó infarto establecido en territorio de la ACMD, como también evento isquémico reciente en territorio de la ACM izquierda (ACMI) (Figura 3). En la ecografía Doppler de vasos del cuello se reportó oclusión trombótica de arteria carótida interna derecha (ACCD) desde el bulbo. En la evaluación ultrasonográfica cardíaca a la cabecera del paciente no se encontraron trombos intracavitarios, trastornos en la contractilidad o disfunción del ventrículo derecho. A los 11 días desde el inicio de los síntomas respiratorios se hizo diagnóstico de muerte encefálica.
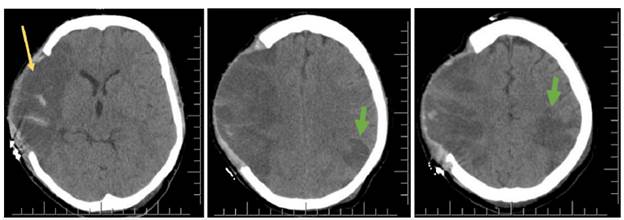
Fuente: imagen tomada de repositorio de la institución con aval por familia y la institución.
Figura 3 Tomografía de cráneo simple, día 3 del accidente cerebrovascular. A. Corte axial a nivel de los núcleos de la base. B y C. Corte axial por encima de los núcleos de la base. Se encuentra ausencia quirúrgica de hueso parietal derecho, área de isquemia extensa en el territorio de la arteria cerebral media derecha (flecha amarilla) y área isquémica aguda en territorio de la arteria cerebral media izquierda (flechas verdes cortas).
DISCUSIÓN
La covid-19 se asocia con complicaciones trombóticas en la circulación venosa, documentadas hasta en el 31 % de los pacientes. En el último año se ha reportado un aumento de casos de trombosis en lechos arteriales; el ACV isquémico se ha descrito en el 1 al 5 % de los casos, por detrás del infarto agudo de miocardio 3,9. Característicamente, se identifica en pacientes de edad avanzada y con factores de riesgo cardiovasculares clásicos como hipertensión arterial sistémica, diabetes mellitus, enfermedad coronaria y enfermedad cerebrovascular previa 10,11.
Múltiples estudios han planteado que el estado proinflamatorio secundario a la infección viral induce la ulceración de placas ateroscleróticas preexistentes y la alteración de la coagulación 12. La hiperactividad del sistema inflamatorio conlleva daño endotelial y neuronal directo, lo que genera endotelialitis y muerte celular favorecida por inflamación. Lo anterior favorece la existencia de un estado hipercoagulable con agregación plaquetaria aumentada, activación espontánea de las vías de la coagulación y trombosis arterial 13, todo lo cual se traduce en concentraciones elevadas de PCR, ferritina y VSG por la inflamación sistémica, de LDH por el daño celular y del dímero D como producto del metabolismo de la fibrina en la cascada de la coagulación.
También se han descrito concentraciones elevadas de interleuquinas 7, 2, 6 y 10, pero estas, a diferencia de las anteriores, no se midieron en nuestra paciente debido a la no disponibilidad de reactivos en la institución. Con respecto al dímero D, existe una revisión sistemática de la literatura que propone una concentración de 3,3 microgramos/mililitro como punto de corte para considerar riesgo de trombosis en SNC 14. En nuestra paciente, el dímero D inicial estaba en rangos de normalidad, pero no se hicieron mediciones seriadas. Esperaríamos que, si el ACV se hubiese presentado de forma más tardía, se hubieran realizado controles periódicos del dímero D que pusieran en evidencia una elevación progresiva y significativa en sus concentraciones, como se describió en otro reporte de caso 15.
Por otro lado, se han descrito otros mecanismos potenciadores del estado de hipercoagulabilidad y daño endotelial en los pacientes con covid-19, entre los cuales se encuentra la aparición de anticuerpos antifosfolípidos, identificables hasta en el 30 % de los pacientes infectados pero que no se midieron en nuestra paciente 16; también se ha descrito que un aumento en las especies reactivas del oxígeno por el metabolismo anaerobio en el contexto de hipoxia y la sobreestimulación del receptor tipo 1 para la angiotensina 2, se asocian con fenómenos de vasoconstricción, trombosis y fibrosis endotelial en los pacientes 17.
No se descarta que la enfermedad cardíaca asociada a la covid-19 pueda ocasionar un ACV isquémico cardioembólico secundario a fibrilación auricular, miocarditis aguda y cardiopatía por estrés 18. En nuestro caso, consideramos que una limitante significativa en el estudio etiológico del ACV pudo haber sido el no realizar una ecocardiografía formal ni un registro holter; sin embargo, la paciente estuvo monitorizada de forma continua durante su estancia en la UCI, y se pudo establecer que no presentó arritmias cardíacas relevantes. Así mismo, en la evaluación ultrasonográfica realizada a la cabecera luego del ACV, no se encontraron trombos intracavitarios ni disfunción ventricular.
Desestimamos el papel de los anticonceptivos orales combinados (ACOS) en la etiología del ACV de nuestra paciente, ya que la evidencia disponible sugiere efecto protrombótico solamente en el sistema venoso. De manera específica, la información en torno a la asociación con ACV isquémico es contradictoria, con algunos metaanálisis que consideran el uso de ACOS como un factor protector 19.
Otro hallazgo relevante fue el hecho que el ACV se presentó a los 6 días del inicio de los síntomas respiratorios, lo que contrasta con la evidencia actual, de acuerdo con la cual la mayoría de los eventos aparecen 10-12 días después del primer síntoma 20. Además, en comparación con pacientes sin covid-19, se reportan hasta 3 veces más el compromiso de un solo vaso y de gran territorio cerebral, probablemente debido a la ulceración de las placas preexistentes o lesión endotelial 11. En una revisión de estudios observacionales realizada durante el 2020, se describió que hasta el 71 % de los casos revisados tenían compromiso de un vaso grande 21. Al igual que nuestra paciente, el territorio irrigado por la ACMD es el que se compromete con mayor frecuencia, seguido por la ACMI y las carótidas; es probable que esto se deba a la existencia de fuerzas de cizallamiento en dichas zonas que las hace más proclives a daño endotelial y trombosis 22.
Por último, se ha propuesto la necesidad de anticoagulación como estrategia para disminuir estos eventos trombóticos agudos, y aunque la dosis óptima no está definida, se recomienda la administración de dosis altas de tromboprofilaxis o anticoagulación plena en pacientes de alto riesgo 23,24. Así mismo, al considerar la respuesta inflamatoria aguda, se esperaría que la inmunomodulación pueda tener algún efecto protector.
CONCLUSIONES
La covid-19 puede desencadenar un estado de hipercoagulabilidad e inflamación que favorece el daño endotelial y la presencia de eventos trombóticos, incluso en pacientes sin factores de riesgo cardiovasculares clásicos, y por tanto debe ser tenida en cuenta en el estudio del ACV isquémico en pacientes jóvenes. Este reporte de caso refuerza los datos de la literatura que describen una asociación entre la infección por SARS-CoV-2 y ACV isquémico con afectación de vasos de gran calibre, mayor morbimortalidad y pérdida de capacidad laboral. Queda pendiente evaluar el papel de la antiagregación, y considerar si se requieren dosis más altas de anticoagulación o de inmunosupresión en etapas tempranas de la enfermedad, especialmente en pacientes que se identifiquen como de mayor riesgo trombótico.














