INTRODUCCIÓN
La cefalea durante la gestación es un motivo de consulta frecuente en urgencias, se estima que puede afectar hasta el 35 % de las mujeres embarazadas 1, por tal razón, el médico debe estar capacitado para realizar un adecuado diagnóstico y un abordaje terapéutico oportuno, hasta donde su competencia lo permita. Durante la anamnesis y el examen físico, se debe buscar la presencia de banderas rojas y determinar posteriormente si la cefalea es primaria (el dolor es la enfermedad, p. ej., migraña, cefalea tipo tensión, trigémino-autonómicas) o secundaria (el dolor es el síntoma de una enfermedad) 2,3.
Dentro de las cefaleas primarias, la migraña es la que genera mayor número de consultas al servicio de urgencias 4. A su vez, es la segunda causa de discapacidad a escala mundial, tanto en hombres como en mujeres, y es la primera causa de discapacidad en mujeres entre los 15 y los 49 años 5. La mitad de los pacientes debutan antes de los 20 años, y la enfermedad afecta más a mujeres que a hombres, siendo más frecuente entre los 25 y los 55 años 6.
La migraña es una enfermedad crónica en la que se presenta dolor de cabeza de características definidas, que puede acompañarse de síntomas adicionales como náusea, vómitos, sonofobia, entre otros, o verse precedida de síntomas focales reversibles a los cuales se denomina auras 1,2,6. La semiología de la migraña permite que esta patología se pueda clasificar en migraña sin aura (MSA) y migraña con aura (MCA), y su diagnóstico es clínico.
Durante el embarazo, se ha reportado una reducción en la frecuencia de las crisis de migraña 3,7,8, no obstante, en un grupo pequeño de gestantes puede haber poca o ninguna mejoría, y en algunos casos empeoramiento 3,8,9, siendo las embarazadas con MSA previa a la gestación las que mayor probabilidad tienen de mejorar, no así aquellas con MCA 1.
La disminución de las crisis es gradual durante el transcurso del embarazo, con un mayor alivio durante el último trimestre 10, a pesar de lo cual la cefalea tiende a reaparecer dentro de la primera semana del puerperio 3.
La mejoría del dolor se debe a que en la gestación no hay fluctuaciones de los niveles séricos de estrógenos, como también a la liberación de endorfinas y cambios emocionales 11. Por otro lado, no se sabe exactamente cuál es el mecanismo que determina la persistencia del dolor, en especial en gestantes MCA, pero se ha postulado que es secundario a un efecto hormonal por parte los estrógenos y a una disfunción endotelial 3,11.
TIPOS DE CEFALEA EN EL EMBARAZO
Tanto en la población general como en las gestantes, las cefaleas primarias son más frecuentes que las secundarias 12,13. Un estudio realizado por Robbins et al. en el 2015 encontró que dentro de un grupo de 140 gestantes que acudieron a urgencias por cefalea, el 65 % presentó cefaleas primarias, siendo la migraña la más frecuente en este grupo (91,2 %), seguida de la cefalea tipo tensión episódica, la cefalea punzante primaria y la cefalea tipo tensión crónica 12. Estos datos son equiparables a los resultados obtenidos por Muñoz et al. en el 2021, de acuerdo con los cuales el 65 °% de las cefaleas en gestaste fueron primarias, y la migraña fue la más frecuente (62,3 %) entre todos los tipos de cefalea 14. Robbins et al. documentaron de igual forma, que el 35 % de las cefaleas fueron secundarias, siendo los trastornos hipertensivos (preeclampsia, PRES, eclampsia, HELLP, hipertensión arterial aguda, síndrome de vasoconstricción cerebral reversible) las causas más frecuentes, seguidas de la apoplejía pituitaria, el neumoencéfalo, la trombosis de los senos venosos, entre otras 12.
Las cefaleas secundarias tienden a ser más frecuentes a partir del segundo trimestre del embarazo, que coincide con el tiempo de aparición de los trastornos hipertensivos propios de la gestación (a partir de la semana 20) 15. En cuanto a la trombosis de los senos venosos, durante el embarazo es más frecuente en el tercer trimestre, no obstante, el 75 % de los casos sucede en el puerperio 16. Por otro lado, la apoplejía pituitaria tiende a ser más frecuente dentro del segundo trimestre 17.
ESTRÓGENOS Y MIGRAÑA
En mujeres no gestantes, los estrógenos tienen un efecto bimodal. Las altas concentraciones producidas de manera natural pueden facilitar la génesis de la migraña 18,19, en tanto que los periodos con descensos rápidos de esta hormona pueden facilitar la aparición de reagudizaciones (crisis) de esta patología 19,20. En la figura 1 se puede ver la relación entre los niveles de estrógenos y las diferentes fases del ciclo menstrual.
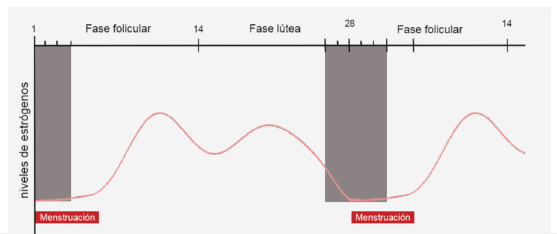
Fuente: Adaptada de Krause et al 20.
Figura 1 Aparición de crisis de migraña en relación con los niveles de estrógenos en el ciclo hormonal.
Algunos estudios en roedores han reportado que el nervio trigémino posee múltiples receptores ER- a, que al unirse con los estrógenos llevan a la expresión de genes que producen un estado proinflamatorio y nociceptivo, lo que podría explicar la predisposición de la migraña en las mujeres 22. Por otro lado, la disminución rápida de las concentraciones estrogénicas desencadena un aumento de los receptores de B2 de bradicininas, que al ser estimulados liberan el péptido relacionado con el gen de calcitonina (CGRP, por sus siglas en inglés) 20,23. Este neuropéptido ha sido relacionado con la sensibilización central, cambios en el tono vascular e inflamación neurogénica 24,25.
Durante la gestación hay un aumento progresivo de los niveles estrogénicos 1. Este aumento, asociado con la ausencia de fluctuaciones de esta hormona, conlleva una supresión de la activación del CGRP, lo que disminuye la frecuencia de las crisis de migraña 20. De igual forma, durante este periodo también hay liberación de endorfinas que contribuyen a la modulación del dolor 11.
MIGRAÑA SIN AURA
Es la presentación más usual tanto en la población general como en gestantes, con una frecuencia que oscila entre 64 y 73 % en estas últimas 1,13,14. Adicionalmente, puede iniciarse de novo hasta en el 10 °% de las embarazadas 3.
Durante la gestación, hasta en un 89 % de los casos se presenta mejoría medida por el número de ataques por mes, de manera más notoria en el tercer trimestre del embarazo 3,7,26. No obstante, durante el primer trimestre se puede experimentar empeoramiento de los síntomas, tal como lo reportaron Frederick et al. en un estudio de cohortes, en el cual el 40 °% de las gestantes con cualquier tipo migraña presentó empeoramiento del dolor medido por el test de evaluación de la discapacidad por migraña (MIDAS, por sus siglas en inglés) 27. Las posibles causas de este deterioro son la reducción o limitación de medicamentos para el tratamiento agudo o profiláctico de la migraña, así como la emesis matutina y el insomnio 28.
Durante el puerperio, hay un rápido retorno del dolor de cabeza, posiblemente por el descenso de los niveles estrogénicos y de endorfinas, así como el estrés, la falta de sueño y la depresión 3.
MIGRAÑA CON AURA
Se caracteriza por cefaleas asociadas con un fenómeno neurológico denominado aura. Las auras típicas se atribuyen a un fenómeno conocido como despolarización cortical propagada, el cual se caracteriza por una breve excitación de la actividad cortical, seguido por una inhibición de hasta 30 min 29,30. Este periodo de excitación es mediado por el glutamato y el óxido nítrico 29) y es seguido por una vasoconstricción que disminuye el flujo sanguíneo sin llegar al umbral isquémico 31. La despolarización cortical propagada puede afectar cualquier área encefálica incluido el tronco cerebral, no obstante, la corteza occipital es la más afectada debido a su alta concentración de neuronas glutaminérgicas 31,32,33.
Las auras pueden ser visuales, sensitivas, motoras, del lenguaje, del tallo encefálico, o retinianas y suelen resolverse dentro de los primeros 60 minutos 13,34, no obstante, pueden ser de mayor duración, hecho que puede estar relacionado con a una hiperexcitabilidad de los receptores NMDA o con una disfunción inhibitoria central 29.
Su presentación en gestantes oscila entre un 10 a un 37 % 1,13,14, con una mejoría del 43 al 83 %% 3. Así mismo, estas pacientes pueden tener nuevos tipos de auras o en algunos casos presentar auras sin cefalea 3. Esto puede explicarse por el efecto excitatorio de los estrógenos sobre el sistema nervioso central, que conlleva una mayor depresión cortical propagada 35, lo que explicaría también por qué algunas gestantes con MSA presentan episodios de MCA.
Las posibles causas de la no mejoría del MCA durante la gestación incluyen el aumento de la depresión cortical propagada (tal como se comentó anteriormente), como también una disfunción endotelial mediada por una hiperagregación plaquetaria y una disminución de la producción de prostaciclinas 3,11.
MIGRAÑA CRÓNICA
Este tipo de migraña afecta aproximadamente del 1,4 al 2,2 % de la población general 36) y aproximadamente al 8% de las gestantes con cefalea 13. Se define como el dolor de cabeza que ocurre en 15 o más días al mes durante más de 3 meses y que, en al menos 8 días al mes, el dolor tiene las características de la migraña 21.
Las crisis constantes llevan a una sensibilización central, debido a una estimulación dolorosa repetitiva que viaja hacia el sistema nervioso central por medio las fibras trigeminals, lo que genera una disminución del umbral del dolor y por ende cefaleas más frecuentes 36.
La migraña crónica inicia como una migraña con o sin aura, pero al estar presentes factores cronificadores, el dolor se hace resistente a la analgesia 36. Entre estos factores se encuentran las alteraciones del sueño, la obesidad, el sexo femenino, el abuso de analgésicos y la cafeína 36.
ESTATUS MIGRAÑOSO
Es una complicación de la migraña, que se caracteriza por una cefalea mayor a 72 horas, continua, intensa e incapacitante 21,37. No se tienen datos epidemiológicos concretos de esta entidad en embarazadas. Las principales causas del estado migrañoso son el uso frecuente e inapropiado de analgésicos, el estrés, la depresión y la menstruación 37.
Para un correcto diagnóstico de las diferentes presentaciones de la migraña se utilizan los criterios diagnósticos ICHD 3, los cuales pueden revisarse en la tabla 1. Estos criterios, asociados con un amplio interrogatorio y un examen físico adecuado, permiten hacer un diagnóstico preciso de la entidad 14.
Tabla 1 Criterios diagnósticos de migraña.
Fuente: adaptado de la III edición de la Clasificación Internacional de las Cefaleas
TRATAMIENTO FARMACOLÓGICO AGUDO DEL DOLOR
El manejo farmacológico ya sea profiláctico o agudo en gestantes ha de ser prescrito con cautela, debido a que algunos de estos medicamentos pueden aumentar el riesgo de complicaciones maternofetales (malformaciones, aborto espontáneo, cierre del ductus, parto prematuro, entre otras). En este apartado se mencionarán fármacos y procedimientos para el manejo agudo del dolor y de su seguridad en el embarazo, las dosis de cada medicamento pueden consultarse en la tabla 2.
Tabla 2 Medicamentos utilizados para el tratamiento la migraña durante el embarazo
| Medicamento | Categoría | Dosis | Comentario |
|---|---|---|---|
| Acetaminofén | B | 500-1000 mg VO la primera dosis | - |
| AINE | C: primer trimestre hasta la semana 19 D: desde la semana 20 de gestación | Ibuprofeno: 400 -800 mg VO la primera dosis Diclofenaco: 75 mg IM dosis única | No usar aspirina |
| Corticoides | C |
|
|
| Difenhidramina | B | 25 mg VO o IV | - |
| Metoclopramida | B | 10 mg IV/VO dosis única | Evitar su uso durante el trabajo de parto |
| Sumatriptán | C | Oral: 25, 50, o 100 mg dosis inicial Subcutánea: 6 mg | - |
Fuente: listado de medicamentos que pueden ser utilizados durante la gestación de acuerdo con la edad gestacional 9,57,62
Acetaminofén (paracetamol)
Es el analgésico de primera elección debido a su buena efectividad y a su seguridad en el embarazo 38. Si bien hasta la fecha no se ha evidenciado que su uso aumente el riesgo de alteraciones maternofetales, algunos estudios han reportado una asociación entre su consumo y la presencia de asma 39, así como de alteraciones del comportamiento y la atención 3. Sin embargo, dichos estudios presentaron errores metodológicos, por lo que la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA, por sus siglas en inglés) no ha cambiado su categoría 40.
Medicamentos antiinflamatorios no esteroides
En este grupo se encuentran múltiples analgésicos que actúan a través de la inhibición de las enzimas COX 1 y COX 2. Algunos estudios encontraron que el uso de cualquier antiinflamatorios no esteroides (AINE) en el primer trimestre aumenta la frecuencia de abortos espontáneos 41,42, sin embargo, en el 2015 la FDA publicó un comunicado en el que manifestaba que tales estudios presentaban errores en sus diseños, lo que los hacía no concluyentes 40. Por otro lado, se ha reportado que el uso de estos medicamentos a partir de la semana 20 del embarazo se correlaciona con oligohidramnios e insuficiencia renal neonatal 43, como también con cierre prematuro del ductus arterioso sin son administrados durante en el tercer trimestre 3,7. Por lo anterior, la FDA recomendó evitar el uso de cualquier AINE desde la semana 20 de gestación hasta la finalización de este periodo 43. No se ha reportado aumento del riesgo de malformaciones en humanos con el uso del ibuprofeno o diclofenaco 44,45.
La aspirina está clasificada como tipo D, dado que puede generar alteraciones en la homeostasis materno-fetal, malformaciones, retardo del crecimiento intrauterino, hemorragia intracraneal en prematuros y cierre prematuro del ductus arterioso, entre otros problemas 3,7,8,9.
En resumen, se puede recomendar el uso de ibuprofeno o diclofenaco hasta la semana 19 de embarazo y evitarlo a partir de la semana 20 de gestación.
Triptanes
La administración de sumatriptán en animales, a dosis supraterapéuticas para los humanos, reportó embrioletalidad y malformaciones. Sin embargo, hasta la fecha no se ha reportado ninguna malformación en fetos humanos 3,7,8. En cuanto a su relación con abortos, un metaanálisis en el 2015 reportó una mayor frecuencia de abortos espontáneos de hasta 25 % en gestantes migrañosas que consumieron sumatriptán al compararlas con gestantes sin migraña 46 (la frecuencia de abortos espontáneos oscila entre un 9 y un 15 % 47). No obstante, no hubo un aumento en su frecuencia al comparar las gestantes con migraña expuesta al sumatriptán con las gestantes migrañosas no expuestas al fármaco. De igual forma, un estudio de cohortes controlado realizado por Spielmann et al. en julio del 2017, no reportó un aumento en la frecuencia de abortos espontáneos con el uso de este medicamento 48. En cuanto a complicaciones en el posparto, un estudio retrospectivo canadiense reportó que el consumo de triptanes durante el segundo o tercer trimestre conllevo un aumento del sangrado en el posparto, debido a un aumento de la atonía uterina, pero sin riesgo fetal (OR: 1,4, IC 95 %: 1,1-1,8) 49.
Entre las complicaciones propias del feto, un estudio noruego realizado en menores de 3 años, hijos de madres expuestas a triptanes durante el primer trimestre del embarazo, mostró un aumento discreto de conductas externa-lizantes 50, sin embargo, los mismos autores dos años después llevaron a cabo un estudio similar en menores de 5 años, el cual no reportó aumento de alteraciones comportamentales 51.
En el 2020 se reportó un caso una hipoperfusión placentaria en una gestante con el sobreuso de almotriptán, sin que se hayan reportado casos similares hasta la fecha 52. Por lo expuesto anteriormente, se puede concluir que el uso del sumatriptán durante el embarazo no genera alteraciones maternofetales de gran impacto, por lo que puede recomendarse su uso de manera ocasional en aquellas gestantes muy sintomáticas 48,53.
Opioides
Si bien los fármacos de este grupo son eficaces, su uso en las cefaleas no está recomendado dado que pueden empeorar la náusea y exacerbar el dolor de cabeza 54. Algunos estudios reportaron un aumento en la presentación de malformaciones a nivel vertebral y cerebral, sin embargo, la FDA expresó que estos estudios presentaron fallas metodológicas, por lo cual no se pudo establecer una relación causal 40,55,56. El uso prolongado de cualquier opioide puede generar síndrome de abstinencia en el recién nacido, y si son administrados en el tercer trimestre o durante el trabajo de parto aumentan el riesgo de depresión respiratoria neonatal 3,7,8. Si bien estos medicamentos pueden usarse en circunstancias excepcionales, no se recomienda dejar de prescribirlos en el tratamiento de la migraña 57.
Derivados del cornezuelo del centeno
En este grupo encontramos un amplio número de medicamentos, ya sea de tipo natural o sintético, y la ergotamina es la más usada en nuestro medio. Cualquiera de estos fármacos se encuentra totalmente contraindicado en gestantes, debido a su potente efecto vasoconstrictor y útero-estimulante 53,58, que puede conllevar restricción del crecimiento intrauterino, abortos o partos prematuros 7,8.
Cafeína
La administración de cafeína a altas dosis en animales ha reportado un aumento en la frecuencia de malformaciones 59, sin embargo, hasta la fecha no hay ningún estudio que pueda evidenciar esto en seres humanos. Una revisión de 17 metaanálisis realizado por James en el 2020 reportó que 14 de estos estudios evidenciaron una relación entre el consumo de cafeína y la presencia de aborto espontáneo, mortinatos, bajo peso al nacer o pequeño para la edad gestacional, leucemia y sobrepeso y obesidad infantil, sin que haya un nivel de dosis mínima de cafeína que genere estos efectos adversos 60. De igual forma, un estudio de cohortes realizado por Gleason et al. en el 2022 reportó que la detección en plasma de niveles de cafeína y paraxentina de 25-50 ng/mL, respectivamente, en embarazadas estuvo asociado con una estatura baja para la edad en los hijos de estas gestantes en los primeros 8 años de vida 61. Si bien el Colegio Americano de Ginecología y Obstetricia recomendó en el 2022 hasta 130 mg de cafeína en combinación con acetaminofén 62, por parte de este estudio no recomendamos la administración de analgésicos combinados con cafeína, considerando el efecto fetal deletéreo ya reportado, así como el hecho de que no hay un nivel claro de cuál es la dosis mínima segura de este compuesto y, por último, porque es difícil determinar qué cantidad de cafeína ha ingerido una persona al momento de la consulta, ya que este compuesto se encuentra en múltiples alimentos de frecuente consumo.
Corticoides
El uso de corticoides en la población general ha sido recomendado para el estatus migrañoso como coadyuvante analgésico y en migraña crónica para disminuir las cefaleas de rebote 57,63. Un estudio retrospectivo 64 reportó que el uso de corticoides durante el primer trimestre genero un aumento pequeño en la frecuencia de labio paladar hendido (OR: 1,7, IC: 1,1-2,6), siendo la prednisolona la de mayor riesgo. Otros estudios han reportado aumento en el riesgo de parto pretérmino, trastornos hipertensivos propios del embarazo, bajo peso al nacer, diabetes gestacional, pero sus resultados no son concluyentes 65. El uso de glucocorticoides a dosis altas es un factor de riesgo protrombótico 66, por lo que debe tenerse precaución en pacientes con trombosis de senos venosos, ya que esta patología puede generar dolores de cabeza tipo migraña 67.
En resumen, los corticoides deben evitarse durante el primer trimestre y, en caso de presentarse estatus migrañoso o una migraña crónica en el segundo o tercer trimestre, deben considerarse dosis no mayores de 60 mg de prednisona o su equivalente en dexametasona.
Sulfato de magnesio
A este medicamento se le han atribuido efectos analgésicos en algunos tipos de cefalea, puesto que antagoniza los receptores NMDA 68,69. Este receptor, al ser estimulado por el glutamato puede llevar a vasoconstricción o inicio de la despolarización cortical propagada, entre otros efectos 70,71, sin embargo, ensayos clínicos controlados (ECC) han mostrado resultados controversiales con su uso. En el 2013, un metaanálisis en el que se incluyeron 5 ECC que buscaban valorar la eficacia del sulfato de magnesio en la migraña, no encontró que su efectividad fuera superior a la de los fármacos de los grupos de control. No obstante, dado que los estudios presentaron errores metodológicos, sus resultados no fueron concluyentes 71. Ese mismo año (después de la publicación del metaanálisis) Ali Shahrami et al. publicaron un ECC aleatorizado doble ciego el cual comparaba el uso de sulfato de magnesio con dexametasona/ metoclopramida, y encontraron que el sulfato de magnesio fue eficaz y superior al grupo de control, con resultados estadísticamente significativos 72.
Este medicamento se encuentra clasificado como categoría D, pues su administración por más de 5 días se asocia con anormalidades óseas y osteopenia en el feto 73,74, por lo que su uso en migraña solo deberá considerarse bajo vigilancia de obstetras 75.
Bloqueos de nervios periféricos
Los anestésicos locales (AL) combinados o no con corticoides son una de las nuevas líneas terapéuticas para el tratamiento agudo o preventivo de las migrañas refractarias. Su mecanismo de acción es el bloqueo reversible de los canales de sodio localizados en las membranas plasmáticas de los nervios periféricos sensitivos, lo cual impide la conducción nerviosa 76. Se caracterizan por tener un efecto rápido y una vida media corta. No obstante, su uso en bloqueos nerviosos para el tratamiento de algunas cefaleas primarias (incluyendo la migraña) ha generado periodos largos de remisión 77. Se ha postulado que su efecto analgésico en casos agudos responde a que disminuye la transmisión dolorosa transportada hacia el núcleo espinal del trigémino en su pars caudalis y al asta dorsal cervical, lo que desencadena una analgesia extensa 78. Sin embargo, aún no es claro cómo los AL pueden generar alivio de los síntomas a largo plazo. Se cree que el bloqueo de los impulsos llevados por las fibras trigeminales o por los nervios occipitales conlleva una disrupción de la sensibilización central y por ende un alivio del dolor por mayor tiempo 78.
Los nervios pericraneales susceptibles a bloqueo nervioso son: el nervio supratroclear, el supraorbitario, el auri-culotemporal, el occipital mayor y el occipital menor, como también el ganglio esfenopalatino 78.
Antieméticos
El uso de estos medicamentos en combinación con analgésicos se ha recomendado para el alivio de la migraña, siendo la metoclopramida y la difenhidramina los que mayor seguridad tienen durante la gestación 79,80. La metoclo-pramida es quizás el antiemético más usado en esta patología 3,8, ya que se ha podido comprobar que además de aliviar la náusea, también disminuye la intensidad de la cefalea 81. Los mecanismos postulados de este efecto analgésico incluyen su acción antagónica sobre los receptores 5HT3 del área postrema, como también una acción antagonista sobre los receptores de dopamina D2, lo cual suprime la activación trigeminovascular 82. Entre sus efectos adversos se encuentran: somnolencia, fatiga, extrapiramidalismo (discinesias, parkinsonismos, acatisia y discinesias tardías), por lo que se desaconseja su uso durante el trabajo de parto 8.
La difenhidramina se usa para la prevención del extrapiramidalismo por metoclopramida y como agente analgésico, ya que se parte de la hipótesis de que la histamina contribuye a la génesis de los ataques de migraña 83. Un estudio aleatorizado doble ciego del 2016, que buscaba comparar la mejoría de la migraña con el uso de metoclopramida más difenhidramina vs. metoclopramida más placebo, encontró que no hubo una mejoría significativa de la cefalea con el uso de la difenhidramina. Así mismo, la presencia de acatisia (el único efecto extrapiramidal encontrado en el estudio) fue comprable en ambos grupos 84. El Colegio Americano de Ginecología y Obstétrica recomienda la administración de 25 mg de difenhidramina en asociación con la metoclo-pramida 62.
En resumen, se recomienda el uso de metoclopramida durante el embarazo excepto durante el trabajo de parto. Por otro lado, si bien el uso de difenhidramina es seguro y recomendado durante el embarazo, se requieren más estudios que evalúen su efectividad como coadyuvante del dolor en este tipo de población.
TRATAMIENTO NO FARMACOLÓGICO EN CASOS AGUDOS
El manejo no farmacológico hace parte de los pilares del manejo preventivo de la migraña, el cual consta de un amplio grupo de recomendaciones, entre las que se incluyen la actividad física y evitar gatilladores de las crisis como la deprivación del sueño, saltarse el horario de las comidas, la mala hidratación o el estrés, entre otros 1,3,9. En los casos intrahospitalarios, se recomienda continuar estas medidas ajustadas a las limitaciones propias de los centros de salud, asegurándose de mantener una buena hidratación 1 y manteniendo a las pacientes en la medida de lo posible en sitios con poca luz y escaso ruido, para evitar el empeoramiento del dolor y lograr la conciliación del sueño. Por otro lado, se ha comprobado que el uso de bolsas de hielo en la región carotidea del cuello genera modulación del dolor en casos agudos de migraña, sin embargo, se desconoce su mecanismo analgésico 85.
En las figuras 1, 2 y 3 se resume el abordaje terapéutico mediante un algoritmo basado principalmente en la edad gestacional de la paciente.
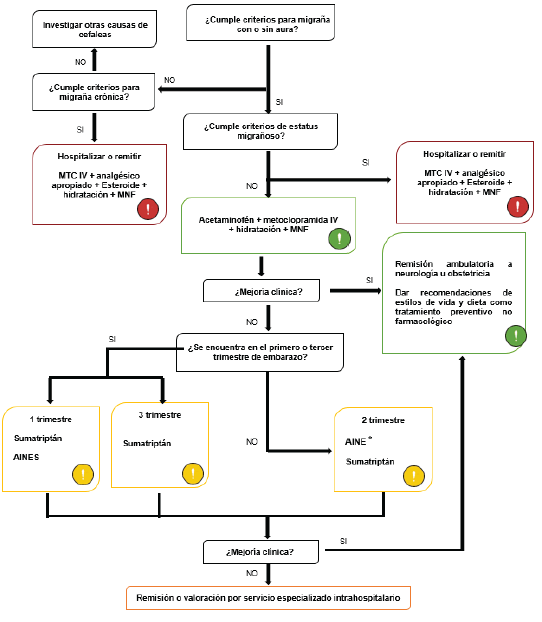
Fuente: Adaptado de Negro et al 3
Figura 2 Algoritmo de manejo agudo de la migraña en paciente embarazada.















