INTRODUCCIÓN
La lesión cerebral post paro cardiaco (LCPPC) es la principal causa de muerte y discapacidad en pacientes que sobreviven a la resucitación por paro cardiaco.
En Colombia se desconoce la realidad del paro cardiaco por la no implementación de un formato estandarizado que capture la información intra y extrahospitalaria de los eventos cardiacos que requieren maniobras de resucitación 1.
El estudio EuReCa TWO registró los casos de paro cardiaco extrahospitalarios durante el último trimestre de 2017 en 28 países europeos con una población de casi 179 millones de habitantes, con un total de 37.054 casos confirmados de los cuales 25.171 (68%) recibieron resucitación cardiopulmonar (RCP) por circunstante, con un retorno a circulación espontánea (RCE) en una tercera parte de los casos (33%) y solo un 8% de los pacientes egresaron vivos del hospital 2.
En Estados Unidos en el año 2019 la incidencia de paro cardiaco extrahospitalario fue de 76,5 casos por 100.000 habitantes por año con una tasa de supervivencia de 10,6%. La incidencia de paro cardiaco intrahospitalario es de 10,6 por cada 1000 admisiones hospitalarias 3.
El objetivo del presente artículo es revisar los aspectos neurológicos más importantes de la resucitación cardiopulmonar (RCP), el neuropronóstico de la LCPPC o encefalopatía hipoxoisquémica y los aspectos de orden médico, ético y legal en la toma de decisiones.
FISIOPATOLOGÍA
Los eventos que terminan afectando el encéfalo se dan por mecanismos de lesión primaria (isquemia) y secundaria (reperfusión) que secuencialmente suceden durante el paro, la resucitación y la fase aguda post resucitación 4.
Lesión primaria
El metabolismo neuronal es altamente dependiente del aporte de glucosa y oxígeno por parte de la circulación sanguínea. La integridad celular de la neurona depende de la bomba de Na+ / K+ y del ATP que resulta del metabolismo aeróbico de la glucosa en las mitocondrias. Al paralizarse esta bomba, el Na+ por gradiente de concentración ingresará al interior de la neurona, y con él, el agua, ocasionando edema celular citotóxico verdadero, el cual puede observarse de manera temprana en las imágenes por resonancia magnética (IRM) con hiperintensidad en DWI (Diffusion-wieighted imaging) e hipointensidad en los mapas ADC (Apparent Diffusion Coefficient) y tardía con hipodensidad en la tomo-grafía computarizada (TC) de cráneo 5. Posterior al paro cardiaco la inconsciencia sobreviene en escasos segundos, el electroencefalograma (EEG) se torna isoeléctrico en los primeros 30 segundos y los potenciales evocados corticales pueden continuar generándose algunos minutos después de la parada 6. Concomitante con la entrada de sodio al interior de la célula se presenta también la salida de K+, así como la apertura de canales voltaje sensibles de Ca++ y su ingreso a la neurona 4.
Lesión secundaria
El cerebro constituye el 2% del peso corporal y demanda hasta un 15% del gasto cardiaco. El flujo sanguíneo cerebral (FSC) normal es de 60 a 70 ml/100gr/min en la sustancia gris y 25 ml/100gr/min en la sustancia blanca. El masaje cardiaco en la RCP solo alcanza el 25% del FSC normal, porcentaje bastante bajo para alcanzar los límites mínimos que aseguren la integridad celular y eviten el daño neuronal 4. Cuando hay RCE, el arribo circulatorio a los lechos vasculares cerebrales isquémicos desencadena una serie de eventos nocivos llamados lesión secundaria.
La noxa isquémica libera glutamato que genera ingreso adicional de Ca++ a la neurona y el colapso energético intracelular permite la liberación del Ca++ contenido en el retículo endoplasmático que activa enzimas líticas como lipasas, caspasas y proteasas que contribuyen al daño en organelos intracelulares como las mitocondrias, principales generadores de ATP en la cadena de electrones 4.
Por otra parte, la activación del sistema inmune innato involucra a elementos celulares como la microglía y leucocitos, que liberan citocinas y amplían la respuesta inflamatoria local permitiendo la apertura de la barrera hematoencefálica (BHE) y la formación de edema cerebral 4.
Cambios en la perfusión cerebral en la LCPPC
Áreas vulnerable
Una vez se reanuda la circulación espontánea, la reperfusión cerebral dista de ser completa y homogénea. Por el contrario, se presentan en el encéfalo múltiples defectos de perfusión cuyo número y extensión están relacionados con la duración de la noxa isquémica. Estos defectos de perfusión son más notorios en áreas vulnerables a la isquemia como el cuerpo estriado, hipocampo, tálamo y amígdala 4.
Hipoperfusión tardía
Se ha demostrado aumento en la perfusión cerebral los primeros 15 a 30 minutos siguientes a la reanudación de la circulación espontánea (hiperemia global) con una caída ulterior hasta en un 50% del FSC. Es evidente la caída en la tasa de metabolismo cerebral de oxígeno y en la fracción de extracción de oxígeno cerebral 24 a 72 horas posterior al paro cardiaco. La hipoxia tisular cerebral puede ser medida mediante microcatéteres insertados en el parénquima e indicada como presión tisular cerebral de oxígeno (PbtO2) y si esta es menor a 20 mm Hg está relacionada con mayores índices de lesión cerebral 4.
Cambios en la autorregulación cerebral
La autorregulación cerebral es una propiedad inherente de la microcirculación cerebral que permite mantener un FSC constante en un rango variable de presiones arteriales medias (PAM). La autoregulación cerebral se altera en pacientes con LCPPC y ocasiona que cifras bajas de tensión arterial generen más daño 4.
Los factores de edema citotóxico y vasogénico ya expuestos aumentan la presión intracraneana lo cual puede disminuir la presión de perfusión cerebral (PPC) y empeorar también la LCPPC.
TRATAMIENTO
Una revisión detallada del manejo de la LCPPC está fuera de los objetivos de la presente revisión. Sin embargo, se hará énfasis en aquellos tópicos más relevantes relacionados con las intervenciones terapéuticas que pueden llegar a modificar los desenlaces neurológicos.
La guía 2021 del European Resuscitation Councily la European Society of Intensive Care Medicine7 sobre cuidados post resucitación establece las siguientes metas en hemodinamia, oxigenación y ventilación:
Corregir hipovolemia con cristaloides
PAM > 65 mm Hg
Lactato normal o disminuido
Gasto urinario mayor a 0,5 ml/kg/hora
PaO2 de 75 a 100 mm Hg
SaO2 94-98%
PaCO2 de 35 a 45 mm Hg
TV (tidal volume) 6 a 8 ml/kg.
Manejo de temperatura objetivo (Targeted Temperature Management).
El manejo de temperatura objetivo o TTM por sus siglas en inglés, se refiere a todas aquellas estrategias que pretenden alcanzar y mantener una temperatura corporal específica que oscila entre 33 a 37,5°C. Se le conoció como hipotermia terapéutica pero aún es controversial cuándo iniciarla, a qué dosis o nivel de temperatura y durante cuánto tiempo aplicarla 7.
En un primer estudio sueco de TTM pacientes inconscientes posteriores a paro cardiaco extrahospitalario atribuidos a causa cardiaca tratados con una temperatura objetivo de 33°C no demostró beneficio al compararlo con el grupo tratado con una temperatura de 36°C 8. En el estudio francés HYPERION 9 pacientes resucitados de ritmos iniciales no desfibrilables (asistolia o actividad eléctrica sin pulso) tratados con una TTM de 33°C y comparados con el grupo de pacientes con una TTM de 37°C durante 24 horas, los primeros tuvieron mayores porcentajes de desenlaces neurológicos favorables. Sin embargo, su índice de fragilidad de tan solo 1, no permite dar recomendaciones sólidas al respecto.
El estudio TTM2 10 publicado en al año 2021 comparó pacientes con paro cardiaco extrahospitalario tratados con TTM de 33°C con los tratados con TTM de 37°C, evitando fiebre (mayor o igual a 37,8°C) en todos ellos, sin demostrar descenso de la mortalidad o mejoría de la calidad de vida a 180 días. El grupo de TTM de 33°C tuvo mayores porcentajes de arritmia cardiaca.
Para el mes de abril de 2021 la guía del European Resuscitation Council y la European Society of Intensive Care Medicine7 recomendaba TTM en adultos con paro cardiaco intra o extrahospitalario independiente del ritmo inicial y que persistían inconscientes después de la reanudación de la circulación espontánea. La temperatura objetivo debía mantenerse constante entre 32°C y 36°C por lo menos 24 horas, evitando fiebre (mayor o igual a 37,7°C) por lo menos 72 horas en pacientes en coma después de la reanudación de la circulación espontánea.
Sin embargo, dos publicaciones recientes de revisión sistemática y metaanálisis, uno de ellos de red, de las temperaturas objetivo demostraron que hipotermias leves, moderadas o profundas no mejoraban los desenlaces de sobrevida ni funcionales después de paro cardiaco extrahospitalarios cuando se les comparaba con normotermia 11,12.
Con base en la síntesis de la evidencia anterior la Inter-nationalLiaison Committee on Resuscitation (ILCOR) modificó la recomendación previa de 32°C a 36°C durante 24 horas por una prevención activa de fiebre por lo menos durante las primeras 72 horas con una TTM menor o igual a 37,5°C en pacientes en coma posterior a paro cardiaco 4.
Crisis epilépticas
El estatus epiléptico no convulsivo se presenta en un 12% de los pacientes post paro cardiaco y tratados con hipotermia 13. La monitorización continua con electroencefalograma (cEEG) es altamente recomendada y no existe evidencia suficiente para recomendar antiepilépticos profilácticos en LCPPC.
Se recomiendan antiepilépticos no sedantes con vida media corta (levetiracetam, ácido valproico) para no interferir con la evaluación clínica neurológica 14. Levetiracetam o el ácido valproico IV son los antiepilépticos de primera línea para tratar crisis epilépticas post paro cardiaco 7.
Las mioclonías son las manifestaciones epilépticas predominantes, pero crisis tonicoclónicas focales o generalizadas pueden aparecer, incluso en el mismo paciente. No está claro aún si las crisis epilépticas ocasionan mayor daño cerebral o si ellas son simplemente una manifestación más de la severidad de la LCPPC 4.
En el estudio TELSTAR la supresión de los patrones rítmicos o periódicos en EEG mediante un esquema escalonado de antiepilépticos más sedación comparada con sedación sola, en pacientes en coma posterior a paro cardiaco, no logró reducir el mal pronóstico en la LCPPC a los 90 días y los desenlaces fueron muy pobres en ambos grupos 15.
¿De qué muere un paciente con LCPPC?
La inestabilidad cardiovascular y la falla multiorgánica son las principales causas de muerte durante las primeras 48 a 72 horas después del retorno a la circulación espontánea, pero dos terceras partes de los pacientes fallecen por LCPPC 4. En el registro danés de paro cardiaco 16 durante los años 2005 al 2014 la supervivencia a los 30 días de los pacientes que llegaban al servicio de urgencias resucitados de paro cardiaco conscientes, en estado de coma y en RCP fue de 89%, 39% y 1,2% respectivamente. Se estima que el 12,6% de los pacientes con LCPPC que mueren en el hospital lo hacen bajo criterios de muerte encefálica y el porcentaje es significativamente mayor en aquellos pacientes que reciben terapia ECMO comparados con el grupo de pacientes con RCP, con una tasa de donación de órganos de 41,8% 17. Sin embargo, muchos pacientes fallecen después del retiro de las terapias de sostenimiento de vida (WLST: withdrawal of life-sustaining treatment) guiados por un anticipado mal pronóstico neurológico 18.
¿Cómo se evalúan funcionalmente a los pacientes que sobreviven a la LCPPC?
Se han diseñado diferentes herramientas para evaluar la condición funcional del paciente que sobrevive a la LCPPC. La primera de ellas es la escala de Categorías de Desempeño Cerebral (CDC) diseñada por el grupo de Pittsburgh que dicotomiza en dos grandes grupos de buen (CDC 1-2) y mal (CDC 3-5) desenlace. En la tabla 1 aparecen delineados cada uno de los grados que ponderan dicha escala. Sus limitaciones principales son no incluir condiciones intermedias ni evaluar funciones mentales superiores como lenguaje, funciones ejecutivas o memoria, dominios frecuentemente afectados en estos pacientes 4,18.
Tabla 1 Escala de Categorías de Desempeño Cerebral (CDC)*
| CDC 1 | Capaz de llevar una vida y trabajo normal, pero puede tener déficit neurológicos o psicológicos menores. |
| CDC 2 | Disfunción cerebral moderada, capaz de llevar un trabajo de tiempo parcial, o realizar AVD** independientemente. |
| CDC 3 | Disfunción cerebral severa con cognición limitada. Dependiente de otros |
| CDC 4 | Estado vegetativo |
| CDC 5 | Muerte encefálica |
*Cerebral Performance Categories (CPC). ** AVD actividades de la vida diaria.
Fuente: Tomada de 4.
Neuropronóstico en la LCPPC
El neurólogo adquiere un rol protagónico en el manejo de pacientes con LCPPC. Su labor debe estar dirigida a: (i) recolectar la información acerca del paro cardíaco como causa, tipo de ritmo cardiaco, tiempo al retorno de la circulación espontánea, curso clínico post paro, (ii) proveer recomendaciones de manejo para optimizar la recuperación neurológica, minimizar el daño y la orientación diagnóstica para definir el neuropronóstico y (iii) discutir potenciales desenlaces con la familia del paciente 18. El momento para dilucidar con los familiares lo ateniente al neuropronóstico no debe ser antes de las 72 horas y debe ser sustentado en lo posible con evaluaciones clínicas periódicas y pruebas diagnósticas.
Sesgos para tener en cuenta en el neuropronóstico
Las pruebas diagnósticas son realizadas para evaluar la severidad de la LCPPC y la toma de decisiones acerca del manejo inmediato del paciente, especialmente en el retiro de las terapias de sostenimiento de vida o WLST. Las pruebas son predictoras de mal pronóstico cuando arrojan resultados anormales (positivas) e idealmente su tasa de falsos positivos debería ser cero (alta exactitud) y sus intervalos de confianza estrechos (alta precisión) para que así un paciente que se vaya a recuperar no sea erróneamente marcado con un desenlace desfavorable 4.
Otras fuentes de confusión para los predictores diagnósticos son la sedación y las causas extracerebrales como la falla multiorgánica 4.
Predictores mayores de desenlaces neurológicos
Examen clínico
El examen clínico es el punto de partida y pieza fundamental en el manejo multimodal de los pacientes con LCPPC en la determinación del pronóstico neurológico. La exploración se inicia con la valoración del estado de consciencia a través de un abordaje escalonado de estímulos externos iniciando con el llamado del paciente por su nombre, seguido por un palmoteo o un estímulo verbal vigoroso y finalizar con estímulos mecánicos que superen el umbral doloroso como la compresión del lecho subungueal.
El predictor clínico más importante de un mal desenlace neurológico es la ausencia de reflejos pupilares a partir de las 72 horas post paro cardiaco tanto en pacientes no tratados con TTM (tasa de falsos positivos [TFP] de 0 a 1%) como en los tratados con TTM (TFP de 1 a 2,1%) 18,19,20. Sin embargo, la presencia de estos no se traduce necesariamente en un buen desenlace neurológico (valor predictivo positivo [VPP] 61%). El análisis cuantitativo con pupilómetro no está disponible en Colombia. Se pueden dar falsos positivos con pupilas dilatadas fijas por el uso prolongado de relajantes musculares como en rocuronium 21. La ausencia de reflejo corneano tiene una TFP de 2 a 5% y se afecta con más frecuencia por la sedación empleada; su presencia tampoco es un signo fiable de buen pronóstico (VPP 62%).
El examen motor de la escala de Glasgow menor o igual a 3 (no respuesta, extensión o flexión inapropiada) puede ser considerado si el paciente no está en TTM 19.
Las mioclonías son sacudidas repentinas, breves e involuntarias generadas por la contracción o inhibición muscular. Es frecuente la aparición de estos fenómenos motores en LCPPC y no siempre están ligados a un mal desenlace pues hasta un 9% sobreviven 19. Su aparición en las primeras 48 horas, distribución generalizada, patrón sincrónico y estereotipado, con una duración mayor a 30 minutos (estatus mioclónico) son indicadores de mal pronóstico. A pesar de lo anterior, su análisis debe complementarse con EEG pues hay patrones eléctricos con mayor especificidad para buen y mal pronóstico 22.
Electroencefalograma (EEG)
El EEG es el registro de la actividad eléctrica de la corteza cerebral y esta última es muy sensible a la lesión hipóxica por lo que el EEG es una buena herramienta de evaluación en pacientes en coma posterior al paro cardiaco, tanto en la detección de crisis epilépticas como en la determinación del pronóstico neurológico 22 Figura 1.
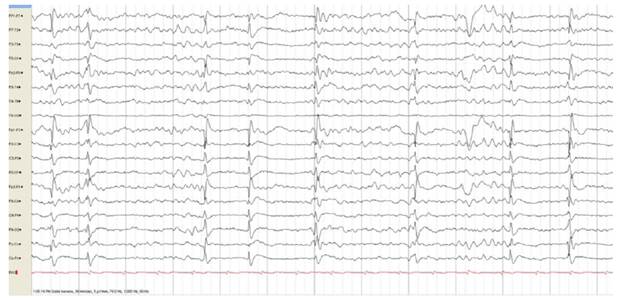
Fuente: Archivo personal Dr. Luis Carlos Mayor, Fundación Santafé de Bogotá.
Figura 1 Trazado EEG con descargas periódicas generalizadas de punta - onda en paciente con lesión cerebral post paro cardiaco.
Las crisis epilépticas convulsivas y no convulsivas son frecuentes en los pacientes con LCPPC e incluso pueden llegar a presentarse estatus epiléptico en un 32% de los casos 23.
La terminología EEG para cuidado crítico fue estandarizada en las guías de la American Clinical Neurophysiology Society en el 2021 24.
El trazado de base (background) refleja el funcionamiento cerebral cortical global y es muy sensible a la lesión hipóxica con lentificación y disminución en su amplitud. El trazado de base puede ser clasificado de acuerdo con su continuidad en:
Continuo: <1% supresión (amplitud < 10 μv).
Casi continuo: supresión 1-9%
Discontinuo: supresión 10-49%
Estallido* supresión (burst - suppression): supresión 50-99%
Suprimido: supresión >99%.
*El estallido es un grafoelemento en EEG caracterizado por una duración ≥0,5 segundos con ≥4 fases (debe pasar por lo menos tres veces la línea de base) y una duración <30 segundos.
Los trazados de base continuos son de mejor pronóstico mientras que los de estallido suspensión están relacionados con mal pronóstico 22. Sin embargo, algunos trazados de base continuos como el coma alfa son de mal pronóstico. Hay subtipos especiales de estallidos que aparecen de manera sincrónica con inicio abrupto y descargas epilépticas generalizadas o los "estallidos idénticos" (aquellos en los cuales los primeros 0,5 segundos o más de cada estallido o estallidos en clusters estereotipados de 2 o más son visualmente similares), que están relacionados con malos desenlaces neurológicos 22. Cuando el patrón estallido supresión este asociado a mioclonías es considerado altamente maligno.
Las mioclonías de intención correspondientes al síndrome de Lance-Adams pueden aparecer de manera temprana o tardía posterior al paro cardiaco, se asocian a trazados EEG continuos y a descargas epilépticas en una tercera parte de los casos, localizadas en el vértex y revisten casi siempre buen pronóstico 25.
La presencia de crisis epilépticas convulsivas o no convulsivas aumentan la demanda metabólica cerebral y empeorarían el pronóstico neurológico del paciente. Manifestaciones interictales en el EEG como patrones periódicos o la actividad delta periódica pueden evolucionar a crisis electrográficas o estatus epiléptico electrográfico (EEE). Si esta actividad epiléptica surge de un trazado de estallidos supresión es de mal pronóstico neurológico y si lo hace desde un patrón continuo será de mejor pronóstico 19,22.
La reactividad en el EEG es un predictor de buen pronóstico y se refiere a cambios en voltaje o frecuencia. La presencia de ella puede aumentar de 3 a 8 veces la probabilidad de buen desenlace 26. Un protocolo escalonado de estímulos durante el EEG consiste en palmoteo, llamar al paciente por su nombre y compresión del lecho subungueal 27.
Las descargas periódicas generalizadas se presentan en un 77 a 81% de los pacientes en coma post paro cardiaco, las crisis electrográficas en un 10%, los patrones con evolución de un 2-4% y otros patrones rítmicos o periódicos (0,5 a 2,5 Hz) en un 6 a 10% 15.
Potenciales evocados somatosensoriales (PESS)
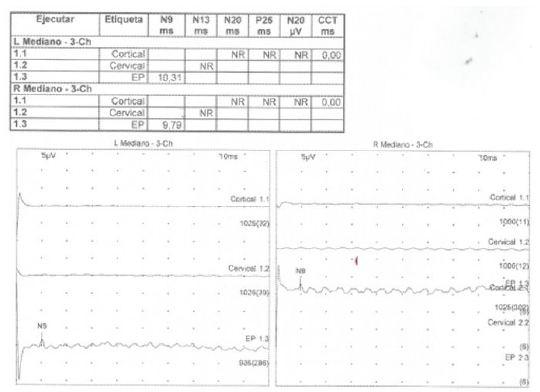
Un potencial evocado es una respuesta neuronal que se da posterior a un estímulo sensorial. Los más utilizados como predictores en LCPPC son los somatosensoriales en miembros superiores y resultan del promedio de respuestas generadas en la corteza cerebral a los 20 milisegundos posteriores a estímulos eléctricos sobre el nervio mediano a nivel de la muñeca. Se le conoce como N20 (potencial negativo o con inflexión hacia arriba de la línea isoeléctrica). No es afectado por la hipotermia o medicamentos y su ausencia es un fuerte predictor de mal pronóstico con una TFP de 0 a 1% 20 Figura 2. La disminución en su amplitud está relacionada también con mal pronóstico 28. En las mioclonías del Síndrome de Lanz-Adams se pueden observar potenciales N20 de gran amplitud (gigantes) 25.
Imágenes diagnósticas.
Una TC sin contraste de manera temprana después del paro cardiaco permite descartar causas neurológicas como el ACV hemorrágico o la hemorragia subaracnoidea (HSA). La relación baja entre sustancia gris y blanca medida en unidades Hounsfield en núcleo caudado, putamen o tálamo versus cuerpo calloso o brazo posterior de la cápsula interna, son un predictor temprano (≤2 horas) de mal pronóstico con TFP de 0 a 15%. Otros cambios en LCPPC severa son el borramiento de surcos corticales, la pérdida en la diferenciación cortico subcortical y la obliteración de cisternas peritroncales 29 Figura 3.
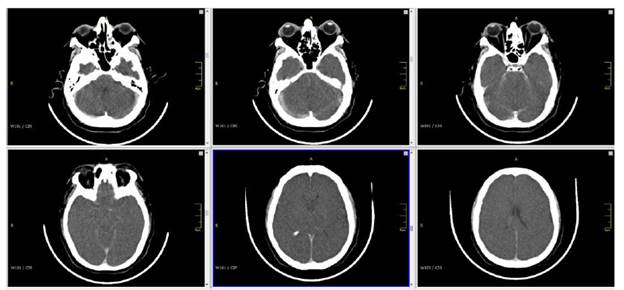
Fuente: Archivo personal doctor Javier Francisco Torres Zafra.
Figura 3 Tomografía computariza (TC) de cerebro en paciente con lesión cerebral post paro cardiaco (LCPPC). Se aprecia disminución en el tamaño de ventrículos cerebrales (*), pérdida de la relación cortico subcortical (**) y borramiento de cisternas peritroncales (***).
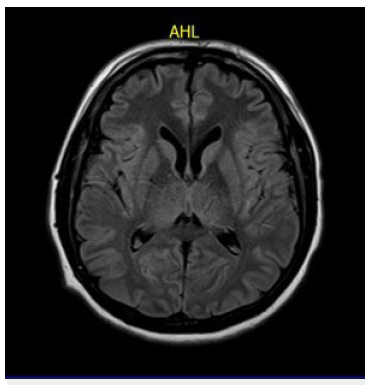
Las IRM son más sensible que la CT cerebral en detectar cambios tempranos y generalizados de la LCPPC. La restricción a la difusión en las secuencias de DWI y mapas ADC, así como hiperintensidad cortical y gangliobasal en FLAIR están asociados a mal pronóstico funcional 20 Figura 4.
Biomarcadores
Los biomarcadores más estudiados como predictores de mal pronóstico en LCPPC son la enolasa neuronal específica (NSE), la proteína ligante del calcio S-100 (S-100B) y el neurofilamento de cadena ligera (NFL). El mejor estudiado de ellos es la NSE 30.
La NSE está presente en tejido neuronal, neuroendocrino y eritrocitos. Puede elevarse en LCPPC, pero también lo puede hacer en tumores neuroendocrinos o hemólisis por lo que arrojaría falsos positivos en esos escenarios 7,31.
No se ha determinado un punto de corte para la NSE que se relacione con mal pronóstico y se recomienda un seguimiento diario de estos niveles entre 48 a 72 horas. El nivel recomendado hoy como predictor es mayor o igual a 60|ag/L entre 48 a 72 horas 7,20. No es operativa su disponibilidad actual en Colombia para el seguimiento de pacientes con LCPPC.
En un estudio reciente de síntesis de la evidencia se estudiaron los principales biomarcadores que se liberan sistémicamente desde el tejido nervioso después del paro cardiaco y su valor pronóstico. Se estudiaron la NSE, la S-100B, proteína fibrilar ácida glial, el NFL, tau e hidrolasa carboxilo ubiquitina. De ellos el NFL que refleja el daño de la sustancia blanca y la lesión axonal, demostró la más alta certeza como predictor de desenlaces neurológicos en lesión cerebral hipoxoisquémica después del RCE 31.
Es importante que los resultados de los biomarcadores y los de todas las otras pruebas en LCPPC deban estar insertos en un engranaje de pronóstico multimodal y no ser tomados de manera aislada 4.
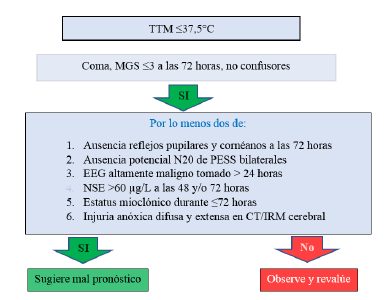
La European Resuscitation Council y la European Society of Intensive Care Medicine publicaron en el año 2021 una estrategia para sugerir pronóstico (algoritmo) basada en los predictores multimodales expuestos anteriormente y ser aplicada en pacientes en coma posterior a paro cardiaco 4,7 Figura 5.
La piedra angular en el pronóstico de LCPPC es la valoración clínica que debe excluir también factores de confusión como la sedación y el uso de bloqueadores neuromusculares.
Las variables utilizadas deben concordar en predecir el mal pronóstico y por lo menos deben existir dos de ellas, de no ser así la evaluación pronóstica debe ser reasumida 4.
Puntaje de muerte encefálica post paro cardiaco (MEPPC) 32.
Encefálico y cerebral no son términos intercambiables. Muerte encefálica (ME) se refiere a la pérdida irreversible de la función de la corteza cerebral, cerebelo y tallo cerebral. Una de las estructuras más vulnerables al insulto isquémico durante el paro cardiaco es la corteza cerebral 14 y una de las que más lo resiste es el tallo cerebral. Por lo tanto, la semiología del tallo cerebral juega un rol esencial en el diagnóstico de muerte encefálica.
Entre un 10 a 15% de los pacientes con LCPPC evolucionan hacia muerte por criterios neurológicos y son potenciales candidatos a la donación de órganos. Un retiro temprano de las terapias de sostenimiento de vida (WLST) pueden malograr la posibilidad de un potencial donante de órganos. El puntaje de MEPPC, recientemente presentado, pretende estimar de manera temprana el riesgo de muerte encefálica en pacientes con LCPPC 32 Tabla 2.
Tabla 2 Puntaje de MEPPC.
| Covariable | No. Puntos |
|---|---|
| Mujer | +4 |
| Ritmo no desfibrilable | +24 |
| Causa cardiaca del paro cardiaco extrahospitalario | -6 |
| Causa neurológica del paro cardiaco extrahospitalario | +45 |
| Natremia a las 24 horas | +(natremia-140) mEq/L |
| Soporte vasoactivo ingreso UCI | +4 |
| Soporte vasoactivo a las 24 horas | +6 |
Fuente: Tomada de 32
En esta revisión basada en dos ensayos clínicos de LCPPC [CYRUS 33 y Epo-ACR-2 34] se tomaron pacientes que sobrevivían 24 horas después de su ingreso a UCI post paro cardiaco. De un total de 569 pacientes elegibles, 84 (14,8%) cumplieron criterios de muerte encefálica diagnosticada ±SD de 5,3 ± días después de ingresar a UCI. El predictor más fuerte para ME fue la causa neurológica de paro cardiaco extrahospitalario, seguido por ritmo inicial no desfibrilable, hipernatremia, mujeres y por último el requerimiento de soporte vasopresor al ingreso y 24 horas después.
En esta escala el punto de corte fue de 50 puntos. La ME en la cohorte de validación sobrevino en el 4% de los pacientes con puntaje menor a 20, en 20,4% en puntajes entre 20 a 50 y en el 67,7% con puntajes mayores a 50. El área bajo la curva (AUC) para el puntaje de MEPPC en esta cohorte fue de 0,82 (95%IC 0,77-0.86) 32.
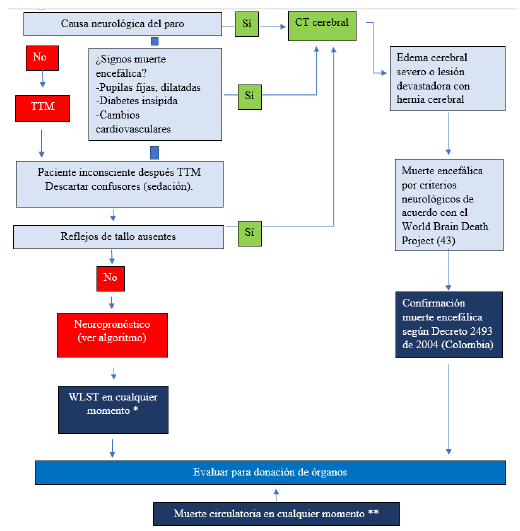
Donación de órganos
La donación de órganos debe ser considerada en todo paciente en LCPPC que cumpla los criterios de ME, Figura 6. En pacientes con alta probabilidad de evolucionar a ME (puntaje > 50 en MEPPC) y mal pronóstico neurológico de acuerdo con el algoritmo ERC/ESICM 2021, Figura 5, debe procurarse los cuidados de fin de vida tendientes al cuidado de los órganos de potencial donante 7 y no aplicar de manera prematura la WLST.
Aspectos éticos y legales del retiro de terapias de sostenimiento de vida (WLST)
Figura 6 Algoritmo ERC/ESICM 2021 para donación de órganos en ICPPC Fuente: Modificada de 7
En los últimos años ha crecido el interés por la donación desde aquellos pacientes cuya muerte ha sido determinada por criterios circulatorios y respiratorios. Esta donación después de muerte circulatoria puede ser controlada si la muerte ocurrió después de la aplicación de la WLST o no controlada si la donación proviene de personas que murieron como consecuencia de un paro cardiaco súbito y no esperado en quienes las maniobras de resucitación fueron fallidas 35. Es poco probable la autoresucitación (reinicio espontáneo de la actividad cardiaca) más allá de 5 minutos después de la WLST o de 10 minutos después de la RCP 36.
Esta forma de donación controlada cuando la muerte sobreviene posterior a la WLST es ampliamente practicada en unidades de cuidado intensivo desde los años 80 en Estados Unidos y en Europa, pero en Colombia aún no se tiene claridad desde el ámbito legal y procedimental y, aun reviste cuestionamientos éticos, siendo desconocido este mecanismo de donación por la población general.
Adecuación del cuidado terapéutico
En el escenario clínico de predecir un mal pronóstico con base en la historia clínica y el algoritmo de las ERC/ ESICM 2021 7 se plantean los siguientes escenarios: (i) pacientes con puntajes de MEPPC >50 puntos en los cuales debe mantenerse las terapias de sostenimiento de vida, (ii) pacientes con mal pronóstico neurológicos y no expectativa de ME candidatos al retiro de terapias de sostenimiento de vida (WLST).
Hay gran variabilidad en la toma de decisiones de WLST en diferentes regiones del mundo, países e incluso en las mismas UCI. En general el WLST se considera con más frecuencia en Europa (84%), en contraste con Latinoamérica donde la literatura es limitada y no hay datos claros de esta práctica 37. En unidades de cuidado intensivo alemanas, el 77,5% de los pacientes mueren después del WLST, sin embargo, solo el 21.9 % tenían voluntad anticipada y/o cuidador apoderado que la conociera 38. La aplicación de WLST en pacientes neurocríticos se basa en la percepción de pobre pronóstico neurológico lo cual implica la necesidad de contar con pruebas precisas para predecir resultados neurológicos confiables para la toma de decisiones de fin de vida 39.
La toma de decisión de WLST debe obedecer a un protocolo y equipararse al de ME con la participación del neurólogo. Es fundamental establecer las necesidades emocionales, físicas, espirituales de la familia durante el proceso, teniendo en cuenta que la lesión cerebral postparo es una condición súbita, catastrófica y no esperada en la mayoría de los casos, donde se debe mitigar los efectos psicológicos a largo plazo de la familia, reconociendo las diferencias socioculturales, basados en la comunicación asertiva 40.
Las decisiones de fin de vida deben basarse en los principios éticos de autonomía, beneficencia, no maleficencia y justicia 41. En Colombia, la ley 1733 del 2014 establece el derecho a suscribir un documento de voluntad anticipada en casos de enfrentarse a una enfermedad que comprometa su calidad de vida, determinando los límites de intervención y tratamientos deseados. Sin embargo, en la práctica, son ocasionales los casos donde se conocen los deseos previos de los pacientes o presentan documento firmado previamente en casos de LCPPC. Existe un vacío jurídico en Colombia de quién toma esta decisión y generalmente lo hace un cuidador subrogado (Health-care surrogate) 38, tampoco existe la figura jurídica del cuidador apoderado (Healthcareproxy)38, por lo que debe tenerse en cuenta el carácter vinculante de la voluntad anticipada en este escenario. Por lo anterior se debe insistir en intervenciones tempranas personalizadas para pacientes y familias donde se tomen decisiones anticipadas, incluyendo la donación de órganos reglamentada en la ley 1805 de 2016, equilibrando así los deseos tanto del paciente como de su familia y favorecer la elaboración adecuada del duelo en el momento de considerar la WLST 42.
CONCLUSIÓN
La lesión cerebral post paro cardíaco es un reto para neurólogos e intensivistas por sus matices médicos, éticos y legales. El encéfalo se ve afectado desde un primer momento del paro cardíaco y continúa una vez se logra la circulación espontánea por afectación neuronal que en muchos casos es irreversible. Se debe establecer un pronóstico con base en una aproximación multimodal que empieza con la observación y el examen clínico, seguido por predictores como el EEG, los PESS, biomarcadores e imágenes diagnósticas como la TC e IRM cerebral. Los patrones EEG no continuos como el de estallido supresión, los de descargas epilépticas generalizadas o periódicas asociadas a estatus mioclónicos durante las primeras 48 horas están asociados a malos desenlaces.
La aplicación de WSLT de manera prematura puede llevar a decisiones erróneas si no se ha cumplido con los algoritmos recomendados y en muchas ocasiones malogra las opciones de donación de órganos en pacientes que evolucionan a muerte por criterios neurológicos.
Las causas neurológicas del paro cardíaco son la principal variable para estimar la probabilidad de muerte encefálica en pacientes con lesión cerebral post paro cardíaco.
La toma de decisiones médicas debe ser hecha en conjunto por los equipos de UCI y neurología, en consenso con la familia, teniendo en cuenta aspectos emocionales, culturales, religiosos y la voluntad anticipada del paciente, debidamente documentada.