Introducción
El sistema nervioso central (SNC) ha sido considerado un sistema inmunológicamente privilegiado, carente de conexión directa con el sistema inmune, por la ausencia de vasos linfáticos que permitan la circulación de células especializadas y contribuyan a la eliminación de productos de desecho metabólico intersticial. Este paradigma ha venido cambiando, debido a estudios que evidencian un sistema que involucra rutas perivasculares y vasos linfáticos meníngeos, conocido como el sistema glinfático, que desafía el concepto del SNC como un santuario inmunológico y así mismo genera controversia en cuanto a la dinámica de formación y circulación del líquido cefalorraquídeo (LCR) conocida hasta el momento 1-3. Esta revisión expone los hallazgos de investigación que han permitido la identificación anatómica, funcional y finalmente las implicaciones clínicas desarrolladas alrededor de esta vía del SNC, lo cual ha facilitado la compresión fisiopatológica de múltiples trastornos neurológicos.
Conceptualización del sistema glinfático
La primera descripción anatómica del sistema linfático en el SNC data del siglo XVII, por parte de Mascagni, quien mediante modelos humanos en cera representó la ubicación de los vasos linfáticos del SNC en las meninges 3. Dos siglos después, estudios de microscopia electrónica confirmarían la existencia de estructuras denominadas estomas meníngeos, localizados entre las células mesoteliales de la duramadre, lo cual generó la hipótesis de un sistema que desempeña un papel importante en el drenaje linfático y el mantenimiento de las funciones fisiológicas cerebrales 4. En el 2015 Louveau, mediante estudios con disección de meninges de roedor y marcadores de células linfáticas, observó vasos que expresan proteínas específicas de células endotelia-les linfáticas y se alinean con los senos durales para egresar del cráneo, siguiendo una ruta de drenaje linfático hacia los ganglios cervicales profundos 5.
Con respecto a la ruta perivascular, la identificación de los espacios alrededor de los vasos de pequeño calibre tuvo lugar en 1842, por parte de Durand Fardel, mediante observación en muestras de cerebros post mortem, en los núcleos de la base, a los cuales denominó etat crible. Posteriormente, Virchow (1851) y Robin (1859) hicieron otra descripción de estos espacios como potenciales conexiones con los espacios perineuronales como un primer acercamiento a la discusión de la interrelación entre el LIC y el LCR adyacente 6.
La existencia de una conexión linfática entre el SNC y la periferia se expuso desde 1960 con los estudios de Csanda et al. Así mismo, el rol en el drenaje de los desechos del metabolismo celular se atribuye a la ruta perivascular, por la cual se establece el intercambio de fluidos entre el LCR y el LIC 3, lo que determina el sistema glinfático como una vía para el intercambio de fluidos entre estos compartimentos y su desecho final a través del sistema linfático meníngeo hacia la periferia 2. Esta hipótesis se apoya en estudios de Cserr y Rennels, quienes mediante trazadores demostraron el intercambio de solutos entre el LCR y el LIC a lo largo de la microvasculatura intraparenquimatosa a través de un influjo convectivo facilitado por las pulsaciones de las arterias cerebrales a la microvasculatura 7,8.
Iliff et al.9 demostraron la comunicación y la trayectoria de estos dos compartimentos, mediante microscopia in vivo de dos fotones, en el sistema cisternal de roedores, ya que al inyectar dextranos marcados se observó la fluorescencia del LCR a lo largo de vías perivasculares de las arterias penetrantes, su desplazamiento dentro del parénquima cerebral y la eliminación posterior a través de las vénulas de drenaje 10.
Finalmente, se conoce que existen tres capas meníngeas (duramade, aracnoides y piamadre), sin embargo, Mollgard et al. demostraron la existencia de una cuarta capa meníngea, denominada membrana subaracnoidea de tipo linfático, que organiza el espacio subaracnoideo en compartimientos y tiene también funciones tanto en el intercambio de líquidos como inmunológicas. Esta nueva capa, estudiada por medio de técnicas especiales como la microscopia de dos fotones en modelos murinos, participa en el intercambio directo de pequeños solutos entre el líquido cefalorraquídeo y la sangre venosa, ya que recubre el borde endotelial de los senos venosos; además, divide el espacio subaracnoideo entre un compartimiento externo y uno interno. Por último, esta capa tiene la presencia de células inmunológicas que ejercen un papel protector local 11.
Anatomía del sistema glinfático
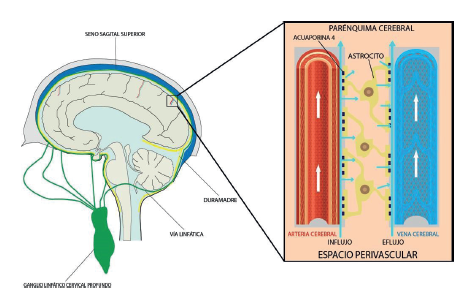
Se trata de un sistema macroscópico altamente estructurado de transporte de fluidos, eliminación de metabolitos y distribución de moléculas, con funciones metabólicas y neuroendocrinas en el SNC, que establece una conexión de intercambio continuo entre el LCR y el LIC 12-14. Toma su nombre por la similitud de su función con el sistema linfático periférico y el papel de los canales AQP4 gliales en el transporte de fluido convectivo 12. Está formado por tres regiones anatómicas principales: una ruta de entrada de LCR periarterial, una región parenquimatosa cerebral que depende del transporte de agua astroglial a través de la AQP4, y una vía de aclaramiento del líquido intersticial perivenosa 14,15 (figura 1).
Espacio periarterial o unidad perivascular
Las arteriolas que penetran en el parénquima están rodeadas de piamadre. Entre la membrana basal del músculo liso del vaso y la piamadre que lo envuelve, se forma un espacio conocido como el espacio de Virchow-Robin, ocupado por LCR. A medida que se profundizan en el parénquima, los capilares y las vénulas van ganando estructuras como pericitos entre las células endoteliales y reemplazan el recubrimiento pial por la membrana basal laxa, rodeada por los pies de los astrocitos que forman la pared externa del espacio perivascular 6,13,16. Este compartimiento se ha descrito como una "autopista perivascular" separada para el intercambio de líquidos, que crea una vía para el flujo de LCR a lo largo de las arterias penetrantes y el flujo de salida del LIC por medio del espacio perivenoso hasta su drenaje por venas profundas de gran calibre 17.
La barrera glial
Esta barrera se encuentra constituida por los podocitos, que entran en contacto con la superficie del músculo liso o los pericitos y que se extienden hasta cubrir el 99 % de los vasos sanguíneos cerebrales 16,18. Se caracteriza por su concentración de canales de agua acuaporina 4 (AQP4), cuya estructura supramolecular permite la unión de un conjunto completo de AQP4 mediante un solo enlace a la membrana plasmática, a través del anclaje al complejo proteico asociado de la distrofina (DAPC) (1921). Su importancia reside en la disminución de la resistencia al intercambio de LCR entre los espacios perivasculares e intersticiales del parénquima 2,14,22. Esta teoría se ha soportado en los estudios de Illif et al., que demostraron una reducción de 70 % en el flujo de LCR a través del parénquima en roedores modificados genéticamente con ausencia de AQP-4, en comparación con los roedores control 9,13.
Ruta de la vía glinfática
Inicia desde el espacio subaracnoideo, donde el LCR ingresa por convección hacia el parénquima cerebral a lo largo de los espacios perivasculares de Virchow Robin, caracterizados por una matriz fibrosa laxa que confiere baja resistencia al paso del LCR. Este último fluye a través de la membrana basal glial y los procesos astrogliales que expresan una alta concentración de canales de acuaporina 4 (AQP4), cuya organización molecular disminuye la resistencia y facilita el flujo del LCR desde el compartimento perivascular hacia el parénquima cerebral. Una vez en el intersticio se mezcla con el LIC, y el fluido se dispersa de acuerdo a la presión osmótica e hidrostática de los dos compartimentos, con un movimiento neto hacia el espacio perivenoso 1,2,9,16,23 (figura 1).
Sistemas de depuración postglinfática
Tradicionalmente, se ha considerado que el drenaje final desde el espacio perivenoso se realiza a través de vías como: las granulaciones aracnoideas de válvula unidireccional en el seno meníngeo 24; la vía linfática de la mucosa nasal que drena al nodo linfático cervical 25; por trasportadores y receptores presentes en el lado apical del epitelio del plexo coroideo 26; y por espacios perineurales de los nervios craneales, como el nervio vago 2.
Sin embargo, Louveau y Aspelund identificaron vasos meníngeos con semejanza estructural y molecular a los vasos linfáticos periféricos. Estas estructuras de la duramadre absorben el LCR subyacente y el LIC a través del sistema glinfático y lo transportan hacia los nodos linfáticos cervicales profundos, lo que supone un nuevo hito en la dinámica del flujo de LCR y en la función inmunológica en relación con el drenaje de macromoléculas y el transporte de células inmunes, dado que su drenaje se lleva a cabo de manera directa por una red linfática dural adyacente que se dirige hacia el sistema linfático periférico 5,27,28.
Regulación del sistema glinfático
Variables fisiológicas
La regulación fisiológica del intercambio entre los compartimientos del espacio subaracnoideo y el espacio intersticial está dada por múltiples variables, que contribuyen al transporte del LCR a través del sistema glinfático, entre las que se encuentra el ciclo cardiaco, la respiración y las pulsaciones de muy baja frecuencia, que promueven el movimiento del líquido dentro del parénquima cerebral 11,23,29.
La pulsatilidad arterial en la eficiencia del sistema glinfático fue descrita por Illif, quien mediante la ligadura unilateral de la arteria carótida interna de murinos, demostró una disminución tanto de la pulsatilidad arterial en un 50 % como el intercambio de LCR-LIC. De tal manera, puso en evidencia que la pulsatilidad arterial es determinante en el impulso del LCR paravascular a través del parénquima cerebral. Así mismo, la pulsatilidad cardíaca favorece el flujo del LCR a las regiones profundas del parénquima cerebral, donde se produce el intercambio con el líquido intersticial, el cual se favorece por canales de agua de tipo acuaporina glial 4 (AQP4), y su drenaje subsiguiente tiene lugar a través de espacios peri-venosos y nervios craneales, vasos linfáticos meníngeos y cervicales, a la circulación venosa sistémica 11.
Un estudio de neuroimagen funcional planteó tres mecanismos simultáneos de regulación del flujo glinfático: el mecanismo de pulsación cardiovascular, que inicia en los espacios periarteriales alrededor del polígono de Willis y se irradia de manera centrífuga hacia la corteza cerebral; las pulsaciones respiratorias periódicas centrípetas, que ocurren de manera predominante en los espacios perivenosos; y las fluctuaciones lentas en la onda vasomotora (pulsaciones de muy baja frecuencia) que se difunden con patrones espaciotemporales diferentes 29.
Rol del ciclo sueño-vigilia
El sistema glinfático se encuentra supeditado al ciclo sueño-vigilia, por tanto, es activo durante el sueño y la anestesia, en tanto que su actividad se suprime durante la vigilia 31. Esto se comprobó en un estudio que utilizó una evaluación en tiempo real de la difusión de tetrametilamonio y la formación de imágenes de dos fotones en modelos murinos, en la cual se demostró que el sueño y la anestesia (ketamina/xilazina) se relacionan con un aumento del 60 % en el volumen del espacio intersticial, un aumento en la velocidad del transporte del sistema glinfático, y una mayor eliminación de amiloide -ft. Durante la vigilia, en cambio, debido al aumento del tono noradrenérgico, el volumen del espacio intersticial se reduce, y aumenta la resistencia al movimiento del fluido convectivo, lo que se traduce en la disminución del intercambio LCR-LI 31-33.
Funciones del sistema glinfático Función de depuración
La capacidad de drenaje de metabolitos de desecho de la actividad neuronal ha sido demostrada con el lactato, cuya máxima concentración se presenta durante la vigilia, mientras que disminuye en el sueño no-REM, por lo que se ha sugerido como un marcador de la eficiencia del sistema glinfático al correlacionarse inversamente con el aclaramiento glinfático-linfático 34. Así mismo, se ha demostrado la depuración de macromoléculas en el intersticio, como el amiloide -ft y la proteína tau, determinadas por un patrón de ciclo sueño-vigilia, de manera que alcanzan una mayor concentración durante el estado alerta y presentan una más baja durante el sueño. Incluso, en modelos murinos se ha documentado cómo la privación de sueño repercute de manera significativa en la acumulación de amiloide -ft en el hipocampo, lo que conlleva destacar la importancia de la higiene del sueño para la adecuada función cerebral como factor protector de la enfermedad de Alzheimer 2,10,23,32,35.
Función en la distribución de nutrientes y el metabolismo cerebral local
Se ha documentado que la circulación perivascular permite el transporte de moléculas lipofílicas de bajo peso molecular, su movimiento rápido en el líquido intersticial y la señalización de calcio glial, lo que sugiere que el espacio perivascular sirve como un equivalente del sistema linfático periférico para el transporte de lípidos y moléculas de señalización 36.
Con respecto al metabolismo local se sugiere que esta vía de transporte permite el mantenimiento de la homeostasis metabólica, de modo que se preserva el equilibrio del ciclo glutamato/GABA/glutamina, al absorber la mayor parte de GABA en los podocitos para evitar la lesión por neurotoxicidad del glutamato 31.
Otras funciones asociadas
Se ha involucrado al flujo de la vía glinfática en la activación de los canales de N-metil-D-aspartato (NMDA), por efecto mecánico del fluido sobre estos receptores, lo que sugiere un rol en la mecano-transducción, de manera que permite la apertura de los canales y una mayor corriente de Ca++ que genera la activación glial 37. Esta hipótesis fue probada en estudios que midieron la respuesta fisiológica de los astrocitos en modelos de roedores con lesión cerebral traumática. Dichos estudios sugirieron que la sensibilidad mecánica de los NMDAR puede desempeñar un papel en la fisiología del movimiento de fluido a través del sistema glinfático y a su vez tener implicaciones en la fisiopatología del trauma craneo-encefálico (TCE) (38).
Impacto clínico Enfermedad de Alzheimer
Los hallazgos de diferentes investigaciones proponen que el sistema glinfático es la vía con mayor tasa de aclaramiento de amiloide-ft 9,14,32, como se ha demostrado en modelos murinos modificados genéticamente con ausencia de AQP-4, en los cuales la depuración del amiloide-ft se reduce hasta en el 55 % y favorece su acumulación intersticial 9,39. Un estudio de Burfeind encontró variantes genéticas asociadas a AQP-4 que podrían retardar (rs9951307 y rs3875089) o acelerar (rs3763040 y rs3763043) la velocidad del deterioro cognitivo 40.
Una variable determinante en el retraso de la depuración glinfática asociada a la neurodegeneración es la alteración en la polaridad de la AQP4, lo cual se evidenció en un estudio post mortem de 79 pacientes con enfermedad de Alzheimer, en quienes la inmunorreactividad de la AQP 4 aumentó de manera global; sin embargo, la polaridad de estos canales hacia los podocitos se vio alterada, lo que demostró su pérdida en la pared externa de la unidad perivascular, y facilitó, en consecuencia, la agregación de amiloide-ft 41.
Puesto que existe una relación entre el sueño y la eficacia del sistema glinfático para la depuración del amiloide-t, se documentó que su aclaramiento se duplica en roedores durante el sueño, en comparación con la vigilia 32,42, y se presenta una disminución en la velocidad de aclaramiento cuando se les somete a privación del sueño. Lo anterior se demostró en un estudio con PET de 20 pacientes sanos, en quienes la interrupción del sueño de onda lenta condujo al aumento de la concentración de los niveles en LCR de amiloide-ft 35, lo que apoya la hipótesis de que la mala calidad del sueño es un factor de riesgo para el deterioro cognitivo y demencia secundario a la disfunción la vía glinfática. Sin embargo, existen estudios contradictorios en los cuales se argumenta que el amiloide-t se produce con mayor frecuencia durante la vigilia o el sueño REM, lo que lleva a la hipótesis de que es el aumento de la producción de amiloide-t, relacionado con los cambios en el ciclo de sueño de los adultos mayores, los que desemboca en la enfermedad de Alzheimer 43.
En cuanto al drenaje por parte de los vasos linfáticos meníngeos, se conoce que disminuye su velocidad de intercambio con la edad, lo cual se ha evidenciado en murinos que presentaron una disminución en el diámetro de los vasos linfáticos meníngeos en edades avanzadas y exhibieron una reducción de la depuración de LCR. Esto contribuye a la acumulación de amiloide-ft en las meninges y en el hipocampo 44.
Migraña
Aproximadamente un tercio de los pacientes con migraña presentan aura, fenómeno que ha sido relacionado fisiopatológicamente con la onda de depresión cortical (ODC) 45,46, cuya propagación se acompaña de un aumento transitorio en la concentración extracelular de potasio, glutamato, ATP 47, proteína relacionada con el gen de la calcitonina, y óxido nítrico 46. Estas sustancias se difunden por el líquido intersticial cortical y después ingresan a los espacios perivasculares y producen una activación de los nociceptores vasculares y meníngeos 48, lo que da lugar a la activación del sistema trigémino vascular, con la consecuente generación del dolor craneofacial.
Un estudio de Schain et al. establece la relación entre la migraña y el sistema glinfático, mediante la visualización del espacio perivascular por microscopia de dos fotones, en la cual se demostró que la ODC produce una alteración en la estructura y en la función del sistema glinfático, al ocasionar un cierre transitorio de los espacios perivasculares tanto arteriales como venosos, con la consecuente reducción en la salida del LIC desde el parénquima hacia el espacio perivenoso. De tal manera, se evita su reabsorción definitiva por los vasos linfáticos y tiene lugar una acumulación de las sustancias químicas y de las citocinas inflamatorias que producirían un estímulo constante sobre los nociceptores, lo que conduce a una hiperexcitabilidad cortical prolongada 49.
Trauma craneoencefálico
Una causa documentada del deterioro del intercambio glinfático durante la lesión cerebral postraumática se ha asociado con la pérdida de la polarización de los canales de AQP4 en la pared glial externa perivascular, que es suficiente para limitar el flujo de LCR hacia el compartimiento intersticial 50. Así mismo, se ha observado que la generación de la ODC posterior a una lesión traumática produce alteraciones estructurales en los espacios perivasculares y suprime la función de la vía glinfática 51.
La lesión cerebral traumática promueve la acumulación de amiloide-t y tau. Esta última, se libera debido a la disrupción de los microtúbulos durante la lesión axonal y se correlaciona con la gravedad de la lesión cerebral, con posterior acumulación intracelular, lo que da paso a la formación de ovillos neurofibrilares que se diseminan con un patrón similar a los priones 13,52. Por este mecanismo, posiblemente contribuya al riesgo de deterioro cognitivo en los pacientes con TCE.
Se conoce también la relación bidireccional entre la cefalea postraumática y los trastornos del sueño posteriores a la lesión cerebral 53. El mecanismo fisiopatológico por el cual se vinculan no está completamente dilucidado, sin embargo, se ha descrito que la disfunción del sistema glinfático posterior al TCE es subyacente a ambos procesos y limita la depuración de neuropéptidos perivasculares asociados con la cefalea, o, indirectamente, la interrupción del sueño postraumática reduce el aclaramiento estos neuropéptidos, de manera que promueve la cronificación de la cefalea 50.
Conclusiones
La identificación anatómica y funcional del sistema glinfático no solo ha cambiado la perspectiva sobre el concepto previo de la dinámica de producción y circulación del líquido cefalorraquídeo, sino que ha ampliado el conocimiento sobre la regulación del metabolismo cerebral en cuanto a distribución de nutrientes y cascadas de señalización celular. Al establecer una interacción entre el espacio subaracnoideo subyacente y el espacio intersticial cerebral, el sistema glinfático ha surgido como uno de los mecanismos protagonistas de la homeostasis cerebral.
La disfunción de esta vía, caracterizada por la alteración en la depuración intersticial de productos de desecho y la desregulación metabólica local, hace parte de los mecanismos fisiopatológicos de múltiples trastornos neurológicos, ya sea por la acumulación de macromoléculas, como ocurre en la enfermedad de Alzheimer, o por la reducción del drenaje de sustancias químicas y citocinas proinflamatorias en patologías como la migraña o el trauma craneoencefálico. Investigaciones futuras permitirán plantear al sistema glinfático como una alternativa diagnóstica y de tratamiento de diversas patologías neurológicas que hasta el momento se han considerado crónicas, degenerativas o irreversibles.