Introducción
Los síntomas neuropsicológicos son una preocupación importante para los pacientes con epilepsia 1. Una encuesta de más de mil personas con esta enfermedad reveló que los problemas cognitivos relacionados con la memoria, la concentración y la capacidad de pensar con claridad se consideraban las complicaciones más importantes asociadas con la epilepsia 2. En este sentido, otros estudios también han encontrado que los síntomas cognitivos y afectivos pueden llegar a ser mucho más ¡nfluyentes en la calidad de vida de estos pacientes, incluso por encima de las crisis epilépticas 3-5. En el caso de la epilepsia del lóbulo temporal, las alteraciones cognitivas y neuropsicológicas son muy frecuentes y afectan diferentes habilidades como el lenguaje, la atención, las praxias y la función ejecutiva; sin embargo, el síntoma cognitivo más importante de esta epilepsia es la alteración en la memoria 6.
Existen muchos factores clínicos que influyen en el desenlace cognitivo de estos pacientes, los más importantes son la etiología de la epilepsia, la edad de inicio, la duración de la enfermedad y la frecuencia de las crisis 7,8. Todos estos factores pueden cambiar la estructura y el metabolismo cerebral normal y generar síntomas crónicos, en muchos casos progresivos 7,9. Otro factor clínico que influye en el desempeño cognitivo de estas personas es la lateralidad de la epilepsia. Está claramente demostrado que los síntomas mnésicos de la epilepsia del lóbulo temporal varían en función del hemisferio cerebral afectado. Diferentes estudios han demostrado que los volúmenes del hipocampo izquierdo están directamente relacionados con la memoria verbal, mientras que los volúmenes del hipocampo derecho están relacionados con la memoria visual 10.
Es importante mencionar que a partir de la organización espaciotemporal del tejido cerebral epiléptico, hoy se plantea que la epilepsia del lóbulo temporal es una enfermedad de redes anatómicas y no de lesiones estructurales 11-13. Este concepto de red establece que las crisis epilépticas, así como las comorbilidades de la epilepsia, no pueden explicarse únicamente por una lesión estructural cerebral; por lo anterior, se plantea la hipótesis de que la epilepsia afecta a todo el cerebro en diversos grados 11. Este concepto de enfermedad de redes tiene mucha influencia en la neurobiología de los síntomas neuropsicológicos y cognitivos, y esta es en parte la razón por la cual muchos pacientes con epilepsia del lóbulo temporal tienen otros síntomas cognitivos, diferentes a la memoria, que están relacionados con una disfunción ejecutiva, una disminución en la velocidad de procesamiento o una alteración en el lenguaje 6,7,11 (figura 1). Todos estos síntomas han sido descritos a partir de diferentes métodos que evalúan el perfil cognitivo de los pacientes con epilepsia del lóbulo temporal (tabla 1). En este artículo realizamos una revisión narrativa de la literatura, con el objetivo de describir el riesgo neuropsicológico relacionado no solamente con la epilepsia per se, sino también con las intervenciones quirúrgicas que se llevan a cabo en pacientes refractarios a la medicación.
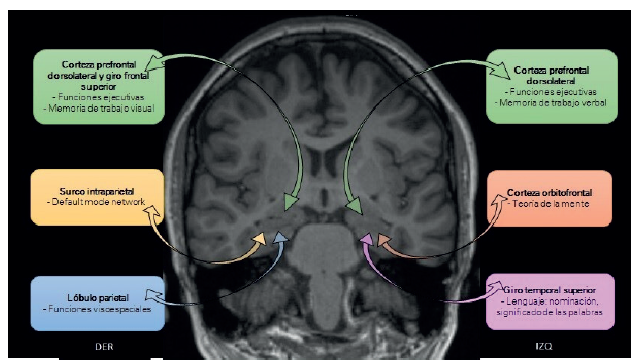
Nota: esquema de las conexiones corticales hipocampales y de los diferentes tipos de compromiso neuropsicológico que se pueden generar. Las flechas indican las proyecciones recíprocas entre el hipocampo y las áreas corticales. Los roles cognitivos de estas conexiones se encuentran indicados debajo de cada área cortical. Una alteración en las proyecciones hacia la corteza prefrontal dorsolateral (PFDL) (verde), explica un compromiso de funciones ejecutivas y de la memoria de trabajo visual (derecha (DER)) y verbal (izquierda (IZQ)). Adicionalmente, en estudios de neuroimagen se ha visto mayor activación del lóbulo frontal superior propuesto como mecanismo compensatorio por pérdida funcional de la corteza PFDL derecha. Las conexiones a la corteza orbitofrontal (rojo) se han visto relacionadas con la teoría de la mente, y su interrupción se plantea en el compromiso afectivo y comportamental en estos pacientes. Con respecto a las conexiones al lóbulo parietal derecho (azul), una alteración en la dinámica de la red genera compromiso de funciones visoespaciales y orientación, y, en particular, en el surco intraparietal (naranja), que hace parte de la default mode network, se plantea el compromiso en la atención. Asimismo, alteraciones entre las conexiones al giro temporal superior (morado) explican el compromiso del lenguaje (nominación e identificación del significado de las palabras) que se ha visto en pacientes con epilepsia del lóbulo temporal.
Fuente: elaboración propia.
Figura 1 Conexiones funcionales recíprocas hipocampales y compromiso neurocognitivo asociado
Tabla 1 Métodos diagnósticos para evaluar el rendimiento cognitivo en pacientes con epilepsia
| Test | Ventaja | Desventaja |
|---|---|---|
| Evaluación neuropsicológica | Es una forma sencilla y no invasiva de evaluar el perfil cognitivo de los pacientes con epilepsia | Las pruebas neuropsicológicas evalúan a la persona y no al cerebro, con lo cual existen circunstancias culturales, educativas, afectivas y de motivación por parte del paciente que pueden afectar el resultado final |
| Resonancia cerebral funcional | Es un método no invasivo que evalúa de forma objetiva el rendimiento cognitivo (memoria y lenguaje) | Es costosa y requiere un protocolo específico y unos paradigmas de memoria adaptados a la población en estudio |
| Test de Wada | Evalúa de forma directa y en tiempo real el rendimiento cognitivo (memoria y lenguaje) | Es un método invasivo y riesgoso que depende, entre otras, de las consideraciones anatómicas propias de cada paciente (sistema vascular cerebral anterior). Adicionalmente, el efecto farmacológico solamente dura unos minutos, por lo cual, la evaluación cognitiva está limitada |
Fuente: elaboración propia.
Riesgo neuropsicológico según la lateralidad del procedimiento quirúrgico
Para los pacientes con epilepsia refractaria, la resección del foco epileptogénico es una opción terapéutica ampliamente aceptada, que ha demostrado una alta probabilidad de libertad de crisis 14. Pese a que el principal indicador para el éxito quirúrgico es la ausencia de crisis, se hace necesario tener en cuenta los cambios neuropsicológicos posquirúrgicos que se presentan, ya que estos tienen un gran impacto en la calidad de vida e independencia en las actividades de la vida diaria de los pacientes 15. Los cambios neuropsicológicos que ocurren en pacientes con epilepsia refractaria después de una intervención quirúrgica del lóbulo temporal han sido ampliamente estudiados. Se ha demostrado que la memoria y el lenguaje son las áreas neuropsicológicas que se ven más comprometidas tras la cirugía 16,17.
La localización hemisférica del foco epileptogénico se encuentra correlacionada con el tipo de información que se ve afectada 11,18. La evidencia demuestra que el lóbulo temporal izquierdo maneja procesos de la memoria verbal (codificación y recuperación de la información) y del lenguaje (denominación y clasificación semántica) 19-21. Por su parte, el lóbulo temporal derecho maneja procesos de la memoria visoespacial (e. g., memoria para caras y espacios) 19,22,23. Los resultados más frecuentes muestran deterioro de la memoria verbal, posteriormente a una resección del lóbulo temporal izquierdo, y, a su vez, deterioro en la memoria visual tras una resección del lóbulo temporal derecho 24,25. Un metaanálisis encontró que 44 % de los pacientes sometidos a resección temporal izquierda presentaron deterioro en su memoria verbal, en tanto que los pacientes con resección del lado derecho presentaron deterioro en su memoria visual en un 20 %. Así mismo, encontró que los pacientes con cirugía del lóbulo temporal izquierdo presentaron deterioro en denominación y clasificación semántica en un 34 %, y que en los pacientes con resección del lóbulo temporal derecho no se evidenció déficit del lenguaje 16. De esta manera, la tasa de deterioro de la memoria y el lenguaje es más alta en pacientes que se someten a resecciones del lóbulo temporal izquierdo; por el contrario, los pacientes con resección del lóbulo temporal derecho muestran mejoría o estabilidad en su memoria verbal posoperatoria 16,26,27. Los pacientes sometidos a resecciones del lóbulo temporal derecho presentan deterioro únicamente en su memoria visual, sin que se vean comprometidas otras áreas cognitivas 14,28. Hallazgos empíricos señalan que el principal predictor del nivel de funcionamiento cognitivo posquirúrgico se basa en la integridad de las redes neuronales del paciente. Es así como pacientes que presentan un adecuado rendimiento cognitivo pre-quirúrgico muestran una mayor disminución en los resultados neuropsicológicos posquirúrgicos 29. Por el contrario, pacientes con menor rendimiento cognitivo prequirúrgico permanecen estables después de la cirugía, y en algunos casos se puede observar una mejoría sutil 30).
La evidencia muestra que existe mejora en otras áreas neuropsicológicas, como atención y funciones ejecutivas, sin importar el lado de la intervención 19,28. No se ha encontrado una alteración pos-quirúrgica significativamente alta en el coeficiente intelectual (CI) de los pacientes sometidos a cirugía del lóbulo temporal, por el contrario, existe mejora o estabilidad en la inteligencia de los pacientes 19,31,32. Estudios longitudinales mostraron que a largo plazo (más de 5-15 años) el perfil neuropsicológico de los pacientes se mantiene estable o tiene una leve tendencia a la mejoría en todas las áreas neuropsicológicas 24,30, con excepción de los pacientes con resección del lóbulo temporal izquierdo, que presentan deterioro a muy largo plazo de su memoria verbal 30.
Se debe considerar que el riesgo neuropsicológico posquirúrgico no solo se debe a los factores anteriormente descritos, sino a diferentes variables, como el tiempo de evolución de la enfermedad, la edad a la que se realiza el procedimiento quirúrgico, la reserva cognitiva, el control de las crisis posquirúrgicas, la reducción posquirúrgica de dosis de fármacos antiepilépticos y el tipo de intervención quirúrgica realizada 24,33.
Riesgo neuropsicológico según el tipo de procedimiento quirúrgico
Con respecto al tipo de procedimiento quirúrgico, se plantean los enfoques de abordaje, teniendo en cuenta el objetivo de disminuir la frecuencia de las crisis epilépticas, pero además se busca disminuir las secuelas neuropsicológicas asociadas al procedimiento. La lobectomía temporal anterior (LTA) solía ser la resección estándar más ampliamente realizada para el tratamiento de epilepsia del lóbulo temporal con compromiso neuropsicológico secundario, descrito principalmente en la memoria 34; en este sentido, el deterioro de la memoria verbal es el más constante después de la lobectomía temporal anterior (LTA) izquierda 35-37. Entre el 22 % y el 63 % de las personas experimentan un deterioro significativo en la memoria verbal, mientras que alrededor del 7 % muestra una mejoría 26.
Posteriormente, gracias a la mejoría en la calidad de las imágenes estructurales y funcionales de alta resolución, se desarrollaron resecciones limitadas o ajustadas, como la amigdalohipocampectomía selectiva (AHS), que tiene como objetivo resecar la zona epileptogénica sugerida, cuya cirugía se limita a estructuras temporales mesiales 35,38,39. Este tipo de procedimiento se diseñó para preservar las estructuras del lóbulo temporal lateral, buscando ofrecer un control de las crisis equivalente a la LTA, y con un posible beneficio adicional, al plantear que si se preserva la denominada "corteza temporal sana", mejorarían los desenlaces neuropsicológicos 35-37. Se debe tener en cuenta que, con independencia de la técnica quirúrgica utilizada, la lateralidad del procedimiento va a definir la presencia de secuelas neuropsicológicas diferentes 40,41.
En cuanto a los beneficios neuropsicológicos de la AHS, la evidencia sigue siendo controversial. Desde 1982 se describieron los déficits de memoria verbal posteriormente a la LTA izquierda y deterioro en el aprendizaje visual después de la LTA derecha, no evidenciados después de la AHS 42,43. Sin embargo, también se han descrito estudios donde ambos procedimientos han generado compromiso significativo de la memoria verbal 14,36,44, y no se ha visto diferencia significativa entre los procedimientos en el seguimiento 45,46.
En la cirugía del lado derecho, se ha evidenciado que la AHS ha mostrado resultados neuropsicológicos favorables en comparación con la LTA, incluido el coeficiente intelectual verbal, el coeficiente intelectual a gran escala, la memoria verbal y la memoria total 35,47.
En una revisión sistemática publicada en el 2011 sobre desenlaces neuropsicológicos después de cirugía de epilepsia, en la que se incluyen varios tipos de procedimiento quirúrgico, se menciona que el compromiso de la memoria verbal pareció ser consistente en todos los estudios, con independencia del tipo de procedimiento, y que los estudios de resultados de nominación sugirieron una tasa de disminución más alta en los estudios con las resecciones más grandes 16.
Un estudio comparó la función de la memoria prequirúrgica y posquirúrgica en pacientes que se sometieron a LTA y AHS. Los pacientes con LTA tuvieron deterioro en el desempeño de la memoria inmediata después de la cirugía, sin importar el hemisferio resecado y a pesar de un desempeño inicial similar. Por el contrario, el reconocimiento tardío de una lista de palabras no relacionadas se deterioró más después de la AHS en comparación con la LTA, y este resultó ser más evidente en el caso de los pacientes con resección del hemisferio derecho 48.
Finalmente, en una revisión sistemática más reciente, se describe que la función del lenguaje se deterioró después de la AHS realizada en el lado izquierdo y mejoró después de la AHS realizada en el lado derecho. En esta revisión se plantea la necesidad de conocer el rendimiento neuropsicológico preoperatorio, ya que este también puede ser un predictor de las secuelas y el manejo futuro 36.
Con respecto a las lesionectomías, la evidencia es más escasa; se describe un análisis retrospectivo de un estudio donde se comparó AHS y LTA con un grupo control de lesionectomía neocortical sin afectar las estructuras mesiales y epilepsia lesional izquierda, donde los pacientes de todos los grupos mostraron deterioro de la memoria verbal antes de la cirugía, sin embargo, se observaron pérdidas mínimas después de la lesionectomía en comparación con los otros dos procedimientos 44,49. También, en un estudio longitudinal, al comparar LTA y "resecciones adaptadas", en el que se incluyeron AHS y lesionectomías, se identificó un efecto de interacción significativo según el tipo de cirugía, particularmente en el aprendizaje y el recuerdo libre diferido, donde la LTA izquierda se asoció con pérdidas mayores que las resecciones adaptadas 50.
Conclusión
La epilepsia del lóbulo temporal, y en general todas las epilepsias focales, deben ser consideradas una enfermedad de redes anatómicas y no de lesiones estructurales. A partir de este concepto, es más fácil comprender que las crisis epilépticas son solamente un síntoma dentro de una constelación de manifestaciones clínicas, entre las que se incluyen la afectación cognitiva y neuropsicológica. En el caso de la epilepsia del lóbulo temporal, existen muchas variables que influyen en el desempeño cognitivo, sin embargo, la lateralidad de la epilepsia representa una de las más importantes, y está claramente demostrado que los síntomas neuropsicológicos varían en función del hemisferio cerebral afectado. Es importante conocer estos conceptos antes de tomar decisiones quirúrgicas en pacientes refractarios y entender que el tipo de cirugía también influye en el desempeño cognitivo de estas personas. Se debe buscar un equilibrio entre la libertad de crisis y las posibles secuelas neuropsicológicas posquirúrgicas. Los dos extremos (libertad de crisis a expensas de secuelas neuropsicológicas o seguridad neuropsicológica sin libertad de crisis) pueden ser perjudiciales.















