Introducción
La epilepsia es una alteración del sistema nervioso central que se caracteriza por una actividad eléctrica anormal de las neuronas, la cual se manifiesta como crisis recurrentes, espontáneas e impredecibles. Aunque la causa de estas crisis no es clara, se ha encontrado que puede tener relación con un desequilibrio que incluye una disminución de neuro-transmisores de tipo inhibitorio como el ácido gamma-aminobutírico y un incremento de excitadores como el glutamato 1.
La epilepsia del lóbulo temporal (ELT) abarca cerca del 40 % de todos los casos de epilepsia, lo cual la convierte en la más frecuente de las epilepsias en los seres humanos. Esta, en un porcentaje significativo, puede hacerse refractaria (ER) 1,2. Por esto, se deben buscar otras alternativas de tratamiento como el manejo quirúrgico y en caso de no ser candidatos, la estimulación eléctrica (o neuroestimulación). Este tratamiento puede hacerse en el sistema nervioso central (SNC) o en el sistema nervioso periférico (SNP) 2-4. Así, el propósito de este artículo es revisar la literatura para describir cuatro tipos de neuroestimulación: del nervio vago, hipocampal, núcleos anteriores del tálamo (ANT, por sus siglas en inglés) y núcleos centromedianos del tálamo (CMNT, por sus siglas en inglés). Para la localización de los documentos bibliográficos se emplearon los gestores de búsqueda Google Scholar, PubMed y PubMed Central, así como los siguientes términos en español e inglés: epilepsia del lóbulo temporal, neuroestimulación, estimulación eléctrica, estimulación del nervio vago, estimulación del hipocampo, estimulación del núcleo anterior talámico y estimulación del núcleo centromediano talámico.
Epilepsia del lóbulo temporal
Las epilepsias se clasifican, de acuerdo con el inicio de las crisis epilépticas, en focales, generalizadas y no determinadas 5. Dentro de las focales, las ELT son las más frecuentes (entre 40 y 80 %) 2,6,7, y se han subdividido en cinco subtipos, según la localización anatómica: mesial, temporopolar, mesiolateral, lateral y temporal 'plus' (figura 1) 8.
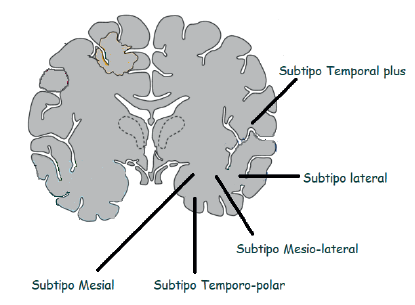
Fuente: hecha con base en Kahane y Bartolomei 8.
Figura 1 Subtipos de epilepsia temporal según localización anatómica
Las ELT se caracterizan por presentar crisis focales, que entre el 16 y el 30 % se vuelven refractarias al tratamiento farmacológico 1,2,9, es decir, que estos pacientes a pesar de ser tratados con dos o más medicamentos antiepilépticos, con indicación y dosis adecuada en monoterapia o politerapia, no quedan libres de crisis 1,10. Estas ER conllevan disminución de la calidad de vida y aumento de la morbimortalidad de los pacientes que las padecen, debido a un deterioro del paciente, tanto biológico como psicológico y cognitivo 4.
Manejo terapéutico de pacientes con ELT
Debido a que un gran porcentaje de pacientes con ELT son refractarios, se debe recurrir a otros tratamientos, dentro de los cuales están los procedimientos quirúrgicos, que pueden ser resectivos temporales como la lobectomía temporal anterior o la amigdalohipocampetomia selectiva; resectivos extratemporales como la hemisferectomía o la transección subpial; y quirúrgicos paliativos como las desconexiones y la estimulación eléctrica cerebral (núcleo centromediano del tálamo, núcleo anterior del tálamo, corteza motora, hipocampo, etc.), que permiten controlar las crisis epilépticas y disminuir el número de medicamentos 11.
Con la cirugía de la epilepsia se busca, mediante la resección de la zona epileptógena, eliminar o disminuir las crisis epilépticas 12. Sin embargo, cerca de un tercio de estos pacientes no son candidatos a esta alternativa por tener dos o más focos epilépticos o estar localizados en áreas corticales importantes para la funcionalidad del paciente (lenguaje, aprendizaje, memoria, movimiento, entre otros), conocidas como áreas elocuentes 1,12-15. Por lo tanto, deben recurrir a otras alternativas terapéuticas eficaces como la estimulación eléctrica de áreas cerebrales específicas 1,16, las cuales buscan estimular durante la fase interictal e ictal para interrumpir la manifestación clínica de las crisis y reducir la gravedad de estas 17,18.
Estimulación eléctrica, neuroestimulación o neuromodelación
La neuroestimulación consiste en la administración directa de pulsos eléctricos al tejido nervioso para modular un sustrato patológico 19. Este tratamiento, a diferencia del tratamiento farmacológico sistémico, se aplica a un área específica y a sus circuitos de red asociados, lo cual puede ser una ventaja en el momento de diseñar los objetivos de estimulación, al permitir que se reduzcan los efectos adversos, pero a su vez puede ser una limitante para aquellos pacientes con regiones epileptogénicas extendidas o con una rápida propagación de la actividad epiléptica 17.
Los parámetros de la estimulación, que incluyen la amplitud, la frecuencia y el ancho del pulso, se han seleccionado con base en las preferencias de cada centro y en la experiencia del médico o investigador en otras enfermedades 20. Por ello, no hay evidencia concreta de cuáles son los mejores parámetros para estas alternativas; no hay una diferencia clara entre el ciclismo y la estimulación continua 21 o la estimulación unilateral y bilateral 22. Sin embargo, hasta la fecha, los estándares que se manejan son: frecuencia ≥ 100 Hz y voltaje a 1-10 V para la estimulación del ANT; frecuencia ≥ 130 Hz y voltaje a 1-5 V para estimulación del hipocampo y núcleo subtalámico (STN, por sus siglas en inglés); estimulación de alta frecuencia a voltaje 1-10 V para estimulación del CMNT; y estimulación baja (10 Hz) o alta (200 Hz) para el cerebelo 23.
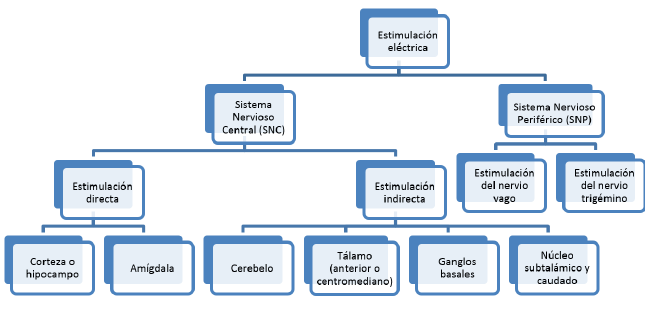
De acuerdo con el área del sistema nervioso donde se implemente, se clasifica en estimulación eléctrica del SNC y del SNP (figura 2) 4,24,25. En el SNC, la estimulación puede ser directa o indirecta. En la estimulación directa, se hace una evaluación invasiva prequirúrgica utilizando una rejilla subdural intracraneal o electrodos de profundidad para localizar el área epileptogénica responsable del inicio de las crisis. En la estimulación indirecta se apunta a estructuras subcorticales para bloquear las redes epilépticas. En el SNP, la estimulación puede hacerse sobre los nervios craneales vago o el nervio trigémino, que sirven como blancos para modular la excitabilidad cortical (figura 2) 4,24,25.En este artículo se revisarán tres estimulaciones del SNC (hipocampo, ANT y CMNT) y una del SNP (nervio vago).
Estimulación eléctrica del hipocampo
Las crisis que surgen de estructuras temporales mesiales (amígdala, hipocampo y circunvolución parahipocampal) ocurren en más del 90 % de los pacientes con ELT y se controlan con mayor frecuencia mediante la lobectomía temporal anterior 26. Sin embargo, algunos de estos pacientes no son candidatos a esta cirugía, por un riesgo de pérdida de memoria 27 o hasta amnesia severa 28.
Así, los pacientes con epilepsia del lóbulo temporal 29, con mayor riesgo de pérdida de memoria por la lobectomía, con resonancia magnética normal y pacientes sin esclerosis mesial temporal 30 son candidatos a la estimulación eléctrica del hipocampo, la cual se aplica directamente sobre la zona epileptógena sospechosa dentro del hipocampo. Se han estudiado aproximadamente 73 pacientes en 10 estudios y han reportado tasas de respuesta que oscilan entre el 60 % y el 100 % 31. Un estudio realizado en pacientes con ELT encontró que en el 55 % de ellos hubo una respuesta positiva a la estimulación del hipocampo luego de 18 meses de seguimiento, con una reducción promedio del 80 % 32. En otro estudio, realizado en el 2014, nueve pacientes con ELT seguidos durante treinta meses mostraron una reducción media de la frecuencia del 66 al 100 %, dependiendo del tipo de ELT 22. Este mismo grupo, en el 2017, estudió a 16 pacientes, de los cuales 8 fueron asignados al azar al grupo de estimulación activa, y de estos 4 quedaron libres de crisis y 7 se definieron como respondedores, mientras que uno no respondió a la terapia 33.
Una investigación que incluyó a 11 pacientes, en la cual se cambió la estimulación unilateral a bilateral a los 3 años de seguimiento, cuando no mostraban una reducción mayor al 90 %, se observó una reducción de la frecuencia de crisis mayor o igual al 90 % en 6 pacientes, sin afectación neuropsicológica 34. Adicionalmente, a pesar de que el hipocampo está implicado en los procesos de la memoria, la mayoría de los estudios de series de casos y de otros diseños no mostraron efectos adversos significativos en las funciones neuropsicológicas o cognitivas 35-38.
Estimulación eléctrica de los núcleos anteriores del tálamo
Los núcleos anteriores del tálamo (ANT, por sus siglas en inglés) hacen parte de un grupo de núcleos de relevo de primer orden, que reciben aferentes de centros cerebrales inferiores (cuerpos mamilares y fórnix) y transmiten mensajes al neocórtex (principalmente al cíngulo). Esta característica los hace componentes integrales del sistema límbico y un objetivo atractivo para la neuromodulación eléctrica, debido a que se convierten en una vía adecuada para la propagación de la actividad epileptogénica 4,39,40.
Esta estimulación se hace durante la fase ictal para cortar la propagación de la crisis o disminuir su severidad 41. En general, se han realizado cerca de 20 estudios en humanos que han incluido a cerca de 220 pacientes y han mostrado una reducción variada en la frecuencia de las crisis 15,21,39,42, con tasas de respuesta que varían entre 44 % y 100 % 31,43-46. Estas diferencias en las tasas pueden depender del tipo de epilepsia, ya que algunos estudios han mostrado que todos los tipos de crisis me joraron 40,47, mientras que otros han encontrado mejor respuesta en las crisis tonicoclónicas, tónicas, crisis focales, con generalización o asociadas a caídas 21,47,48. Sin embargo, una revisión sistemática y metaanálisis realizada en el 2022, recomienda la estimulación en este núcleo principalmente en pacientes con crisis focales 29. Además, se debe usar con precaución en pacientes con alto riesgo de cambios cognitivos como los ancianos, o en los que presentan alteración del estado de ánimo basal 49.
Un estudio piloto abierto de estimulación eléctrica intermitente del ANT en cinco pacientes con seguimiento entre 6 y 36 meses, realizado en el 2004, mostró, en cuatro de ellos, un benefício clínico y estadísticamente significativo con respecto a la frecuencia y la gravedad de las crisis, y en uno de los cinco sujetos mostró una disminución estadísticamente significativa en la frecuencia total de las crisis 48. En el 2008 otro estudio siguió durante 2 años a 4 pacientes con estimulación de NTA, y encontró una tasa de reducción media del 49,6 % y una tasa de complicaciones del 50 % que incluyó hematoma frontal, debilidad transitoria del lado izquierdo y erosión del cable de extensión 50.
En el 2010 se realizó el estudio "Estimulación del núcleo anterior del tálamo para epilepsia" (SANTE, por sus siglas en inglés), que incluyó a 110 pacientes con crisis focales o secundariamente generalizadas y refractarias, de los cuales 75 recibieron estimulación y la otra mitad no la recibió. La reducción media de crisis fue del 49 % en el primer año; después de 25 meses de seguimiento, hubo una reducción porcentual media del 56 % en la frecuencia de las crisis, el 54 % de los pacientes tuvo una reducción de las crisis de al menos el 50 % y 14 pacientes estuvieron libres de crisis durante al menos 6 meses, y a los 5 años de seguimiento la disminución fue del 69 %. Este mismo estudio encontró que los efectos adversos más frecuentes fueron la depresión y la memoria 51.
Otra investigación, en el 2012, siguió a 15 pacientes durante 27 meses y observó una reducción media del 70,4 % de las frecuencias de las crisis y solo un evento adverso (infección de la herida) 15. En este mismo año, un estudio que buscó, además, evaluar aspectos cognitivos y conductuales a los 12 meses del procedimiento en 9 pacientes, encontró una tasa media de reducción de las crisis epilépticas de 57,9 %, mejoras en la fluidez verbal y la evocación de la memoria audioverbal y ningún deterioro cognitivo significativo un año después 52.
Estimulación eléctrica de los y núcleos centromedianos del tálamo
El núcleo centromediano del tálamo representa la vía de salida del sistema reticulocortical, que participa de forma crucial en el proceso de regulación de la excitabilidad cortical 53. Este núcleo puede controlar el estado fisiológico del tálamo por medio de conexiones intratalámicas, o puede suprimir la actividad crítica mediante proyecciones excitatorias con el estriado 54.
La estimulación aguda en el núcleo centromediano ha mostrado un relevo de un sistema reticulocortical que participa en el despertar, los procesos atencionales, la regulación de la excitabilidad cortical y en la fisiopatología de las crisis epilépticas generalizadas 55,56. En 1987, Velasco et al. comenzaron a hacer ensayos con esta terapia en humanos, para lo cual implantaron electrodos bilaterales en el CMNT de 5 pacientes con epilepsia generalizada o multifocal, y después de 3 meses de tratamiento la frecuencia de las crisis generalizadas se redujo entre el 80 % y el 100 %, en tanto que las puntas interictales y las ondas lentas del EEG se redujeron también significativamente 57. En 1992, Fisher et al. realizaron un ensayo doble ciego en el cual encontraron una media de reducción de la frecuencia de crisis tonicoclónicas del 30 % con respecto a la línea de base cuando el estimulador estuvo encendido, frente a un descenso del 8 % cuando estaba apagado; sin embargo, no hubo mejoría en el número total de crisis generalizadas con estimulación y las diferencias en el tratamiento no fueron significativas 58. A raíz de estos hallazgos, Velasco et al. hicieron varios ensayos abiertos para reevaluar sus primeros resultados, donde encontraron una disminución en el número de las crisis focales motoras en el síndrome de Rasmussen y crisis tonicoclónicas en el síndrome de Lennox-Gastaut, lo que persistió más de 3 meses tras la discontinuación de la estimulación en el primer estudio 59. En el segundo ensayo encontraron que las crisis tonicoclónicas generalizadas se redujeron significativamente hasta casi desaparecer en todos los casos, con una reducción significativa de las descargas interictales paroxísticas y una tendencia hacia un incremento en la frecuencia de fondo del EEG, al tiempo que otras crisis generalizadas (ausencias atípicas) disminuyeron significativamente, pero sin cambios en el número de crisis focales con alteración de conciencia 53. En el tercero, realizado en el 2000, hallaron resultados similares a los anteriores 60, y en el cuarto, del 2007, que lo hicieron en pacientes con crisis multifocales y epilepsia focal continua, el número de crisis generalizadas de origen cortical y de las crisis focales motoras disminuyó 61. Otros estudios realizados entre el 2009 y el 2017 hallaron tasas de respuesta al tratamiento que oscilan entre el 50 % y el 100 %, según el estudio y el tipo de epilepsia por tratar 62-68.
Esta técnica se recomienda para el tratamiento de la epilepsia generalizada 29,60, especialmente en pacientes con síndrome de Lennox-Gastaut primario o secundario, con hasta un 80 % de pacientes que muestran una buena respuesta, pero no parece ser eficaz para el tratamiento de las crisis focales con alteración de la conciencia 60.
Estimulación eléctrica del nervio vago
Esta técnica coadyuvante, que consiste en una forma extracraneal de estimulación, desarrollada en la década de 1980 19 y aprobada en 1997 por la FDA, es una opción para pacientes a partir de los 4 años 69,70. Mediante un generador de impulsos que puede ser graduado externamente tanto en frecuencia como en intensidad, que se coloca subcutáneamente en la región infraclavicular, se hace una estimulación eléctrica intermitente del nervio vago izquierdo en el cuello. De los pacientes que han sido sometidos a VNS, el 8 % queda libre de crisis y entre el 50 % y el 60 % logra una reducción del 50 % o más en la frecuencia de las crisis y, por lo tanto, una mejor calidad de vida 70-72.
La VNS ha presentado efectos adversos, unos relacionados con la implantación quirúrgica y otros con la estimulación eléctrica como tal 73. Con respecto a la primera, un estudio retrospectivo donde se analizó a 247 pacientes con VNS, reportó una tasa del 8,6 % de complicaciones quirúrgicas, siendo la infección (2,6 %), el hematoma posoperatorio (1,9 %) y la parálisis de las cuerdas vocales (1,4 %) las más frecuentes 74. En relación con la estimulación eléctrica, la ronquera y la disnea fueron los efectos adversos más prevalentes en los pacientes 17,75.
En los últimos años, se han desarrollado sistemas VNS no invasivos (nVNS, por sus siglas en inglés), los cuales evitan la implantación quirúrgica y por consiguiente disminuyen los efectos adversos asociados a ella y a la estimulación, debido a que se realiza con menos frecuencia 17,76. Algunos de estos sistemas son los NEMOS (Cerbomed, Erlangen, Alemania), que consisten en una estimulación trans-cutánea (tVNS) mediante el uso de un electrodo intraauricular dedicado (como un auricular) que estimula la rama auricular del nervio vago, y otro son los gammaCore (electroCore LLC, Basking Ridge, Nueva Jersey, EE. UU.), que son estimuladores portátiles con batería electrónica generadora y amplificadora de señal y una interfaz de usuario de control digital que controla la amplitud de la señal 76.
La estimulación del nervio vago es una buena opción eficaz y segura para el tratamiento paliativo de epilepsias refractarias a tratamiento médico en casos bien seleccionados de crisis focales y crisis generalizadas multifocales 77; sin embargo, debe usarse con precaución en pacientes con sospecha de apnea del sueño 49.
Conclusiones
La epilepsia del lóbulo temporal es la más frecuente y muchos de estos pacientes son refractarios al tratamiento farmacológico. Una opción para ellos es el tratamiento quirúrgico, sin embargo, no todos son candidatos, por lo tanto, se puede recurrir a otras opciones como a la estimulación eléctrica. Este procedimiento consiste en la administración directa de pulsos eléctricos al tejido nervioso para modular un sustrato patológico y en los últimos años se han venido considerando otras estructuras del sistema nervioso central (hipocampo, ANT y CMNT) y una del SNP (nervio vago) como dianas, que permitan obtener mejor resultados en estos pacientes. Esta estimulación es un tratamiento seguro y eficaz en pacientes con ELT para controlar las crisis, al disminuir la morbimortalidad y aumentar la calidad de vida. Sin embargo, aún tiene desafíos por superar como la selección adecuada de candidatos, los óptimos parámetros de estimulación y los sitios objetivo. En consecuencia, se requieren más estudios que permitan definir las condiciones mínimas para que sea más exitosa.