Introducción
La epilepsia del lóbulo temporal es la más común de las epilepsias focales y representa uno de los principales motivos de consulta en centros de cirugía de epilepsia 1. Sin embargo, con la experiencia de los registros electroencefalográficos invasivos y el fracaso quirúrgico después de la cirugía, se ha hecho evidente que la epilepsia del lóbulo temporal es mucho más compleja de lo que se creía, y en la actualidad es considerada una enfermedad de redes neuronales y no de lesiones estructurales 2. La información neurofisiológica e imagenológica actual permite concluir que en esta epilepsia están involucradas varias redes neuronales temporales y extratemporales que contribuyen a la extensión de la zona epileptógena 2. Está claramente demostrado que las crisis epilépticas del lóbulo temporal pueden surgir no solo del hipocampo, sino también de estructuras extrahipocampales. En este sentido, la extensión de las resecciones del hipocampo y la corteza entorrinal se asocia de forma independiente con la libertad de crisis posquirúrgica, lo que sugiere que en algunos pacientes, las estructuras parahipocampales pueden ser incluso más influyentes en la generación de la epileptogénesis 3,4.
A partir de la organización espaciotemporal del tejido cerebral epiléptico y las consiguientes alteraciones en el resto de estructuras, se propone que la epilepsia del lóbulo temporal es un trastorno de redes neuronales 5. El concepto de red establece que las crisis epilépticas, así como las comorbilidades de la epilepsia, no pueden explicarse únicamente por una lesión estructural cerebral espacialmente restringida, por lo anterior, se plantea la hipótesis de que la epilepsia afecta a todo el cerebro en diversos grados. En el caso de la cirugía de epilepsia, donde el objetivo sigue siendo eliminar la menor cantidad de corteza para que el paciente quede libre de crisis, es necesario considerar el área que se va a resecar como un "nodo crítico" dentro la red epiléptica 3,5,6 (figura 1).
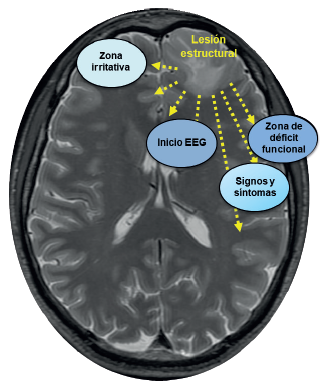
Nota: la zona epileptógena es la zona cortical que puede generar crisis epilépticas y cuya resección quirúrgica o su desconexión resultarán en libertad de crisis. No es una zona única, por el contrario, corresponde a la sumatoria de muchas subzonas relacionadas con la expresión clínica y neurofisiológica de la epilepsia. La zona epileptógena termina siendo, en últimas, una red neuronal disfuncional. En el caso de la cirugía de epilepsia, donde el objetivo es eliminar la zona epileptógena para que el paciente quede libre de crisis, es necesario considerar que lo que realmente se reseca es un "nodo crítico" dentro de la red anatomofuncional alterada.
Fuente: elaboración propia.
Figura 1 Redes neuronales involucradas en la epileptogénesis de las epilepsias focales
Una forma de entender el concepto de red epiléptica en la epilepsia del lóbulo temporal, es a partir del conocimiento de la corteza piriforme (CPR). Varias líneas de investigación han relacionado a las regiones olfativas con la fisiopatología de las epilepsias focales 7-9. Entre esas regiones, la CPR representa la mayor parte de la corteza olfatoria primaria 9. Varios estudios clínicos han mostrado que en pacientes con epilepsia del lóbulo temporal asociada con esclerosis hipocampal existe una disfunción interictal del procesamiento olfatorio que es más significativa en comparación con pacientes con epilepsia focal extrahipocampal y controles sanos 10. Esta alteración es, probablemente, la consecuencia de una red neuronal disfuncional que se extiende más allá del hipocampo y que afecta a otras estructuras cercanas, incluida la CPR. En este artículo hacemos una revisión narrativa de la literatura con el objetivo de establecer un vínculo entre la CPR y la epileptogénesis del lóbulo temporal, y demostramos que esta enfermedad es la consecuencia de una disfunción de redes neuronales que no depende exclusivamente de una anormalidad estructural en el hipocampo o en estructuras cercanas.
Consideraciones anatómicas y funcionales de la corteza piriforme
La CPR es una estructura que se extiende sobre la superficie ventrolateral del prosencéfalo basal y se localiza en la unión entre los lóbulos temporal y frontal, medial al asta temporal del ventrículo lateral 7. Tiene una orientación transversal, en forma de U, cuando se evalúa en cortes coronales, rodeando la arteria cerebral media 11. La CPR fue denominada así por su forma anatómica de pera (latín: pirum)11,12. Se puede dividir macroscópicamente en dos regiones: una anterior (región frontal) y otra posterior (región temporal), cada una de ellas tiene conexiones y funciones diferentes 13 (figura 2). A nivel histológico, la CPR, al igual que el hipocampo, es considerada una alocorteza, por ser una estructura de 3 capas 14. La primera es la capa plexiforme superficial (capa I), ubicada en la superficie del surco entorrinal, la cual recibe principalmente aferencias del tracto olfatorio lateral; la segunda es la capa de cuerpos neuronales liberadores de glutamato (capa II) y finaliza con la capa de fibras y somas de células piramidales profundas (capa III) 11,14.
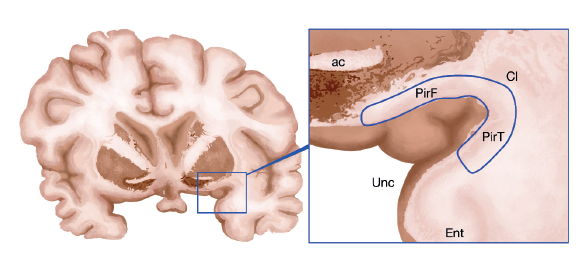
Nota: la CPR se divide en dos regiones: una anterior o frontal y otra posterior o temporal. La región anterior o frontal de la CPR se encuentra lateral al tracto y tubérculo olfatorio; y la región posterior o temporal está localizada desde la zona más anterior de la ínsula y se proyecta hasta la corteza amigdalina. Los límites laterales y mediales de la CPR son la neocorteza insular y la corteza perirrinal/ entorrinal, respectivamente. PirF: región frontal de la corteza piriforme, PirT: región temporal de la corteza piriforme, ac: comisura anterior, Cl: claustro, Unc: uncus, Ent: corteza entorrinal.
Fuente: adaptada de Vaughan y Jackson 11.
Figura 2 Localización y márgenes anatómicos de la corteza piriforme
Adyacente a la capa III, se encuentra el núcleo endopiriforme, el cual está compuesto por células multipolares importantes para la generación y propagación de las crisis epilépticas 15. Esta alocorteza tiene un contenido celular específico que está compuesto por 3 tipos de células excitatorias: las células semilunares, las células piramidales superficiales y las células piramidales profundas, las cuales tienen una distribución detallada en cada una de las 3 capas 16. Como hallazgo para resaltar, en el aspecto más ventral y anterior de la CPR, se encuentra un área diferente denominada el Area Tempestas (AT), la cual es una zona con alta sensibilidad a estímulos quimioconvulsivantes y se caracteriza por una menor concentración de aferencias inhibitorias GABAergicas, lo que la lleva a ser una zona de alta susceptibilidad epileptógena 17. La CPR es el componente más grande de la corteza olfatoria. Su funcionalidad principal se encuentra en relación con el procesamiento del olfato, además de la codificación y la categorización de la memoria desencadenada por olores 18. La CPR se ha implicado en la generación y la propagación de actividad epiléptica, así como en la presencia de síntomas olfatorios interictales 10,15.
La CPR, además de su ubicación estratégica y sus características histológicas especiales, tiene una gran variedad de conexiones tanto con el sistema límbico como con estructuras extralímbicas (corteza occipital, temporal, parietal y frontal basal), lo que permite la propagación de la actividad epileptiforme dentro del circuito límbico, así como fuera de este8. Es importante mencionar que las conexiones GABAergicas de la CPR son más densas en la zona posterior que en la anterior, lo que se correlaciona con el AT (localizada en la región anterior), crucial para la generación de actividad epileptiforme 19. La mayoría de las aferencias y eferencias que recibe y proyecta la CPR provienen desde y hacia la corteza entorrinal y perirrinal, sin embargo, también existen conexiones directas recíprocas entre la región posterior de la CPR y la amígdala 19.
En menor medida, existen otras proyecciones más indirectas hacia estructuras hipocampales (giro dentado, CAI, CA3 y subiculum) desde la corteza entorrinal; por consiguiente, y mediante la interconectividad directa (corteza entorrinal, perirrinal, amígdala y regiones extratemporales) e indirecta (estructuras hipocampales), se considera que la CPR es un sitio anatómico crucial para la propagación de la actividad epiléptica en el lóbulo temporal 20. En este sentido, la inhibición farmacológica de las estructuras relacionadas con la CPR (corteza perirrinal y entorrinal) atenúa la severidad de las crisis epilépticas generadas por el AT 15. De igual forma, los diferentes estudios que usan kindling farmacológico y eléctrico, sugieren que la CPR, en asociación con la corteza entorrinal, tiene un umbral bajo para la epileptogénesis en comparación con otras estructuras prosencefálicas 21,22. Toda esta amplia interconectividad neuronal genera un circuito de retroalimentación positiva, lo que produce la propagación de la actividad epileptiforme de forma eficiente 23.
Implicaciones de la corteza piriforme en la epileptogénesis del lóbulo temporal
La CPR constituye un zona anatómica fundamental para la epileptogénesis del lóbulo temporal 23. Su ubicación anatómica estratégica permite que sea una vía común para la propagación de descargas epileptiformes en las epilepsias focales. Esto se correlaciona con algunos estudios de neuroimagen los cuales han demostrado que, en pacientes con epilepsia del lóbulo temporal, la disfunción de los circuitos anatómicos va más allá del hipocampo y afecta a muchas otras estructuras 24-26. Estos estudios han identificado cambios volumétricos y morfológicos en la CPR, lo que sugiere que su atrofia es ipsilateral al foco epiléptico. De igual forma, esta atrofia se correlaciona con la pérdida volumétrica del hipocampo y de la amígdala ipsilateral, y esto sugiere que la disminución en el volumen de las diferentes estructuras del lóbulo temporal es el resultado de la disfunción de las redes que las interconectan difusamente 25.
Algunos estudios de EEG-fMRI han mostrado que los pacientes con epilepsia del lóbulo temporal tienen una activación ipsilateral de la CPR, la ínsula, el claustrum y la amígdala, lo que apoya la idea de que la CPR es una vía común para la propagación de descargas epileptiformes en epilepsias focales 27. Otros estudios clínicos han mostrado que, en comparación con pacientes con epilepsias focales extra-hipocampales y controles sanos, los pacientes con epilepsias temporales asociadas con esclerosis de hipocampo tienen una disfunción olfatoria basal caracterizada por una alteración en la discriminación y en la identificación de olores 10,28. Estas funciones están ampliamente representadas en la CPR, por lo cual estos hallazgos apoyan la hipótesis de que la disfunción olfatoria observada en los pacientes con esclerosis de hipocampo es la consecuencia de una red epileptógena disfuncional que se extiende a través de la CPR y las estructuras cercanas. En este sentido, un estudio reveló la importancia de la resección quirúrgica de la CPR en el desenlace final de pacientes con epilepsia del lóbulo temporal. En este estudio se documentó que la resección de al menos la mitad de la CPR aumentaba las probabilidades de estar libre de crisis hasta en 16 veces (IC 95%, 5-47) 29. Otros estudios recientes han mostrado resultados similares 30,31.
Adicionalmente, algunos estudios clínicos también han encontrado una fuerte correlación entre la disfunción olfatoria interictal y la alta frecuencia de crisis 10. Este hallazgo es consistente con algunos estudios en animales y de neuroimagen que han demostrado que la CPR es altamente susceptible al kindling eléctrico 21-23. En un estudio realizado con dos grupos de pacientes con epilepsias focales, utilizando EEG-fMRI o PET [11C] Flumazenil, se encontró que la unión del receptor GABAa a la CPR frontal ipsilateral al supuesto foco epiléptico, se reducía significativamente en los pacientes que tenían crisis más frecuentes 32. Estos datos sugieren que la inhibición GABAérgica alterada en la CPR puede ser una consecuencia de una mayor frecuencia de crisis, lo cual es congruente con los resultados clínicos que muestran que los pacientes con alta frecuencia de crisis tienen una tendencia a tener un menor desempeño en tareas olfativas como la discriminación y la identificación de olores 10,32.
Todos estos estudios plantean una asociación entre la CPR y la epileptogénesis del lóbulo temporal, lo cual apoya la hipótesis de que las epilepsias son en realidad una enfermedad de redes anatomofuncionales y no de lesiones estructurales. La CPR parece ser entonces un "nodo" importante dentro de toda esta red neuronal disfuncional. En el caso puntual de la epilepsia del lóbulo temporal, la disfunción olfativa interictal documentada en pacientes con esclerosis de hipocampo, plantea la posibilidad de utilizar pruebas olfativas unificadas en la evaluación no invasiva de estos pacientes. Esta idea ya se ha comenzado a confirmar y algunos estudios recientes han mostrado que la alteración en la identificación de olores puede ser un marcador pre-quirúrgico no invasivo que ayuda a identificar a los pacientes que pueden tener un mejor resultado luego de una cirugía resectiva del lóbulo temporal 33.
Conclusiones
La epilepsia del lóbulo temporal, así como las epilepsias focales en general, puede ser concebida como una enfermedad que involucra redes anatomofuncionales, en lugar de lesiones estructurales. Este enfoque permite una mejor comprensión del inicio y la propagación de las crisis, así como de las co-morbilidades asociadas. Un ejemplo ilustrativo de esta perspectiva es la disfunción olfatoria interictal observada en pacientes con epilepsia temporal asociada a esclerosis de hipocampo, que demuestra que esta epilepsia es el resultado de una red anatómica disfuncional que se extiende más allá del hipocampo. Es necesario que evolucionemos desde el concepto de "zona epileptógena" hacia el de "red epileptógena", ya que esta transformación conceptual nos permitirá adoptar un enfoque clínico y terapéutico más completo y ajustado a los conocimientos neurofisiológicos e imagenológicos actuales en el campo de la epilepsia.















