Introducción
La epilepsia constituye una condición globalmente prevalente en la población adulta, con 6,38 casos por cada 1000 habitantes (IC 95 % 5,57-7,30), y una incidencia anual acumulada de 67,77 por 100.000 habitantes, según cálculos para el 2017 1,2, oscilando entre 45,0 (RIC 30,3-66,7) en países de altos ingresos y 81,7 (RIC 28,0-239,5) en países de medianos y bajos ingresos 2. Se ha descrito a su vez que en la población con epilepsia es también más prevalente la presencia de trastornos del sueño, 3 entre ellos de principal relevancia el síndrome de apnea obstructiva del sueño (SAOS), hallado hasta en un 33 % de los pacientes con epilepsia, según series estadounidenses 4-8.
El síndrome de apnea obstructiva del sueño
Se ha reconocido al SAOS como un desorden crónico caracterizado por una obstrucción parcial o completa intermitente de la vía aérea superior que produce una alteración de la ventilación, cursa con episodios de desaturaciones intermitentes o hipercapnia y además tiene un impacto cardiovascular demostrado 9. Incluso tiene efectos negativos sobre la función cognitiva y puede ocasionar somnolencia diurna, lo que a su vez puede afectar la calidad de vida y la seguridad del paciente. De tal manera, supone una complicación en condiciones medicas comórbidas como desordenes psiquiátricos, cardiovasculares y otros trastornos neurológicos 3,10-12.
Específicamente en la población que padece epilepsia se ha descrito una mayor probabilidad de desarrollar refractariedad farmacológica debido al efecto facilitador de crisis que revisten las apneas 4,5,13,14, e incluso un posible mayor riesgo de experimentar muerte súbita (SUDEP) entre los pacientes con epilepsia refractaria 15,16.
Los efectos negativos del SAOS incluyen depresión, irritabilidad, reducción de la libido, fatiga y fallas cognitivas, principalmente de atención y memoria, por lo que se considera que interfiere en el funcionamiento diario y en las interacciones sociales 17-25. La distribución de los efectos previamente mencionados podría tener diferente frecuencia y severidad entre diversas poblaciones étnicas, lo cual es característico en nuestro medio con respecto a lo descrito en la literatura estadounidense.
El número de escalas validadas al español para la evaluación de trastornos del sueño es limitado, y el número de escalas destinadas a la evaluación del SAOS para la población con epilepsia es aún menor, por lo cual la adaptación transcultural de esta escala ofrece la base para la identificación de SAOS en este grupo de pacientes.
La escala de apnea del sueño del cuestionario de trastornos del sueño (Sleep Apnea Scale of the Sleep Disorders Questionnaire, SA-SDQ), es una subescala validada en población de habla inglesa para el estudio del SAOS en pacientes con epilepsia. Esta escala es parte del cuestionario de trastornos del sueño (Sleep Disorders Questionnaire, SDQ), un robusto instrumento que a su vez se deriva del banco de preguntas Sleep Questionnaire and Assessment of Wakefulness (SQAW), creado en la Clínica de Trastornos del Dormir de la Universidad de Stanford, por Lauhton et al. en 1979 26.
Se llevó a cabo una adaptación transcultural del instrumento en español proveído por los autores de la subescala, para determinar sus puntos de corte en una muestra de nuestra población.
Metodología
Sujetos
Tanto para la adaptación transcultural como para la de determinación de los puntos de corte de la escala se incluyeron pacientes entre los 18 y los 80 años diagnosticados con epilepsia focal o generalizada, según criterios ILAE, que asistieron a la consulta externa de neurología en el hospital de San José Centro, en Bogotá (Colombia) entre el 1.o marzo y el 31 de agosto del 2022, y que no contaban con el diagnóstico previo de síndrome de apnea del sueño. De todos los pacientes se obtuvo un consentimiento informado antes de participar; dicha participación fue siempre voluntaria.
Los pacientes incluidos en la fase de adaptación transcultural fueron excluidos de la segunda fase de determinación de los puntos de corte de la escala, pues a los primeros no se les solicitó polisomnografía.
Se excluyeron las pacientes en curso de gestación o lactancia, así como los que presentaban enfermedades médicas graves no compensadas como insuficiencia renal, cirrosis, insuficiencia cardíaca, enfermedades cerebrovasculares con discapacidad importante (Rankin modificado mayor o igual a 3) y problemas psiquiátricos que limitaran la colaboración del paciente. De igual manera, se consideró excluyente ser analfabeto o tener alguna discapacidad cognitiva o sensorial que impidiera entender la encuesta.
La versión propuesta por los autores en español (versión en castellano de México) del cuestionario SA-SDQ fue aplicada luego de obtener autorización de los propietarios (tabla 1). Se aplicó primero el instrumento a una población piloto de 10 individuos para verificar la interpretabilidad de las palabras, las frases y las oraciones, e inmediatamente, tras la aplicación del instrumento, se les solicitó a los participantes señalar qué comprendían de cada frase.
Tabla 1 Versión del cuestionario, SA-SDQ, utilizado en este estudio
| Instrucciones | ||||||
|---|---|---|---|---|---|---|
| Es importante que conteste todas las preguntas porque algunas enfermedades se manifiestan con un patrón de respuestas. Al contestar cada pregunta considere los últimos seis meses de su vida, a menos que la persona que le aplique este cuestionario le indique otra cosa. Algunas personas trabajan en horario nocturno o en turnos rotatorios. Otros tienen una hora de acostarse muy variable. Para estas personas, las preguntas que hablan sobre “la noche, tiempo nocturno, hora de acostarse, nocturno” se refieren al periodo en que se duermen por más tiempo. | ||||||
| La mayoría de las preguntas son afirmaciones simples. Se responden marcando un número del 1 al 5. | ||||||
| 1. Si usted está en total desacuerdo con la afirmación, o si nunca le ha pasado, conteste“1”. | ||||||
| 2. Si le ha ocurrido rara vez, conteste “2”. | ||||||
| 3. Si le ha ocurrido ocasionalmente “3”. | ||||||
| 4. Si le ha ocurrido frecuentemente conteste “4”. | ||||||
| 5. Si en su caso la afirmación es verdadera siempre conteste “5”. | ||||||
| Ejemplo: | ||||||
| ¿Qué tan frecuente cae nieve en Cartagena? 1 2 3 4 5 | ||||||
| Como sabemos que nunca cae nieve en Cartagena, se debe escoger la opción número 1. En el cuestionario que presentamos a continuación, la respuesta número 1 significa que nunca le ha pasado a usted y la respuesta número 5 significa que le ha pasado siempre. | ||||||
| Pregunta 1 | Me dicen que mi ronquido es fuerte y molesta a otros | 1. | 2. | 3. | 4. | 5. |
| Pregunta 2 | Me dicen que por momentos dejo de respirar cuando duermo “sostengo larespiración” | 1. | 2. | 3. | 4. | 5. |
| Pregunta 3 | Despierto súbitamente sofocado, sin poder respirar | 1. | 2. | 3. | 4. | 5. |
| Pregunta 4 | Transpiro o sudo mucho durante la noche | 1. | 2. | 3. | 4. | 5. |
| Pregunta 5 | Tengo (o tuve) la presión alta | 1. | 2. | 3. | 4. | 5. |
| Pregunta 6 | Tengo el problema de que se me tapa la nariz cuando estoy tratando de dormir. (alergias, infecciones) | 1. | 2. | 3. | 4. | 5. |
| Pregunta 7 | Mis ronquidos o mis problemas respiratorios empeoran si duermo boca arriba | 1. | 2. | 3. | 4. | 5. |
| Pregunta 8 | Mis ronquidos o mis problemas respiratorios empeoran si me quedo dormido después de haber tomado bebidas alcohólicas | 1. | 2. | 3. | 4. | 5. |
| Pregunta 9 | ¿Cuánto pesa actualmente? | 1. 60,5 kg o menos 2. 61-72 kg 3. 72,5-83 kg 4. 83,5-95 kg 5. más de 95,5 kg | ||||
| Pregunta 10 | ¿Qué edad tiene usted? | 1. 25 o menos años 2. 26 a 35 años 3. 36 a 44 años 4. 45 a 50 años 5. 55 o más | ||||
| Pregunta 11 | ¿Cuántos años ha fumado? | 1. ninguno 2. 1 año 3. 2 a 12 años 4. 13 a 25 años 5. 26 o más años | ||||
| Pregunta 12 | Índice de masa corporal (esta pregunta será diligenciada por el médico luego de tomar su talla) | 1. 22,2 o menor 2. 22,3 a 25,7 3. 25,8 a 27,5 4. 27,6 a 31,4 5. 31,5 o mayor | ||||
| Autorización para el uso de datos personales: | ||||||
| Con mi firma autorizo al Dr______________________________para utilizar los datos de este cuestionario y de mi historia clínica para fines académicos. Se me ha informado que estos datos se mantendrán siempre anónimos y no se publicarán con los resultados del estudio. ----------------------------------------------------espacio para la firma del paciente y cedula. --------------- Fecha | ||||||
Contenido del cuestionario SA
Se trata de un cuestionario autoadministrado de 12 preguntas, las primeras 8 con estructura ordinal-politómica, que miden la frecuencia de problemas relacionados con el sueño, mientras que las últimas 4 indagan sobre variables antropométricas y el tabaquismo, si existe como antecedente (tabla 1) 27.
El rango de puntuaciones va de 12 a 60; se llevó a cabo un análisis descriptivo de la edad, el índice de masa corporal y el promedio de puntaje de la escala SA-SDQ.
Polisomnografía
Las polisomnografías se llevaron a cabo en las diferentes instituciones en las cuales se encontraban asignados los pacientes por su entidad promotora de salud (EPS). Se verificó que en cada reporte la clasificación de los eventos se realizara siguiendo las pautas estándar 28. El índice de apnea-hipopnea (IAH) que se usó fue mayor o igual a 5 para definir SAOS.
Análisis estadístico
Para todas las pruebas estadísticas, un valor de P < 0,05 se consideró significativo. Las pruebas estadísticas se hicieron utilizando el paquete de análisis estadístico Stata.
Los resultados tabulados incluyeron la edad, el sexo, el índice de masa corporal (IMC), el índice de apnea-hipopnea (AHI) y la puntuación del SA-SDQ. Las variables cualitativas se resumieron mediante frecuencias absolutas y relativas, en tanto que en el caso de las variables cuantitativas se emplearon medidas de tendencia central. Se utilizaron pruebas U de MannWhitney para comparar la edad y la puntuación del SA-SDQ entre sujetos con y sin SAOS.
Se generaron curvas de características operativas del receptor (ROC) para el grupo, utilizando las puntuaciones SA-SDQ y el puntaje mayor o igual a 5 en la polisomnografía, con lo cual se determinaron los puntos de corte óptimos de la escala SA-SDQ en función de las sensibilidades y las especificidades obtenidas. Finalmente, la consistencia interna de la escala se evaluó con el procedimiento a de Cronbach, que detectó los coeficientes de confiabilidad de los ítems individuales.
Este estudio fue aprobado por el comité de ética del hospital de San José Centro, en Bogotá (Colombia), el lunes 9 de mayo del 2022 en la sesión 654, y fue considerado un estudio sin riesgo en su diseño metodológico o en sus resultados.
Resultados
Características de los sujetos
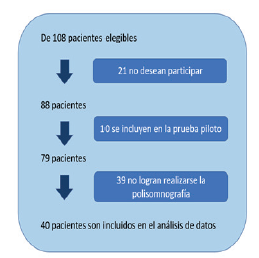
Entre el 1.o de mayo y el 31 de agosto del 2022 fueron atendidos 179 pacientes con diagnóstico de epilepsia (figura 1a), de los cuales 13 tenían diagnóstico previo de SAOS, para una prevalencia del 7,2 %.
De 108 pacientes elegibles, 88 aceptaron participar en el estudio (figura 1b), a todos se les aplicó la escala SA-SDQ, 10 como parte de la prueba piloto. Finalmente, solo 40 pacientes pudieron realizarse la polisomnografía, por lo que fueron incluidos en el análisis estadístico. De estos, 22 (55 %) fueron mujeres. Con el reporte polisomnográfico (PSG) se diagnosticó SAOS a 30 de 40 pacientes (el 75 %), con la misma proporción de hombres y mujeres (tabla 2). La alta incidencia de SAOS en la muestra se explica porque la proporción de sujetos de la población elegible que lograron realizarse PSG, lo hicieron porque en su historia estaban consignadas indicaciones clínicas de severidad cuando fueron sometidos a auditoría para ser autorizados por las diferentes EPS.
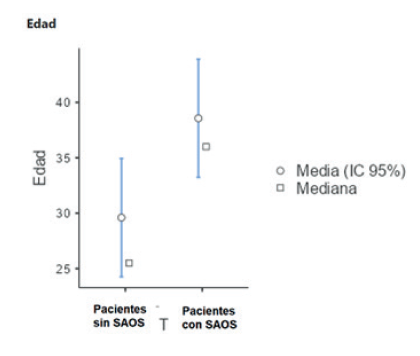
La severidad hallada fue la siguiente: 18 (60 %) pacientes tuvieron AHI 5-20, lo cual indica SAOS leve; 9 (30 %) tuvieron AHI 21-50, que corresponde a SAOS moderado; y 3 (10 %) tuvieron AHI de más de 50, lo que constituye un síndrome severo, Para un promedio de AHI en nuestra población de 23,7 %. La edad, el IMC y puntaje de la escala SA-SDQ de los pacientes con SAOS se detallan en la tabla 2.
Tabla 2 Características demográficas y puntación de la escala SA-SDQ
| Datos demográficos | Frecuencia (%) | Mediana y rango intercuartílico |
|---|---|---|
| Edad sanos |
Hombres 15 (37,5 %) Mujeres 15 (37,5 %) |
25,5 años (19-43) |
| Edad enfermos | Hombres 3 (7,5 %) Mujeres 7 (17,5 %) | 36 años (19-64) |
| Índice de masa corporal |
Pacientes con SAOS 22,2 o menor 2) 22,3-25,7 3) 25,8-27,5 4) 27,6-31,4 |
6 (20 %) 9 (30 %) 9 (30 %) 6 (20 %) |
| Pacientes sin SAOS |
1) 22,2 o menor 2) 22,3-25,7 3) 31,5 o mayor |
4 (40 %) 5 (50 %) 1 (10 %) |
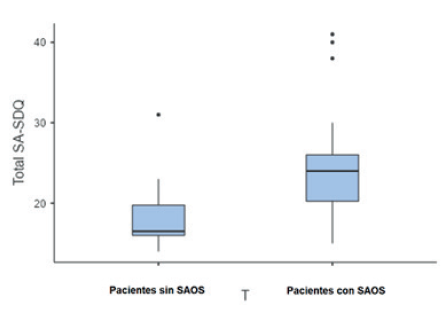
| Puntaje promedio de SA-SDQ | Pacientes con SAOS 24,6 rango 15-41 | Pacientes sin SAOS 18,7 rango 14-31 |
Fuente: elaboración propia.
La escala logró una distribución relativamente normal cuando se puntuó por separado por grupo (con y sin SAOS) (figuras 2 y 3). La W de Wilk varió desde un mínimo de 0,80 entre pacientes sanos, hasta un máximo de 0,90 entre pacientes con apnea del sueño en la escala SA. Cuando se puntuó la edad de los pacientes, se mostró que no seguía un comportamiento normal (P = 0,72).
Fuente: elaboración propia.
Figura 3 Distribución de puntajes de SA-SDQ entre pacientes sanos y enfermos
No hubo diferencias significativas en la edad de los pacientes en función del sexo por la prueba de U de Mann-Whitney (P = 0,76) y tampoco se distribuyó de manera diferente la edad entre sanos y enfermos (P = 0,12).
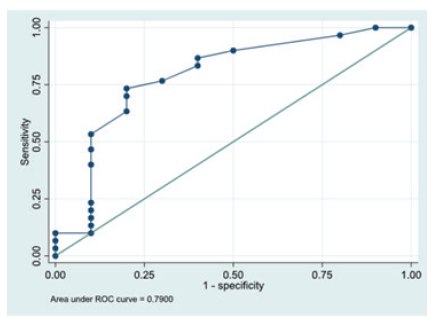
Curvas características de funcionamiento del receptor
El área bajo la curva fue de 0,790 para la población en estudio. La puntuación SA-SDQ de 21 proporcionó una sensibilidad del 73,3 % (IC 53,83-87,02 %) y una especificidad del 80 % (IC 44,4-96,4 %). El valor predictivo positivo fue del 91,6 % (IC 71,5-98,5 %) y el negativo fue del 50 % (figura 4 [curva ROC] y detalle de sensibilidad y especificidad. La consistencia interna del SA-SDQ mostró una α= 0,713).
La prueba piloto
En esta se evaluó la capacidad de comprender el instrumento en su versión en castellano mexicano, por lo que fue aplicada a 10 individuos con diagnóstico de epilepsia, pero sin SAOS. Tras la aplicación se indagó a los participantes en torno a las dificultades en la comprensión de las preguntas, a lo cual no hicieron ningún comentario. En la posterior aplicación del instrumento al resto de la muestra tampoco se reportaron dificultades en la comprensión de palabras, frases u oraciones.
Discusión
La escala SA SDQ es una escala validada en población de habla inglesa para el estudio de SAOS en pacientes que padecen epilepsia, con puntos de corte diferentes descritos entre los diversos grupos que han trabajado con la escala. Douglas et al. 25, luego de validarla, describieron puntos de corte de 36 para hombres (85 % de sensibilidad y 76 % de especificidad) y 32 para mujeres (88 % de sensibilidad y 81 % de especificidad) para identificar SAOS. Posteriormente, en el grupo de Weatherwax se determinaron puntos más bajos de 29 en hombres y 26 en mujeres 26, y de manera más reciente tanto Economou 5 como Methipisit 29 en sus trabajos plantearon un punto de corte de 25, con una buena sensibilidad de 73 % y especificidad del 72 % 5
En nuestro estudio determinamos un punto de corte más bajo (21 puntos), con similar sensibilidad y especificidad y un valor aceptable de área bajo la curva (0,790) en comparación con 0,744-0,788 27 y 0,771 5. Se obtuvo también un valor similar de alfa de Cronbach (0,716), comparado con 0,792 5, 0,79127 y 0,724 26.
Con respecto a la explicación de unos puntajes más bajos en nuestra población, encontramos que en el estudio de los autores de la subescala el promedio de edad para los pacientes con SAOS fue 49 años para hombres y 50,9 para mujeres 26, lo cual es en promedio una edad más alta con relación a la de nuestra muestra (39 años entre los hombres y 38 años entre las mujeres con SAOS). Esta diferencia puede explicar en promedio uno a dos puntos más en la escala SA-SDQ. A su vez, una mayor edad también conlleva un mayor tiempo de comorbilidades, lo que puede explicar puntajes más altos en los ítems de presión arterial, años de tabaquismo e incluso en peso e IMC. Con respecto a estos dos últimos ítems, es necesario mencionar que las características antropométricas de la población latina suelen diferir notoriamente de las de la población estadounidense.
Limitaciones
El pequeño tamaño de la muestra impidió contar un grupo de control más grande para realizar un agrupamiento estratificado por edad y sexo con los pacientes con SAOS, lo que se intentó mitigar buscando abordar a toda la población elegible en el periodo en estudio.
Haber excluido a pacientes con discapacidad cognitiva por la naturaleza de encuesta autoadministrada impidió buscar SAOS en esta población. Así, se excluyó a un 22,3 % (40/179) de los pacientes, y los pacientes con discapacidad cognitiva explicaron casi la mitad de los pacientes con SAOS: 6 de 13/179, el 3,3 % en nuestra población). Quizá la aplicación del instrumento a familiares convivientes permita hacer una aproximación a estos pacientes.
Al llevarse a cabo los estudios de polisomnografía en las diferentes instituciones contratadas por las EPS de cada paciente, quedó fuera del alcance del presente estudio verificar la idoneidad de los profesionales encargados de la interpretación de cada polisomnografía, lo cual podría constituir una fuente de sesgos de información.
La auditoría de las EPS limitó el tamaño muestral, al restringir la autorización de la polisomnografía solo a los pacientes con signos de severidad, o solo tras un segundo concepto por un especialista en otorrinolaringología adscrito a la EPS, por lo cual los pacientes asintomáticos o con síntomas leves no pudieron hacer parte del estudio. De lo anterior surge la necesidad de hacer nuevos estudios, con un mejor tamaño muestral, y en los cuales el personal profesional encargado de la interpretación de la polisomnografía esté incluido en el diseño metodológico del estudio y no sea asignado por la EPS, lo que permitirá un mejor control de sesgos y un mejor reconocimiento de la prevalencia del SAOS y las propiedades métricas de la escala en nuestro país.
Conclusiones
La escala SA-SDQ es un instrumento útil para tamizar SAOS en la población colombiana que padece epilepsia. Nuestros resultados indican que los puntos de corte sugeridos anteriormente (29-36 para hombres y 26-32 para mujeres) pueden ser demasiado altos para nuestra población.
Los pacientes con puntaje > 21 pueden tener un mayor riesgo de padecer SAOS y por tanto se les debería solicitar una polisomnografía.