Introducción
Los síntomas neurológicos focales transitorios (SNFT) son frecuentes en Neurología y pueden originarse por un amplio espectro de patologías del sistema nervioso central. Así, los SNFT de origen central incluyen unas causas comunes como la patología vascular, la epilepsia, la migraña con aura y otras no tan comunes como trastornos metabólicos, tumores, esclerosis múltiple, enfermedades psiquiátricas y amnesia global transitoria.
Se resalta que la patología vascular es una causa frecuente de SNFT y ataques isquémicos transitorios (AIT) 1, donde los síntomas de estos últimos se describen como negativos, de rápida instauración, sin progresión, sin factor precipitante y usualmente de menos de una hora de duración 2, sin embargo, la enfermedad hemorrágica intracraneal con microsangrados cerebrales corticales, siderosis cortical superficial o hemorragia subaracnoidea de la convexidad cerebral (HSAc) puede manifestarse con SNFT.
Los SNFT por enfermedad hemorrágica de pequeño vaso han sido denominados eventos amiloides o paroxismos amiloides, por su asociación con la angiopatía amiloidea cerebral 3. Estos últimos se describen como SNFT recurrentes, de corta duración y estereotipados, en los cuales predominan las manifestaciones sensitivas, motrices o corticales, con diseminación a partes contiguas corporales, y su mecanismo fisiopatológico no es claro, pero se han desarrollado varias teorías 4-5, sin embargo, no todos los SNFT por hemorragia son causados por enfermedad vascular cerebral de vasos pequeños. A continuación, se presenta un caso de SNFT con microsangrados cerebrales corticales no asociado a enfermedad cerebral de vasos pequeños. El presente caso no tiene ninguna implicación ética.
Presentación del caso clínico
Hombre de 29 años que consultó al servicio de urgencias por SNFT, quien presentó dos episodios de síntomas sensitivos de tipo parestesias en hemi-cuerpo derecho, que iniciaron en la cara y progresaron a miembro superior, duraron 30 minutos y se resolvieron de forma espontánea. El paciente presentó otro episodio de alteración de lenguaje con dificultad para la expresión y la articulación de las palabras, de 20 minutos de duración con resolución espontánea y completa. En su historia clínica no refirió factores precipitantes, debilidad, o cefalea, su único antecedente médico era hipofibrinogenemia congénita diagnosticada en la infancia y en tratamiento irregular con concentrado de fibrinógeno (Fibryga®).
Al examen físico de ingreso el paciente se encontraba en buen estado general con frecuencia cardiaca de 79 por minuto, tensión arterial 120/70 mmHg, frecuencia respiratoria de 16 respiraciones por minuto y saturación de oxígeno del 90 %. Su examen cardiovascular y neurológico eran normales.
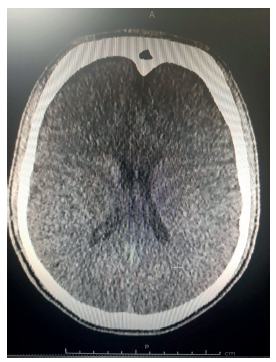
Los laboratorios de ingreso mostraron cuadro he-mático, glicemia, electrolitos y función renal normales. Plaquetas de 316.000 por mm3, tiempo de protrombina de 11 (control de 10,5), tiempo de tromboplastina activado de 28,4 (control de 26,2) y un fibrinógeno de 97 mg/dl. El electrocardiograma y la tomografía computarizada de cráneo simple no mostraron anormalidades (figura 1), al igual que el electroencefalograma, que estuvo dentro de los límites normales. En las secuencias de susceptibilidad magnética de la resonancia magnética (RM) cerebral simple, se observaron múltiples lesiones corticales hipointensas redondeadas de entre 2 mm y 10 mm de diámetro (figuras 2, 3 y 4).
Fuente: elaboración propia.
Figura 1 Tomografía computarizada de cráneo simple axial sin anormalidades
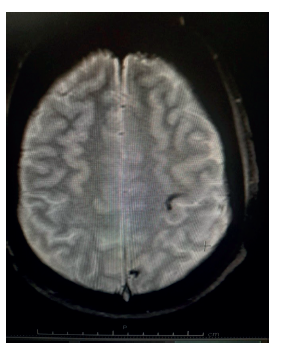
Nota: se muestra microsangrados de lesiones hipointensas redondeadas de 2-10 mm de diámetro en el hemisferio cerebeloso izquierdo.
Fuente: elaboración propia.
Figura 2 Resonancia cerebral de secuencia eco de gradiente (GRE)
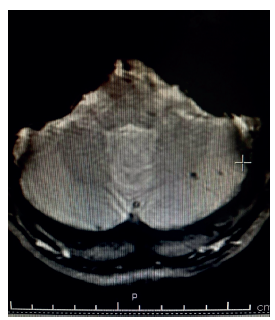
Nota: se muestran lesiones corticales hipointensas redondeadas de 2-10 mm de diámetro en el giro precentral y parietal izquierdo.
Fuente: elaboración propia.
Figura 3 Resonancia cerebral de secuencia eco de gradiente (GRE)
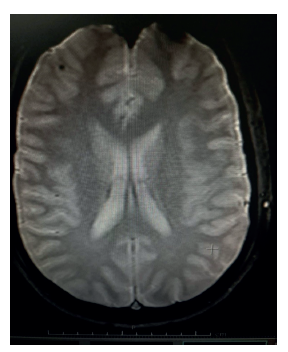
Nota: lesión cortical hipointensa redondeada de 2 cm en giro frontal superior derecho.
Fuente: elaboración propia.
Figura 4 Resonancia cerebral de secuencia eco de gradiente (GRE)
El paciente permaneció asintomático durante la estancia hospitalaria, no se administraron crioprecipitados o plasma fresco congelado y egresó con la administración de Fybriga® de manera ambulatoria y regular, con la meta de fibrinógeno de 150 mg/dl. En el seguimiento a los tres meses, el paciente permanecía asintomático y con concentración de fibrinógeno en sangre en metas.
Un año desde su egreso, el paciente ha presentado dos episodios de disartria transitoria, con dosis de concentrado de fibrinógeno de tres gramos por semana y una concentración en sangre de 80 mg/dl, por lo que se decidió aumentar la dosis a 4 gramos.
Discusión
Se presenta el caso de un paciente con un trastorno de la coagulación congénito y tendencia al sangrado, SNFT y microsangrados cerebrales corticales en las secuencias de susceptibilidad magnética de la RM; donde el manejo de los microsangrados depende del proceso fisiopatológico subyacente 5, en este caso, la discrasia sanguínea con hipofibrinogenemia congénita. Además, el manejo de los sangrados en pacientes con hipofibrinogenemia se basa en la severidad y la localización del sangrado.
Los niveles de fibrinógeno sanguíneo se optimizan mediante la reposición parenteral de la proteína y el control vascular del sangrado 6, pero en nuestro paciente se decidió no administrar crioprecipitado o plasma fresco congelado y se reinstauró la terapia con concentrados de fibrinógeno, con un desenlace satisfactorio a los tres meses.
La enfermedad vascular hemorrágica intracraneal de vasos pequeños (MSCc, HSAc y siderosis cortical superficial) puede presentarse con SNFT 6-7 y aunque su diagnóstico puede ser difícil, la edad del paciente, los antecedentes médicos y las imágenes por RM nos dan una orientación etiológica.
Por su parte, los MSCc son detectados en las secuencias de RM SWI (suscpetibility weighted imaging), T2 estrella (T2*) o eco de gradiente. En estas secuencias se acentúa la pérdida de señal causada por depósitos de hierro, producto de los sangrados 7-8. Así, los MSCc en SWI, T2* y eco de gradiente se caracterizan por lesiones redondas, hipointensas, de 2 mm a 10 mm de diámetro, con un efecto floreciente (blooming), rodeadas al menos en un 50 % por parénquima y que perduran en el tiempo 8. Los MSCc, las HSAc y la SCS pueden tener varias etiologías que incluyen: angiopatía amiloidea cerebral, malformaciones vasculares, síndrome de vasoconstricción reversible (SVCR), trombosis venosa cerebral, vasculitis, uso de simpaticomiméticos y coagulopatías. En pacientes mayores de 60 años, la causa más frecuente es la angiopatía amiloidea cerebral 9 y, en menores de 60 años, el SVCR 10; sin embargo, en pacientes jóvenes se debe considerar una discrasia sanguínea con estudios de plaquetas, tiempos de coagulación y niveles de fibrinógeno sanguíneo 10.
Fisiopatológicamente, los SNFT en pacientes con MSCc, HSAc y SCS se asocian a una depresión cortical cerebral diseminada, donde los productos de degradación de la sangre (hemosiderina) y el proceso inflamatorio desencadenado por la sangre extravascular favorecen la onda de depresión cortical 11, sin embargo, fenómenos epilépticos y de isquemia focal también podrían participar en la generación de los SNFT. En pacientes con angiopatía amiloidea cerebral, la presencia de SNTF, MSCc, SCS y HSAc aumenta el riesgo de hemorragia intracerebral de un 10 % a un 20% por año 12. Por su baja frecuencia, las implicaciones pronósticas de los MSCc en pacientes con coagulopatías son desconocidas, asimismo, tampoco hay guías de manejo de los SNFT asociados a MSCc en pacientes con coagulopatías. Según recomendaciones de expertos, el manejo se basa en la reversión de la discrasia sanguínea, el evitar medicamentos antitrombóticos o antiinflamatorios no esteroideos, el control de la tensión arterial sistémica y el uso de antiepilépticos si los síntomas son frecuentes e incapacitantes 12.
Por otra parte, los SNFT asociados a MSCc, SCS y HSAc no son infrecuentes en pacientes con angiopatía amiloide cerebral, ya que alrededor de un 50 % de estos pacientes presenta síntomas neurológicos positivos, 12 % cefalea con los SNFT, 16 % tiene más de un tipo de ataque, 68 % tiene dos o más ataques, dos tercios de los episodios duran menos de 20 minutos y los síntomas negativos (afasia o debilidad) se presentan hasta en el 48 % de los pacientes. Usualmente, los síntomas son sensitivos, motrices o visuales, y menos frecuentemente de lenguaje 11,12. Además, clínicamente los SNFT asociados a microsangrados semejan un AIT si predominan los síntomas negativos o una crisis epiléptica si predominan los positivos 11,13-14. Los ataques se presentan en intervalos no predecibles de meses o años, o inclusive, varios en un mismo día 11,12-14. Por último, el comportamiento clínico de los SNFT por MSCc, SCS o HSAc en pacientes con discrasias sanguíneas es desconocido.
El fibrinógeno es una glicoproteína de 340 kDa, de síntesis hepática con vida media de 3 a 3,5 días y una concentración plasmática entre 200-400 mg/dl. Su papel principal es de hemostasia, con la formación de fibrina y de cicatrización. El control de su síntesis está bajo la influencia de tres genes ubicados en el cromosoma 4: FGA, FGB y FGG, donde el gen FGA es el más frecuentemente afectado por desórdenes genéticos 15. Las mutaciones que afectan la síntesis y el procesamiento del fibrinógeno se asocian con trastornos cuantitativos (tipo 1), mientras que los trastornos de polimerización, entrecruzamiento y ensamblaje se relacionan con los desórdenes cualitativos (tipo 2) 16-18.
Los trastornos hereditarios del fibrinógeno tipo 1 son la afibrinogenemia y la hipofibrinogenemia y los de tipo 2 son la disfibrinogenemia y los defectos combinados. Estos son enfermedades raras, causando el 0,6 % del total de las discrasias sanguíneas hereditarias 19.
En general, el riesgo de sangrado se correlaciona con los niveles de fibrinógeno sanguíneo, excepto para el caso de las disfibrinogenemias, sin embargo, la mayoría de los individuos con enfermedades hereditarias del fibrinógeno son asintomáticos y solo se identifican de manera incidental o por tamización familiar. En pacientes sin alteraciones adquiridas, la hipofibrinogenemia se confirma con un nivel de fibrinógeno menor a 150 mg/dl en pruebas funcionales y de inmunoensayo 18.
Los trastornos cuantitativos tienen un patrón de herencia autosómico recesivo y la hipofibrinogenemia se presenta en individuos heterocigotos para las mutaciones de afibrinogenemia 17. Los estudios genéticos para la genotipificación del defecto son recomendables, pero no ampliamente disponibles 19, sin embargo, los estudios genéticos pueden ser útiles para determinar el estado del portador, la consejería familiar y el diagnóstico prenatal 17.
La incidencia real de la hipofibrinogenemia es desconocida y se considera que concentraciones de fibrinógeno por encima de 100 mg/dl son a menudo suficientes para prevenir sangrados, donde la sospecha diagnóstica de la hipofibrinogenemia se basa en la presencia de sangrado y la prolongación de los tiempos de protrombina (PT) y tromboplastina activada (aPTT); sin embargo, el PT y el aPTT pueden estar dentro de los límites normales en individuos con niveles de fibrinógeno entre 100-150 mg % (20). La edad de presentación de pacientes con hipofibrinogenemia es variable, su sangrado puede ser leve o severo y su asociación a complicaciones tromboembólicas es rara. Además, la hipofibrinogenemia se ha asociado a un tipo de enfermedad hepática de depósito con acumulación de fibrinógeno anormal en el retículo endoplásmico del hepatocito 21.
El manejo de los pacientes con hipofibrinogenemia se basa en prevenir o tratar sangrados clínicamente significativos, por lo que se sugiere mantener o llevar los niveles de fibrinógeno superiores a 100 mg/ dl o 150 mg/dl y la hemostasia clínica. Para sangrados cerebrales, algunos expertos sugieren objetivos de niveles de fibrinógeno entre 150-200 mg/dl, sin embargo, estos niveles están basados en reportes de casos y series de casos 22. Para lograr la hemostasia clínica y los niveles de fibrinógeno propuestos, se usan los concentrados de fibrinógeno y productos plasmáticos 23.
En la búsqueda de la literatura no se encontraron estudios comparando la eficacia y la seguridad de ambos medicamentos, pero se recomienda el uso de concentrados de fibrinógeno para evitar las reacciones transfusionales, el riesgo de trombosis y la sobrecarga de volumen de los crioprecipitados y del plasma fresco congelado 24. Por otra parte, el uso profiláctico de fibrinógeno en ausencia de sangrado no está recomendado 25; y el manejo de pacientes con hipofibrinogenemia congénita se hace de manera individualizada, con el objetivo razonable de niveles de fibrinógeno > 50 mg/dl 26.
Los MSCc, la SCS y la HSAc pueden causar SNFT y aunque la mayoría de SNFT por enfermedad hemorrágica es por angiopatía amiloidea cerebral, las discrasias sanguíneas adquiridas o congénitas pueden presentarse de esta manera. Otro punto para tener en cuenta es que el abordaje diagnóstico de la enfermedad hemorrágica cerebral de vasos pequeños debe considerar la edad de presentación, las comorbilidades, los antecedentes médicos, los hallazgos neuroimagenológicos y las pruebas hemáticas (plaquetas, PT, aPTT y niveles de fibrinógeno).
Conclusiones
Se presentó un caso raro de hipofibrinogenemia congénita con MSCc y SNFT para alertar al clínico de la gran variedad de patologías que pueden tener presentaciones clínicas e imagenológicas similares.
Vale la pena destacar que los síntomas neurológicos focales transitorios pueden ser causados por micro-sangrados cerebrales corticales, siderosis cortical superficial y hemorragia subaracnoidea de la convexidad. Las discrasias sanguíneas congénitas por alteraciones del fibrinógeno son raras. Sin embargo, la presentación clínica como SNFT, el grupo etario del paciente, los antecedentes médicos y paraclínicos ayudan a pensar en esta etiología como posible causa de microsangrados cerebrales.















