Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Odontología
Print version ISSN 0120-971X
CES odontol. vol.25 no.1 Medellìn Jan./June 2012
Sensibilidad a la amoxicilina de bacterias anaerobias de pacientes con periodontitis agresiva. Rev. CES Odont. 2012;25(1) 12-21.
2Odontólogo.Universidad Autónoma de Manizales.
3Microbióloga. Universidad Autónoma de Manizales.
Recibido para publicación: Febrero de 2012 Aprobado para publicación: Mayo de 2012
Resumen
Introducción y Objetivo: Se han utilizado los antibióticos como terapia adjunta al tratamiento periodontal. La amoxicilina y la amoxicilina/ácido clavulánico son algunos de los más utilizados. Establecer el tipo de bacterias y su sensibilidad a la amoxicilina y a la amoxicilina/ácido clavulánico en pacientes con periodontitis agresiva.
Materiales y Métodos: Este estudio in vitro estableció la sensibilidad a la amoxicilina y a la amoxicilina/ácido clavulánico de las bacterias aisladas de 19 pacientes con periodontitis agresiva. Se obtuvieron muestras de 6 sitios con bolsas iguales o mayores a 7 mm de profundidad, se realizó cultivo y aislamiento de colonias en condiciones anaeróbicas. La identificación de los microorganismos se realizó a través de la coloración de Gram y el Sistema Crystal para anaerobios; para determinar la sensibilidad a los antibióticos se utilizó la técnica descrita por Wilkins y Thiel.
Resultados: En la periodontitis localizada los microorganismos que se presentaron con mayor frecuencia fueron Veillonella species, Peptostreptococcus prevotii, Staphylococcus saccharoliticus, Bacteroides fragilis, Bacteroides ureolyticus. En la periodontitis generalizada se encontró Fusobacterium nucleatum, Veillonella species, Peptostreptococcus prevotii, Peptostreptococcus saccharolitucus, Staphylococcus saccharoliticus. De las 21 especies identificadas, en la periodontitis localizada 4 fueron resistentes a la amoxicilina y 1 resistente a la amoxicilina/Acido clavulánico. En la periodontitis generalizada se encontró 1 microorganismo resistente a la amoxicilina y 1 resistente a la amoxicilina/Acido clavulánico.
Conclusión: Se encontraron bacterias resistentes a la amoxicilina y a la amoxicilina/ácido clavulánico.
Palabras clave: Periodontitis agresiva, Antibióticos, Amoxicilina, Amoxicilina/ácido clavulánico.
Abstract
Introduction and Objective: Antibiotics have been used as an adjunct to periodontal treatment. Amoxicillin and amoxicillin/clavulanic acid are some of the most used.
To define the type of bacteria and their susceptibility to amoxycillin and to amoxicillin/clavulanic acid in patients with aggressive periodontitis.
Materials and Method: This descriptive study stated susceptibility to amoxycillin and to amoxicillin/clavulanic acid of bacteria isolated from 19 patients with aggressive periodontitis, selected by convenience. Samples from six (6) different sites with periodontal pockets equal or greater than 7 mm of depth were obtained. The samples were cultured anaerobically and the isolated colonies were identified by means of the Gram staining procedure and the Crystal System for anaerobics. The Wilkins and Thiel test was used to assess susceptibility.
Results: The microorganisms with the highest presence in localized periodontitis were Veillonella species, Peptostreptococcus prevotii, Staphylococcus saccaharolyticus, Bacteroides fragilis and Bacteroides ureolyticus. Fusobacterium nucleatum, Veillonella species, Peptostreptococcus prevotii, Peptostreptococcus saccharolyticus and Staphylococcus saccharolyticus were found in generalized periodontitis. Four out of the 21 microorganisms species identified in localized periodontitis 4 were resistant to amoxycillin and one to amoxicillin/clavulanic acid. One microorganism was identified as resistant to amoxycillin and one to amoxicillin/clavulanic acid in generalized periodontitis.
Conclusion: Amoxycillin-resistant and amoxycillin/clavulanic acid-resistant bacteria were found.
Key words: Aggressive periodontitis, Antibiotics, Amoxycillin, Amoxicillin/clavulanic acid.
Introducción
En la cavidad oral humana existen más de seiscientas especies bacterianas y pueden residir en el biofilm de la placa bacteriana por encima y debajo del margen gingival, la cual muestra diversidad bajo varias condiciones clínicas periodontales.1
En el caso de las periodontitis, tanto la agresiva como la crónica son causadas por un sobrecrecimiento de patógenos periodontales putativos en la placa subgingival seguido por una respuesta inmune inflamatoria del huésped.2
La periodontitis agresiva es un tipo específico de periodontitis con características clínicas claramente diferentes de la periodontitis crónica. El grado de destrucción periodontal puede estar relacionado con la virulencia bacteriana y la susceptibilidad del huésped.
Debido a la naturaleza infecciosa de la enfermedad periodontal,1 se han utilizado los antibióticos como terapia adjunta al tratamiento periodontal, su utilización se ha valorado a nivel sistémico y crevicular. Aunque la placa microbiana subgingival es extraordinariamente persistente y difícil de eliminar porque las colonias bacterianas están protegidas unas a otras por material extracelular en el cual se embeben por sí mismas, factor que las hace inusualmente persistentes a los efectos de los antibióticos, algunos de ellos se utilizan más frecuentemente debido a que pueden obtenerse, en fluido crevicular, concentraciones superiores a las requeridas para las bacterias objetivo. Tales antibióticos son: amoxicilina, amoxicilina/ácido clavulánico, tetraciclinas, clindamicina y metronidazol.3
Dado que la actividad de la amoxicilina en el tratamiento periodontal se puede ver interferido por la ß-lactamasa, la amoxicilina se combina con ácido clavulónico,3 el cual se une a la enzima permitiendo así la recuperación de la susceptibilidad del germen al antibiótico.
Debido a que la amoxicilina y la amoxicilina/ácido clavulánico son los más utilizados en nuestro medio, el objetivo del presente estudio fue determinar la sensibilidad de las bacterias presentes en pacientes con enfermedad periodontal agresiva a estas dos formas de amoxicilina.
Materiales y Métodos
Se realizó un estudio de tipo descriptivo, para establecer la sensibilidad a la amoxicilina y amoxicilina/ácido clavulánico de bacterias obtenidas de pacientes con periodontitis agresiva.
La muestra fueron 23 bacterias aisladas de 18 pacientes con periodontitis agresiva (localizada y generalizada) atendidos en la clínica del Programa de Odontología de la Universidad Autónoma de Manizales. La muestra fue por conveniencia.
Para la elección de los pacientes se tuvo en cuenta los siguientes criterios de inclusión: bolsas periodontales mayores o iguales a 7mm, adultos menores de 41 años.
Criterios de exclusión: antecedentes de diabetes, cáncer o enfermedades hematológicas, tratamiento periodontal en los últimos 6 meses, tratamiento con antibióticos en los 6 meses previos a la toma de la muestra.
Procedimiento
Se obtuvo muestras de fluido crevicular gingival en sitios con profundidad de bolsa igual o mayor a 7 mm, con un cono de papel No 30 por 30 segundos. Se introdujeron las puntas de papel en 1 ml de Tioglicolato prerreducido y se incubaron durante 2 horas a 37º C. Luego, la muestra se inoculó en Agar Brucella con Vitamina K y Hemina, se incubó durante 5 a 7 días a 37 º C, en ambiente anaerobio, utilizando el Sistema Gas Pak (Oxoid). Se realizó aislamiento de colonias.
La identificación de los microorganismos se realizó a través de la coloración de Gram y el Sistema API BBL Cristal, previa estandarización del inóculo a 0,5 en escala de McFarland.
A cada una de las bacterias aisladas se les realizó la prueba de susceptibilidad de bacterias. Dos tubos con 5 mililitros de caldo de infusión cerebro corazón prerreducido, suplementado con cisteína (0,05%) hemina (0,0005%) menadiona (0,002%) y extracto de levadura (0,5%) se le añadieron 60 µg (amoxicilina, y amoxicilina/ácido clavulánico). A cada uno de ellos se le añadió 1 gota de inóculo. Dos tubos sin antibiótico fueron utilizados como controles de sensibilidad y de resistencia. El primero no fue inoculado con bacterias y el segundo si.
Se incubó durante 18 a 24 horas a 37 °C en condiciones anaerobias. Se observó la presencia de desarrollo microbiano a nivel macroscópico y microscópico (coloración de gram).
Resultados
De las 18 periodontitis agresivas diagnosticadas se presentaron 12 localizadas y 6 generalizadas. El rango de edad en pacientes con P. generalizada estuvo entre 28 y 37 años y en P. localizada entre 20 y 41 años.
La distribución según sexo fue la siguiente: en periodontitis generalizada 1 hombre y 5 mujeres, y en los pacientes con periodontitis localizada 7 hombres y 5 mujeres.
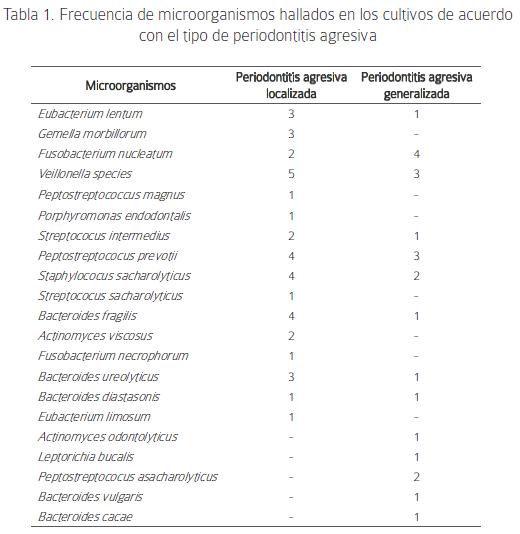
Se identificaron 21 especies de microorganismos distribuidos de la siguiente manera:
En la periodontitis localizada: Veillonella species (5), Peptostreptococcus prevotii (4), Staphylococcus saccharoliticus (4), Bacteroides fragilis (4), Bacteroides ureolyticus (3). En la periodontitis generalizada: Fusobacterium nucleatum (4), Veillonella species (3), Peptostreptococcus prevotii (3), Peptostreptococcus saccharolitucus (2), Staphylococcus saccharoliticus (2). (Tabla 1).
Del total de 21 especies de microorganismos identificados, en la periodontitis localizada 4 fueron resistentes a la amoxicilina y 1 resistente a la amoxicilina/ ácido clavulónico. En la periodontitis generalizada se encontró 1 microorganismo resistente a la amoxicilina y 1 resistente a la amoxicilina/ ácido clavulónico (Tabla 2).
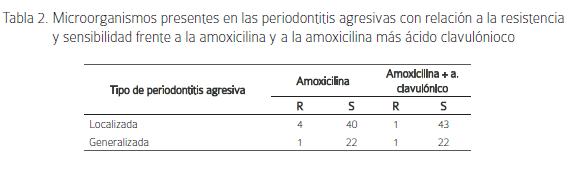
Las bacterias resistentes a la amoxicilina fueron Fusobacterium necrophorum, Bacteroides fragilis, Bacteroides ureoliticus, Eubacterium limosun y el Peptostreptococcus prevotii. Las bacterias resistentes a la amoxicilina/ ácido clavulónico fueron Fusobacterium necrophorum y Peptostreptococcus prevotii.
Discusión
Una fuerte evidencia considera como patógenos periodontales a: Actinobacillus actinomicetemcomytans (A actinomicetemcomytans), Porphyromonas gingivalis (Pg) y Bacteroides forsythus (Tannerella forsythensis). El Actinobacillus actinomicetemcomytans juega un papel en la periodontitis agresiva, P gingivalis y B forsythus están mas asociados con la P crónica. Se cree que existe una moderada evidencia que también sean patógenos periodontales como: Campylobacter rectus, Eubacterium nodatum, Fusobacterium nucleatum, Peptostreptococcus micros, Prevotella intermedia/nigrescens, Streptococcus intermedius, y varias Espiroquetas.
Desde 1999, con la nueva clasificación de la enfermedad periodontal, los criterios microbiológicos no fueron mencionados como característica fundamental para diferenciar la periodontitis agresiva de la crónica; sin embargo para la Periodontitis agresiva una característica secundaria que generalmente, pero no en forma universal esta presente, incluye una elevada proporción de Actinobacillus actinomycetemcomitans y en algunas poblaciones la Porphyromonas gingivalis.1 A pesar de la dificultad de catalogar todos los miembros de la microflora oral y de cómo interactúa con otros y con el huésped humano, algunas especies han sido identificadas como patógenos periodontales.
De allí que en algunos estudios2-4 se ocupan de identificar aquellas especies que han sido descritas como patogénicos, lo cual no se hizo en la presente investigación ya que se identificaron los anaerobios que estaban presentes en las lesiones periodontales.
En consecuencia, se observa diferencia con los tipos de microorganismos descritos en la periodontitis agresiva con respecto a otras investigaciones a nivel mundial. A continuación se proponen unas posibles explicaciones:
En el presente estudio la detección microbiológica se hizo por medio de un cultivo anaerobio, y se identificaron las bacterias anaerobias por medio del sistema de identificación BBL CRYSTAL® (Anaerobe Identification system®), que es una prueba bioquímica para conocer el género y la especie de las bacterias aisladas. La detección de microorganismos patógenos en otros estudios se hizo por RCP (Reacción en cadena de la polimerasa),2,4 por morfología de la colonia sobre microscopio estereoscópico y test rápido bioquímico, algunas confirmadas por la reacción en cadena de la polimerasa (RCP).3
Las técnicas de cultivo bacteriano, los análisis inmunológicos, ensayos enzimáticos y tecnologías de pruebas de ADN son usados para el diagnóstico de bacterias periodontopáticas, pero esas metodologías tienen diferentes ventajas y desventajas. Recientemente las tecnologías basadas en RCP han sido usadas para detectar bacterias periodontopáticas. Ellas son usualmente rápidas y permiten analizar grandes muestras; sin embargo, la cantidad de información clínica en la patogenicidad de las bacterias periodontopáticas es todavía limitada. Adicionalmente aunque estos métodos son usados para detectar bacterias especificas, no son capaces de estimar la calidad y cantidad de las bacterias asociadas con el biofilm.5
La RCP es el método mas seguro, sensible y eficaz.2 Sin embargo, es necesario ser concientes de las características especiales de esos experimentos. Otras razones que puede explicar las diferencias encontradas entre la presente investigación y otros estudios, puede ser la ubicación geográfica, raza, factores relacionados con la muestra como puede ser la cantidad de bacterias dependiendo del método de muestreo, el número de muestras tomadas en un paciente, los criterios de selección del sitio, el método usado para hacer el conteo.6 Se contempla la posibilidad que el tipo de microorganismo puede variar según las diferencias geográficas y raciales.2 En otro estudio se sugiere nuevamente que la prevalencia de los microorganismos varia con la raza y el país.7
Es tal la heterogenicidad de las bacterias presentes en la periodontitis y la forma en que los diferentes estudios (incluido éste) las tratan de categorizar (por especies, por morfotipos, grupos bacterianos o complejos, especies bacterianas individuales, subespecies y serotipos) que no es posible diferenciar entre P agresiva y P. crónica según el tipo de microorganismos presentes. Ello ha obligado a investigadores como Mombelli8 (2002) a enfocar su meta análisis en 5 tipos específicos de bacterias, Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, Bacteroides forsythus, Campylobacter rectus, las cuales tenían parámetros que habían sido reevaluados y discutidos ampliamente en la literatura periodontal. Aparte de una gran variedad de cepas bacterianas se ha discutido el compromiso de virus y microorganismos no bacterianos.7 Aunque la mayoría de investigadores periodontales están de acuerdo que las bacterias son el factor etiológico primario de la enfermedad periodontal destructiva hay alguna evidencia reciente que implica ciertos agentes virales. Tales virus como: Citomegalovirus, Epstein-barr, Papilloma virus, Virus del Herpes simple, pueden tener un papel en la iniciación de la periodontitis, la mayoría afectando la respuesta del huésped a la invasión bacteriana.9
Yasuo Takeuchsin (2003)10 en su estudio encontró que la prevalencia de A actinomicetemcomytans fue baja: 20% para periodontitis localizada, 17% para periodontitis generalizada sin diferencias estadísticamente significativas comparada con P. crónica. La Tannerella forsythensis, Campylobacter Rectus, Porphyromonas gingivalis y Treponema denticula fueron frecuentemente detectados en la Periodontitis agresiva localizada y generalizada.
El A actinomicetemcomytans, la P intermedia, P nigrescens fueron bajos en todos los grupos. La frecuencia de detección de las 7 bacterias periodontopáticas no difiere significativamente entre los 3 grupos de periodontitis. (P agresiva localizada, generalizada y crónica).
Tannerella forsythensis, Campylobacter rectus, Porphyromona gingivalis, Treponema denticula fueron detectados juntos en los mismos sitios en periodontitis agresiva localizada. La prevalencia y proporción de Porhyromonas gingivalis se correlaciona con la severidad de la pérdida de inserción clínica. Estos microorganismos se identificaron con el método RCP. En el estudio de Takeuchi10 no se confirma la alta prevalencia de A actinomicetemcomytans en pacientes con periodontitis agresiva generalizada o localizada, acorde con otros resultados similares obtenidos en investigaciones de China, Chile y Reino Unido y que contradicen otros estudios Norteamericanos y Europeos donde se asocia el A actinomicetemcomytans como el mayor periodontopatógeno presente en adolescentes y adultos jóvenes con periodontitis agresiva.2
Gajardo (2005),2 en su estudio determinó la prevalencia de 8 periodontopatógenos que fueron identificados y encontró que C rectus, P gingivalis, E corrodens, Camnocythophaga species fueron las mas predominantes en periodontitis agresiva en Chile pero solamente se presentaron diferencias estadísticamente significativas entre periodontitis agresiva y P crónica. El A actinomicetemcomytans fue menos prevalente que la Porphyromana gingivalis (33%) y menos prevalente en la periodontitis agresiva que en la crónica; que coinciden con los estudios de Jung-Wook Lee (2003)11 y Takeuchi (2003)10 Trevilatto en el 2002 reportó el perfil genético, microbiológico y clínico de una familia con periodontitis agresiva en Brasil en este estudio las bacterias más frecuentemente encontradas fueron Bacteroides forsythus (Tanerella forsythensis) y Treponema dentícola (45%), se encontró también Porphyromona gingivalis, Prevotella intermedia, Prevotella nigrescens, y A actinomicetemcomytans en bajas proporciones. Esto último puede cuestionar la validez del análisis microbiológico para diagnosticar esta enfermedad, y sugiere la tendencia de las últimas investigaciones donde se cuestiona el A actinomicetemcomytans como periodontopatógeno más frecuente de la periodontitis agresiva.11
Los resultados obtenidos en los artículos descritos previamente difieren con los obtenidos en la presente investigación donde las bacterias más frecuentemente halladas en la periodontitis agresiva fueron: Veilloneilla species, Fusobacterium nucleatum, Peptostreptococcus prevotii, Staphylococcus saccharaliticus y Bacteroides ureolyticus.
Con relación al comportamiento de las bacterias aisladas frente a la amoxicilina y amoxicilina/ácido clavulánico, se puede anotar que un incremento en la prevalencia de la resistencia antibiótica en la microbiota periodontal puede atribuirse al incremento al uso de antibióticos en odontología. Si bien frente a la resistencia a la amoxicilina se usa amoxicilina/ácido clavulánico, dos de las bacterias aisladas en este estudio fueron resistentes a las dos formas de presentación del antibiótico. Llama la atención debido a que el ácido clavulánico no tiene actividad antimicrobiana y su uso se debe a la mayor afinidad de las ß-lactamasas por él lo cual protege a la amoxicilina de la hidrólisis del anillo ß- lactámico.
In vivo muchas teorías han intentado explicar la incrementada resistencia observada en el biofilm bacteriano. Una simple explicación sugiere que el agente antimicrobiano no puede penetrar, o infiltrar, la profundidad del biofilm maduro. Por lo tanto la concentración inhibitoria adecuada nunca alcanza las micro-colonias bacterianas localizadas en la matriz del biofilm.9
El crecimiento de las bacterias en el biofilm es muy diferente al crecimiento de un cultivo en un tubo de ensayo o en un plato de agar. En el Biofilm los nutrientes son limitados y el crecimiento es mucho más lento. Adicionalmente el biofilm protege sus residentes de las fuerzas internas y externas. Las fuerzas internas incluyen productos tóxicos como el acido láctico el cual normalmente baja el pH e inhibe el crecimiento de muchas bacterias. Las fuerzas externas incluyen la respuesta inmune del huésped y la presencia de químicos tóxicos tales como antibióticos y otros antimicrobianos. Existe la hipótesis que las bacterias en un biofilm subgingival son considerablemente más resistentes a los antibióticos que las mismas bacterias que crecen en un cultivo.9
Una teoría alterna propone que las bacterias susceptibles pueden ser protegidas del efecto de un antibiótico por otras bacterias resistentes o sus productos, por ejemplo betalactamasa. Altos niveles de ß-lactamasa han sido observados en bolsas periodontales. Esta combinación con la resistencia innata del biofilm subgingival puede explicar la pérdida de eficacia observada con la amoxicilina, aún con la combinación con acido clavulónico. Este incremento del nivel de la enzima es probablemente suficiente para proteger de la penicilina tanto a los microorganismos que la producen como los que no. Sin embargo la mayoría de los mecanismos de la resistencia antibiótica en la flora oral no comprometen enzimas inactivantes, sino determinantes genéticos que afectan la capacidad del antibiótico para entrar a la célula bacteriana o para interferir con la adhesión del antibiótico.9
Los altos niveles de medicamentos obtenidos por vía local pueden eliminar o severamente suprimir la microflora benéfica normal y como resultado el sitio ser colonizado por bacterias altamente resistentes con potencial patogénico.5
Finalmente, es preciso señalar la importancia del papel del sistema inmune en los procesos salud-enfermedad, de allí que cabe preguntarse: ¿Es en realidad la periodontitis Agresiva una enfermedad de carácter infeccioso? O la investigación en periodoncia a futuro debe profundizar hacia la relación de la enfermedad con el sistema inmune? Al respecto, Holmustrup P (2002)9 afirma que la inmunodeficiencia debe ser sospechada en pacientes que exhiben inflamación o destrucción periodontal que parece desproporcionada con el grado de irritantes locales, como es el caso de la periodontitis agresiva.
Conclusiones
Se encontraron bacterias resistentes a la amoxicilina y a la amoxicilina/ácido clavulánico. Las bacterias aisladas de placa subgingival de pacientes con periodontitis agresiva localizada y generalizada hacen parte de los complejos microbianos descritos por Socransky.
Referencias
1. Socransky SS, Haffajee AD, Cugini MA, Smith C, Kent RL. Microbial complexes in subgingival plaque. J Clin periodontal 1998; 25:134-144. [ Links ]
2. Gajardo M, Silva N, Gómez L, León R, Parra B, Contreras A, Gamond J. Prevalence of periodontopathic bacteria in aggressive periodontitis patients in a Chilean population. J Periodontol 2005;76: 289-294. [ Links ]
3. Walter CB, Karpinia K, Baehni P. Chemotherapeutics: antibiotics and other antimicrobials. Periodontology 2000 2004; 36: 146-165. [ Links ]
4. Craig X A, Guthmiller JM, Cummings HE, Shomberg LL, Noorani SN. Molecular analysis or Peptostreptococcus micros isolates from patients with periodontitis. J Periodontol 2001;72: 877 - 882. [ Links ]
5. Walker C, Godowski K C, Borden L. The effects of sustained release doxicycline on the anaerobic flora and antibiotic-resistant patterns in subgingival plaque and saliva. J Periodontol 2000;71: 768-774. [ Links ]
6. Sutter VL. Pruebas de susceptibilidad para anaerobios. En: Lennette EH. Manual de Microbiologìa Clínica. Buenos Aires: Editorial Médica Panamericana. 1989. [ Links ]
7. Takeuchi Y, Umeda M, Ishizuka M, Huang Y, Ishikaua I. Prevalence of periodontopathic bacteria in aggressive periodontitis patients in Japanese population. J Periodontol 2003;74: 1460 -1469. [ Links ]
8. Mombelli A, Casgni F, Madianos PN. Can presence or absence of periodontal pathogens distinguish between subjects with chronic and aggressive periodontitis? A systematic review. J Clin Periodontol 2002; 29(3): 10-21. [ Links ]
9. Holmustrup P, Glick M. Treatment of periodontal disease in the inmunodeficient patient. Periodontol 2000. 2002;28:190-205. [ Links ]
10. Takeuchsi Y, Umeda M, Ishizuka M, Huang Y, Ishikawa I. Prevalence of periodontopatic bacteria in aggressive periodontitis patients in Japanese population. J Periodontol 2003;74(10): 1470-1479. [ Links ]
11. Lee JW, Choi BK, Yoo YJ, Choi SH, Cho KS, Chai JK, Kim CK. Distribution of periodontal pathogens in Korean aggressive periodontitis. J Periodontol 2003; 74: 1329 - 1335. [ Links ]
12. Trevilatto PC, Tramontina VA, Machado MA, Congalves RV, Sallum AW, Line SR. Clinical, genetic and microbiological findings in a Braziliam family with aggressive periodontitis. J clin Periodontol 2002; 29(3): 233-239. [ Links ]
Correspondencia:
Juan Alberto Aristizabal Hoyos: jarisiti@autonoma.edu.co
Laura Catalina Cataño Velásquez: diseoral@yahoo.com
Jairo Hernando Sanabria Matiz: jhmatiz@hotmail.com
Jorge Hernán Henao Palacio: jorgehenao@hotmail.com
Dora Cardona Rivas: dcrivas@autonoma.edu.co













