Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
CES Odontología
Print version ISSN 0120-971X
CES odontol. vol.27 no.2 Medellìn July/Dec. 2014
Estabilidad de los miniimplantes en Ortodoncia. "Biología ósea y Biomecánica"
Miniimplant stability in Orthodontics. "Bone Biology and Biomechanics"
Daniela Cadavid,1 Laura Duque,2 Santiago Correa,3 Peter H. Buschang,4 Samuel Roldan5
1Odontóloga Universidad CES, Medellín-Colombia. E-mail: cadavid.daniela@gmail.com.
2Magister en Ingeniería, Ingeniera de Diseño de Producto, Investigadora Grupo de Investigación en Bioingeniería GIB (CES-EAFIT), Medellín-Colombia. E-mail: lauris.duque07@gmail.com.
3PhD, Director del Grupo de Investigación en Bioingeniería GIB (CES-EAFIT), Profesor Ingeniería de Diseño de Producto Universidad EAFIT. Medellín-Colombia. E-mail: scorrea5@eafit.edu.co.
4PhD, Profesor y Director Investigación de Ortodoncia. Texas A8M University, Baylor College of Dentistry, Dallas, Texas, EUA. E-mail: phbuschang@bcd.tamhsc.edu.
5Director Centro de Investigación en Crecimiento y Desarrollo Craneofacial, CIC8D-CF. Investigador Grupo de Investigación en Bioingeniería GIB (CES-EAFIT). Profesor Asistente Universidad CES. Medellín-Colombia. E-mail: sroldan@une.net.co
Forma de citar: Cadavid D, Duque L, CorreazS, Buschang PH, Roldán S. Estabilidad de los miniimplantes en Ortodoncia. Biología ósea y Biomecánica. Rev CES Odont. 2014; 27(2) pág 93-103
Recibido: abril de 2014. Aprobado: noviembre de 2014
Resumen
El anclaje ha sido un aspecto crucial para la mayoría de los tratamientos de Ortodoncia. En las últimas dos décadas, el anclaje con miniimplantes ha aumentado el espectro de posibilidades para muchos tipos de tratamientos por presentar numerosas ventajas y pocas desventajas. Este artículo pretende hacer una revisión de literatura sobre los mecanismos de la biología ósea básica, como los aspectos mecánicos los activan y modulan; como se genera la estabilidad primaria y secundaria, como incide de manera crítica el porcentaje de éxito con el uso de los miniimplantes y como se ha estudiado esta interrelación por medio de modelos con elementos finitos.
Palabras clave: Miniimplantes, Oseointegración, Estabilidad primaria, Estabilidad secundaria, Análisis de elementos finitos, Biomecánica.
Abstract
Anchorage is crucial in most orthodontic treatments. During the last two decades, anchorage with mini-screw implants has increased the number of possibilities for many different types of orthodontic treatments. The aim of this paper is to present a literature review regarding how bone biology processes are elicited and modulated; how primary and secondary stability influence the success rate when mini-screw implants are used; and how this relation has been studied by means of the finite element method.
Key words: Mini-screw implants, Osseo-integration, Primary stability, Secondary stability, Finite element methods biomechanics.
Introducción
En la mayoría de los tratamientos de Ortodoncia el anclaje ha sido de vital importancia. En la actualidad se conocen diferentes tipos de anclajes tanto extraorales como intraorales (1). A pesar de su eficiencia, estos anclajes tienen algunas limitaciones, como la colaboración del paciente, pues es indispensable su uso en el tiempo y frecuencia para alcanzar los objetivos propuestos; además, los movimientos indeseados son limitaciones que en ocasiones ocurren en estos esquemas de anclajes tradicionales. Durante años se han buscado anclajes que no produzcan dichos movimientos y que no dependan de la cooperación del paciente. Es por eso que se crean los anclajes absolutos o esqueléticos y es en este tipo de anclajes donde se encuentran los miniimplantes (2).
Los miniimplantes tienen numerosas ventajas como su tamaño pequeño, facilidad de colocación, disminución del tiempo del tratamiento bajo costo, pocos movimientos indeseados y bajo riesgo tanto en la colocación como al retirarlos (2). Sin embargo, presentan algunas complicaciones como por ejemplo, inflamación alrededor del tejido blando del miniimplante, la mayoría de veces se presenta por la mala higiene oral (3), fracturas principalmente en el cuello del miniimplante cuando la fuerza que se ejerce es mayor a la que puede resistir el mismo y por último, en algunos casos hay que esperar un tiempo prudente para la cicatrización de tejidos óseos y blandos para colocar una carga en los miniimplantes (4).
Con respecto a las aplicaciones clínicas de los miniimplantes, estas pueden ser divididas en aplicaciones generales y/o específicas. La indicación general es para pacientes que requieran anclaje esquelético que presentan movimientos dentales asimétricos considerados como complejos o difíciles y pacientes no colaboradores donde no se puedan utilizar anclajes tradicionales. Y las indicaciones específicas serian: impactación posterior, intrusión o extrusión de uno a varios dientes, restusión de incisivos o caninos, cierre de espacios edéntulos, distalización, enderezamiento y mesialización molar.
Con el presente artículo se busca correlacionar los aspectos clínicos con la evidencia actual sobre como los mecanismos biológicos óseos se activan y modulan con los eventos mecánicos; como se genera la estabilidad primaria y secundaria, como incide de manera crítica el porcentaje de éxito con el uso de los miniimplantes y como se ha estudiado esta interrelación con modelos de elementos finitos
Biologia y cicatrización osea
Los ortodoncistas necesitan conocer a profundidad la biología del tejido óseo ya que de esta dependen los movimientos dentales. Conocer como las diferentes cargas que se aplican al hueso influyen en la proliferación, diferenciación y metabolismo celular, es crucial para la adaptación, regeneración y alteración de la morfología ósea (5). Es importante resaltar que el hueso es anisotropico, no homogéneo y que debido a esto las propiedades mecánicas varían entre el hueso cortical y el esponjoso, por ejemplo el hueso cortical presenta unos espacios de porosidad entre un 5-10% mientras que el hueso esponjoso presenta una porosidad del 30-90%, lo cual claramente afecta la rigidez (6).
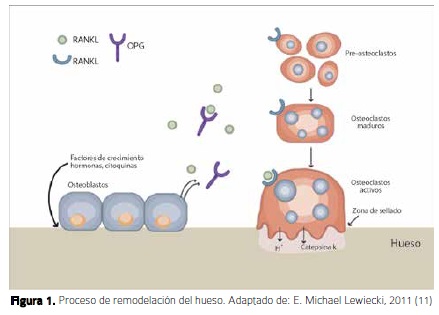
La oseointegración, la estabilidad primaria y la secundaria, son conceptos importantes respecto de cómo la biología ósea determina la viabilidad de los implantes. Branemark (1985) (7), definió la oseointegración como la unión estructural y funcional entre el hueso y una superficie no biológica, en este caso el miniimplante. Histológicamente esta definición es descrita como la formación de hueso en la superficie del implante sin ninguna formación de tejido fibroso (8), lo que clínicamente se conoce como anquilosis. En el momento de colocar el miniimplante, se crea una inducción para formar hueso en el sitio quirúrgico debido a una alteración celular asociada a un microtrauma y microfracturas (9), lo cual produce la osteoconducción y osteoinducción que desencadena diversos procesos para que los osteoblastos produzcan la matriz ósea (8). Para que esto ocurra, es necesario activar las BMU's (de la sigla en inglés: unidades básicas multicelulares), estas constituyen morfológica y funcionalmente el tejido oseo, contienen todos los elementos necesarios para su remodelado y actúan de forma integrada y secuencial con la participación de los osteoclastos y osteoblastos (10). Las BMU's son unas unidades altamente especializadas que se van a convertir en osteoclastos para remodelar el hueso y luego osteoblastos para producir nuevo hueso, este proceso es un estereotipo activación-reabsorción-formación (ARF). Por otro lado, las micro fracturas van a generar el proceso de apoptosis en algunas células óseas, principalmente osteocitos, que liberan prostaglandinas y citoquinas para que finalmente se dé la remodelación ósea. Una vez este proceso termine, empieza a actuar la cascada de la coagulación y la cicatrización reduciendo así la actividad osteoclastica debido a dos sucesos: primero, que los osteoblastos que están conectados con los osteocitos por medio de uniones celulares crean una adhesión de moléculas impidiendo la llegada de los osteoclastos al sitio quirúrgico, y segundo, las citoquinas producen el RANKL ligando (ligando de receptor activador para el factor nuclear k B), y como el preosteoclasto en sangre tiene los receptores RANK, al juntarse van a inducir al osteoblasto a producir OPG (Osteoprotegerin) inhibiendo la diferenciación y activación del osteoclasto. En otras palabras, el RANK y el OPG compiten para unirse con el RANKL (Figura 1) (11). Una vez terminado este proceso llegan las BMU's y empiezan a formar el hueso según el estereotipo ARF, lo cual es fundamental para controlar la reabsorción ósea (12-14).
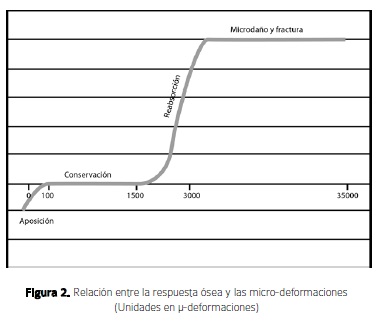
Como factor adicional, un segundo efecto mecánico interviene en estos procesos biológicos; al cargase el mini implante, se va a crear un segundo mensaje mecánico que induce una respuesta ósea, es decir, la carga va a determinar la deformación del hueso, que está dada por las fuerzas de compresión y de tensión que a su vez inducen una respuesta biológica donde la respuesta inicial del osteoblasto se va a generar a partir de los 3.92 GPa (8,15). Después de este punto se produce un daño a la estructura ósea que va a aumentar la porosidad ósea reduciendo la dureza y la resistencia del hueso (13,16), en otras palabras, el hueso solo acepta una cantidad de carga moderada. Según Frost, una carga soportable para el hueso es de 1-2MPa que equivalen a 50-100 micro-deformaciones (uE). Se produce daño a 60MPa que equivale a 4000u y fractura inmediata a los 120MPa que son 25,000uE (13,14). Recientemente Yadav et al. 2012 (12), en un estudio en el que se evaluó la acumulación de microfracturas y el porcentaje de éxito cuando se colocaban miniimplantes autoperforantes y autoroscantes y se compararon con los que se hacía agujero piloto, se encontró que en el primer grupo había mayor cantidad y profundidad de microfracturas y un mayor porcentaje de éxito. Esto parece estar de acuerdo con que estos mayores niveles de esfuerzo y de microfracturas producen daño estructural leve en el hueso, que a su vez produce señales que inducen una mayor actividad de las BMU's, lo que produce un inicio más rápido de los procesos relacionados con la cicatrización secundaria y por tanto, mayor probabilidad de retención del miniimplante en posición (Figura 2).
Estabilidad primaria y secundaria
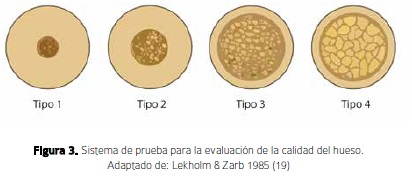
La estabilidad primaria es la estabilidad mecánica que se genera por la comprensión mecánica del hueso cuando entra en contacto con el miniimplante y es el resultado del proceso de inserción, la cual es generalmente alta pero puede ser afectada por múltiples factores, como la madurez y calidad del hueso en el que se coloca, el grosor de la cortical, las micro vibraciones que induce el operador, la desinserción del destornillador y el procedimiento de carga, entre otros (17). Se debe tener presente que esta estabilidad mecánica o primaria disminuye con el tiempo y según Sennerby 1998 (18), depende del contacto directo entre el hueso y la superficie del implante. Esta también depende del tipo de hueso que se presenta, según la literatura hay cuatro tipos de hueso. Hueso tipo I: es un hueso compacto homogéneo con poca irrigación. Tipo II: Espesa capa de hueso compacto rodeando un núcleo de hueso trabecular. Tipo III: Fina cortical, núcleo esponjoso denso y en estos tres tipos de hueso se puede obtener una buena estabilidad primaria. Caso contrario con el hueso tipo IV: cortical delgada y núcleo esponjoso de baja densidad (19), donde Jaffin y Berman, 1991 (20), reportaron un 35% en fallas de los implantes en este tipo de hueso (Figura 3).
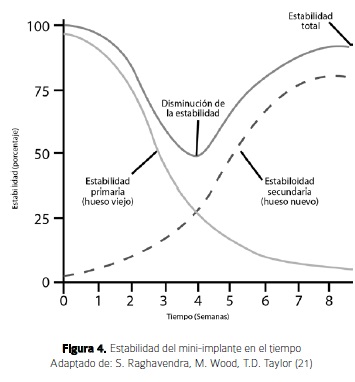
Por otro lado se encuentra la estabilidad biológica o secundaria, la cual inicia con la cascada de eventos mencionados arriba inmediatamente después de la colocación del implante y aumenta a medida que comienza la remodelación o cicatrización ósea que se conoce como estabilidad secundaria. La estabilidad primaria empieza a caer de manera progresiva y es reemplazada por la estabilidad secundaria. Esta transición ocurre durante un período de 8 semanas aproximadamente y tiene su nivel más bajo, en términos de resistencia mecánica y estabilidad hacia el final de la 4a semana después de la colocación del implante, donde se crea un periodo crítico para la estabilidad del mismo. Es por esto que es más conveniente cargar el miniimplante de manera inmediata, o de lo contrario convendría esperar a que se consolide hueso nuevo y que la estabilidad secundaria provea la rigidez necesaria para el uso del miniimplante como anclaje. Al final, la suma de las dos estabilidades es lo que mantiene en si la estabilidad del implante durante estos primeros meses (Figura 4) (21). En el hueso cortical humano las BMUs se tardan 120 días para atravesar un plano dejando una nueva osteona atrás. Aproximadamente se pueden gastar 20 días en aumentar el diámetro de la cavidad de reabsorción seguido de 10 días de quiescencia y finalmente 90 días de deposición centrípeta de matriz ósea (13).
Biomecánica y estudios con elementos finitos
Debido a la importancia que han adquirido los miniimplantes dadas las nuevas posibilidades de control que ofrecen en los tratamientos de Ortodoncia, el entender como estos auxiliares afectan la biomecánica y como este factor puede explicar, al menos en parte, su sobre vida, se hace fundamental el estudio de esta variable. El análisis por elementos finitos, a diferencia de las radiografías o tomografías que solo ayuda a planear el sitio de ubicación del miniimplante (22), permite determinar la distribución y trayectoria de los esfuerzos así como su magnitud, tanto internamente como en el hueso circundante cuando se aplica una carga (23). Los análisis por elementos finitos simulan numericamente una condición dada que permite cuantitficar el comportamiento de una estructura. Este permite establecer el tipo y magnitud de los esfuerzos y deformaciones y así explicar como se puede afectar el comportamiento biológico y de esta manera entender los resultados clínicos obtenidos (6). Son simulaciones en computador en las que se divide una estructura 3D en múltiples elementos que se conectan por medio de nodos para su análisis (24). A dicho modelo se le asignan restricciones teniendo en cuenta las condiciones de contorno definidas para el análisis específico y las fuerzas o intervención clínica que se pretende simular (23,25,26). Este tipo de evaluación es aplicada en muchos campos como ingenierías, mecánica, biomédica, medicina y odontología (23,2527). Otro factor importante en este tipo de simulaciones son las propiedades de los materiales que constituyen el modelo, las cuales dependiendo de la información de la que se disponga puede afectar dramáticamente los resultados. Es así como en el caso de simulaciones de situaciones clínicas en humanos es importante tener en cuenta que la mayoría de los tejidos son de tipo ortotrópico (23). Finalmente, se debe resaltar que los modelos realizados por elementos finitos deben ser validados por trabajos experimentales ya sea clínicos o invitro (28).
Cuando se pretende establecer patrones de deformación y las magnitudes de los esfuerzos para aportar información sobre cómo es la biología ósea en diversas situaciones de carga de los miniimplantes, las propiedades mecánicas asignadas al hueso son críticas. Se sabe que en los primeros años de vida el hueso es de tipo reticular y por tanto isotrópico, pero este luego se vuelve laminar y en consecuencia posee propiedades mecánicas en los tres planos del espacio (29). Así mismo, cuando se hace este tipo de estudios es importante diferenciar no solo morfológicamente, sino también asignar valores específicos de las propiedades mecánicas al hueso cortical y esponjoso, pues tienen características ortotrópicas e isotrópicas, respectivamente, lo cual produce resultados diferentes en las simulaciones con elementos finitos (30).
Se han realizado varios estudios con elementos finitos para evaluar diferentes condiciones, como para optimizar los diseños de los miniimplantes con titanio o acero (31). Singh y cols. (2012) modelaron miniimplantes donde se muestra que la mayor concentración de esfuerzos se da en la parte coronal del miniimplante con un doblamiento en el cuello del mismo sin esfuerzos ni deformaciones en apical. Sin embargo, la geometría del miniimplante se obtuvo con un microscopio y se asignaron propiedades isotrópicas asumiendo que la estructura ósea era homogénea y lineal. Para evaluar el efecto de la angulación en la que se colocan los miniimplantes cuando se hace la retracción de caninos en maxilar y mandíbula, Jasmine et al., (2012) (32) a partir de una tomografía, crearon modelos en elementos finitos y observaron que los mayores esfuerzos se concentraron principalmente en el cuello del implante y que los valores de esfuerzos eran más bajos con la fuerza a 90° del eje del miniimplante lo cual reduciría los niveles de esfuerzos a nivel óseo y por tanto incrementar su estabilidad. En este estudio no se registró ningún esfuerzo en la zona apical y también se modeló el hueso de forma isotrópica. Así mismo, Suzuki, et al., (2011) (33) evaluaron angulaciones de 30°, 40°, 45°, 50°, 60° 70° 80° 90° aplicándoles una fuerza de 2N que equivalen aproximadamente a 200 gr y encontraron que los implantes colocados con angulaciones entre 45° y 80° presentaban los valores más altos, los cuales superan los valores que, de acuerdo con Frost (1988) (16) podrían provocar problemas óseos, mientras que los miniimplantes con angulaciones menores a 45° o iguales a 90° presentan unos rangos aceptables de esfuerzos para que se genere una respuesta ósea adecuada. Pickard et al., (2010) (34), evaluaron los efectos de la angulación del miniimplante con respecto a la fuerza de tracción y encontraron que entre más cerca se encuentre la fuerza aplicada al eje longitudinal del implante esta será mayor.
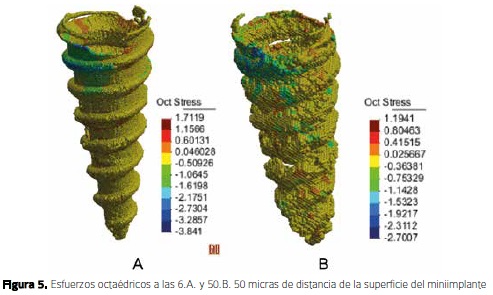
Recientemente, Duque et al. (2012) (35), con un modelo a partir de una microtomografía, por medio de elementos finitos, evaluaron los esfuerzos y deformaciones a nivel óseo cuando se cargaba un miniimplante (36). Encontraron la mayor concentración de esfuerzos en el cuello del miniimplante y no se observaron esfuerzos en la zona apical, lo cual está de acuerdo con los estudios previos con elementos finitos (31-33) pero no con los estudios histomorfometricos (3,14). Adicionalmente, se encontró que en la capa de hueso más cercana al miniimplante (6 micras), los valores de esfuerzos compresivos fueron de 3.8 MPa y en la más externa (50 micras) de 2.7 MPa (36) (Figura 5). Estos valores se encuentran dentro del rango que inducirían una respuesta de aposición y remodelado óseo (16). Sin embargo, estas conclusiones deben ser tomadas con cautela debido a que la malla del modelo no pudo ser validada debido a su gran tamaño, al igual que en los estudios citados; adicionalmente, en las otras investigaciones, el hueso cortical se modeló de forma isotrópica y no se reportan de manera clara la forma como se modeló la interfase miniimplante-hueso.
Conclusiones
La estrecha interacción entre los esfuerzos, ya sea funcionales, parafuncionales o patológicos y la biología ósea ha sido motivo de estudio desde hace mucho tiempo; sin embargo, es reciente el hecho que esta interrelación está cobrando más relevancia. Esto posiblemente se debe a que tanto las técnicas para evaluar la biología ósea como las nuevas herramientas de modelamiento, están permitiendo esclarecer los mecanismos por medio de los cuales se activan los diversos procesos biológicos y por tanto, se pueden proponer técnicas y dispositivos que permitan optimizar los tratamientos actuales y realizar otros que anteriormente debían ser acompañados de procedimientos altamente invasivos.
References
1. Proffit W, Sarver D, Fields H. Contemporary Orthodontics. 4th Ed. Mosby Elsevier; 2006. [ Links ]
2. Buschang PH, Carrillo R, Rossouw PE. Orthopedic correction of growing hyperdivergent, retrognathic patients with miniscrew implants. J Oral Maxillofac Surg [Internet]. 2011 Mar [cited 2012 Apr 27];69(3):754-62. Available from: http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=304630l8tool=pmcentrez8rendertype=abstract. [ Links ]
3. Ikeda H, Rossouw PE, Campbell PM, Kontogiorgos E, Kontogirogos E, Buschang PH. Three-dimensional analysis of peri-bone-implant contact of rough-surface miniscrew implants. Am J Orthod Dentofacial Orthop [Internet]. 2011 Feb [cited 2012 Apr 27];139(2):e153-63. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21300226. [ Links ]
4. Morais LS, Serra GG, Muller CA, Andrade LR, Palermo EFA, Elias CN, et al. Titanium alloy mini-implants for orthodontic anchorage: immediate loading and metal ion release. Acta Biomater [Internet]. 2007 May [cited 2012 Apr 27];3(3):331-9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/17257912. [ Links ]
5. Rey J, Corredor C, Godoy M, Perdomo S, Ospino B. Carga Mecánica como Regulador de la Osteogénesis en Células Madre Mesenquimales Humana. Rev Fac Med Univ Nueva Granada. 2012;20:27-34. [ Links ]
6. Cano J, Campo J, Palacios B, Bascones A. Mecanobiología de los huesos maxilares: I. Conceptos generales. Av Odontoestomatol [Internet]. Ediciones Avances, S.L.; 2007 Dec [cited 2014 Apr 7];23(6):347-58. Available from: http://scielo.isciii.es/scielo.php?script=sci_arttext8pid=S0213-128520070006000028ln.g=es8nrm=iso8tlng=es. [ Links ]
7. Bránemark P-I, Zarb GA, Albrektsson T. Tissue-integrated prostheses: osseointegration in clinical dentistry [Internet]. Quintessence; 1985. Available from: http://books.google.com.co/books?id=sRJqAAAAMAAJ. [ Links ]
8. Albrektsson T, Johansson C. Osteoinduction, osteoconduction and osseointegration. Eur Spine J [Internet]. 2001 Oct [cited 2012 Apr 16];10 Suppl 2:S96-101. Available from: http://www.ncbi.nlm.nih.gov/pubmed/11716023. [ Links ]
9. Cooper LF. Biologic determinants of bone formation for osseointegration: clues for future clinical improvements. J Prosthet Dent [Internet]. 1998 Oct [cited 2012 Apr 27];80(4):439-49. Available from: http://www.ncbi.nlm.nih.gov/pubmed/9791791. [ Links ]
10. Neyro Bilbao J, Cano Sánchez A, Palacios Gil-Antuñano S. Regulación del metabolismo óseo a través del sistema RANK-RANKL-OPG. Rev Osteoporos Metab Min. 2011;3(2):105-112. [ Links ]
11. Lewiecki EM. New targets for intervention in the treatment of postmenopausal osteoporosis. Nat Rev Rheumatol [Internet]. 2011 Nov [cited 2013 Nov 26];7(11):631-8. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21931340. [ Links ]
12. Yadav S, Upadhyay M, Liu S, Roberts E, Neace WP, Nanda R. Microdamage of the cortical bone during mini-implant insertion with self-drilling and self-tapping techniques: a randomized controlled trial. Am J Orthod Dentofacial Orthop [Internet]. 2012 May [cited 2012 Sep 3];141(5):538-46. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22554747. [ Links ]
13. Robling AG, Castillo AB, Turner CH. Biomechanical and molecular regulation of bone remodeling. Annu Rev Biomed Eng [Internet]. 2006 Jan [cited 2013 Nov 9];8:455-98. Available from: http://www.ncbi.nlm.nih.gov/pubmed/16834564. [ Links ]
14. Massey CC. The effect of force on dentoalveolar bone adaptation around miniscrew implantsa three-dimensional microcomputed tomography study. Texas A8M University System Health Science Center; 2010. p. 95. [ Links ]
15. Burr DB, Schaffler MB, Yang KH, Lukoschek M, Sivaneri N, Blaha JD, et al. Skeletal change in response to altered strain environments: is woven bone a response to elevated strain? Bone [Internet]. 1989 Jan [cited 2013 Nov 16];10(3):223-33. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2803857. [ Links ]
16. Frost HM. The biology of fracture healing. An overview for clinicians. Part I. Clin Orthop Relat Res [Internet]. 1989 Nov [cited 2013 Dec 2];(248):283-93. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2680202. [ Links ]
17. Tabassum A, Meijer GJ, Wolke JGC, Jansen JA. Influence of surgical technique and surface roughness on the primary stability of an implant in artificial bone with different cortical thickness: a laboratory study. Clin Oral Implants Res [Internet]. 2010 Feb [cited 2013 Dec 2];21(2):213-20. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20070754. [ Links ]
18. Sennerby L. The relationship between reliable diagnostics and safe, successful dental implant procedures. The Implant Stability Quotient Whitebook. 1st ed. 1998. [ Links ]
19. Lekholm U, Zarb G, Albrektsson T. Patient selectino and preparation. Tissue integrated prostheses. Chicago: QUINTESSENCE PUBLISHING CO, INC; 1985. p. 199-209. [ Links ]
20. Jaffin RA, Berman CL. The excessive loss of Branemark fixtures in type IV bone: a 5-year analysis. J Periodontol [Internet]. 1991 Jan [cited 2013 Dec 2];62(1):2-4. Available from: http://www.ncbi.nlm.nih.gov/pubmed/2002427. [ Links ]
21. Raghavendra S, Wood MC, Taylor TD. Early wound healing around endosseous implants: a review of the literature. Int J Oral Maxillofac Implants [Internet]. 2005 [cited 2013 Dec 2];20(3):425-31. Available from: http://www.ncbi.nlm.nih.gov/pubmed/15973954. [ Links ]
22. Ammar HH, Ngan P, Crout RJ, Mucino VH, M. ukdadi OM. Three-dimensional modeling and finite element analysis in treatment planning for orthodontic tooth movement. Am J Orthod Dentofacial Orthop [Internet]. 2011 Jan [cited 2012 Apr 27];139(1):e59-71. Available from: http://www.ncbi.nlm.nih.gov/pubmed/21195258. [ Links ]
23. Garcia A, Correa S, Isaza JF, Duque L, Roldán S, Buschang PH. Procesamiento de imágenes y modelos FEM 3D de Mini-implantes para Ortodoncia a partir de uCT. VIII Congreso Colombiano de Métodos Númericos. Medellín; 2011. [ Links ]
24. Adams V, Askenazi A. Building Better Products with Finite Element Analysis [Internet]. OnWord Press; 1999. Available from: http://books.google.com.co/books?id=Mnv6qRz73x0C. [ Links ]
25. Castaño MC, Zapata U, Pedroza A, Jaramillo JD, Roldán S. Creation of a three-dimensional model of the mandible and the TMJ in vivo by means of the finite element method. Int J Comput Dent [Internet]. 2002 [cited 2013 Dec 2];5(2-3):87-99. Available from: http://www.ncbi.nlm.nih.gov/pubmed/12680039. [ Links ]
26. Roldán S, Zapata U. Análisis con elementos finitos del efecto de la terapia con mentonera sobre la mandíbula y la articulación temporomandibular. Rev Latinoam Ortod. 2003;2(4):27-32. [ Links ]
27. Calao F. EM, Vázquez ML, Becerra Santos F, Ossa S. J, Enríquez G. C, Fresneda B. E. The finite elements method and its application to dental research. Rev Fac Odontol Univ Antioq [Internet]. [cited 2013 Dec 2];11(1):44-9. Available from: http://bases.bireme.br/cgi-bin/wxislind.exe/iah/online/?IsisScript=iah/iah.xis8src=google8base=LILACS8lang=p8nextAction=lnk8exprSearch=2645258indexSearch=ID. [ Links ]
28. Garzón Alvarado DA. Análisis por elementos finitos del proceso de regeneración ósea. Bogotá: Universidad Nacional de Colombia; 2004. [ Links ]
29. Lalegname A, Sfer D, Etse G. Análisis micromecánico de huesos. Idelsohn SR, Sonzogni VE, Cardona A, editors. Mecánica Computacional. Santa Fe-Paraná, Argentina: Centro de Métodos Numéricos y Computacionales en Ingeniería; 2002. [ Links ]
30. Zapata U, Roldán S. Modelación matemática de estructuras craneofaciales. In: Müller-Karger C, Cerrolaza M, editors. Bioingeniería en Iberoamérica: Avances y Desarrollos. Barcelona: CIMNE; 2003. p. 493-516. [ Links ]
31. Singh S, Mogra S, Shetty VS, Shetty S, Philip P. Three-dimensional finite element analysis of strength, stability, and stress distribution in orthodontic anchorage: a conical, self-drilling miniscrew implant system. Am J Orthod Dentofacial Orthop [Internet]. 2012 Mar [cited 2012 Sep 10];141(3):327-36. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22381493. [ Links ]
32. Jasmine MIF, Yezdani AA, Tajir F, Venu RM. Analysis of stress in bone and microimplants during en-masse retraction of maxillary and mandibular anterior teeth with different insertion angulations: a 3-dimensional finite element analysis study. Am J Orthod Dentofacial Orthop [Internet]. 2012 Jan [cited 2012 Sep 10];141(1):71-80. Available from: http://www.ncbi.nlm.nih.gov/pubmed/22196187. [ Links ]
33. Suzuki A, Masuda T, Takahashi I, Deguchi T, Suzuki O, Takano-Yamamoto T. Changes in stress distribution of orthodontic miniscrews and surrounding bone evaluated by 3-dimensional finite element analysis. Am J Orthod Dentofac Orthop [Internet]. 2011 [cited 2013 Oct 8];140(6):e273-e280. Available from: http://www.sciencedirect.com/science/article/pii/S0889540611007232. [ Links ]
34. Pickard MB, Dechow P, Rossouw PE, Buschang PH. Effects of miniscrew orientation on implant stability and resistance to failure. Am J Orthod Dentofacial Orthop [Internet]. 2010 Jan [cited 2012 Apr 27];137(1):91-9. Available from: http://www.ncbi.nlm.nih.gov/pubmed/20122436. [ Links ]
35. Duque L, Correa S, Roldán S. Esfuerzos y Micro-deformaciones del hueso trabecular alrededor de un Mini-implante: Estudio de elementos finitos basado en una micro-tomografía. Universidad EAFIT; 2012. [ Links ]