Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO -
 Similares em Google
Similares em Google
Compartilhar
CES Odontología
versão impressa ISSN 0120-971X
CES odontol. vol.28 no.2 Medellìn jul./dez. 2015
Aislamiento y capacidad de osteodiferenciación de las células madre provenientes del ligamento periodontal y pulpa dental
Isolation and osteodifferentiation capacity of dental pulp and periodontal ligament stem cells
Natalia Carrillo-Mendigaño1, Dabeiba Adriana García-Robayo2, Liliana Margarita Otero-Mendoza3
1 Ortodoncista, Estudiante posgrado Maestria en Ciencias Biológicas, Centro de Investigaciones Odontológicas Pontificia Universidad Javeriana. Bogotá, Colombia. E-mail: ncarrlllom@unal.edu.co
2 Bacteriologa, Doctorado en Ciencias Biológicas. Docente centro de Investigaciones Odontológicas Pontificia Universidad Javeriana. Bogotá, Colombia. E-mail: adrigaro@hotmail.com
3 Ortodoncista, Magister en Ciencias Biológicas, Doctorado en Ciencias Biológicas. Docente centro de Investigaciones Odontológicas Pontificia Universidad Javeriana. Bogotá, Colombia. E-mail: lotero@javeriana.edu.co
Forma de citar: Carrillo-Mendigaño N, García-Robayo DA, Otero-Mendoza LM. Aislamiento y capacidad de osteodiferenciación de las células madre provenientes del ligamento periodontal y pulpa dental. Rev. CES Odont 2015; 28(2): 20-34.
Recibido: abril de 2015. Aprobado: noviembre de 2015
Resumen
Introducción y objetivo:
Los tejidos dentales contienen células madre mesenquimales con diversas capacidades de diferenciación. El objetivo de este estudio fue comparar la capacidad de osteodiferenciación de células madre de pulpa dental y ligamento periodontal cultivadas con diferentes medios de osteodiferenciación.
Materiales y métodos:
Se obtuvieron 24 muestras de tejido pulpar y 30 de ligamento periodontal de terceros molares, se aislaron y se cultivaron con 5 condiciones diferentes de osteoinducción. La osteodiferenciación fue evaluada mediante RT-PCR y Rojo Alizarin.
Resultados:
Las células aisladas fueron caracterizadas mediante citometría de flujo. Se observó una mayor expresión de Colágeno tipo I para células de pulpa dental, mientras que las células de ligamento periodontal expresaron mayores niveles de RUNX2. Las células Madre de ligamento periodontal presentaron mejor perfil de osteodiferenciación cuando fueron cultivadas en el medio 5, mientras que las células madre extraídas de la pulpa dental presentaron mejores características de osteodiferenciación en el medio de cultivo 4. La única diferencia entre estos dos medios fue la concentración de 50uM de Ácido Ascórbico para el medio 5 y 200uM de Ácido Ascórbico para el medio 4.
Conclusiones:
Las células obtenidas de pulpa dental y ligamento periodontal mostraron características de células madre. La capacidad de osteodiferenciación de estas células fue dependiente de las concentraciones de los sustratos aplicados al cultivo.
Palabras Clave: Células madre, pulpa, ligamento, osteodiferenciación.
Abstract
Introduction and objective:
Dental tissues have mesenchymal stem cells with capacities to differentiate in several tissues. The aim of this research was to compare the ability of osteodifferentiation of stem cells isolated of dental pulp and periodontal ligament cultured with different media.
Materials and methods:
24 samples of pulp tissue and 30 samples of periodontal ligament were obtained of third molars. Stem cells isolated by the explant method were subjected to 5 osteodifferentiation conditions. Osteodifferentiation was evaluated by RT-PCR and Alizarin Red.
Results:
The isolated cells were characterized as stem cells by flow cytometer. Collagen type I showed the highest expression in dental pulp Stem Cells while Runx2 was increased in periodontal ligament Stem Cells. Medium 5 showed the best conditions for osteodifferentiation of periodontal ligament Stem cells while Dental pulp Stem Cells showed better osteogenic profile in medium 4. The unique difference between mediums 4 and 5 was the concentration of Ascorbic Acid 50um in medium 5 and 200um in medium 4).
Conclusions:
The cells obtained both pulp and ligament showed features of Stem Cells. The osteogenic capacity of cells was depending of the concentrations of the substrates applied.
Keywords: Stem cells , dental pulp, periodontal ligament, osteodifferentiation.
Introducción
En el mundo, las enfermedades musculoesquelé-ticas son la causa más común de dolor de larga duración y pérdida de habilidad, el tratamiento de estas condiciones representa en Estados Unidos un costo estimado de 269,3 billones de dólares por año (1). En países en desarrollo, como Colombia, entre 10 y 15 millones de personas al año sufren lesiones óseas, discapacidades o inhabilidades como consecuencia de accidentes de tráfico, muchos de los cuales suceden en gente joven.
Es por esta razón que los defectos óseos de gran magnitud, han representado un reto para la cirugía reconstructiva, particularmente aquellos causados por trauma o por defectos relacionados con infecciones. El uso de injertos de hueso autólogo ha sido considerado como el estándar de oro para el tratamiento de este tipo de defectos (2), sin embargo, este procedimiento tiene varias desventajas dentro de las que se incluyen la limitada cantidad de hueso disponible y la afección del sitio donador, además del alto grado de reabsorción del injerto autólogo, lo que hace necesario tomar cantidades adicionales de hueso para mejorar el éxito del procedimiento (3,4).
Recientemente la regeneración ósea por ingeniería de tejidos ha sido considerada como una alternativa a la técnica de injerto autólogo, las células madre mesenquimales (MSC) de origen humano, han sido estudiadas para este fin (5,6), debido a su múltiple potencial de diferenciación dentro del que se encuentra el linaje óseo.
Las MSC se caracterizan principalmente por su capacidad de adherirse al plástico en cultivo, expresión positiva de marcadores de membrana CD 105, CD73, CD90 y CD146 entre otros y ausencia de expresión de marcadores de superficie CD45, CD34, CD14, CD11b, CD79 (7). El marcador CD146 en las células madre se relaciona con diferencias en la localización in situ, siendo mayormente expresado en MSC localizadas en la región vascular (8).
La mayoría de las MSC investigadas tienen su origen en el tejido medular, sin embargo, su uso ha sido limitado por la injuria que el procedimiento de obtención genera en tejidos sanos, y por la cantidad reducida de tejido que puede ser extraída. Por tanto, se han identificado poblaciones de células madre obtenidas de tejidos alternativos como músculo, tejido adiposo, tejido conectivo (9), la pulpa dental y el ligamento periodontal (10). Las células madre de origen dental fueron aisladas inicialmente por Gronthos y col en el 2000 (11), posteriormente estas células fueron caracterizadas por expresar marcadores de membrana similares a los de otras MSC (12).
Adicionalmente, se ha reportado que las células madre provenientes de la pulpa poseen capacidad osteogénica y condrogénica, mientras que las células madre provenientes del ligamento periodontal tienen además la capacidad de diferenciarse en adipocitos (13). Estas características multipotentes y la posibilidad de tener un acceso relativamente sencillo a estas células, las convierten en un blanco atractivo para los estudios de diferenciación, particularmente hacia el linaje osteoblástico, en respuesta a las necesidades de alternativas terapéuticas para los defectos óseos orales (14).
En condiciones de cultivo, la diferenciación de las MSC hacia el linaje osteogénico ha sido ampliamente probada (15). Los suplementos más comunes para la diferenciación hacia el linaje óseo incluyen la dexametasona (glucocorticoi-de sintético que induce efectos transcripcionales de BSP (proteína morfogenica ósea)), el ácido ascórbico (requerido para la hidroxilación de residuos de lisina y prolina del colágeno y los b-gli-cerofosfatos) y suplemento necesario como fuente de fosfatos inorgánicos (3). Otros suplementos usados para la osteodiferenciación incluyen la melatonina por sus efectos sobre la expresión de proteínas como ALP (fosfatasa alcalina) y BSP en células madre (16). Sin embargo aún no se ha establecido la combinación óptima de condiciones de cultivo y administración de factores de crecimiento para dirigir la diferenciación celular (5). Se ha reportado que variaciones en la concentración de dexametasona pueden detener la diferenciación de las células madre hacia el linaje osteogénico y que el ácido ascórbico puede presentar variaciones debido a su inestabilidad en condiciones estándar de cultivo (3).
En esta forma surgen los siguientes interrogantes: ¿Existen diferencias en la respuesta de células madre de origen dental a diferentes medios de osteoinducción?, ¿Hay variaciones entre la diferenciación osteogénica de células madre aisladas de tejido pulpar y tejido periodontal?, ¿Existe diferencia entre el éxito de aislamiento de células madre de pulpa y ligamento periodontal en diversos es-tadíos de formación radicular? ¿Maniobras previas como la separación celular para células madre con microperlas Milteyi Biotec mejoran la recuperación de células madre obtenidas de ligamento y pulpa dental? La respuesta a estas preguntas ayudará a encontrar medios de diferenciación osteogénica más eficaces para el manejo de células madre provenientes de tejidos dentales. Este conocimiento permitirá en un futuro emplear esta alternativa para la regeneración tisular, ya que se considera que existe un gran potencial en esta área de investigación para resolver problemas clínicos que aquejan a la población general como los defectos óseos tanto en cavidad oral como en el resto del organismo.
Materiales y métodos
Población y muestra
La Población fue establecida como pacientes con indicación terapéutica de extracción de terceros molares que acudieron a la Clínica de cirugía de la Pontificia Universidad Javeriana.
Criterios de inclusión:
- Pacientes sistémicamente sanos
- Dientes sin enfermedad periodontal
- Dientes en cuyo procedimiento quirúrgico no haya sido necesaria la odontectomía
- Dientes con tejido pulpar y ligamento periodontal sano
- Dientes sanos con esmalte intacto
- Terceros molares con estadio radicular de nolla 8, 9 y 10
Criterios de exclusión:
- Pacientes fumadores de 6 o más cigarrillos día
- Pacientes menores de 13 años y mayores de 40 años
- Pacientes que estén consumiendo medicamentos o que hayan consumido medicamentos en los últimos tres meses
- Dientes en cuya exodoncia el instrumental (elevadores) haya alterado la integridad del ligamento periodontal
- Erosiones, atricción, bruxismo.
El universo de pacientes que acudieron a la consulta durante el periodo de recolección de la muestra fueron 150 pacientes, de estos, cumplieron con los criterios de inclusión previamente descritos (50 pacientes) de los cuales fueron tomadas 30 muestras.
Procedimiento de obtención de la muestra:
Antes de realizar el procedimiento quirúrgico se informó al paciente del alcance del estudio y fue firmado el consentimiento informado previamente aprobado por el comité de ética de la facultad de odontología de la Pontificia Universidad Javeriana; posteriormente, se realizaron maniobras de asepsia y antisepsia; una vez realizados los procedimientos anestésicos tronculares con lidocaína mas vasoconstrictor al 2% se procedió a la incisión, levantamiento de colgajo, osteotomía, luxación y extracción del diente cuidando que el elevador no sobrepasara el tercio medio radicular del mismo. Una vez extraído, éste fue embebido en un frasco estéril con medio de transporte (DMEM + 3% de antibiótico) y llevado refrigerado al laboratorio en un tiempo máximo de 30 minutos. Una vez en la cámara de flujo laminar se tomó la muestra del tercio apical y medio del ligamento periodontal mediante una hoja de bisturí # 15, esta muestra fue sometida a la acción de las enzimas dispasa (0,4mg/ml) y colagenasa (0,3mg/ml) por 15 minutos para favorecer su disgregación; posteriormente los dientes fueron seccionados con pieza de alta con abundante irrigación y fresa zecria estériles, una vez seccionados, la pulpa fue extraída mediante una cucharilla #5, esta muestra fue disgregada mecánicamente y sometida a la acción de dispasa (0,1mg/ml) durante 15 minutos.
Los explantes disgregados tanto de pulpa como de ligamento periodontal, fueron colocados en cajas de petri e incubados en condiciones estándar de CO2 (5%) y temperatura (37°C) hasta permitir su fijación en la caja, posteriormente se agregaron 5ml de medio DMEM enriquecido con suero fetal bovino 10% y antibiótico 1%. Las cajas de Petri con las muestras fueron incubadas hasta obtener migración célular. Una vez la migración celular tuvo lugar las células fueron desprendidas mediante la acción de tripsina y cultivadas en cajas independientes hasta 3 pases; posteriormente las muestras fueron caracterizadas por citometría de flujo mediante la evaluación de los anticuerpos CD90, CD 105, CD45, CD34 y STRO-1. Adicionalmente una alícuota de cada muestra fue sometida a separación por el método de Miltenyi Biotec para anticuerpo CD 146 y estas muestras CD146(+) fueron a su vez sometidas a citometría de flujo mediante la evaluación de los anticuerpos CD90, CD 105, CD45, CD34 y STRO-1.
Osteodiferenciación
Las células aisladas fueron sembradas en pozos de 10 cm y sometidas a 4 diferentes condiciones de osteodiferenciación y a un medio sin suplementos de osteodiferenciación o control negativo (1). Adicionalmente se utilizó un control positivo con osteoblastos de la línea Clonetics™ Normal Human Osteoblast Cell System de la casa comercial Lonza, todas las condiciones de osteodiferenciación están resumidas en la (Tabla 1).
Un pozo de cada subgrupo de cada muestra fue desprendido mediante la acción de tripsina al día 14 y otro al día 21 de cultivo. Los pellets obtenidos fueron almacenados a -70°C para ser procesados para RT-PCR. El pozo restante de cada subgrupo se fijó con formaldehido bufferado 4% en el día 21 de cultivo para tinción con rojo alizarin.
Los pellets obtenidos en los días de diferenciación 14 y 21 de cada subgrupo de cada muestra y un control positivo de osteoblastos de la línea Clonetics™ Normal Human Osteoblast Cell System de la casa comercial Lonza, fueron procesados para extracción de RNA. Posteriormente una alícuota de concentración de 200ng/ul de RNA cada muestra fue sometida a la acción de DNase I, Amplification Grade invitrogen (18068-015), posteriormente se realizó la retrotranscripcion utilizando el Kit SuperScript™ III Reverse Transcriptase de invitrogen(18080-093), y se realizaron RT-PCR de cada una de las muestras por duplicado.
Los genes cuya expresión fue analizada mediante RT- PCR: fueron Colágeno tipo I, OPG, RunX2 y osteopontina, y su expresión fue analizada en comparación con la expresión de housekeeping Actina.
Resultados
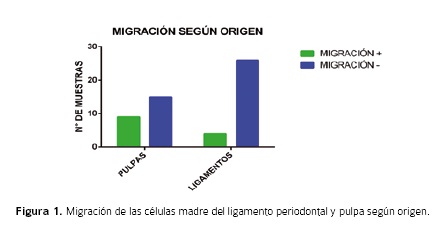
Siguiendo los procedimientos descritos en materiales y métodos fueron obtenidos 30 terceros molares, de los cuales se extrajeron 24 explantes de pulpa de tercer molar y 30 de ligamento perio-dontal. De estos explantes, hubo migración positiva en 9 de origen pulpar y 4 de origen de ligamento periodontal (Figura 1).
Caracterización fenotípica
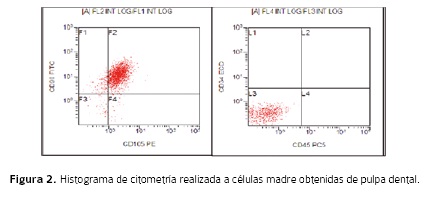
La caracterización de las células obtenidas, fue realizada mediante citometría de flujo para los marcadores CD 90, CD 105, STRO-1 CD 34 CD 45, (Figuras 2 y 3). Esta citometria fue realizada tanto para las muestras con migración positiva como para sus correspondientes alícuotas separadas por el método de Myltenyi. Posteriormente, los datos obtenidos fueron sometidos al test de normalidad D'agosstino8Pearson, encontrándose que la distribución de la variable CD105 no seguía los parámetros de normalidad, los datos fueron depurados mediante la eliminación de un outlier de este grupo después de lo cual se obtuvo una distribución normal de los mismos. El análisis estadístico para comparar la expresión de los marcadores evaluados en el grupo de células separadas con el método de Miltenyi y el grupo sin esta separación, fue una prueba ANOVA de dos vías con un test de múltiple comparación de Sidak. Los resultados obtenidos mostraron que para el grupo de separación con Miltenyi se presentaba una disminución estadísticamente significativa del número de células positivas para CD 90 (p= 0,0007) y CD105 (p=0,04). Los demás datos no presentaron diferencias estadísticamente significativas. Teniendo en cuenta estos resultados, se decidió que para la etapa de osteodiferenciación solo se utilizaría el grupo de células no separado por el método de Miltenyi.
Osteodiferenciación
El proceso de osteodiferenciación fue llevado a cabo a partir de las células aisladas no separadas por el método de Miltenyi siguiendo el protocolo descrito en materiales y métodos. Durante el protocolo de diferenciación, cada una de las muestras originadas de pulpa y las originadas de ligamento fueron diferenciadas con cada una de las 5 condiciones de cultivo expuestas en materiales y métodos.
En los grupos de muestras tanto de pulpas como ligamentos inducidos con el medio de cultivo StemPro ostegenesis (invitrogen) -Medio 3-, todas las células murieron por lo que se eliminó este medio de diferenciación de los análisis posteriores. Los datos obtenidos de los grupos 1 (control negativo), 2, 4 y 5 fueron sometidos a análisis estadístico ANOVA doble vía complementado con un test de comparaciones múltiples de Tukey con el fin de evaluar si había diferencias estadísticamente significativas entre las expresiones génicas de los diferentes grupos para las células madre de pulpa y las células madre provenientes de ligamento periodontal (Figura 4).
Aunque las células madre de pulpa y ligamento demostraron perfiles génicos de osteodiferenciación en los medios 2, 4 y 5; al comparar la capcidad de osteoinducción de los diferentes medios no se encontraron diferencias estadísticamente significativas. Al comparar la expresión de cada uno de los genes (RUNX2, COL1, OPG, OP) solo RUNX2 mostró diferencia estdísticamente significativa (p=0,04) (Figura 5).
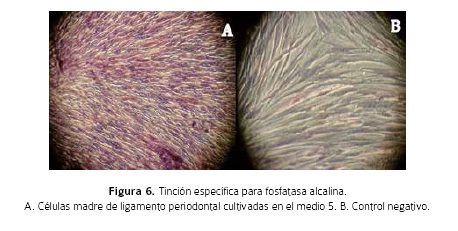
Los pozos de 21 días de cultivo en cada uno de los subgrupos fueron sometidos a tinción con rojo alizarin para evaluar los depósitos de calcio, y las células madre de pulpa en el medio 5 mostraron la mayor coloración (Figura 6).
Discusión
El aislamiento de células madre de origen dental como alternativa viable en bioingeniería de tejidos ha sido ampliamente descrito en la literatura (5,6,10,12), sin embargo, los datos referentes a la tasa de éxito en la recuperación son escasos (17).
En el presente estudio fueron tomadas en condiciones estandar 30 muestras de ligamento periodontal y 24 de pulpa que fueron procesadas para aislamiento de células madre mediante el método de explantes, obteniendo una tasa de migración positiva total de 24,07%. Este hallazgo evidencia que el método de asilamiento de células madre por explante no es 100% reproducible lo que está de acuerdo con lo reportado por Huang y cols (17), quienes encontraron que las células madre obtenidas de pulpa mediante el método de explantes presentaban un porcentaje de expresión de BrdU como marcador de la capacidad de proliferación del 40%, mientras que en las células extraídas por el método de digestión era de 60%. Sin embargo en este mismo estudio se concluye que los dos métodos de extracción de células madre pulpares dan como resultado diferentes poblaciones celulares durante la expansión in vitro y que el método de explantes minimiza daños sobre las células. En contraposición Zhang y cols (18) reportaron una migración del 100% de 90 muestras extraídas de ligamento periodontal por el método de explantes, sin embargo, el medio de cultivo utilizado por Zhang fue suplementado desde el inicio con ácido ascórbico a una concentración de 100um/l lo que si bien favorece la recuperación de las células por su efecto en el ciclo celular, puede también influir tempranamente en su diferenciación hacia el linaje osteogénico. En este estudio no se llevó a cabo una comparación entre los métodos de explantes y digestión enzimática para obtención de células madre, un estudio futuro en este sentido sería de gran utilidad para el establecimiento de protocolos reproducibles para la obtención de células madre de origen dental.
Adicionalmente, en el presente experimento, se observó una migración positiva de 37,5% para células de pulpa y 13.3% para células de ligamento, (p=0,048), lo que sugiere que el sitio de origen de extracción (pulpa vs ligamento periodontal) es una variable que afecta de una forma estadísticamente significativa el porcentaje de migración de células madre siendo mayor la recuperación en células de pulpa. Estas diferencias podrían ser explicadas por el tamaño de los explantes obtenidos para pulpa y ligamento periodontal ya que el volumen de las pulpas es superior al obtenido en muestras de ligamento, tal como lo reportan Iwata y cols (19) al afirmar que las muestras obtenidas de ligamento periodontal son tan pequeñas que presentan una densidad celular inferior a 50 células/cm2. Sin embargo es necesario establecer en estudios posteriores, si el número de células madre que se encuentran en condiciones de salud en el tejido pulpar es proporcionalmente mayor al número de células madre del ligamento para definir si son estas características de celularidad iniciales las que causan las diferencias de migración.
Otro cuestionamiento que ha surgido respecto a la obtención de células madre de origen dental, está relacionado con el efecto que el grado de formación radicular tiene en la migración positiva de dichas células. En el presente estudio, el grado de formación radicular fue evaluado según el método de Nolla (20), encontrándose que de las 54 muestras obtenidas, 27 presentaban un grado de formación radicular de 10 y 27 muestras tenían un estado de Nolla 8; en el grupo de muestras clasificado como nolla 10 se presentó una migración positiva del 12,5% de las muestras, mientras que del grupo de nolla 8 se observó una migración positiva de 39,1%. (p=0,02). Esta diferencia estadísticamente significativa puede ser explicada porque en la zona apical de los dientes con ápice inmaduro se pueden obtener células de cuatro diferentes fuentes anatómicas: el saco dental que rodea la vaina radicular epitelial, responsable del desarrollo del periodonto, la pulpa dental radicular, la papila apical mesenquimal y la papila dental mesenquimal encerrada por la vaina radicular epitelial que es ampliamente reconocida como parte de la pulpa radicular y que constituye una zona apical rica en células (21). Estas dos últimas zonas podrían presentarse como una fuente adicional de células madre para el grupo de dientes con ápice inmaduro. Teniendo en cuenta que en el presente estudio no se tomaron muestras con formación radicular inferior a Nolla 8, se sugiere que posteriores estudios pueden esclarecer la capacidad de migración de células madre originadas de tejidos pulpar y periodontal en dientes más inmaduros.
Las poblaciones celulares obtenidas en este estudio fueron caracterizadas mediante citometría de flujo para los marcadores CD 90, CD105, STRO-1, CD34 y CD45. Los resultados fueron positivos para CD90 (90+/-4,9), CD105 (74,1+/-23), STRO (15,2+/-9,8) y negativos para CD34 (7,1+/-6,2), CD 45 (0,7+/-0,1). Estos resultados permiten afirmar que las células obtenidas son células madre, ya que cumplen con los criterios de identificación sugeridos por la sociedad internacional para terapia celular (22). Adicionalmente, los datos del presente estudio son coincidentes con los obtenidos por Wang (15) quien reporta valores positivos para los marcadores CD105 de 78,6% y STRO 7,3% en células madre obtenidas de tejido pulpar, Huang y cols (12), quienes reportan valores de STRO 5-10%, resultados positivos para CD90, CD105 y negativos para CD 34 y CD45 y Patil y cols en 2004 con reportes de CD90 99,5% CD 34 4,2% y CD 45 5,2% (23).
Según lo reportado por Kramer y cols (24), el aislamiento de células madre de ligamento periodontal usando los marcadores STRO-1 y CD146 da como resultado células con propiedades clonogénicas y potencial de diferenciación multilinaje, lo que posiblemente representa una población de células madre enriquecida que también contiene células progenitoras. En un intento por mejorar la selección de las células se utilizó sobre una alícuota de cada muestra el método de separación de Miltenyi para células madre con microperlas (CD146), las células resultantes de separación fueron sometidos nuevamente a citometría de flujo, observándose una disminución estadísticamente significativa en la positividad de los marcadores CD90 (p=0,0007) y CD105 (p=0,04); estos resultados sugieren que para las poblaciones celulares obtenidas, no todas las células positivas para CD146 son positivas para las marcadores CD90 y CD105. Si bien estos resultados están de acuerdo con los de Wang (15) que reporta valores de CD 146+ para células madre extraídas de pulpa de 17% se contraponen con los resultados de Bakopolou y cols (25) que presentan valores de CD 146+ en el 83,33% de sus células madre extraídas de pulpa con el método de digestión enzimática. Estas diferencias pueden estar relacionadas con los reportes de Tormin (26) que afirman que las células mesenquimales con mayor expresión de CD146 están ubicadas más cerca de las zonas vasculares y no en áreas de revestimiento óseo.
Para este estudio, y teniendo en cuenta que los marcadores CD 90 y CD 105 son considerados como requisitos mínimos para clasificación de una célula como célula madre (7,22), se decidió que el proceso de selección era desfavorable y este grupo de células separadas fue descartado para la etapa de osteodiferenciación del estudio.
Si bien las células madre provenientes de pulpa y ligamento periodontal tienen un origen embriológico similar, se desarrollan en nichos distintos, por lo que establecer diferencias en su respuesta a los estímulos de oseodiferenciación constituye un punto importante en la bioingeniería de tejidos. A este respecto, los resultados del presente estudio muestran que las células madre extraídas de ligamento periodontal y cultivadas con medios suplementados para osteodiferenciación durante 21 días, presentan una mayor expresión de Runx2 comparadas con células madre extraídas de tejido pulpar, que presentan una mayor expresión de Colágeno tipo I, estos hallazgos sugieren que si bien las dos poblaciones celulares se diferencian hacia el linaje osteogénico, tienen respuestas diferentes a los estímulos osteodiferenciadores, lo que previamente había sido descrito por Seo en el 2004 (27) quien reporta menores depósitos cálcicos para células de ligamento comparadas con células pulpa y Liu en 2009 (28) quien muestra mayor expresión de fosfatasa alcalina en células extraídas de ligamento periodontal comparadas con células pulpares.
Teniendo en cuenta las variaciones de expresión sucedidas en el tiempo, en este estudio se puede observar que las células obtenidas de ligamento periodontal diferenciadas hacia el linaje osteogénico, presentan valores mayores de expresión para Runx2 mostrando un leve incremento desde el día 14 hasta el día 21, contrastado con las células de pulpa que presentan niveles inferiores de expresión de Runx2 tanto en el día 14 como en el día 21; si se considera Runx2 como un marcador de osteodiferenciación temprana debido a su característica de factor de transcripción regulador de la expresión de los genes que codifican para las principales proteínas constitutivas de hueso (29), se podría sugerir que la etapa de osteodiferenciación en la que se encuentran las células originarias de tejido periodontal es inmadura en comparación con las células obtenidas de tejido pulpar, ya que estas últimas presentan un marcado incremento de la expresión de genes característicos de osteoblastos maduros como osteopontina y colágeno tipo I entre el día 14 y el día 21. Este hallazgo está de acuerdo con lo reportado por Seo y cols en 2004 (27) quienes encuentran una menor cantidad de depósitos cálcicos en células madre extraídas de ligamento inducidas al linaje osteogénico durante 4 semanas comparado con células originadas de tejido pulpar inducidas bajo las mismas condiciones.
Estos hallazgos podrían sugerir que las células madre pulpares diferenciadas hacia el linaje os-teoblastico se transforman en un menor tiempo en osteoblastos maduros mientras que podría requerirse un tiempo de diferenciación mayor a 21 días para observar marcadores de osteodiferenciación tardía en las células madre extraídas de ligamento. A este respecto, estudios experimentales en perros indican que las fases 3 y 4 del movimiento dental que se conocen como fases de aceleración y lineal, comienzan alrededor del día 40 posterior a la activación y se caracterizan marcadamente por evidencia de células osteoblásticas positivas para fosfatasa alcalina (30), lo que podría corroborar la diferenciación tardía de células del ligamento periodontal hacia el linaje osteoblastico. Este hallazgo que puede ser relacionado con los reportes de Florez y cols en 2013 (31) quienes encuentran un incremento en la relación de los mediadores del metabolismo óseo RANKLs/OPG entre la quinta y octava semana posterior a la activación correspondiente a la fase de aceleración y lineal del movimiento dental. Teniendo en cuenta que en los tratamientos ortodónticos se realizan reactivaciones de la aparatología cada 30 días en promedio, estos resultados podrían sugerir que en este tiempo las células madre del ligamento periodontal pueden estar en un estado de osteoblasto inmaduro por lo que podría ser necesario aumentar el periodo de tiempo entre activaciones. Esta hipótesis debe ser confirmada en estudios posteriores, sometiendo las células madre extraídas de ligamento periodontal a suplementos osteodiferenciadores durante tiempos superiores a 21 días, de esta forma se permitirá confirmar su respuesta tardía a la osteodiferenciación.
Por otro lado, los dos grupos celulares también responden en forma diferente a los diferentes medios de cultivo, en los resultados del presente estudio, hubo una expresión significativamente mayor de Runx2 para las células de ligamento periodontal cuando estas fueron cultivadas con el medio número 5, comparado con otros medios (p=0,04), mientras que las células obtenidas de pulpa presentaron una mejor respuesta al medio 4 particularmente para la expresión de Colageno tipo I. Estos hallazgos están de acuerdo con lo reportado por Seo y cols (27), quienes al someter células madre extraídas de pulpa y de ligamento periodontal a las mismas condiciones de osteodiferenciación observaron una menor expresión de marcadores de oseodiferenciación en las células de ligamento.
Respuestas diferentes de células madre ante estímulos similares también han sido reportadas por Tsumanuma y cols en 2011 (32) quienes encontraron que células madre derivadas de ligamento periodontal, mostraban mayor capacidad regenerativa para tejido periodontal, comparadas con células madre mesenquimales extraídas de médula ósea. Estas diferencias pueden ser explicadas mediante la hipótesis de Brawley y cols en 2004 (33) quienes proponen que el nicho es el factor dominante en el control del destino de las células madre y provee una gran cantidad de pequeñas señales que le confieren a estas células su capacidad de indiferenciación o de diferenciación parcial, principalmente mediante variaciones en la orientación de los husos mitóticos durante la división (34). Teniendo en cuenta que el nicho de las células madre originadas de pulpa difiere del de las células madre de ligamento periodontal, se podría inferir que esta variación en las señales de las células de soporte pueden ser responsables de su diferente respuesta ante un mismo estímulo.
Respecto a los diferentes medios de cultivo, los resultados del presente estudio muestran que ninguna de las células madre aisladas de pulpa y ligamento periodontal cultivadas con el medio de diferenciación número 3 Stempro osteogénesis invitrogen sobrevivieron. Por otro lado se encontró que los mejores resultados de osteodiferen-ciación (expresión de proteínas características de osteoblastos y tinción con rojo alizarin y fosfatasa alcalina) fueron obtenidos con el medio número 5, caracterizado por una concentración de ácido ascórbico de 50uM, como la reportada por Patil y cols (23) quienes presentan tinciones positivas para rojo alizarin con células madre de origen pulpar y reportan una expresión moderada de Runx2. Estos resultados son similares a los del presente estudio para células de origen pulpar, sin embargo, para las células de ligamento periodontal en nuestro estudio se observa una marcada expresión de Runx2 lo que confirma las diferencias de respuesta según origen. Por otro lado el medio 4 que tenía una composición similar al medio 5 con una concentración superior de ácido ascórbico (200uM), se correlacionó con una mayor expresión de Colágeno tipo I en células de pulpa; hallazgo que puede ser explicado por la importante función del ácido ascórbico como cofactor de la prolyl-4-Hi-droxilasa en la hidroxilación de residuos de prolina necesaria para la adecuada síntesis de colágeno (35). Este hallazgo permite concluir que el suplemento de ácido ascórbico es de gran importancia para la inducción de síntesis de colágeno en células madre extraídas de pulpa dental.
Pese a que se obtuvo una muestra importante de explantes de pulpa y ligamento periodontal la migración final fue limitada, por esto es importante realizar estudios futuros que permitan evaluar en una muestra mayor si existe diferencia entre la respuesta de las células madre extraídas de pulpa y ligamento dental con medios enzimáticos y de explantes ante los estímulos de oseodiferenciación. Estos avances permitirán acercarse a protocolos más reproducibles para la obtención de células madre de tejidos dentales, sistematizando este proceso para convertirlo en un recurso valido de obtención de células madre mesenquimales para uso clínico.
Agradecimientos
Este Proyecto fue financiado por la Pontificia Universidad Javeriana.
Este trabajo no habría sido posible sin el apoyo del Centro de Investigaciones Odontológicas de la facultad de Odontología y la solidaridad del programa de posgrados de la facultad de Ciencias de la Pontificia Universidad Javeriana.
Referencias
1. Cambron J, King T. The Bone and JointDecade: 2000 to 2010, Journal ofManipulative and Physiological Therapeutics.2006;29 (2):91-92. [ Links ]
2. Park BW, Kang EJ, Byun JH, Son MG, Kim TH, Hah YS, et al. In vitro and in vivo osteogenesis of human mesenchymal stem cells derived form skin, bone marrow and dental follicle tissues. Differentiation.2012;83(5): 249-259. [ Links ]
3. Vater C, Kasten P, Stiehler M. Culture media for the differentiation of mesenchymal stromal cells. Acta Biomateriala.2011;7(2):463-477. [ Links ]
4. Yamada Y, Nakamura S, Ito K, Yoshimi R, Ueda M, Nagasaka T. A Feasibility of Useful Cell-Based Therapy by Bone Regeneration with Deciduous Tooth Stem Cells, Dental Pulp Stem Cells, or Bone-Marrow-Derived Mesenchymal Stem Cells for Clinical Study Using Tissue Engineering Technology. Tissue Engineering.2010;16(6):1891-1900. [ Links ]
5. Felthaus O, Viale-Bouroncle S, Driemel O, Reichert T, Schmalz G, Morsczeck C. Transcription factors TP53 and SP1 and the osteogenic differentiation of dental stem cells. Differentiation.2012;83(1):10-16. [ Links ]
6. Zhou Q, Zhao Z, ChengJ, Zhang B, Xu J Huang F, Zhao R, Chen Y. Ibandronato promotes osteogenic differentiation of periodontal ligament stem cells by regulating the expression of microRNAs. Biochemical and biophysical Research Communications.2011;404(1):127-132. [ Links ]
7. Dominici M, Blanc K Lec, Mueller I, Slaper-Cortenbach I, Marini F C, Krause DS, et al. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement, Cytotherapy.2006;8(4):315-317. [ Links ]
8. Wang H, Zhang P, Liu L, Zou L Hierarchical organization and regulation of the hematopoietic stem cell osteoblastic niche.Critical Reviews in Oncology/Hematology.2013;85(1):1-8. [ Links ]
9. Malgieri, A, Kantzari, E, Patrizi MP, Gambardella S. Bone marrow and umbilical cord blood human mesenchymal stem cell: state of the art. Int J clin Exp Med.2010;3(4):248-269. [ Links ]
10. Atari M, Caballe-Serrano J, Recio C, Giner-Delgado C, Martinez Sarra E, Garcia Fernandez D, et al.The enhancement of osteogeneisis through the uso of dental pulp pluripotent stem cells in 3D. Bone.2012;50(4):930-941. [ Links ]
11. Gronthos S, Mankani M, Brahim J, Gehron-Robey P, Shi S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proc Natl Acad Sci.2000;97(25):13625-13630. [ Links ]
12. Huang G, Gronthos S, Shi S. Mesenchymal stem cells derived from dental tissues vs.those from other sources: their biology and role in regenerative Medicine. J Dent Res.2009;88(9):792-806. [ Links ]
13. Kawanabe N, Murata S, Fukushima H, Ishihara Y, Yanagita T, Yanagita E, et al. Stage-specific embryonic antigen-4 identifies human dental pulp stem cells. Experimental cell Research.2012;318(5):453- 463. [ Links ]
14. Chen FM, Sun HH, Lu H, Yu Q. Stem cell-delivery therapeutics for periodontal tissue regeneration. Biomaterials.2012;33(27):6320-6344. [ Links ]
15. Wang X, Sha X, Li G, Yang F, Ji K, Wen L, et al. Comparative characterization of stem cells from human exfoliated deciduous teeth and dental pulp stem cells. Archives of Oral Biology.2012;57(9):1231-1240. [ Links ]
16. Roth JA, Kim BG, Lin WL, Cho MI. Melatonin promotes osteoblast differentiation and bone formation. J Biol Chem.1999;274(31):22041-22047. [ Links ]
17. Huang GT, Sonoyama W, Chen J, Park SH. In vitro characterization of human dental pulp cells: various isolation methods and culturing environments. Cell Tissue Res.2006;324(2):225-236. [ Links ]
18. Zhang J, An Y, Gao L, Zhang Y, Jin Y, Chen F. The effect of aging on the pluripotential capacity and regenerative potential of human periodontal ligament stem cells. Biomaterials.2012;33(29):6974-6986. [ Links ]
19. Iwata T, Yamato M, Zhang Z, Mukobata S, Washio K, Ando T, et al. Validation of human periodontal ligament-derived cells as a reliable source for cytotherapeutic use. J Clin Periodontol.2010;37(12):1088-1099. [ Links ]
20. Nolla CM. The development of the permanent teeth. Journal of Dentistry for Children.1960;27:254-266. [ Links ]
21. ziafas D, Kodonas K. Differentiation Potential of Dental Papilla, Dental Pulp, and Apical Papilla Progenitor Cells. JOE.2010;36 (5):781-789. [ Links ]
22. Rosenbaum A, Grande D, Dines J. The use of mesenchymal stem cells in tissue engineering. Organogenesis.2008;4(1):23-27. [ Links ]
23. Patil R, Kumar M, Lee W, Jeon R, Jang S, Lee J, et al. Multilineage potential and proteomic profiling of Human dental stem cells derived from a single donor. Experimental cell Research.2014;320 (1):92 - 107. [ Links ]
24. Kramer PR, Nares S, Kramer SF, Grogan D, KaiserM. Mesenchymal stem cells acquire characteristics of cells in the periodontal ligament in vitro. J Dent Res.2004;83(1):27-34. [ Links ]
25. Bakopoulou A, Leyhausen G, Volk J, Tsiftsoglou A, Garefis P, Koidis P, Geurtsen W. Comparative analysis of in vitro osteo/odontogenic differentiation potential of human dental pulp stem cells (DPSCs) and stem cells from the apical papilla (SCAP). Archives of oral biology.2011;5(6):709-721. [ Links ]
26. Tormin A, Li O, Brune JC, Walsh S, Schütz B, Ehinger M,Scheding S. CD146 expression on primary nonhematopoietic bone marrow stem cells is correlated with in situ localization. Blood.2011;117(19):5067-5077. [ Links ]
27. Seo B, Miura M, Gronthos S, Bartold P, Batouli S, Brahim J, et al. Investigation of multipotent postnatal stem cells from human periodontal ligament. Lancet.2004;364(9429):149-155. [ Links ]
28. Liu L, Ling J, Wei X, Wu L, Xiao Y. Stem Cell Regulatory Gene Expression in Human Adult Dental Pulp and Periodontal Ligament Cells Undergoing Odontogenic/Osteogenic Differentiation. JOE.2009;35(10):1368-1376. [ Links ]
29. Komori T. Regulation ofbone development and maintenance by Runx2. Front biosci.2008;13(1):898-903. [ Links ]
30. Pilon JJAM, Kuijpers-Jagtman AM, Maltha JC. Magnitude of orthodontic forces and rate of bodily tooth movement: an experimental study in beagle dogs. Am J Orthod Dentofacial Orthop.1996;110(1):16-23. [ Links ]
31. Florez G, Isaza D, Tobon S. Time-related changes in salivary levels of the osteotropic factors sRANKL and OPG Through orthodontic tooth movement. Am J Orthod Dentofacial Orthop.2013;143(1):92-100. [ Links ]
32. Tsumanuma Y, Iwata T, Washio K.Comparison of different tissue-derived stem cell sheets for periodontal regeneration in a canine 1-wall defect model. Biomaterials.2011;32(25):5819-5825. [ Links ]
33. Brawley C, Matunis E. Regeneration of male germline stem cells by spermato-gonial dedifferentiation in vivo. Science.2004;304(5675):1331-1334. [ Links ]
34. Januschke J, Nàthke I. Stem cell decisions: A twist of fate or a niche market? In Seminars in cell and developmental biology.2014;34:116-123. [ Links ]
35. Pustylnik S, Fiorino C, Nabavi N, Zappitelli T, da Silva R, Aubin J, Harrison R. EB1 Levels Are Elevated in Ascorbic Acid (AA)-stimulated Osteoblasts and Mediate Cell-Cell Adhesion-induced Osteoblast Differentiation. J. Biol. Chem.2013; 288(30):22096-22110. [ Links ]