Introducción
Las CTMs (MSCs por sus siglas en inglés) son un grupo de células adultas, que fueron inicialmente aisladas y caracterizadas por Friedenstein et, al. en 1974, de la médula ósea de un ratón y las denominó UFC-F, capaces de diferenciarse en osteocitos, condrocitos y adipocitos (1). Las CTMs, son células inmaduras, indiferenciadas que tienen la capacidad de proliferar, auto-renovarse y diferenciarse en varios linajes celulares de las diferentes capas germinales, como lo son el endodermo, el mesodermo y el ectodermo (2-4). Actualmente, la sociedad internacional para la terapia celular postula 3 criterios mínimos para identificar CTMs, los cuales se enumeran como: 1) Adherentes al plástico en condiciones estándar de cultivo, 2) Expresión de antígenos específicos de superficie, siendo positivo en porcentaje mayor al 95%: CD105, CD73 y CD90 y negativo en porcentaje menor al 2% para CD45, 34, 14, y HLA-DR y 3) Potencial de diferenciación en condroblastos, adipocitos y osteoblastos (5).
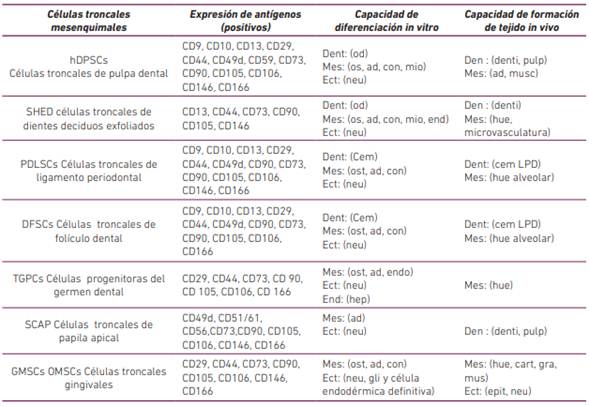
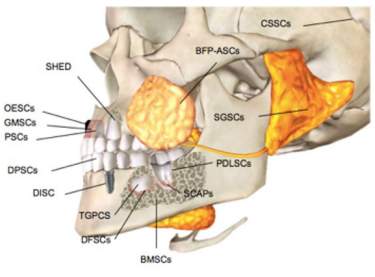
En cavidad oral, se han reportado varias fuentes de estas células indiferenciadas, que son de fácil obtención para el cuerpo odontológico, incluyendo: epitelio oral, encía, glándulas salivares, periostio, médula ósea de hueso orofacial, pulpa dental, ligamento periodontal, papila apical, folículo dental, gérmenes dentales y dientes primarios exfoliados (Tabla 1, Figura 1) (6). Así mismo, las proteínas secretadas por estas células juegan un papel clave y coordinan funciones biológicas tales como, crecimiento, división, diferenciación, apoptosis y señalización.
Linajes de diferenciación: dent (dentinogénico), mes (mesodérmico), ect (ectodérmico), end (endodermo), denti (dentina), pulp (pulpa) od (odontoblasto), os (osteoblasto), ad (adipocito), cho (condrocyte), mio (mioblasto), neu (célula neuronal), endo (célula endotelial), cem (cementoblasto), hep (hepatocito), musc (músculo) hue: (hueso) cem: (cemento) gra: (grasa), epit: (epitelio), gli: (glia) ND: no determinado. (Tabla modificada de Egusa et al., 2012).
BMSCs: Bone marrow-derived MSCs, DPSCs: Dental pulp stem cells; SHEDs: Stem cells from human exfoliated deciduous teeth; PDLSCs: Periodontal ligament stem cells; DFSCs: Dental follicle stem cells; TGPCs: Tooth germ progenitor cells; SCAP: Stem cells from the apical papilla, OESCs: Oral epithelial progenitor/ stem cells; GMSCs: Gingiva-derived MSCs, PSCs: Periosteum-derived stem cells, SGSCs: Salivary gland-derived stem cells, DISC: Dental implant stem cells, BFPASCs: Bichat’s fat pad Adipose-derived stem/stromal cells and CSSCs: Craniofacial sutures derived MSCs (41).
En regeneración tisular y en medicina regenerativa se plantea la hipótesis paracrina como un enfoque alterno para la utilización de las células troncales como potencial terapéutico. El SCT incluye citocinas, quimiocinas y factores de crecimiento y presenta un interés creciente en los últimos años debido a sus múltiples implicaciones en reparación y regeneración de tejidos lesionados o enfermos de manera crónica y/o irreversible (7).
Metodología
Estrategia de búsqueda
Se realizó una revisión bibliográfica hasta el 15 de mayo de 2017 bajo criterios específicos (Tabla 2). Se utilizaron las siguientes estrategias de búsqueda utilizando términos MeSH: (“Mesenchymal Stromal Cells”[Mesh] AND “Immunomodulation”[Mesh]), 804 resultados; (“Mesenchymal Stromal Cells”[Mesh] AND “Immunomodulation”[Mesh] AND “secretome”), 6 resultados; (“Tissue Engineering”[Mesh] AND “Mesenchymal Stromal Cells”[Mesh] AND “secretome”), 8 resultados; y (“Tissue Engineering”[Mesh] AND “Mesenchymal Stromal Cells”[Mesh] AND “secretome” AND “immunomodulation”), 1 artículo. Se eligieron 56 artículos por su relevancia para esta revisión.
Desarrollo del tema
La evidencia científica arroja abundante información que demuestra la existencia de factores solubles y de vesículas extracelulares como componentes del secretoma identificado in vitro en los medios condicionados, lo que sustenta la actividad paracrina atribuida a las CTMs.
Las CTMs se describieron inicialmente a partir de médula ósea (8) pero se sabe que pueden ser encontradas en diferentes tejidos incluyendo sangre de cordón umbilical, tejido adiposo y pulpa dental (9-13). Dado que las señales provenientes de las CTMs pueden promover el reclutamiento de múltiples tipos de progenitores celulares, y a su vez regular la respuesta inmune e inflamatoria, se ha sugerido que el potencial terapéutico de estas células podría ser independiente de procesos de diferenciación per se y más dependiente de su interacción con el microambiente tisular (14-16). Aún más, las CTMs han demostrado eficacia en estudios clínicos para reducir el grado y duración de enfermedad injerto-contra-huésped de presentación común en pacientes receptores de trasplantes hematopoyéticos alogénicos (17,18).
Células troncales de la cresta neural
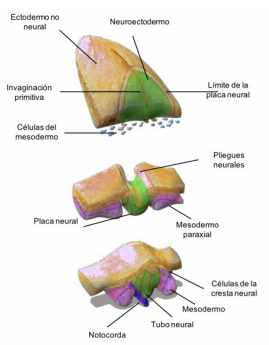
En 1868 el embriólogo suizo Wilhelm His descubrió una banda delgada de células no detectadas previamente, agrupadas entre el ectodermo y el tubo neural embrionario de un pollo en desarrollo. El Dr. His las denominó “Zwischenstrang” o "la cuerda intermedia". Al final del siglo XIX, el término Zwischenstrang fue reemplazado por el término en inglés más descriptivo de "células de la cresta neural", debido a su localización geográfica en la cresta del tubo neural como su sitio de origen (Figura 2) (19).
Las interacciones entre el ectodermo no neural (azul) y el mesendodermo (verde) con la placa neural (púrpura) inducen los márgenes de la placa neural (azul claro). A medida que avanza de tubo neural, la placa neural se enrolla y los márgenes de la placa neural se convierte en los pliegues neurales. Cerca del momento del cierre del tubo neural (dependiendo de la especie), las células de la cresta neural pasan por una transición epitelial a mesenquimal y migran a lo largo de las vías definidas.
La pulpa dental considerada como un reservorio de las hDPSCs (human Dental Pulp Stem Cells) las cuales son células troncales derivadas del neuroectodermo originadas a partir de la migración de las células de la cresta neural hacia el mesénquima del estomodeo para constituir el ectomesénquima, las cuales poseen propiedades de células troncales mesenquimales (20). Se han identificado la existencia de células troncales de cresta neural en la papila apical y en el folículo dental de dientes en desarrollo que presentaron capacidad de autorrenovación, formaron neuroesferas in vitro, expresaron marcadores asociados a la cresta neural p75, Snail, Slug y fenotipo de células troncales neuronales Nestin+, Musashi1+ o Receptor del Factor de Crecimiento Nervioso p75 NGFR-p75.
Acciones paracrinas de las células mesenquimales
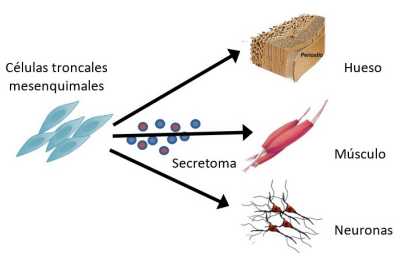
El secretoma de las células troncales es una fuente rica de proteínas como citocinas, quimiocinas y factores de crecimiento que ha atraído la atención en los últimos años debido a sus múltiples implicaciones en medicina regenerativa (Figura 3) (21). Los resultados iniciales hacia la aplicación del secretoma de células troncales para el tratamiento de distintas enfermedades son prometedores (22). Posteriores estudios al respecto lo confirmaron y además reportaron un bloqueo de la función de subpoblaciones CD4+ Th1 y Th2, células dendríticas y células asesinas naturales NK desencadenado por las CTMs (23,24) En general, se han reportado 3 mecanismos principales implicados en la acción inmunomoduladora mediada por las CTMs: a) El contacto célula-célula, b) la síntesis de moléculas inhibitorias y c) la inducción de células T reguladoras.
Después del aislamiento, las células troncales se expanden in vitro y liberan factores tróficos en su medio de cultivo a través de la secreción de microvesículas y de exosomas. Los Factores liberados directamente en el medio condicionado o contenidas en las microvesículas pueden usarse como agente terapéutico para la regeneración y reparación de tejidos.
La liberación de factores solubles inmunosupresores desempeña un papel fundamental y ha permitido evaluar el potencial terapéutico de moléculas derivadas de CTMs en condiciones inmunológicas (25). En estos experimentos, se concluyó que las CTMs reducían la mortalidad relacionada con sepsis mediante mecanismos dependientes de IL-10, receptores de tipo Toll 4 y prostaglandina E2 directamente sobre los macrófagos (26). Las CTMs suprimen de manera específica respuestas inflamatorias según la etiología en diferentes estadios de enfermedad o tejidos lesionados. Un gran número de estudios han proporcionado sólida evidencia sobre la contribución de las CTMs en la regeneración de órganos lesionados in vivo, en parte debido a la modulación de la respuesta inmune del huésped (27-29).
En modelos animales, las CTMs han demostrado promover la regeneración de órganos y tejidos lesionados sin una alta incidencia o duración de injerto (30-33). Por ejemplo, Van Poll y cols. han proporcionado evidencia clara que la terapia con CTMs genera un beneficio significativo de supervivencia, una reducción del 90% de apoptosis hepatocelular y un aumento en el número de hepatocitos proliferantes en un modelo inducido por D-galactosamina de lesión hepática aguda en ratas, lo que crearía una nueva posibilidad para el tratamiento de falla hepática fulminante (34,35). Xin y cols., utilizando un modelo de accidente cerebrovascular por oclusión cerebral en ratas, demostraron que las CTMs secretan exosomas que contienen microARN miR-133b, responsable del incremento significativo del remodelado cerebral y la recuperación mediante la regulación de la expresión génica en los astrocitos y neuronas (36).
Discusión
Young-Ae y cols., demuestran que los estudios de investigación que caracterizan el secretoma de las CTMs comúnmente se dirigen a moléculas, tales como factores de crecimiento y hormonas, con funciones conocidas en la prevención de la apoptosis, la inducción de la proliferación celular y la diferenciación o la regulación de las respuestas inmunes e inflamatorias (37). En un estudio realizado por Iso y cols., utilizaron ELISA para analizar el secretoma de los medios condicionados de CTMs humanas con potencial rol en el tratamiento del infarto agudo de miocardio. De este modo, demostraron una mejoría en la cicatrización y en la función cardíaca posterior a la inyección de CTMs humanas en ratones inmunodeficientes con infarto agudo, sin evidencia de injerto después de 3 meses de la inyección (36).
Para examinar el papel de factores secretados por las CTMs, demostraron además que el secretoma de las CTMs humanas cultivadas, utilizadas en el estudio in vivo rescataron de la muerte celular inducida por hipoxia in vitro a los cardiomiocitos murinos y células endoteliales de la vena umbilical humana. Para identificar blancos potenciales por validación proteómica, emplearon análisis de microarreglos para comparar los perfiles de expresión genética de las CTMs con la de las células de médula ósea humana. Encontraron ARN para varios factores cardioprotectores secretados que se sobre expresan en las CTMs. La validación mediante ELISA de los genes más altamente expresados demostró la presencia de VEGF, HGF, adrenomedulina, PlGF y la IL-6 en secretoma derivado de CTMs. Chiellini y cols., en 2008 utilizaron medios condicionados de CTMs de médula ósea y de tejido adiposo humano adherentes al plástico para evaluar la diferenciación in vitro osteogénica y adipogénica en los cuales identificaron las moléculas PAI-1, GRP-78, PTX-3 y BIGH-3 implicadas en el balance osteoblastos y adipocitos como efecto terapéutico. Choi y cols. en el 2010, identificaron en el secretoma obtenido de medios condicionados de CTMs de médula ósea humana adherentes al plástico con fenotipo CD29+, CD44+, CD90+, CD105+, CD146+, HLA-ABC+, CD14-, CD34-, CD106-, a las proteínas SMOC1, CHI3L1, FGFB1, EFEMP1, TIMP3, POSTN, THBS2 y CTGF como responsables de la diferenciación osteoblástica (37).
Kristensen y cols. en el 2012, determinaron que el factor STC2 hallado en medios condicionados de CTMs humanas estaba involucrado en la diferenciación osteoblástica (38,39). Posteriormente en el 2013, el equipo de Kim encontró las moléculas Anexina A2, LTBP1 y LTBP2 en medios condicionados de CTMs de médula ósea humana con una función no establecida en la diferenciación osteoblástica. con su increíble capacidad inmunomoduladora y capacidad regenerativa (40).
En resumen, existe una gran cantidad de información que demuestra cómo los factores solubles y las vesículas extracelulares (EVs) dentro del secretoma contribuyen de manera importante a la actividad paracrina atribuida a las CTMs.