Introdução
O termo “osteonecrose dos maxilares” (do inglês “osteonecrosis of the jaws” ou ONJ) ficou mais conhecido na última década, ao ser associado ao uso de medicações sistêmicas, vinculadas ao tratamento da osteoporose ou de neoplasias malignas; os bisfosfonatos (1). Ainda que essa classe de medicação estivesse no mercado desde 1977 foi Marx, em 2003, que fez a primeira descrição da ONJ relatando 36 casos de exposições ósseas dolorosas, em mandíbula e/ou maxila, que não respondiam ao tratamento médico ou cirúrgico, em pacientes que faziam uso de pamidronato e ácido zolendrônico (2,3).Nesse mesmo trabalho, Marx também já apontava diferenças entre os bisfosfonatos (BPs) que contém nitrogênio (pamidronato e ácido zolendrônico, alendronato, risedronato, ibandronato) e os que não contêm (etidronato, tiludronato, clodronato), associando ao primeiro tipo um risco maior, por possuírem uma metabolização difícil, resultando em uma ação prolongada, o que levaria ao acúmulo nos ossos (3,4). Além disso, Ebetino e colaboradores em 2011 relataram que a localização específica do nitrogênio na composição dos bifosfonatos nitrogenados é capaz de influenciar a potência que o fármaco tem em inibir a reabsorção óssea (4).
Revisão da literatura
Histórico, Definição e epidemiologia
Em 2004, após a publicação de Marx e de mais 63 casos descritos por Ruggiero, a Novartis, empresa farmacêutica produtora do Aredia ®(pamidronato) e do Zometa® (ácido zolendrônico), divulgou uma carta incluindo a osteonecrose como efeito adverso do uso dessas medicações (3,5,6). Com o aumento crescente da publicação de diversos relatos e séries de casos, o termo “Biphosphonate-Associated ou Bisphosphonate-Related Osteonecrosis of the Jaw (BRONJ)” estabeleceu-se entre os profissionais de saúde.
A identificação de outros agentes antirresorptivos, como o denosumabe, e outras classes de medicamentos, os antiangiogênicos, como responsáveis pelo aumento significativo do risco de desenvolver a osteonecrose dos maxilares, levou a American Association of Oral and Maxillofacial Surgeons (AAOMS) a sugerir que o termo “BRONJ” fosse substituído por “Medication-Related Osteonecrosis of the Jaw (MRONJ)” (7-10). A AAOMS definiu MRONJ como “osso exposto (ou que possa ser sondado através de uma fístula intra-oral ou extra-oral) na região maxilo-facial que persiste por mais de 8 semanas, em paciente sob tratamento atual ou anterior com agentes antirresorptivos ou antiangiogênicas e sem histórico de radioterapia ou doença metastática evidente nos maxilares (10).
Os estudos diferem quanto a incidência e a prevalência dessa condição. Na última revisão sistemática publicada até o momento, verifica-se que a incidência é maior em pacientes oncológicos (que utilizam altas doses de medicação endovenosa em intervalos frequentes) variando de 1% a 15%. Em pacientes com osteoporose, esse valor cairia para uma faixa compreendida entre 0,001% a 0,01%, o que representa uma taxa muito mais alta do que a da população geral (<0,001%) (11). Ainda em 2015 foi publicada uma extensa série que analisou os casos de MRONJ no sistema de relato de eventos adversos da Food and Drug Administration dos Estados Unidos (FAERS). No período entre 2010 e 2014 foram identificados 3.310.419 eventos adversos causados por medicações, dos quais 17.119 eram casos de MRONJ. 69,7% dos casos de MRONJ eram em mulheres e 41% usavam medicamentos para prevenir a osteoporose. A maioria dos casos identificados relacionava-se ao uso de bisfosfonatos (67,1% com ácido zolendrônico, 42,7% com alendronato e 30,7% com pamidronato), 6,9% com denosumabe, 7% com agentes antiangiogênicos (4,1% bevacizumab, 2,4% sunitinib, 0,5% soranfenib) e 112 casos foram associados com inibidores da m-TOR (everolimus e temsirolimus). Dentre os pacientes que utilizavam drogas endovenosas para prevenção de eventos no esqueleto 24% tinham câncer de mama, 20% mieloma múltiplo, 9% câncer de próstata, 3,7% câncer de rim, 1,3% câncer de pulmão e 3% tinham metástases ósseas relacionadas a outros tipos de câncer (12).
Etiologia, patogenia e fatores de risco
A etiologia e patogenia dos MRONJ não foram totalmente elucidados, entretanto, os mecanismos de ação das drogas podem explicar grande parte do desenvolvimento desta condição.
Os BPs inibem a reabsorção óssea por interferir nas vias de sinalização dos osteoclastos ou por induzir a apoptose destes. Os BPs nitrogenados atuam dentro dos osteoclastos somente após serem absorvidos a partir dos cristais de hidroxiapatita. O osteoclasto é então desativado intracelularmente através da via dos isoprenoides. Já os BPs sem nitrogênio agem de forma diferente e não são tão potentes pois não se unem tão avidamente aos cristais de hidroxiapatita. A meia vida longa, especialmente dos BPs que contém nitrogênio, é devido ao seu acúmulo dentro da rede de cristais de hidroxiapatita do osso. O processo para remover esses BPs dessa rede é através da ação osteoclástica mas esta ação resulta no acúmulo intracelular de BPs. O turnover aumenta expressivamente e a ação desses BPs pode continuar por muitos anos sendo a meia vida de alguns estimada em 10 anos ou mais (13). Como os osteoclastos da mandíbula e seus precursores internalizam uma grande quantidade de BPs comparados a outros ossos do corpo e a inibição dos osteoclastos é dose dependente, a remodelação óssea está mais reduzida na mandíbula do que em outros sítios. Outro efeito dos BPs é promover senescência prematura dos queratinócitos da mucosa oral, dificultando a cicatrização de feridas. Além disso os BPs também possuem atividade antiangiogênica, associada a redução de células endoteliais circulantes e diminuição dos níveis séricos de fator de crescimento vascular endotelial (VEGF) (14).
O denosumabe é um anticorpo monoclonal humano que bloqueia o RANKL, um membro da superfamília de fator de necrose tumoral (TNF) que tem um papel chave na regulação da reabsorção. O RANKL é secretado por osteoblastos ativados em resposta a citocinas circulantes (interleucinas) e hormônios (glicocorticoides) e desencadeia uma cascata de sinalização intracelular que resulta na maturação e proliferação de osteoclastos. Ao contrário dos BPs, que tem a tendência de se acumular e persistir no osso por vários anos depois de descontinuada a terapia, o denosumabe pode permanecer no corpo por um período de tempo limitado devido à falta de afinidade pela hidroxiapatita. A desativação irreversível dos osteoclastos que o denosumabe promove persiste somente até a morte celular. Como novos osteoclastos são formados diariamente, se um novo osteoclasto é formado após uma administração da droga e antes da próxima administração, este osteoclasto será completamente funcional. Assim, espera-se que seus efeitos se dissipem após 6 meses (13,15).
As drogas antiangiogênicas são muito utilizadas no tratamento de neoplasias malignas já que a angiogênese é uma etapa crítica para a progressão dos tumores. O receptor de superfície VEGF desempenha um papel importante na progressão do câncer e pode ser alvo de drogas inibitórias. As drogas anti-VEGF podem ser classificadas em duas categorias: anticorpos monoclonais que se ligam ao VEGF e assim neutralizam sua atividade biológica e inibidores de tirosino quinase (TKI), que bloqueiam o receptor de VEGF e sua via de sinalização. Os TKIs têm como alvo os macrófagos, que, através de fatores de estimulação de colônias, tem efeito nos monócitos para inibir os osteoclastos dentro do circuito de retroalimentação de desenvolvimento osteoclástico. Os inibidores de VEGF atuam de forma mais direta na inibição de osteoclastos através da sua ação nos monócitos dentro do circuito de retroalimentação de desenvolvimento osteoclástico (8,13-15).
Além do conhecimento da ação das medicações a avaliação da etiologia da MRONJ engloba pelo menos três fatores de risco: fatores relacionados às drogas, fatores locais e fatores sistêmicos.10 Quanto aos fatores relacionados às drogas utilizadas, a avaliação recai, em grande parte, sobre o uso dos bisfosfonatos. Essa classe de drogas, além de responder pela grande maioria dos casos de MRONJ, é a que tem suas características melhor conhecidas. A potência e a via de administração dos BPs são identificadas como grandes fatores de risco (10,16).
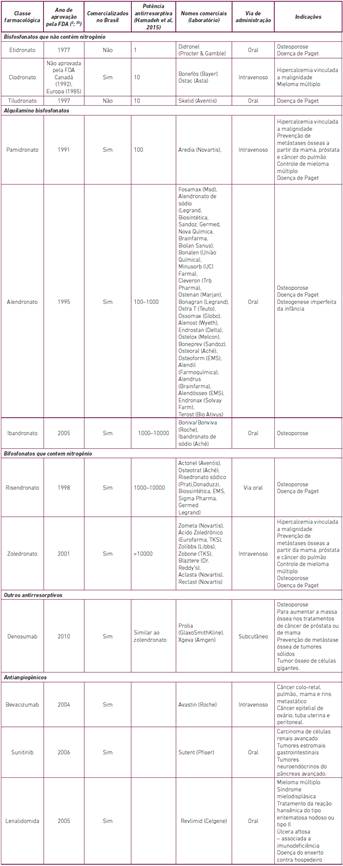
Assim, pacientes com câncer que recebem bisfosfonato endovenoso têm um risco de desenvolver MRONJ 2.7 a 4.2 vezes maior do que pacientes com câncer que não utilizam BFs. Dentre as medicações endovenosas o ácido zolendrônico, por ser uma droga mais potente, representaria um risco maior do que o uso de pamidronato (15). Alguns autores também acreditam que a duração da terapia se associa ao aumento do risco. Em pacientes com câncer que utilizaram ácido zolendrônico ou denosumabe a incidência de desenvolvimento de MRONJ foi, respectivamente, 0.6% e 0.5% no primeiro ano, 0.9% e 1.1% no segundo ano e 1.3% e 1.1% no terceiro ano.10Segundo Palaska e colaboradores o tempo de tratamento em pacientes que desenvolveram MRONJ foi, em média, de 1,8 anos com o uso de ácido zolendrônico, 2,8 anos com pamidronato e de 4,6 anos com o uso de alendronato via oral (17). A tabela 1 retrata as características clínicas e comerciais das medicações mais associadas ao desenvolvimento de MRONJ.
Os fatores locais incluem: cirurgias dentoalveolares (risco de 5,3 a 21 vezes maior de desenvolver MRONJ do que pacientes que não fazem cirurgias); anatomia local (zonas com maior densidade mineral óssea representariam maior risco - a mandíbula é duas vezes mais afetada que a maxila); presença de doença inflamatória na mucosa oral (zonas de abscessos periodontais e dentoalveolares apresentam um risco 7 vezes maior). O uso de próteses removíveis (totais ou parciais) também aparece como um fator de risco duas vezes maior em pacientes que utilizam BPs endovenosos. Dentre os fatores sistêmicos incluem-se a idade (maior), condições sistêmicas que possam diminuir o aporte de oxigênio tecidual (diálise, deficiência de hemoglobina, obesidade, diabetes), exposição a agentes quimioterápicos (ciclofosfamida, eritropoietina, esteroides) e hábitos como o tabagismo (10,16).
Alguns estudos começam a investigar a possibilidade de polimorfismos genéticos em diferentes genes estarem envolvidos com um risco maior de MRONJ (18,19). Também foi relatado que fatores indutores da MRONJ são geneticamente associados e a MRONJ ocorre devido ao mau funcionamento da modificação pós-translacional em osteoclastos levando ao comprometimento da morfologia celular e aderência (20).
Classificação e tratamento
Os principais objetivos do tratamento da MRONJ são eliminar a dor, controlar a infecção e minimizar a progressão da necrose óssea. A literatura possui diversos relatos de tratamentos exitosos em todos os estágios de MRONJ, quer sejam eles conservadores ou invasivos. Mas, nas principais diretrizes publicadas, a eleição do tipo de tratamento está vinculada ao estadiamento clínico do paciente. A comissão especial reunida pela AAOMS em setembro de 2013, propôs a utilização de um sistema de estadiamento revisado para melhor orientar as diretrizes de tratamento e coletar dados para avaliar o prognóstico em pacientes que foram expostos a terapias antirresorptivas (IV ou oral) ou antiangiogênicas (Tabela 2) (10).
Tabela 2 Estadiamento e estratégias de tratamento da MRONJ (adaptado de Ruggiero et al, 2014; Khan et al, 2015; Fleisher et al , 2010; Bodem et al, 2015; Rupel et al, 2014)

*Independentemente do estágio da doença, segmentos móveis de sequestros ósseos devem ser removidos sem expor o osso que não está envolvido. Exodontias de dentes sintomáticos envoltos por osso necrótico exposto devem ser consideradas já que é pouco provável que a extração exacerbe o processo necrótico estabelecido.
Manejo conservador
As terapias conservadoras incluem manter a higiene oral ótima, eliminação de doenças dentais e periodontais ativas, uso tópico de exaguatórios bucais antimicrobianos e uso de terapia antibiótica sistêmica, quando requerido. A terapia conservadora é a base do tratamento e, embora possa não necessariamente levar à completa resolução das lesões, pode proporcionar alívio sintomático a longo prazo (10,11).
Um total de 3 trabalhos foram publicados, relatando o uso bem-sucedido da teriparatida no manejo da MRONJ. Cabe ressaltar que 2 das publicações referiam-se a casos clínicos e uma das publicações a uma série pequena de casos. As publicações revelam que essa alternativa é viável apenas para pacientes que estão sendo tratados com agentes antirresorptivos para osteoporose e desenvolvem MRONJ. Nesses casos clínicos a teriparatida foi utilizada na dose de 20 μg ao dia até a cura completa da lesão, que variou entre 4 semanas e 6 meses (21-23). Pode ser que esta medicação se torne uma alternativa aos tratamentos conservadores de eleição já descritos, entretanto, sua utilização ainda requer evidências mais robustas, que somente serão possíveis com o desenvolvimento de estudos metodologicamente desenhados para avaliar esse desfecho.
Outros tratamentos, como a aplicação tópica de ozônio, o transplante intralesional de células tronco hematopoiéticas e a adição de pentoxifilina e tocoferol ao tratamento antibiótico padrão, ainda são experimentais e requerem mais estudos. A associação de terapias convencionais à utilização de lasers de baixa intensidade tem apresentado resultados favoráveis. A terapia conservadora deve ser descontinuada caso exista progressão obvia da doença, dor não controlada pelos meios conservadores ou se o paciente tiver sua terapia antirresorptiva descontinuada pelo seu oncologista em decorrência da MRONJ (11).
Manejo invasivo (cirúrgico)
Inicialmente acreditava-se que o melhor manejo para a MRONJ seria o conservador, evitando-se procedimentos invasivos. Diversos relatos têm demonstrado a eficiência da manipulação cirúrgica dessas lesões. As técnicas cirúrgicas podem ser divididas em intervenções locais ou intervenções radicais, dependendo da extensão do osso a ser manipulado. As intervenções locais referem-se ao osso alveolar e podem ser executadas em ambulatório e são utilizadas nos estágios 2 e 3 enquanto intervenções radicais são executadas em pacientes com amplos segmentos de osso necrótico que atinjam estruturas ósseas além do processo alveolar e normalmente são executadas em centros cirúrgicos por profissionais especializados (estágio 3). Alguns cuidados são necessários na implementação de técnicas cirúrgicas. Essas técnicas requerem além da remoção do osso afetado, a remodelação de arestas para impedir que traumatizem a mucosa posteriormente. O paciente deve ser medicado com amoxicilina (2 gr/dia) e metronidazol (1gr/dia), iniciando 3 dias antes da cirurgia e terminando, pelo menos, 2 semanas após a cirurgia. A incisão deve ser ampla, incluindo toda a área de necrose e revelando as margens do osso sadio. Todo o osso necrótico deve ser removido até que seja visível um osso sadio, sangrante. Após a remoção do osso necrótico pode ser executada irrigação com solução antibacteriana como, por exemplo, PVPI 10% ou clorexidina 0,12%. A sutura deve provocar a coaptação total das bordas cirúrgicas, mas deve ser livre de tensão e executada, de preferência, com fio reabsorvível. O paciente deve ser instruído a utilizar enxaguatório antimicrobiano a base de clorexidina, 3 vezes ao dia, até a cura completa da ferida cirúrgica. As avaliações pós-operatórias devem ser periódicas e ao final dos 6 primeiros meses a avaliação radiológica deve ser realizada. Caso seja necessária reintervenção cirúrgica deve ser executada após 3 meses (10,11,24-29). Além de ser executada convencionalmente, a fase cirúrgica propriamente dita (excisão do osso necrótico), também pode ser executada com o auxílio de aparelho ultrassônico (piezelétrico) com potência de 72 W (30) e com laser Er:YAG (200 mJ, 20 Hz) fibra 1.3 mm de diâmetro e 12 mm de comprimento (31). No transoperatório (antes da remoção do osso necrótico) e no pós-operatório imediato, também pode ser utilizada a terapia fotodinâmica, com o objetivo de reduzir a carga bacteriana, com a aplicação de azul de metileno (50 mg/5 ml), e laser de diodo, com comprimento de onda de 680 nm, distância de 2 mm por 90 segundos (densidade de potência: 1.25 W/cm2 ; fluência: 112.5 J/cm2 ; energia total: 6.75 J), duas vezes por semana (32).
Alguns tratamentos adjuvantes tem sido descritos em combinação com o tratamento cirúrgico, como a utilização intraoperatória de lâmpada fluorescente para detectar as margens da necrose (VELscope; LED Dental, White Rock, British Columbia, Canadá) ou a aplicação do laser de baixa potência (Nd:YAG laser, 1064 nm; potência: 1.25 W; frequência: 15 Hz; diâmetro da fibra: 320 mm) que poderia ser utilizado intraoperatoriamente (repetindo a aplicação por 5 vezes) e posteriormente, em aplicações semanais, nas 6 primeiras semanas ou até a cura da ferida cirúrgica (28,29,33).
Resultados promissores foram encontrados com a aplicação local do plasma rico em plaquetas (PRP), do fator de crescimento derivado de plaquetas (PDGF) e da proteína morfogenética óssea 2 (BMP2) (11,22,34).
O pós-operatório também parece beneficiar-se da oxigenoterapia hiperbárica na utilização de 40 tratamentos compostos de 2 ATM, por duas horas, duas vezes ao dia e da ozonoterapia aplicada após a remoção de sequestros ósseos, em sessões de 3 minutos, duas vezes por semana, ambas associadas à terapia convencional cirúrgica e com antibióticos (35,36).
Prevenção
A prevenção é uma questão fundamental para reduzir a incidência de MRONJ. Sabe-se que pacientes que receberam tratamento odontológico preventivo, antes de iniciar o esquema terapêutico com drogas antirresorptivas e antiangiogênicas, tiveram uma redução de 50% no risco de desenvolver MRONJ. Sendo assim, todos os pacientes recém diagnosticados com mieloma múltiplo ou doenças oncológicas que apresentem metástase devem ser referenciados a um cirurgião dentista para que sejam submetidos a avaliação odontológica completa e para que o tratamento odontológico seja instituído antes do início da terapia oncológica. O plano de tratamento deve ser agressivo e deve objetivar a eliminação completa de infecções agudas e áreas de potencial infecção e a implementação de um protocolo preventivo e eficiente de higiene oral. Todos os restos radiculares e dentes não restauráveis devem ser extraídos, incluindo aqueles com mobilidade, envolvimento de furca, grandes cáries, e patologias periapicais. Todos os terceiros molares parcialmente irrompidos e os impactados associados com cistos odontogênicos devem ser considerados para a extração. A cirurgia oral deve ser realizada executando-se alveoloplastia, para a remoção de espiculas ósseas e arredondamento de protuberâncias, evitando, assim que o tecido mole possa ser traumatizado. Torus e exostoses também devem ser considerados para remoção cirúrgica, já que a mucosa sobrejacente usualmente é mais fina e consequentemente existe um alto risco de trauma e de osteonecrose. Preferencialmente, os procedimentos cirúrgicos devem ser feitos cerca de 3 semanas antes do início da terapia com antirresorptivos ou antiangiogênicos, para permitir a completa epitelização do leito cirúrgico. Caso o paciente utilize próteses totais ou parciais removíveis, estas devem ser reavaliadas quanto a sua estabilidade e adaptação, para evitar traumatismos à mucosa. Devem ser consideradas as hipóteses tanto de reembasamento como de execução de nova peça protética (37).
Para pacientes que já iniciaram a terapia antirresorptiva ou antiangiogênica e necessitam de procedimentos odontológicos, estes devem ser executados com o mínimo de trauma possível. As intervenções cirúrgicas devem ser evitadas, mas caso sejam necessárias devem ser executadas sob terapia antimicrobiana sistêmica associada a potentes antimicrobianos locais, que devem ser ministrados até a completa epitelização da região operada (27).
Há controvérsias quanto a suspensão do tratamento com bisfosfonatos orais ou denosumabe em pacientes que necessitam de extrações dentárias. Em 2011 o Conselho da Associação Dental Americana sobre assuntos científicos sugeriu que pacientes expostos a bisfosfonatos orais (por menos de 2 anos) ou a denosumabe, poderiam continuar a terapia durante o tratamento odontológico (38). Em pacientes utilizando BPs por mais de 4 anos e que tenham outros fatores de risco sistêmico para MRONJ (diabetes, fumo, artrite reumatoide, terapia adicional com glicocorticoides) é recomendada a suspensão da droga até a reparação completa da ferida cirúrgica (9,10,11). Ainda que não existam dados substanciais disponíveis para orientar as decisões relativas ao início ou a duração da suspensão das medicações, com base na fisiologia óssea e na farmacocinética das drogas, Damm e Jones propõe que estas sejam suspensas 2 meses antes do procedimento cirúrgico (39). A explicação reside no fato de que como 50% dos BPs séricos sofrem excreção renal, o maior reservatório dos BPs é o osteoclasto, cujo tempo de vida é de 2 semanas. Assim, a quantidade de BPs livres no soro seria extremamente baixa dois meses após a última dose de BPs orais, fazendo com que um período de suspensão de 2 meses fosse adequado antes de um procedimento odontológico invasivo (38). Já a AAOMS sugere que o intervalo de interrupção dos BPs seja de 3 meses antes e 3 meses após o procedimento cirúrgico (10,16). A decisão de descontinuar a terapia com agentes antirresorptivos também deve considerar o risco de fratura e implicações para a saúde esquelética (11).
É importante salientar que a suspensão da medicação antirresorptiva está condicionada tanto ao risco do paciente desenvolver MRONJ como ao risco do comprometimento da condição sistêmica que originou a prescrição da medicação. Segundo a International Task Force on Osteonecrosis of the Jaw “Não existe atualmente qualquer evidência de que a interrupção da terapia medicamentosa em doentes que necessitam de procedimentos dentários reduza o risco de MRONJ ou a progressão da doença.” Por outro lado, também afirmam que “Em indivíduos com fatores de risco significativos para MRONJ, incluindo pacientes oncológicos em terapia antirresorptiva de doses elevadas, bem como aqueles indivíduos com múltiplos fatores de risco para MRONJ, pode ser benéfico suspender o tratamento com BP ou denosumab após cirurgia oral até a cicatrização dos tecidos moles.” Concluem dizendo que o plano de tratamento deve ser individualizado de acordo com o risco de cada paciente. Assim se, por exemplo, um paciente com osteoporose apresenta um risco extremamente elevado de fratura óssea (fratura vertebral), o antirresorptivo não deve ser sunspenso (40).
Conclusões
No Brasil, somente em 2013 foi lançado um “alerta terapêutico de farmacovigilância sobre o uso de bifosfonatos associado ao risco de osteonecrose de mandíbula” pelo Centro de Vigilância Sanitária da Secretaria Estadual de Saúde de São Paulo (41). Apesar disso a Anvisa ressalta que não havia sido gerado sinal de risco sanitário no banco de dados do sistema de notificação da Agência e solicitava aos profissionais de saúde que notificassem, as suspeitas de reações adversas graves, relacionadas ao uso de bifosfonatos, pelo sistema NOTIVISA (http://www.anvisa.gov.br/hotsite/notivisa/index.htm). Trabalhos executados na Europa ressaltam que um quarto dos pacientes com MRONJ permanecem sem diagnóstico (42).
Nesse contexto também cabe ressaltar que os profissionais de saúde além de relatarem os efeitos adversos de drogas conhecidas, como os bisfosfonatos, também devem estar atentos a novos casos de MRONJ vinculados a outras medicações antirresorptivas (denosumabe) e a medicações antiangiogênicas. A cada dia novas drogas são apontadas como possuidoras de potencial farmacodinâmico para desencadear essa condição. Um exemplo recente são os inibidores do alvo da rapamicina de mamíferos (mTor) (43).
A MRONJ é uma condição de instalação rápida e que pode progredir ao ponto de comprometer sobremaneira a qualidade de vida do paciente. O conhecimento aprofundado dos mecanismos de desenvolvimento dessa condição e de suas características clínicas leva o profissional a executar um diagnóstico preciso e a instituir protocolos de prevenção adequados. Seu manejo ainda é avaliado pela comunidade científica como extremamente dificultoso, mas os inúmeros trabalhos publicados confirmam a tendência de deixar para trás uma opção mais conservadora de tratamento. Diversos protocolos de tratamento foram publicados e, hoje em dia, a maioria dos profissionais prefere optar por um tratamento que inclua a remoção do osso necrótico associando-a ao controle microbiano extenso.
Conclui-se que, para prevenir e executar um diagnóstico precoce, diminuindo a morbidade para o paciente, todos os pacientes que tenham o diagnóstico de uma doença que necessite terapias antirresorptivas ou antiangiogênicas devem ser encaminhados para avaliação odontológica logo após o diagnóstico (para que haja tempo suficiente de executar o tratamento odontológico antes do início da terapia medicamentosa) e devem ser seguidos rotineiramente, em intervalos curtos, enquanto perdurarem os efeitos sistêmicos das drogas.