Introducción
El uso de productos naturales es una práctica antigua y muy común en la historia de la humanidad. Existen varios factores que ayudan a difundir esta práctica, entre ellos, el uso como alternativa para el tratamiento de algunas enfermedades, en lo que respecta al control o la reducción de los síntomas e incluso el reemplazo de drogas sintéticas que, a su vez, pueden tener efectos secundarios indeseables. En este contexto, se estima que el 40% de los medicamentos disponibles se produjeron a partir de fuentes naturales: 25% de plantas, 13% de microorganismos y 3% de animales, todos los cuales han sido desarrollados y aprobados para su uso en las últimas décadas 1. Además, aproximadamente el 25% de los medicamentos aprobados por el Food and Drug Administration (FDA) y/o la Agencia Europea de Medicamentos (EMA) se derivan directa o indirectamente de las plantas 2,3.
La demanda de productos naturales para una vida saludable ha aumentado el uso de estos compuestos en alimentos, cosméticos y productos farmacéuticos. Su comercialización ha contribuido a un aumento en su consumo y, en odontología, también han sido objeto de marketing debido a la gran variedad de estos productos disponibles en todo el mundo. Por lo tanto, a menudo se induce a los consumidores a comprar estos productos sin siquiera demostrar su efectividad, ya que la presencia de compuestos naturales en su formulación, por sí sola, no garantiza su actividad biológica 4.
Desde un punto de vista ecológico, la cavidad oral es similar a varias secciones que forman el tracto intestinal, ya que también alberga una microbiota residente con una composición definida y característica. Las principales enfermedades que pueden afectar el ecosistema oral (caries y enfermedades periodontales) son afecciones multifactoriales mediadas por la acumulación de microorganismos en forma de biopelícula en la superficie de los dientes 5. Por lo tanto, la eliminación mecánica de las biopelículas por parte del paciente a través del cepillado dental con dentífrico juega un papel fundamental en el mantenimiento de la salud bucal 6.
En los últimos años, los extractos de plantas se han incorporado a la fórmula de dentífricos, desempeñando un papel cosmético. Sin embargo, el objetivo principal es mejorar la acción antimicrobiana y actuar como agentes terapéuticos. Por lo tanto, la acción terapéutica esperada no solo está relacionada con la presencia de fluoruro en su composición, que tiene como objetivo prevenir o revertir las lesiones incipientes de caries, sino especialmente con la presencia de otras sustancias incorporadas en sus fórmulas 7.
Entre las alternativas estudiadas, el propóleos, una resina producida por las abejas, ha mostrado importantes propiedades biológicas, como propiedades antioxidantes, antiinflamatorias, inmunomoduladoras y curativas que, combinadas con su efecto antimicrobiano comprobado, han llevado a la industria farmacéutica a explotar comercialmente esta sustancia al asociarla con dentífricos 8,9.
El extracto puro de propóleos ha demostrado propiedades antimicrobianas en los patógenos orales 10,11, y los estudios clínicos han demostrado la eficacia de la solución antiséptica en los niveles salivales de Streptococcus mutans (S. mutans) en niños con caries activa 12, así como en el tratamiento de gingivitis y periodontitis crónica 13. Además, los estudios in vivo con dentífricos que contienen extractos de propóleos de diferentes fuentes han demostrado efectos beneficiosos relacionados con la salud oral 14-16, incluidas las reducciones en los niveles de S. mutans 17.
Esta efectividad de incorporar extractos de propóleos en soluciones antisépticas y dentífricos sugiere un posible impacto positivo en pacientes con trastornos orales como caries dental, enfermedad periodontal, infecciones endodónticas y candidiasis, que involucran patógenos distintos. Por lo tanto, el presente trabajo tuvo como objetivo investigar la acción antimicrobiana in vitro de los dentífricos basados en propóleos sobre microorganismos que juegan un papel importante en la etiología de ciertas patologías orales, como S. mutans, Lactobacillus acidophilus (L. acidophilus), Fusobacterium nucleatum (F. nucleatum), Aggregatibacter actinomycetemcomitans (A. actinomycetemcomitans), Enterococcus faecalis (E. faecalis) y Candida albicans (C. albicans).
Materiales y métodos
Preparación de los dentífricos
Se evaluó la actividad antimicrobiana de tres dentífricos de propóleos - Noplak Max®, Protta® y Forever Bright®. Como control negativo, se utilizó un dentífrico cuya fórmula no contenía agentes antimicrobianos: Malvatrikids®. Los controles positivos fueron clorhexidina al 0.2% (Industria Farmacéutica Rioquímica Ltda.), diluida adicionalmente al 30% para igualar la concentración de clorhexidina de uno de los dentífricos evaluados, y extracto de propóleos (Apis Flora® al 11%). Para las pruebas, los dentífricos se diluyeron al 30% en agua destilada estéril y la suspensión resultante de cada muestra se esterilizó por filtración 18.
Microorganismos y condiciones de cultivo
La actividad antimicrobiana se determinó usando cepas de F. nucleatum (ATCC 10953) y A. actinomycetemcomitans (AUS 431) del Instituto de Ciencias Biomédicas de la Universidad de São Paulo (São Paulo, Brasil), y E. faecalis (ATCC 29212), S. mutans (ATCC 25175), L. acidophilus (ATCC 4356) y C. albicans (ATCC 90028), del Instituto Nacional para el Control de Calidad de la Salud de la Fundación del Instituto Oswaldo Cruz (Río de Janeiro, Brasil).
Se cultivaron bacterias anaerobias estrictas (F. nucleatum y A. actinomycetemcomitans) en caldo de tioglicolato (Fluid Thioglycolate medium Difco-BD, Detroit, MI, EE. UU.) enriquecido con hemina y vitamina K, y se incubaron en anaerobiosis a 37°C durante 48 h. Se usó agar BHI (Brain Heart Infusion Agar, Acumedia, Lansing, MI, EEUU) para el cultivo de E. faecalis y S. mutans, y agar de DeMan-Rogosa-Sharpe (MRS agar, Difco-BD) incubado en microaerofilia con 5% de CO2 para el cultivo de L. acidophilus. C. Albicans se cultivó en agar Sabouraud en aerobiosis a 37ºC.
Evaluación de la actividad antimicrobiana
La evaluación de la actividad antimicrobiana se realizó con base en el método de difusión de agar descrito anteriormente, con algunas modificaciones 19. Para la prueba, se prepararon placas de Petri con medio de cultivo específico para los microorganismos probados (Tabla 1). Tras la solidificación de los medios, se realizaron perforaciones de aproximadamente 6mm en la superficie del agar y se inocularon suspensiones microbianas estándar (Tubo de McFarland, escala n. ° 0,5).
Tabla 1 Condiciones de cultivo (incubación) de microorganismos para prueba de actividad antimicrobiana
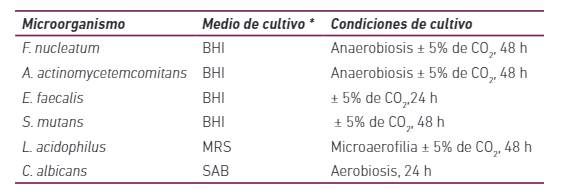
*BHI: Brain Heart Infusion agar añadido de hemina y vitamina K; MRS: agar de Man-Rogosa-Sharpe (Difco-BD); SAB: agar Sabouraud (Himedia, Mumbai - India)
Se dispensaron alícuotas de 25 µl de la solución original, así como cada dilución de los dentífricos probados en las perforaciones realizadas en los medios de cultivo. Las placas se incubaron luego en las condiciones descritas en la Tabla 1 y las zonas de inhibición del crecimiento bacteriano (halo) se midieron y expresaron en milímetros. Además, se realizaron diluciones sucesivas con agua destilada estéril en una proporción de 1:2 a una dilución de 1:32 para evaluar la dilución inhibitoria máxima (DIM) [20], aplicando 25 µL de cada dilución a las cavidades. La DIM se definió como la dilución más alta capaz de inhibir el crecimiento bacteriano in vitro. Las pruebas de actividad antimicrobiana para cada microorganismo se realizaron por triplicado.
Resultados
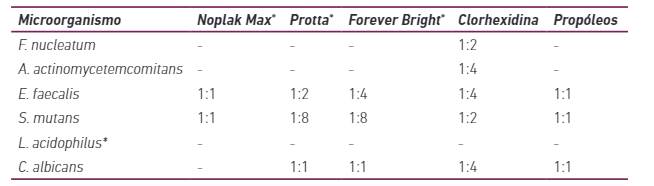
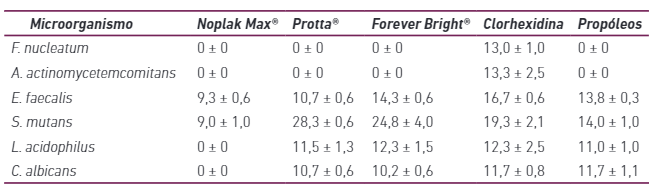
Los resultados relativos a las pruebas de actividad antimicrobiana de dentífricos en patógenos orales se describen en las Tablas 2 y 3.
Los resultados de la actividad antimicrobiana mostraron diferentes niveles de susceptibilidad en relación con los tres dentífricos probados (Tabla 2). Forever Bright® y Protta® mostraron el mayor espectro de acción antimicrobiana, inhibiendo cuatro de los seis microorganismos analizados. E. faecalis y S. mutans fueron inhibidos por todos los dentífricos, mientras que las bacterias anaerobias no fueron inhibidas por ninguno de los productos evaluados. En general, cuando hubo un efecto antimicrobiano, los diámetros de los halos de inhibición del crecimiento oscilaron entre 9mm y 28,83mm.
La determinación de la DIM confirmó la variabilidad en la susceptibilidad de los microorganismos (Tabla 2). La clorhexidina produjo halos de inhibición para los seis microorganismos, lo que confirma su amplio espectro de actividad antimicrobiana.
Tabla 2 Halo de inhibición del crecimiento bacteriano (mm) formado por los dentífricos evaluados, sin dilución (media ± desviación estándar)
Discusión
El presente estudio evaluó la acción antimicrobiana in vitro de los dentífricos de propóleos sobre los microorganismos patógenos S. mutans, L. acidophilus, F. nucleatum,A. actinomycetemcomitans, E. faecalis y C. albicans.
Se halló que los dentífricos Protta® y Forever Bright® tenían una mayor actividad antimicrobiana, inhibiendo cuatro de los seis microorganismos probados, mientras que Noplak® solo inhibía dos patógenos orales. Ninguno de los productos probados inhibió las especies periodontopatógenas A. actinomycetemcomitans y F. nucleatum. Este hecho también se observó con el extracto de propóleos utilizado como control positivo. Por otro lado, la clorhexidina mostró actividad antimicrobiana contra todos los patógenos probados.
Un estudio in vitro comparó la acción de los extractos de propóleos al 11%, 20% y 30% con los enjuagues bucales Periogard®, Listerine®, Malvatricin® y Parodontax® sobre microorganismos encontrados en la saliva humana. Tras la recolección de saliva, la adición de glucosa al 25% y la incubación, descubrió que los extractos de propóleos, incluso a diferentes concentraciones, tenían la misma eficacia de acción antimicrobiana en comparación con los productos industrializados 21. Estos resultados son similares a los dentífricos probados con las mismas sustancias que se encuentran en los enjuagues bucales.
En el caso de actividad contra bacterias cariogénicas, un doble ensayo que asocia el extracto etanólico de propóleos con fluoruro de sodio (NaF), De Carli et al. 22 demostraron la acción sobre la biopelícula dental y el riesgo de desarrollar lesiones de caries dental. Dos grupos recibieron la aplicación tópica de las siguientes sustancias: Grupo 1 (Gel A - Propóleos 5% + NaF 0,05%) y Grupo 2 (Gel B - Propóleos 5%). Los parámetros evaluados en el estudio fueron el recuento salival de S. mutans, la acumulación de biopelículas (IHOS - índice de higiene oral simplificado) y la cantidad activa de lesiones cariosas no cavitadas. Hubo una reducción en los niveles salivales de S. mutans y IHOS en ambos grupos, sin diferencias significativas entre ellos. También encontraron que la inactivación de las lesiones cariosas activas no cavitadas se produjo solo en individuos del grupo 1, probablemente debido a la capacidad de remineralización del esmalte ejercida por el fluoruro de sodio. El gel compuesto solo por propóleos mostró propiedades antibacterianas, pero sin acción remineralizante. Estos resultados son compatibles con los encontrados en este estudio.
Con respecto a las infecciones endodónticas, E. faecalis se ha considerado un patógeno muy importante y también puede estar presente como miembro de la microbiota normal 23. Por lo tanto, un dentífrico con actividad antimicrobiana en este patógeno podría tener un beneficio profiláctico, ya que podría reducir la carga microbiana en la microbiota oral y el riesgo de infección. Otra posibilidad de uso terapéutico del propóleos en infecciones endodónticas sería en la forma de medicamentos intracanales que contienen la resina. En este contexto, un estudio in vitro concluyó que el propóleos puede considerarse como una alternativa para el tratamiento de infecciones endodónticas persistentes 24.
Curiosamente, el uso de propóleos puro puede tener un mayor efecto inhibitorio sobre E. faecalis que en combinación con melaleuca. Por otro lado, se informó un efecto contrario en S. mutans, porque la asociación con Melaleuca demostró una actividad antimicrobiana superior. Los autores concluyeron que los dentífricos con compuestos naturales tienen potencial terapéutico, pero necesitan más investigación para su correcta aplicación terapéutica clínica 7.
Además de actuar sobre las bacterias planctónicas, el propóleos también actúa sobre los microorganismos en las biopelículas. Una comparación entre diferentes dentífricos ha demostrado que todos tienen efectos inhibidores del crecimiento en este modelo de biopelícula supragingival, lo que representa una reducción lineal de aproximadamente 80-88%, mientras que el enjuague bucal de propóleos no tuvo efecto 25. Por otro lado, varios estudios clínicos y microbiológicos han evidenciado que controlar el crecimiento de S. mutans puede causar una reducción significativa en la formación de biopelículas en la superficie dental 7,17,26,27. Desde esta perspectiva, los resultados del presente estudio mostraron evidencia de la capacidad de control del crecimiento de S. mutans mediante el uso de dentífricos Noplak®, Protta® y Forever Bright®. Especialmente de los dos últimos, ya que han demostrado ser más efectivos, ya que tenían una DIM de 1:8 en ambos dentífricos.
Los microorganismos periodontopatógenos evaluados (F. nucleatum y A. actinomycetemcomitans) no fueron inhibidos por los dentífricos probados, y no hubo efecto inhibidor del extracto de propóleos utilizado como control positivo. Estos hallazgos apuntan a la ausencia de actividad antimicrobiana de esta sustancia contra las dos bacterias gramnegativas probadas en el presente trabajo. Estas bacterias se clasifican como gramnegativas 28,29 y estudios previos han informado una menor sensibilidad de este grupo de bacterias al propóleos 30,31. De hecho, la actividad antibacteriana del propóleos se ha descrito como más alta que las bacterias grampositivas debido a la presencia de compuestos fenólicos como flavonoides, ácidos y ésteres aromáticos en la resina. Estos compuestos tienen efectos en las paredes celulares de estos microorganismos a través de un mecanismo aún desconocido 30. En este contexto, vale la pena señalar que las bacterias Gramnegativas tienen una membrana externa hidrófoba que cubre la pared celular, la cual está ausente de las bacterias grampositivas, lo que podría reducir o bloquear el acceso de compuestos fenólicos a la pared bacteriana 32. Sin embargo, se deben realizar más estudios para confirmar esta hipótesis.
En un estudio reciente que tuvo como objetivo comparar la eficacia antimicrobiana del extracto etanólico de propóleos (EEP) para el gluconato de clorhexidina (CHX) en S. mutans planctónicos, S. sobrinus, L. acidophilus, L. salivarius subsp. salivarius, A. actinomycetemcomitans, P. intermedia, P. gingivalis, S. aureus, E. faecalis, A. israelii y C. albicans, se observó que CHX exhibía concentraciones bactericidas más bajas que EEP contra las biopelículas de A. actinomycetemcomitans, S. aureus y E. faecalis. Se encontró que las concentraciones bactericidas y fungicidas de ambos agentes eran iguales con respecto a las biopelículas de Streptococci, P. gingivalis, A. israelii y C. albicans. Los resultados de este estudio revelaron que los propóleos eran más efectivos para inhibir las bacterias grampositivas que las bacterias gramnegativas en su estado planctónico, y se sugirió que el EEP podría ser tan efectivo como el CHX en microorganismos orales en su estado de biopelícula 33.
Un estudio realizado en 2017 probó un dentífrico basado en Melaleuca alternifolia y EEP polaco y encontró diferencias estadísticas significativas en el valor del Índice de Higiene Oral en el grupo que usa el dentífrico activo. En este estudio, los autores concluyeron que el uso de un dentífrico que contiene extracto de propóleos y aceite de Melaleuca ayuda a mantener el equilibrio de la microbiota oral y elimina los microorganismos que causan la enfermedad de las encías y la caries dental 15.
El origen geográfico del propóleos es importante para su aplicación terapéutica efectiva 8,34,35. Además, la proporción de sustancias presentes en el propóleos varía según su ubicación y momento de recolección 36). Esto podría explicar la no formación de halo de inhibición en la prueba Noplak® en algunas situaciones. Otro factor que podría justificar la no actividad de este dentífrico es la concentración de propóleos presente, ya que tiene su conocido efecto antimicrobiano. Se hicieron varios contactos con el fabricante para obtener información sobre el origen y la concentración de propóleos empleados en Noplak®, sin obtener una aclaración. Además, el efecto antagonista entre las sustancias presentes en la fórmula podría ser otro factor que estaría interfiriendo con la actividad antimicrobiana.
Es importante recordar que los microorganismos se probaron por separado, es decir, fuera de las condiciones orales en las que existe la presencia de saliva, pH variable y flora bacteriana variable, en términos cualitativos y cuantitativos, de individuo a individuo. Tales situaciones son totalmente diferentes de las que se encuentran en las pruebas in vitro, lo que enfatiza la necesidad de realizar más estudios para demostrar la efectividad de estos dentífricos. Por lo tanto, se necesita más investigación in vivo para confirmar la efectividad del uso de los dentífricos a base de propóleos como alternativas auxiliares a los tratamientos de enfermedades orales.
Los propóleos, debido a su composición química diversificada, tiene actividades biológicas variadas, que incluyen acción antiinflamatoria, cicatrizante, antibacteriana, fungicida, antiviral, inmunoestimuladora, analgésica, anestésica, antitumoral y antioxidante 37.
Conclusiones
Por lo tanto, el uso de un dentífrico que contiene propóleos para su uso eventual como complemento terapéutico en odontología es justificable considerando tales actividades farmacológicas. En los productos probados, la actividad antimicrobiana más completa se evidenció en dentífricos Protta® y Forever Bright® contra los microorganismos S. mutans, E. faecalis y C. albicans, lo que confirma el posible uso en patologías relacionadas con estos agentes.