Introducción
El labio con/sin paladar hendido (LH±PH) es una de las malformaciones craneofaciales congénitas más comunes a nivel mundial 1. En Colombia, el Instituto Nacional de Salud reportó una prevalencia de 8,5 por 10.000 nacidos vivos en el 2017 2. Esta malformación se presenta como resultado de la falta de fusión de las masas mesenquimatosas de las prominencias nasales y las maxilares que debería darse entre la sexta y séptima semana del desarrollo intrauterino, comprometiendo la formación de un labio superior, paladar primario y/o paladar secundario intactos 3,4. LH±PH se puede manifestar de forma sindrómica en el 30% de los casos, y no sindrómica (de manera aislada) en el otro 70% 5. En ambos tipos de LH±PH, además de las repercusiones médicas que conlleva esta anomalía, se presentan grandes compromisos a nivel orofacial como incompatibilidad labial y del velo faríngeo, respiración oral, hipoplasias de esmalte, caries dental, gingivitis, periodontitis, entre otros 6. Adicionalmente, se ha reportado que las personas con LH±PH presentan mayor dificultad en la higiene oral afectando aún más su calidad de vida 7. Aunque existen múltiples factores ambientales asociados con la etiología de LH±PH, el componente genético es uno de los aspectos de mayor contribución en su aparición. De hecho, se ha reportado que variaciones en la secuencia de múltiples genes son necesarias y predisponen a la presentación de esta malformación 1,8-10.
La saliva tiene funciones esenciales relacionadas con la protección, lubricación, aclaramiento y dilución de azúcares y ácidos, capacidad amortiguadora, remineralización dental y propiedades antimicrobianas 11-13. Por lo tanto, alteraciones que afecten la función, composición y flujo salival pueden comprometer el equilibrio ecológico de la cavidad oral 14,15. La disfunción salival es indicativa de la presencia de enfermedades sistémicas y orales; por esta razón, la saliva puede ser utilizada con fines diagnósticos, por lo que ha sido investigada como fuente de biomarcadores específicos para enfermedades humanas como cáncer, periodontitis e inclusive en LH±PH 16-18. A pesar del importante papel que desempeña la saliva en la homeostasis oral, no es evaluada rutinariamente en la práctica clínica general y de pacientes con diferencias craneofaciales como el LH±PH. Las diferencias en las características bioquímicas salivares con relación a pacientes sanos podrían actuar como posibles factores contribuyentes a la perdida de la salud bucal en los pacientes con LH±PH no sindrómicos. La presente investigación tiene como objetivo comparar la funcionalidad de las glándulas salivales (composición, tasa de secreción, pH, capacidad amortiguadora de la saliva, cantidad de células viables de streptococcus mutans) en niños con LH±PH con la de niños sin LH±PH.
Materiales y métodos
Población de estudio
Este estudio descriptivo transversal contó con una muestra de 42 niños entre los 5 a 10 años (17 niños con LH±PH no sindrómico de la Fundación Clínica Noel y 25 niños de grupo control -sin LH±PH- de la ciudad de Medellín). Los niños incluidos en el estudio no presentaban compromiso sistémico, alteraciones del desarrollo dental ni aparatología ortodóntica, además, se excluyeron niños con alguna discapacidad que impidiera la recolección de las muestras, y niños que hubieran recibido terapia antibiótica o antimicótica 3 meses previos a la toma de la muestra. Los padres de familia y los menores recibieron información sobre los objetivos del estudio y firmaron un consentimiento y asentimiento informado. Este estudio fue aprobado por el Comité de Ética de la Facultad de Odontología de la Universidad de Antioquia (acta número 03/2017) y por el Comité de Ética de la Fundación Clínica Noel (23/02/2017).
Recolección de muestras de saliva
Para minimizar el efecto de los ritmos circadianos se colectaron de manera simultánea muestras de saliva no estimulada (SNE) y saliva estimulada (SE) una hora después del desayuno. Los niños suspendieron los enjuagues bucales al menos siete días previos a la toma de la muestra, realizaron cepillado de dientes en la mañana después del desayuno y no consumieron ningún alimento una hora antes del muestreo. Las muestras se almacenaron a 4°C en hielo y se procesaron dentro de las siguientes 2 h.
Análisis fisicoquímico de SNE y SE
Se calculó la tasa secreción salival dividiendo el volumen de saliva colectado por el tiempo de estimulación de las glándulas salivales (5 min). Posteriormente, el pH de la saliva fue estimado mediante el uso de un pHmetro digital (HI 2221, HANNA Instruments, Colombia). Para determinar la capacidad amortiguadora de la saliva se realizó el método de Ericsson modificado 19. Las muestras fueron alicuotadas por duplicado y centrifugadas a 8000 rpm por 10 min a 4ºC. Los sobrenadantes se congelaron a -20ºC para realizar cuantificación de iones y proteína total.
Recuento de estreptococos del grupo mutans (EM)
Se realizaron microdiluciones de las muestras de SNE y SE en solución salina 0,9%. 100 µL de las diluciones 10-1- 10-3 fueron inoculados en Agar Mitis Salivarius (Difco Laboratories, Le pont de claix, France) con telurito de potasio al 1% (Lab M Ltd, Lancashire, UK), 10% de sacarosa (Fisher Chemical, Waltham, USA) y 0,2 U mL-1 de bacitracina (Sigma-Aldrich, Missouri, USA). Los cultivos fueron incubados a 37°C por 48 h en 5% de CO2. Posteriormente, se realizó el recuento de células viables el cual fue expresado como UFC mL-1 (Unidades Formadoras de Colonias por mililitro de saliva).
Cuantificación de proteína total
Se empleó el método de Bradford con el kit Bio-Rad Protein Assay (Sigma-Aldrich, Missouri, USA). Se realizó la curva de calibración con la proteína estándar albúmina de suero bovino-BSA. Posteriormente, para determinar la concentración de proteína, se mezclaron 10 µL de cada una de las muestras de saliva con 200 µL del colorante azul brillante Coomassie G-250. Las muestras fueron incubadas a temperatura ambiente por 5 min y se midió la absorbancia a una densidad óptica (DO) de 595 nm.
Cuantificación de iones de calcio
Se utilizó el kit Calcium Colorimetric Assay (Sigma-Aldrich, Missouri, USA). Luego de realizar la curva de calibración a partir de una solución de calcio 5 mM, se realizó la cuantificación de iones de calcio. Se mezclaron 40 µL de cada muestra con 10 µL de agua ultrapura. Posteriormente, se agregó 90 µL de reactivo cromogénico y 60 µL de buffer de calcio. Las muestras fueron incubadas a temperatura ambiente por 10 min y se midió la absorbancia (DO575nm).
Cuantificación de fosfato
El kit Phosphate Colorimetric Assay (Sigma-Aldrich, Missouri, USA) fue empleado para medir los niveles de fosfato. La curva de calibración se realizó a partir de una solución estándar fosfato de 0,1 mM. Antes de cuantificar los niveles de fosfato, la SNE y SE fue diluida en agua ultrapura (1:4). Posteriormente, 2 µL de las muestras fueron mezcladas con 198 µL de agua ultrapura y 30 µL de reactivo fosfato. Las muestras fueron incubadas a temperatura ambiente por 30 min y se determinó la absorbancia (DO650 nm).
Cuantificación de magnesio
Se usó el kit Magnesium Assay (Sigma-Aldrich, Missouri, USA). La curva de calibración se realizó a partir de una solución estándar de magnesio. Posteriormente, para determinar la concentración de magnesio en las muestras, 10 µL de SNE y SE fueron homogenizadas con 40 µL agua ultrapura. Seguidamente, se adicionó 50 µL de la mezcla de reacción (Magnesium Assay Buffer, Magnesium Developer y Magnesium Enzyme Mix). La absorbancia fue medida (DO450 nm) luego incubar las muestras a 37ºC por 10 min.
Análisis estadísticos
Los análisis estadísticos se realizaron usando el programa SPSS versión 21. Las variables cuantitativas fueron descritas mediante el uso de medidas de tendencia central. Para contrastar la normalidad de los datos se realizó la prueba de Kolmogorov-Smirnov. Para realizar comparaciones entre grupos se realizó la prueba no paramétrica de Mann-Whitney. Los valores de p<0,05 fueron considerados significativos.
Resultados
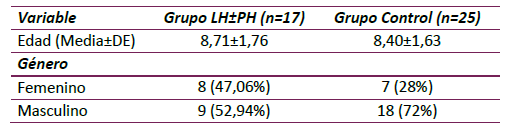
Descripción de la población de estudio
El promedio de edad de los pacientes con LH±PH fue de 8,71 años y del grupo control 8,40 años. El género masculino predominó en ambos grupos (Tabla 1). En el grupo LH±PH, la anomalía más común fue labio y paladar hendido unilateral izquierdo (41,18%), seguida de labio y paladar hendido unilateral derecho (35,29%), paladar hendido (17,65%), y labio y paladar hendido bilateral (5,88%).
Análisis fisicoquímico de saliva estimulada y no estimulada
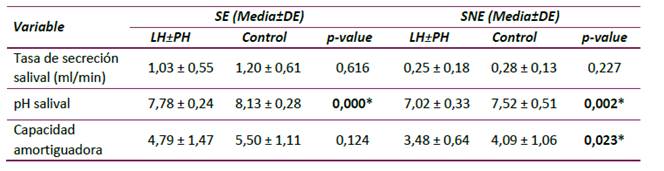
En las tablas 2 y 3 se describen las características fisicoquímicas de SE y SNE de los grupos LH±PH y control. Estas características fueron significativamente diferentes dentro de cada grupo al comparar SE frente a SNE (SE: mayores tasas de secreción salival, pH salival y capacidad amortiguadora) (p˂0,05). A pesar que los valores de secreción y pH salival de los grupos LH±PH y control fueron similares, la tasa de secreción salival de SE y SNE del grupo control mostró una tendencia a ser mayor. La capacidad amortiguadora de la saliva del grupo LH±PH fue más baja tanto en SE como en SNE, comparada con el grupo control (Tabla 2).
Tabla 2 Comparación de las características fisicoquímicas salivares según la presencia o ausencia de LH±PH en ambos tipos de saliva (SE y SNE).
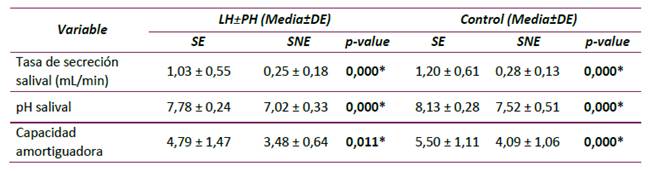
*p<0,05. Prueba de Mann-Whitney.
Al comparar las características fisicoquímicas de SE entre ambos grupos, los valores correspondientes a la tasa de secreción y capacidad amortiguadora no tuvieron diferencias estadísticamente significativas (p˃0,05). En comparación, sólo la capacidad amortiguadora de la SNE en el grupo LH±PH fue estadísticamente menor en comparación con la del grupo control (p=0.023). En cuanto al pH salival de SE y SNE de ambos grupos, fue posible establecer una disminución significativa en los valores de pH del grupo LH±PH obtenidos en SE y SNE al compararlos con los valores control (p˂0,01) (Tabla 3).
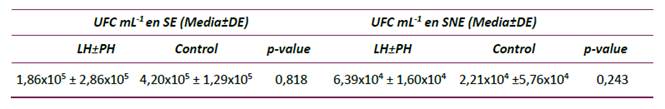
Recuento de estreptococos del grupo mutans (EM)
Los niveles de EM fueron superiores en SE en ambos grupos, en comparación con lo observado en SNE. A pesar de no encontrar diferencias estadísticamente significativas en los recuentos en SE y SNE en los grupos evaluados, se evidencia un notable incremento en los recuentos de EM de SNE en el grupo LH±PH (Tabla 4).
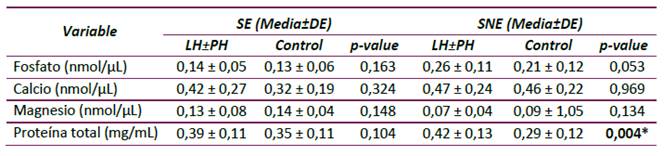
Proteína total, iones de calcio, fosfato y magnesio en SE y SNE
Se observó que los niños con LH±PH presentaron un leve aumento en los iones fosfato, calcio y proteína total, y una disminución en la concentración de magnesio tanto en SE como SNE. Sin embargo, solo se presentaron diferencias significativas en proteína total de SNE, evidenciando que la concentración de estas biomoléculas es superior en SNE de niños LH±PH (Tabla 5).
Discusión
La comunicación constante entre las cavidades oral y nasal de pacientes con LH±PH, además de comprometer la alimentación y la respiración, puede alterar el ecosistema oral generando un entorno diferente en comparación con individuos normales. También se asume que esta diferencia craneofacial influye en la composición, la velocidad del flujo salival, la secreción sistémica de las glándulas salivales y puede alterar la microbiota oral en niños que presentan esta anomalía 20,21. Por consiguiente, en este estudio se analizaron algunas características fisicoquímicas de la saliva, que incluyeron evaluación de la tasa de secreción, pH y capacidad amortiguadora de SE y SNE, así como la cuantificación de iones, proteína total y células viables de EM en un grupo de niños con LH±PH y un grupo de niños control.
La SNE proporciona una fuente de información útil sobre su contribución en la homeostasis oral debido a que se encuentra en reposo la mayor parte del día, y es considerada el principal determinante para el barrido oral confiriendo un fuerte efecto protector contra la caries, por ejemplo 22,23. Por otro lado, la SE también cumple funciones protectoras, pero, aunque se encuentra en boca por menos tiempo, representa la secreción normal como respuesta a la ingesta de alimentos y a diversos estímulos mecánicos u olfativos, generando un aumento en la tasa de flujo y el pH salival, y un cambio en la composición de iones y concentración de proteínas secretadas 22. Por lo tanto, se observó que el pH de la SE de los niños de ambos grupos fue alto en comparación con los valores de referencia 5-7,24), debido a que al estimular las glándulas salivales se secretan proteínas con capacidad buffer y se activa el sistema bicarbonato 12, ocasionando un incremento en los niveles basales del pH durante el tiempo del estímulo. Sin embargo, a pesar de evidenciar que los valores del pH de SE y SNE de los niños con LH±PH y control son superiores a 7,0, se encontraron diferencias significativas; estos resultados no concuerdan con los reportados en otros estudios que indican que el pH de la saliva de niños con LH±PH es igual al de los niños del grupo control 25,26. Además de evidenciar un incremento en el pH de la SE de los niños con LH±PH y control, fue posible determinar que la capacidad amortiguadora de la SE de los niños con LH±PH es baja ((5,5) 24) en comparación con el grupo control, lo que podría indicar que la habilidad de la saliva de estos niños para contrarrestar los cabios de pH de cavidad oral es insuficiente.
La composición de la saliva varió de acuerdo con su tipo (estimulada o no estimulada) como respuesta a la función que cada una de ellas cumple 22,23. Al comparar los grupos se evidenció que aunque la concentración de fosfato y calcio no fueron significativamente diferentes a las del grupo control, la SNE de los niños con LH±PH presentaron un aumento en los niveles de estos iones y una disminución en los niveles de magnesio. Este hallazgo está en concordancia con estudios realizados anteriormente en SNE 21,26,27.
La concentración de proteína total en SNE fue mayor en niños con LH±PH; estos resultados concuerdan con los hallazgos de estudios recientes que reportan un incremento estadísticamente significativo en comparación con el grupo control 21,26. Es importante mencionar que la saliva primaria, formada a nivel de los acinos, principalmente los serosos, aporta el contenido de proteínas a la saliva total, la cual es modificada a nivel de los conductos para ser finalmente secretada; además, las variaciones en los niveles de proteína total ocurren en respuesta a cambios fisiológicos o a diferentes estados patológicos 12,15,28. Deshpande y colaboradores establecieron que existe correlación entre los niveles de proteína total en SNE en niños con defectos congénitos asociados a LH±PH, y establecen, por lo tanto, que la saliva puede ser utilizada como un biomarcador que puede ayudar a comprender la constitución genómica de defectos congénitos 28. Además, se ha reportado que el incremento en los niveles de proteína total puede deberse a la sobre-expresión de varias proteínas secretadas (actina, cistatinas salivales, queratinas y otros activadores de queratinocitos) que son de vital importancia para la protección general y la regeneración tisular en pacientes con labio y paladar hendido 27,29.
El aumento en la concentración de proteína total en SNE se podría explicar desde el punto de vista biológico y genético asociado a LH±PH 30. Aunque en este estudio no se hizo una caracterización genética de los pacientes con LH±PH, ni se identificaron posibles genes asociados al defecto, estos resultados podrían sugerir la presencia de una alteración en la formación de las glándulas salivales, como por ejemplo atrofia de los acinos mucosos y obliteración de los conductos, lo cual explicaría además la disminución observada en el pH y la capacidad amortiguadora de la SNE. Esta especulación estaría en línea con lo reportado en recientes investigaciones en ratones con defectos genéticos asociados a LH±PH, en donde además de la hendidura, se presentaron alteraciones en la morfogénesis y función de las glándulas salivales, principalmente las submandibulares. Como consecuencia, la salud oral fue afectada debido a la disminución del flujo salival, capacidad buffer y al aumento de los niveles de Streptococcus mutans16,20. Además, como los pacientes con LH±PH pueden presentar un espectro fenotípico, se esperaría que retengan alguna función de la proteína afectada. En consecuencia, sería razonable esperar interrupciones más sutiles en la función de la glándula salival 20, tal como se evidencia en este estudio. De allí la importancia de realizar este tipo de investigaciones que proporcionen las bases para posteriores estudios de tipo genético que corroboren las hipótesis planteadas a partir de los resultados del orden fenotípico aquí encontrados.
Así mismo, como la saliva es el principal vehículo de movilización y transmisión de microorganismos, se optó por estimar los niveles de EM en este fluido. Estudios previos han señalado que los niveles de EM en saliva aumentan en pacientes con LH±PH 25,31. De manera similar y pese a no encontrar diferencias significativas, se evidencio una mayor cantidad de células viables en SNE de pacientes con LH±PH comparado con el grupo control. Ahluwalia y colaboradores determinaron que los niveles de EM de SNE de niños con LH±PH fueron significativamente elevados, probablemente porque luego de consumir carbohidratos fermentables, presentaban un tiempo de aclaramiento oral más prolongado que los niños del grupo control, constituyendo un factor de riesgo para el desarrollo de caries 32. Sin embargo, los resultados de este estudio podrían deberse a la disminución encontrada en el pH y capacidad amortiguadora en SNE de este grupo; lo que podría darle mayor susceptibilidad a la colonización bacteriana.
Conclusiones
La saliva no estimulada de los niños con LH±PH presentó una mayor concentración de proteína total y una disminución del pH y capacidad amortiguadora con respecto al grupo control; lo que podría predisponer a una menor habilidad para neutralizar ácidos y por lo tanto menor capacidad a la remineralización. Aunque, estas diferencias podrían explicarse desde el punto de vista biológico por una alteración en la formación y función de las glándulas submandibulares que más aportan a la secreción de SNE; deben realizarse estudios para corroborar esta hipótesis. Sin embargo, estos resultados podrían resaltar la importancia de evaluar la SNE en los programas de salud oral de pacientes con LH±PH.