Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.18 no.1 Bogotá Jan./Mar. 2003
Utilidad de un protector desechable de látex para el tubo de inserción del endoscopio
Martín A. Gómez (1), Roberto Olivares (2), Oscar O. González (3), Vicky Valero (4)
(1) MD. Internista gastroenterólogo, Universidad Nacional de Colombia. Gastroenterólogo - ISS, Hospital Tunal.
(2) MD. Gastroenterólogo - ISS.
(3) MD. Internista Gastroenterólogo ISS.
(4) MD. Epidemióloga clínica, Universidad Nacional de Colombia.
Resumen
Con la epidemia mundial del sida y el creciente aumento de infecciones como la hepatitis B y C, los pacientes son cada vez más temerosos sobre el riego de contaminación por medio de los equipos de endoscopia digestiva, lo cual es muy difícil si se siguen los delineamientos publicados para desinfección de estos equipos. Pero desgraciadamente hasta 70% de las instituciones no los acatan lo cual aumenta aún más los temores de nuestros pacientes. Esto nos obliga a exigir que estas normas se cumplan y aumentar la confianza de los pacientes a este examen. Nosotros decidimos realizar un estudio prospectivo para evaluar cuál es el conocimiento que tienen los pacientes sobre la desinfección de los equipos y cual sería la utilidad de un "protector externo" desechable que cubre la superficie externa del endoscopio y que se cambia con cada paciente. Se fabricaron 50 protectores creados y diseñados en nuestra unidad los cuales son de látex y miden 80 cm de largo por 9,5 mm de ancho, tienen un orificio en la parte distal para dejar libre la punta del endoscopio y se presentan de forma enrollada como un condón para permitir su colocación
Materiales y métodos: Se incluyeron 100 pacientes consecutivos que asistieron al servicio para endoscopia digestiva alta de los cuales se asignaron aleatóriamente al grupo I; 50 pacientes con protector que cubre todo el tubo de inserción y grupo II, 50 pacientes sin protector. Antes de la endoscopia todos los pacientes contestaron un formulario que además de los datos demográficos contenía cuatro preguntas; 1° ¿sabe usted cómo se desinfectan los equipos de endoscopia?, si la respuesta era negativa se les explicaban los lineamientos de la Asociación Americana de Endoscopia Gastrointestinal (ASEG). Posteriormente se preguntaba; 2° ¿tiene dudas sobre la efectividad de estos métodos?, 3° sabiendo los costos, ¿debería utilizar un equipo diferente para cada paciente? 4° ¿debería usarse un protector externo desechable, así solo cubra 50% del contacto con las secreciones?.
También se evaluó la duración de la endoscopia, la tolerancia de procedimiento y la facilidad de la limpieza mecánica en una escala análoga visual, y su duración. La duración de la fase de desinfección fue en todos 20 minutos porque en los dos grupos se siguieron de forma estricta los delineamientos publicados.
Resultados: No se encontraron diferencias de edad (50.0 +/-15.8 vs. 48+/-15.7 años) ni de sexo (hombres 42 vs. 46%) para el grupo I y II respectivamente. El 98% de los 100 pacientes dieron una respuesta negativa a la primera pregunta y 72% manifestaron dudas sobre el método de desinfección después de su amplia explicación; 24% desearían que se les realizara; externo así este no cubra la parte interna del equipo. No se encontraron diferencias en las indicaciones para la endoscopia en los dos grupos. Los principales hallazgos endoscópicos fueron; gastritis crónica antral en 70% grupo I vs. 64% grupo II, hernia hiatal 28 vs. 32% y gastritis erosiva 12 vs. 14% (p = ns). La duración de la endoscopia fue de 121.8+/-53 segundos para el grupo I y de 125.4+/-50 para el grupo II (p = 0.263). La tolerancia al examen por el paciente fue calificada con 33.2 en el grupo I y 27.5 en el grupo II (p=ns). No se encontraron diferencias entre los dos grupos en cuanto a la tolerancia al examen valorada por el médico. La limpieza mecánica duro 523 segundos en el grupo I y en el II 595 (p=0.01) la facilidad de la limpieza mecánica valorado por el auxiliar en la escala análoga visual fue 42 en el grupo I vs. 64 en el I (p=0.001).
Conclusiones: El cumplimiento estricto de las indicaciones para desinfección de los equipos de endoscopia garantiza el muy bajo riesgo de infección con este examen. Este estudio mostró que los pacientes desconocen cómo se desinfectan los equipos y quedan con dudas a pesar de la explicación de los delineamientos, las cuales aumentarán aún más cuando se enteren de que estos no se siguen de forma adecuada. Este protector externo, único en el mundo y creado por nosotros, puede ser útil (sin reemplazar ninguno de los delineamientos establecidos para desinfección) para aumentar la confianza de nuestros pacientes para decidir realizarse una endoscopia digestiva alta además de facilitar la limpieza mecánica del equipo ya que evita el contacto de las secreciones con la parte externa del endoscopio es decir en 50% de la superficie. Asimismo el protector no interfirió con el examen ni con su tolerancia.
Introducción
La endoscopia digestiva alta es un examen de alta tecnología, fácilmente realizado por personal entrenado; es además económico, y de gran utilidad no sólo en nuestro medio sino en el mundo debido a la alta prevalencia de cáncer gástrico (1). Todo esto hace que cada día se realicen más endoscopias. Anualmente, sólo en Estados Unidos se realizan más de 10 millones de endoscopias altas. En la clínica Carlos Lleras- I.S.S. de Bogotá, se realizan aproximadamente 800 endoscopias al mes. Además, con la mayor difusión de sus indicaciones, su amplia disponibilidad y la importancia que adquiere cada día más la detección temprana y la prevención del cáncer gástrico, la cantidad de endoscopias tiende a aumentar en gran número (2).
Si a este aumento del número de exámenes agregamos el aumento en la dinámica de transmisión de infecciones graves como el HIV, la hepatitis B y C, y la presencia cada vez mayor de pacientes inmunosuprimidos, se hace mayor el riesgo de transmisión de las infecciones y se generan dudas en los pacientes acerca de la limpieza de los equipos. Por ello, es importante que sigamos de forma estricta las medidas de prevención para la transmisión de infecciones (3,4) a través del cumplimiento estricto de los delineamientos de desinfección establecidos por las sociedades de endoscopia e implementemos nuevas medidas para control de las infecciones y para generar confianza en nuestros pacientes.
Marco teórico
Transmisión de infección por endoscopia gastrointestinal
En la literatura hay varios artículos (5-7) que discuten la transmisión de infecciones durante la endoscopia gastrointestinal. Un artículo de revisión (6) citó 281 casos de transmisión de microorganismos por la endoscopia, 240 de ellos antes de 1988. En este año la Sociedad de Enfermedades Gastrointestinales (SGNA) (8), y la Sociedad Americana de Endoscopia Gastrointestinal (ASGE) (9) publican los delineamientos para limpieza y desinfección de los endoscopios. Últimamente la preocupación sobre los procedimientos de limpieza y desinfección en la endoscopia gastrointestinal se ha enfocado sobre la transmisión potencial del virus de la inmunodeficiencia humana (HIV) y hepatitis B (HBV). Sin embargo el CDC declaró que los procedimientos actuales para la desinfección de endoscopios contaminados con estos virus son adecuados y garantizan su seguridad (10,11). Desde 1988, no se ha informado casos de transmisión de HIV o HBV.
Los factores más importantes en la transmisión de microorganismos durante la endoscopia gastrointestinal son la concentración y el tipo de microorganismo, la eficacia y la adherencia a los procedimientos de limpieza y desinfección. Los organismos más frecuentemente reportados son E. coli (12), pseudomonas (13), klebsiella (12), salmonella (12), y hepatitis C (14). La mayoría de los episodios de infección se ha atribuido a los errores en los delineamientos publicados. Las bacterias o virus transmitidos por endoscopios inadecuadamente limpiados pueden concentrarse en las uniones o hendiduras, del equipo, el agua embotellada contaminada, el uso inadecuado de maquinas automáticas, uso de soluciones desinfectantes inadecuadas, y el secado inadecuado para el almacenamiento nocturno del equipo.
Procedimientos para la desinfección de los endoscopios
Las siguientes son las normas de la ASGE para limpieza y desinfección de los endoscopios flexibles publicadas en 1988 (9). Comprenden tres fases:
Limpieza mecánica
El primero y más importante paso en la prevención de infección durante la endoscopia es la limpieza mecánica. La eficacia de la limpieza y la desinfección es personal-dependiente; por lo cual el entrenamiento y control de calidad es esencial para asegurar su efectividad.
La limpieza manual es sumamente importante y debe comenzarse inmediatamente después del procedimiento limpiando el endoscopio con una tela o una esponja con detergente. Después del examen, un endoscopio retiene materiales orgánicos como sangre, moco y saliva que son ricos en microorganismos. Si estas no se retiran se pegan a la superficie del endoscopio evitando la penetración del desinfectante lo cual lo hace ineficaz.
Debe cepillarse el interior del equipo y la punta del mismo al igual que las válvulas, y las áreas menos accesibles como lo recomiende cada fabricante del endoscopio. Según el Congreso Mundial de Gastroenterología (15), pueden usarse máquinas de lavado automáticas para los procedimientos de desinfección, pero ellos no reemplazan nunca la limpieza manual. Los accesorios de endoscopia que penetran la mucosa gastrointestinal deben esterilizarse después de cada uso (16).
Desinfección química
Después de la limpieza mecánica, el próximo paso es la desinfección química de alto nivel. El glutaraldehido al 2% es el desinfectante recomendado debido a su espectro amplio de eficacia contra las bacterias, virus y hongos; es deseable una inmersión completa del endoscopio por espacio de 20 minutos y cada canal del endoscopio debe irrigarse con el desinfectante.
Aunque el óxido de etileno es un método eficaz de esterilización, no es práctico para el uso rutinario ya que el proceso requiere varias horas. El autoclave también es un método de la esterilización eficaz, pero no es práctico porque destruye el endoscopio.
Las soluciones de glutaraldehido son eficaces durante 14 a 30 días pero deben supervisarse para asegurar que se mantengan concentraciones eficaces. Las soluciones del glutaraldehido pueden ser potencialmente lesivas para el personal de salud y el paciente (17); por ello deben enjuagarse los instrumentos completamente para quitar el glutaraldehido y el personal debe llevar ropa de protección y trabajar en un área bien ventilada.
Irrigación y secado
Él enjuagado requiere vaciar los grandes volúmenes de agua que está en todos los canales para lograr la evacuación completa del bactericida. El secado es especialmente importante para prevenir la proliferación de bacterias residuales y hongos durante el almacenamiento. Después de enjuagar con agua estéril o filtrada (0.2-micron de tamaño del poro) los instrumentos son secados con aire forzado y guardados en una posición colgante. El alcohol puede promover el secado e inhibir el crecimiento de organismos en los instrumentos guardados (18).
Un factor importante en el proceso de la desinfección es adhesión del personal de salud (gastroenterólogo, endoscopista, auxiliares de enfermería, etc) a las pautas establecidas para la limpieza y desinfección de los endoscopios. Dos estudios han encontrado que en 30 a 70% hay incumplimiento con las pautas recomendadas (19,20). En la inspección de las unidades de endoscopia hay una proporción alta de incumplimiento a las normas (21).
Justificación:
Fundamentos para el desarrollo de un protector desechable para los endoscopios
Nosotros consideramos que es de suma importancia la prevención de la transmisión de infecciones a través de la realización de los diferentes procedimientos endoscopicos, pero principalmente de la endoscopia digestiva alta. Ninguna medida adicional es extrema y cualquier precaución no es excesiva si se tiene en cuenta que desconocemos en la mayoría de situaciones el estado infeccioso de un paciente y que un caso de infección transmitida por la endoscopia es una conducta iatrogénica con las implicaciones para él médico y el paciente que esto trae, mayores aun si se tienen en cuenta las epidemias del sida y hepatitis.
Existen instituciones donde el volumen de endoscopias es muy alto, lo que significa que el tiempo de desinfección puede verse disminuido, acarreando mayor riesgo de transmisión de la infección, aunque se conoce que la limpieza mecánica limpia 99% de las bacterias que se encuentran en el equipo después del examen y que el tiempo de contacto del equipo con el desinfectante puede ser de 10,15 ó 20 minutos con adecuada inhibición de las infecciones, lo cual hace que hasta 70% de instituciones no se adhieren estrictamente a los criterios para desinfección de endoscopios de la ASGE, que recomienda 20 minutos en glutaraldehido al 2% y es la más aceptada a nivel mundial (9).
Si, como vimos en el marco teórico, las endoscopias altas o bajas cada vez se realizan más, las infecciones y los pacientes inmunosuprimidos cada día son más númerosos, debemos reforzar los delineamientos establecidos de desinfección y si es posible mejorarlos porque los pacientes cada vez conocen más medicina y se informan muy bien de los exámenes antes de realizárselos. En este punto debemos anotar que desde hace 5 a 10 años están apareciendo artículos de médicos no gastroenterólogos que critican fuertemente el sistema de desinfección de los endoscopios, con criterios de poco fundamento pero que los divulgan a los pacientes y estos entran en temores mayores sobre el procedimiento, en muchos casos rechazándolo por miedo a contraer infecciones. Estas voces parece que están haciendo eco en los políticos y existen rumores sobre leyes que desean aplicarse para que todos los endoscopios sean esterilizados antes de cada procedimiento, lo cual acarrearía costos incalculables para las instituciones ya que los tiempos de esterilización con oxido de etileno duran horas y el autoclave no se puede usar en estos equipos.
Vale la pena resaltar una vez más que el paso más importante en el reprocesamiento de los endoscopios antes del siguiente examen es la limpieza mecánica, por encima incluso de la desinfección, ya que si no se hace una buena limpieza mecánica, quedan detritus microscópico de saliva, sangre, etc., sobre la superficie externa e interna del endoscopio y el desinfectante no penetra para eliminar las bacterias o virus. Es por todo esto que decidimos realizar un protocolo para crear y evaluar la utilidad de un protector de endoscopia que cubra el tubo de inserción en su totalidad, de látex, desechable y para un solo uso. Nosotros pensamos que así como cada vez que realizamos una endoscopia nos colocamos un nuevo par de guantes, al endoscopio le debemos colocar su "guante" o condón, el cual nunca reemplazará los procesos normales de desinfección pero sí tendrá la capacidad de ser una barrera más de prevención contra la transmisión de infecciones y reforzar (sin reemplazar de ninguna manera) la limpieza mecánica, además de aumentar la confianza del paciente en el examen. Aunque el protector solo cubre la parte externa del equipo y la interna persistirá sin protección, con su utilización estamos disminuyendo en 50% el contacto del equipo con las secreciones, sangre, materia fecal etc., de cada paciente.
El tubo de inserción de un endoscopio tiene una longitud de un metro con un diámetro de 9.8 mm y es la única parte que se introduce a través de la boca, durante el cual se tiene contacto con líquidos de la cavidad oral, esófago, gástricos y duodenales; hay además, en muchas ocasiones contacto con sangre ya sea por trauma faríngeo a la introducción o por succión o toma de biopsias.
El protector diseñado por nosotros y fabricado por encargo en la compañía ETERNA S.A tiene una longitud de 100cm y 9,5mm de diámetro y un costo de solo $200; está presentado de forma enrollada sobre sí mismo con lubricación y montado sobre un aplicador de pasta para permitir su fácil colocación y que se deslice suavemente sobre el tubo de inserción. En su extremo distal tiene un orificio de bordes engrosados con un diámetro de 9.5mm, para permitir el paso de la imagen y no obstaculizar la visualización del lente, el paso del haz de luz y la función de los canales de succión y aire/agua (Figuras 1 y 2). Este protector además sirve para proteger todo tipo de endoscopio teniendo en cuenta sus diferentes diámetros y longitud como el rectosigmoidoscopio, y el colonoscopio.
Es la primera vez en el mundo que se crea un elemento de este tipo por lo cual decidimos evaluar en un trabajo prospectivo cuál es la utilidad de la endoscopia digestiva con el protector de látex en el tubo de inserción comparado con la endoscopia realizada de forma convencional.
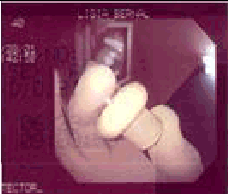
Figura 1. Podemos observar el protector enrollado sobre sí mismo a manera de preservativo listo para su colocación
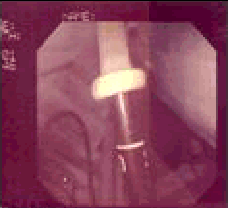
Figura 2. Observamos cómo se está colocando el protector por parte del examinador, el cual se desenrolla sobre el endoscopio.
Objetivos
General
Conocer la utilidad de un nuevo protector externo desechable de látex en la endoscopia digestiva alta.
Objetivos específicos
1. Evaluar cuál es el conocimiento que tienen los pacientes sobre la desinfección de los equipos y si tienen dudas sobre ésta.
2. Conocer la aceptabilidad que tendría entre los pacientes el uso de este protector, conociendo de antemano que solo cubre la parte externa.
3. Evaluar si el uso de este protector interfiere en el procedimiento o la tolerancia al mismo.
4. Conocer si este protector facilita la limpieza mecánica del endoscopio por el personal de enfermería.
5. Evaluar si este protector diminuye el tiempo de la limpieza mecánica.
Sujetos y métodos
Sujetos del estudio
La muestra se obtuvo de los sujetos que fueron remitidos para practicar una endoscopia de vías digestivas altas (EVDA) por presentar síntomas sugestivos de enfermedades gastrointestinales altas al servicio de gastroenterología de la clínica Carlos Lleras del I.S.S., Universidad Nacional.
Los sujetos incluidos fueron adultos entre 18 a 60 años de ambos sexos que asistieron a la unidad entre enero y marzo de 2001.
En total se incluyeron 100 pacientes consecutivos asignados de forma aleatoria al grupo I; endoscopia digestiva alta con protector (50 pacientes) y al grupo II endoscopia digestiva alta sin protector (50 pacientes).
Tipo de estudio
Se trata de un ensayo clínico, aleatorizado y controlado
Criterios de exclusión del trabajo:
1. No aceptar participar de forma voluntaria en el estudio.
2. Pacientes enviados al servicio para endoscopia digestiva alta de urgencias.
3. Pacientes con enfermedades asociadas crónicas, debilitantes como ICC, EPOC, IRC.
4. Pacientes con TP prolongado o coagulopatías.
5. Ser menor de 18 años
Producto
Los protectores desechables fueron fabricados en látex sobre una varilla metálica de un metro de longitud y 9.5mm de espesor; posteriormente se les aplicó como lubricante silicona y se enrollaron sobre sí mismos, colocándose sobre un cilindro de pasta que mide 1 cm de ancho por 2 cm de longitud, el cual se acopla a la parte distal del endoscopio y permite la fácil colocación del protector sobre el tubo de inserción. Posteriormente, se esterilizaron en óxido de etileno y se empacaron en bolsas plásticas separadas. Solo se fabricaron 50 protectores para el estudio por una empresa que fabrica guantes en látex por más de 20 años los cuales se describen en las Figuras 1, 2, 3 y 4.
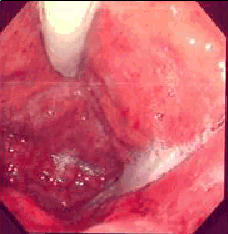
Figura 3. Podemos observar una foto de una endoscopia realizada con el protector, en esta se está haciendo una retrovisión y podemos ver el endoscopio con el protector.
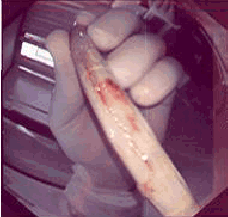
Figura 4. Observamos el endoscopio con el protector recién terminamos una endoscopia, nótese como existen abundantes secreciones pegadas al látex el cual ha evitado que tengan contacto con la parte externa del endoscopio.
Procedimientos
A todos los pacientes incluidos en el estudio se les hizo firmar un consentimiento escrito de aceptación voluntaria para participar en el estudio y se les llenó un formulario (anexo) que contenía entre otros datos, los siguientes: información sociodemográfica como nombre, edad, sexo, estado civil, estrato socioeconómico, ocupación. Luego se preguntaron los síntomas que motivaron el examen, antecedentes personales y familiares. Además se realizaron las siguientes preguntas:
1. ¿Sabe usted como se desinfectan los equipos de endoscopia? Si la respuesta era negativa se les explicaban los delineamientos de la ASGE, en sus tres fases; a. Limpieza mecánica, b. Desinfección, c. Irrigación y secado, para lo cual se utilizaron gráficas didácticas, se explicaron los tipos de desinfectantes y la seguridad de cada uno de ellos.
2. ¿Cuál es su opinión sobre estos métodos de desinfección?
3. ¿Sabiendo los costos, cree usted que se debería utilizar un equipo diferente para cada paciente?
4. ¿Usted cree que siempre debería usarse un protector externo deshechable para el endoscopio así solo cubra 50% del contacto con las secreciones?
A todos los pacientes se les mostró el protector haciendo la aclaración sobre sus ventajas y desventajas y anotando además que este dispositivo no está en uso.
El formulario también incluye los resultados de los hallazgos endoscópicos y la toma de biopsia, una escala análoga visual (22) de 0 a 100 mm donde el paciente evaluaba cómo se sintió durante el examen, en la cual cero era muy mal y 100 era muy bien. En otra escala análoga visual el enfermero evaluaba de 0 a 100 mm cuál era la facilidad de la limpieza con protector o sin protector.
Se registró el tiempo en segundos de cada endoscopia y la duración de la fase mecánica de la limpieza de los endoscopios. Se siguieron en los dos grupos de forma estricta los delineamientos de la Asociación Americana de Endoscopia Digestiva (ASGE) que fueron explicados en la introducción por lo cual la fase de desinfección en todos los pacientes dura 20 minutos.
Una vez se llenaba el formulario, el paciente se asignaba de forma aleatoria a uno de los dos grupos. A todos se les realizaba la endoscopia sin sedación y con la aplicación de 80 mg de lidocaina tópica al 2% (equivalente a 4 spray). Previamente en el grupo I se había colocado el protector al endoscopio. Durante el procedimiento se cronometraba el tiempo del examen, una vez terminado el examen en el grupo I se retiraba inmediatamente el protector y se desechaba junto con los guantes utilizados en el procedimiento, en el grupo II, se utilizaba una compresa para retirar las abundantes secreciones que entraron en contacto con el endoscopio.
En los dos grupos se lavaba el endoscopio y se cepillaba el canal interno, luego se aspiraba el detergente enzimático y se dejaba por 5 minutos. Toda esta fase denominada limpieza mecánica era cronometrada en los dos grupos.
Luego de la fase mecánica seguía la fase de desinfección de alto nivel que consistía en la inmersión del endoscopio en glutaraldehido al 2% siempre por 20 minutos. Luego el endoscopio era retirado, lavado por fuera y por dentro, se le aspiraba alcohol y se secaba antes de realizar nuevamente el procedimiento.
Análisis estadístico
Las variables evaluadas fueron: edad, sexo, estrato, peso, talla. En una escala análoga visual de 100mm se evaluaron la ansiedad, tolerancia, arcadas, tos, dolor, duración del examen, la limpieza mecánica y la evaluación de la facilidad de esta.
La variable independiente es el uso del protector.
Las variables cuantitativas fueron estudiadas para establecer su distribución normal. En caso de ser necesario sé realizaron transformaciones logarítmicas y se aplicaron pruebas no paramétricas.
En la primera fase exploratoria de los datos se realizaron estadísticas descriptivas para las variables incluidas en el estudio tanto en el grupo intervenido como en el control.
Los datos son presentados en tablas. Se presentan como medias o proporciones, acordes con el tipo de variables estudiadas. Se utilizaron pruebas de diferencias de medias y pruebas de diferencias de proporciones. Las pruebas estadísticas presentadas están acompañadas por el valor p. La hipótesis nula fue rechazada para niveles de significancia menores de 5%.
Los datos fueron capturados en bases de datos IBM compatibles y fueron analizados mediante el paquete estadístico Stata 7,0 y Systat 3,0 (Systat Inc).
Aspectos éticos
Además del consentimiento informado los sujetos no recibieron ninguna remuneración; fueron informados ampliamente sobre los riesgos y beneficios; ninguno fue presionado ni recibió dinero, ni ningún tipo de retribución económica.
Resultados
En total se incluyeron 100 sujetos, 50 para el grupo I y 50 para el grupo Il. Como se observa en la Tabla 1 no se observa ninguna diferencia demográfica entre los dos grupos. Las características de base de los dos grupos se muestran en la Tabla 1.
Tabla 1. Características de línea base de los sujetos de estudio
| Grupo I (n=50) Intervenido | Grupo II (n=50) Control | Diferencia | Valor p | ||||
|
|
|
| SD | SD |
|
|
|
| Edad (años) | X | 50,0 | 15,8 | 48,68 | 15,7 | 1,31 | 0,405 |
| Hombres | % | 42 |
| 46 |
| 4 | 0,691 |
| Peso (Kg) | X | 62,1 | 9,95 | 61,7 | 7,9 | 0,41 | 0,824 |
| Talla (cm) | X | 159,6 | 9,5 | 158,1 | 8,3 | 1,5 | 0,664 |
| Estrato II | % | 46 |
| 54 |
| -8 | 0,496 |
La principal indicación de la endoscopia fue enfermedad ácido péptica en 64% del grupo I vs 62% del grupo II. Veintiocho por ciento de los pacientes del grupo I, ya tenían una endoscopia frente a 32% del grupo II (p=ns) (Tabla 2).
Tabla 2. Principales hallazgos endoscópicos en los dos grupos de pacientes evaluados
Ante las preguntas formuladas a los 100 pacientes antes de distribuirlos en cada grupo estos contestaron:
1. ¿Sabe usted como se desinfectan los equipos de endoscopia? Solo dos pacientes conocían que los equipos se reutilizaban, con previo lavado y desinfección de los mismos en líquidos especiales, es de anotar que uno de ellos era auxiliar de enfermería y el otro familiar de una enfermera. Ante la respuesta negativa en los 98 pacientes restantes se les explicaron los delineamientos de la ASGE, en sus tres fases; a. Limpieza mecánica, b. Desinfección, c. Irrigación y secado, para lo cual se utilizaron graficas didácticas, se explicaron los tipos de desinfectantes y la seguridad de cada uno de ellos.
2. ¿Le quedan dudas sobre estos métodos de desinfección? Sí: 72% de los pacientes manifestó dudas, 28% manifestó no tener dudas sobre los métodos explicados.
3. ¿Sabiendo los costos, cree usted que se debería utilizar un equipo diferente para cada paciente? Veinticuatro por ciento de los pacientes manifestaron que idealmente se les debería realizar la endoscopia con un equipo nuevo.
4. ¿Usted cree que siempre debería usarse un protector externo desechable para el endoscopio así solo cubra 50% del contacto con las secreciones?; 76% de los pacientes manifestó su deseo de que se usara al menos un protector externo como barrera para prevenir el contacto del equipo con las secreciones así esto fuera para el exterior únicamente. El principal diagnóstico endoscópico en los dos grupos fue la gastritis crónica antral en 70% del grupo I vs. 64% del II, hernia hiatal (28% vs 32%) y esofagitis (12 vs 10%) respectivamente. La duración del examen fue de 121,8+/-53 segundos para el grupo I y de 125,4+/-50 para el grupo II (p=0,26); 34% de los pacientes del grupo I fueron biopsiados contra 40% el grupoII (Tabla 3). La valoración del paciente en cada uno de los grupos sobre cómo se sintió durante la endoscopia, se efectuó por dos parámetros; uno de forma cuantitativa a través de una escala análoga visual de 100mm donde 0 es muy mal y 100 es muy bien. Otro de forma cualitativa de (1= no sintió, 2= se sintió bien, 3= sintió alguna molestia, 4= mucha molestia y 5= incapaz de tolerar). Los pacientes del grupo I en promedio calificaron la escala cuantitativa en 33,2 vs 27,8 para el grupo II (p=ns) y en la escala cualitativa calificaron como 2 en 68% del grupo I vs 64% del grupo II. La misma escala análoga sirvió para evaluar la ansiedad antes del examen en cada grupo y la tolerancia del paciente a la endoscopia valorada por el medico. La ansiedad fue calificada como 19,4 vs. 20,5 y la tolerancia del médico; 34,08 vs. 31,46 para el grupo I y II respectivamente (Tabla 3). Durante el procedimiento se presentaron episodios de tos en 10% del grupo I vs. 12% del grupo II, dolor en el examen en 4 vs. 6% y arcadas durante el mismo en 38% vs. 36% para el grupo I y el II respectivamente (Tabla 3). Tabla 3. Características del procedimiento endsocópico
La limpieza mecánica, incluidos los 5 minutos que de forma estándar duraron todos los endoscopios en detergente enzimático después del examen, duró 523 segundos en el grupo que usó protector vs. 595 segundos para el que no lo usó (p= 0,01).
La evaluación sugestiva del auxiliar de enfermería sobre la facilidad de la limpieza mecánica sobre una escala análoga visual de 100mm (0= muy fácil y 100= muy difícil) fue 42 para el grupo con protector y 64,08 para el grupo sin protector (p= 0,01).
Es de anotar que la fase de desinfección dura 20 minutos en los dos grupos por protocolo.
Discusión
En los últimos años se han logrado grandes avances tecnológicos sobre los endoscopios pero la limpieza y desinfección de los mismos sigue siendo un problema mayúsculo (23-25). El reprocesamiento de los endoscopios (limpieza, desinfección y secado antes de un nuevo examen) es un proceso costoso y que consume tiempo, su efectividad puede estar comprometida no solo por errores del procedimiento sino por variaciones en la temperatura y la duración de la exposición al desinfectante o por el uso de maquinas automáticas (26,27). El proceso puede complicarse aun mas debido a que el diseño de los endoscopios es complejo, con múltiples uniones, válvulas, canales etc (28).
Aunque los delineamientos de la ASEG para limpieza y desinfección son ampliamente aceptados (en el papel) y la transmisión de infecciones por endoscopia puede ser baja (si se siguen estrictamente), los endoscopios son una fuente potencial de infección cruzada (29,30). Un estudio microbiológico realizado por Merighi y cols (31) sobre un periodo de dos años durante los cuales evaluó 109 endoscopios, mostró que a pesar de un apropiado procesamiento de los endoscopios, se presento contaminación de los canales en 41% y de la superficie externa en 60%. En un estudio multicéntrico aproximadamente en 24% de los endoscopios listos para usar se encontró un significante crecimiento bacteriano a nivel del canal de trabajo (32). Pero el riesgo actual de contraer una infección por endoscopia es muy difícil de valorar en la práctica clínica. Unas referencias señalan una incidencia tan baja como 1 en 1.8 millones de endoscopias (6), pero 2030 enfermeras de unidades de endoscopia reportaron en 116 (6%) infecciones inducidas por endoscopia (33). Una posibilidad para reducir el riesgo de contaminación al paciente y el grupo de endoscopia y ganar la confianza en la comunidad debido al temor de esta a contraer infecciones graves como sida, hepatitis o enfermedad por priones es el uso de endoscopios no reutilizables (endosheath) (34,35) pero desafortunadamente estos son muy costosos aun en experimentación, estando incluso lejos del alcance de los países ricos. Por ello el uso de este protector creado por nosotros que es sumamente económico (medio dólar) puede ser una solución (aunque parcial porque solo cubre la superficie externa del tubo de inserción) para este problema que se plantea y que seguramente cada día será mayor porque como observamos en nuestro estudio 98% de los pacientes desconoce cómo se desinfectan e incluso muchos no saben que los equipos se reutilizan. Con bastante frecuencia en nuestra práctica observamos que los pacientes se aterran porque se les vaya a hacer la endoscopia con el mismo equipo con el que le acaban de hacer la endoscopia al paciente con el cual el estaba hablando solo hace unos minutos y que sale con marcadas náuseas o vómito. Es por ello que en el trabajo observamos como hasta 26% de los pacientes desearía un equipo nuevo para su examen y que el costo lo asumieran las instituciones de salud, algo completamente ilógico e innecesario. Pero al comentarles sobre si estarían de acuerdo en que además de una adecuado proceso de desinfección les colocaran un protector tipo condón en la superficie externa del endoscopio, el cual se les enseñó y se les explicaron sus ventajas y desventajas 76% estuvieron completamente de acuerdo.
En nuestro trabajo observamos que los dos grupos fueron comparables entre sí porque fueron muy uniformes. No encontramos diferencias significativas para los grupos I (con protector) y el grupo II (sin protector) en cuanto a la edad (48,7 vs 51,3 años), sexo (42% vs. 46 % hombres), peso (62,12 vs. 61,7kg), talla (1,59 vs. 1,58m), estrato socioeconómico (II=48% vs 52% y III=34 vs 32%) ni tampoco en los hallazgos endoscópicos. También observamos que el uso del protector no crea incomodidades en el paciente ni existieron diferencias en la tolerancia al examen en el grupo I ya que en promedio calificaron la escala cuantitativa de tolerancia en 33,2 vs 27.8 para el grupo II (p=ns) y en la escala cualitativa calificaron como buena en 68% del grupo I vs 64% del grupo II. La misma escala análoga sirvió para evaluar la ansiedad antes del examen en cada grupo y la tolerancia del paciente a la endoscopia valorada por él medico. La ansiedad fue calificada como 19,4 vs. 20,5 y la tolerancia del medico; 33,08 vs. 31,46 para el grupo I y II respectivamente.
Durante el procedimiento se presentaron episodios de tos en 10% del grupo I vs. 12% del grupo II, dolor en el examen en 4 vs. 6% y arcadas durante el mismo en 38% vs. 36% para el grupo I y el II respectivamente, lo que demuestra que el látex utilizado para fabricar el protector no ocasionó incomodidad al paciente.
La más importante ventaja práctica del protector fue el acortamiento en el tiempo de la fase mecánica de desinfección el cual fue de 523 segundos en el grupo que usó protector vs. 595 segundos para el que no lo usó (p= 0,001) y la mayor facilidad de la limpieza como valorado por el auxiliar de 42 para el grupo con protector y 64,08 para el grupo sin protector (p= 0,001) en la escala análoga visual. Esto puede acortar el tiempo de reprocesamiento
del equipo lo cual es una gran ventaja para unidades de endoscopia pequeñas que cuentan con escaso personal de enfermería para la limpieza de los equipos o unidades grandes que cuentan con un gran volumen de pacientes y pocos endoscopios, pero debe señalarse que el protector tiene aún algunas dificultades en su elasticidad y flexibilidad las cuales ocasionan leve dificultad para su colocación pero estamos seguros de que si se pudiera fabricar con una máquina para hacer condones (no disponible en nuestro país) se superarían fácilmente.
Es claro para nosotros, que ejercemos la gastroenterología diariamente, que en nuestro país por tener uno de los más altos indicies de prevalencia del cáncer gástrico y por su muy bajo costo, la endoscopia digestiva alta se realiza en gran número. Por ello, en la mayoría de los centros se realiza sin sedación y en muchas ocasiones en consultorios ambulatorios, pero también es claro que debido a nuestra legislación existen muchos médicos con entrenamiento insuficiente que practican este examen a lo largo de la geografía nacional sin regulación de ningún tipo. Si además tenemos en cuenta que en los Estados Unidos hasta 70% de las unidades de endoscopia no se ciñen a los criterios de la ASGE, es de suponer que en nuestro medio el porcentaje sea también mayor y por lo tanto que el riesgo y miedo de los pacientes a las infecciones sea mayor. En nuestra experiencia personal hemos encontrado sitios donde únicamente se lava el equipo y se limpia con gasas, otros centros no usan detergente enzimático y lo más común, que no dejan el equipo en el desinfectante ni siquiera por espacio de 5 minutos. Muchas veces debido a la practica desleal, el gran número de pacientes, la no disponibilidad de varios endoscopio, etc, pero es necesario alertar que los pacientes cada vez se informan más sobre los exámenes que se van a realizar, y con el advenimiento del Internet tienen acceso a páginas que le explican muy bien cómo se debe hacer el examen. Aunque en este estudio modelo 98% de los pacientes desconoce cómo se procesan los endoscopios es llamativo que una vez informados, 76% tenga dudas sobre la desinfección y que si el paciente se informa cómo debe desinfectar los equipos va reclamar cuando no se cumplan estas normas y podemos estar sujetos a demandas médicolegales, por ello debemos cumplir y reforzar las medidas de desinfección. En EEUU existen personas que han alertado a los pacientes sobre la inadecuada desinfección de los equipos que hacen algunos centros. Nuestro protector que no busca en ningún momento reemplazar los métodos de desinfección establecidos en los delineamientos, los cuales consideramos son muy seguros para prevenir cualquier tipo de infección por los endoscopios, sino busca reforzar las medidas de desinfección, al evitar el contacto externo con las secreciones, sangre, fluídos, etc y llamar la atención a la comunidad médica sobre las dudas que se pueden generar en los pacientes si los delineamientos no se siguen teniendo en cuenta el gran temor que tienen ellos con la aparición de epidemias como en sida, Hepatitis B y C, las infecciones por priones como los de las vacas locas etc.
Además, este protector, único en el mundo y creado por nosotros, puede servir para dar confianza y seguridad a nuestros pacientes, los cuales con bastante frecuencia y desconfianza se preguntan; 1. ¿Para cada endoscopia no se usa un equipo diferente?, Lo cual es casi imposible desde el punto de vista económico, pero indirectamente al colocar un protector podríamos dar una idea similar. 2.¿Para cada endoscopia si se desinfecta bien el equipo? al colocar el protector delante del paciente de forma similar como nos colocamos los guantes y de igual forma al botar el protector junto con los guantes al terminar el examen podemos dar una mayor confianza a nuestros pacientes sobre los procedimientos de desinfección del equipo.
Conclusiones y recomendaciones
1. Existe un gran desconocimiento de los pacientes sobre cómo se desinfectan los equipos de endoscopia.
2. Aparentemente, el protector endoscópico puede generar mayor confianza en el paciente sobre la seguridad de la desinfección.
3. El protector facilita la limpieza mecánica (el paso fundamental en la desinfección) al impedir el contacto de secreciones con el tubo de inserción, es decir con 50% del endoscopio.
4. El protector no interfiere con el procedimiento endoscópico.
5. El protector no altera la tolerancia del paciente al examen.
6. Se requiere mayor tecnología para fabricar protectores más delgados y flexibles que sean más fáciles de colocar, la cual no es disponible en nuestro país.
7. Se requieren estudios multicéntricos y con mayor número de pacientes para confirmar los resultados de este trabajo.
Nota. Los autores manifiestan no tener ningún vínculo con la fábrica Eterna S.A, la cual de manera desinteresada y sin ningún costo fabricó el protector de acuerdo con los modelos enviados por nosotros.
Agradecimientos
Queremos agradecer especialmente al señor Víctor Vargas, jefe de látex de la compañía Eterna S. A, por sus invaluables sugerencias y apoyo técnico durante la realización de este estudio.
También agradecemos la colaboración de los pacientes voluntarios que permitieron la realización del estudio y sin los cuales no hubiera podido lograrse.
Referencias
1. Angel L. Gutiérrez O, Rincón D. Epidemiología de la enfermedad ácido-péptica. Rev Colomb Gastroenterol 1997;3:135-144. [ Links ]
2. Parsonnet J, Harris RA. Modeling cost-effectiveness of Helicobacter pylori screening to prevent gastric cancer: a mandate for clinical trials. Lancet 1996; 348:150-154. [ Links ]
3. OConnor HG, Axon ATR. Gastrointestinal endoscopy: infection and disinfection. Gut 1983;24:1067-1077. [ Links ]
4. Spach DH, Silverstein FE, Stamm WE. Transmission of infection by gastrointestinal endoscopy and bronchoscopy. Ann Intern Med 1993; 118:117-128. [ Links ]
5. Allen J, Allen M, Olson M, et al. Pseudomonas infection of the biliary system resulting from use of a contaminated endoscope. Gastroenterology 1987; 92:759-763 [ Links ]
6. Technology Assessment Position Paper: transmission of Infection by gastrointestinal endoscopy. American Society for Gastrointestinal Endoscopy, April 1993. [ Links ]
7. Bronowicki JP, Venard V, Botte C, et al. Patient-to-patient transmission of hepatitis C virus during colonoscopy. N Engl J Med 1997; 337:237-240. [ Links ]
8. Practice Committee of the Society of Gastroenterology Nurses and Associates. Standards for infection control and reprocessing of flexible gastrointestinal endoscopes. Gastroenterology Nursing 1997;20(suppl):1-13s. [ Links ]
9. Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy. Infection control during gastrointestinal endoscopy: Guidelines for clinical application. Gastrointestinal Endoscopy 1988; 34(supplement):37-40s. [ Links ]
10. Centers for Disease Control. Update: Universal Precautions for Prevention of Transmission of Human Immunodeficiency Virus, Hepatitis B Virus, and Other Bloodborne Pathogens in Health-Care Settings. Morbidity and Mortality Weekly Report 1988;37:377-382,387-388. [ Links ]
11. American Society for Gastrointestinal Endoscopy ad hoc Committee on Disinfection. Reprocessing of Flexible Gastrointestinal Endoscopes. ASGE, Manchester, MA. 1995. [ Links ]
12. Standard Practice for cleaning and disinfection of flexible fiberoptic and video endoscopes use in the examination of the hollow viscera. ASTM Standard F1518-94, American Society for Testing and Materials, 1916 Race Street, Philadelphia, PA 19103. [ Links ]
13. Birnie G, Quigley E, Clements G, Follet E, Watkinson G. Case report: endoscopic transmission of hepatitis B virus. Gut 1983;24:171-174. [ Links ]
14. Martin MA, Reichelderfer M. APIC guideline for infection prevention and control in flexible endoscopy. Am J Infect Control 1994;22:19-38. [ Links ]
15. Standards of Practice Committee of the American Society for Gastrointestinal Endoscopy. Antibiotic prophylaxis for gastrointestinal endoscopy. Gastrointestinal Endoscopy 1995;42:630-635. [ Links ]
16. Burton D, Ott BJ, Gostout CJ, DiMagno EP. Approach to designing a gastrointestinal endoscopy unit. Gastrointestinal Endoscopy Clinics of North America 1993;3:525-540. [ Links ]
17. Jain N, Larson D, Schroeder K, et al. Antibiotic prophylaxis for percutaneous endoscopic gastrostomy. Ann Intern Med 1987; 107:824-828. [ Links ]
18. Alfa MJ, Sitter KL. In-hospital evaluation of contamination of duodenoscopes: a quantitative assessment of the effect of drying. J Hosp Infect 1991; 19:89-98. [ Links ]
19. Occupational Safety and Health Administration. Occupational exposure to bloodborne pathogens: Final rule. Federal Register, 1991; 56: 64003-64182. [ Links ]
20. Decker MD. The OSHA Bloodborne Hazard Standard. Infect Control Hosp Epidemiol 1992;13:407-417. [ Links ]
21. Gostout CJ, Ott BJ, Burton D, DiMagno EP. Design of the endoscopy procedure room. Gastrointestinal Endoscopy Clinics of North America 1993;3:509-524.
22. Revill SI, Robinson JO, Rosen M, Hogg MIJ. The reliability of a linear analogue for evaluating pain. Anesthesia1976;31:1191-1198. [ Links ]
23. Anon. Cleaning and disinfection of equipment for gastrointestinal flexible endoscopy: interim recommendations of a working party of the British Society of Gastroenterology. Gut 1988;29:1134-1151. [ Links ]
24. Rutala WA, Weber DJ. FDA labeling requirements for disinfection of endoscopes: A counterpoint. Infect Control Hosp Epidemiol 1995;16: 231-235. [ Links ]
25. Rutala WA. Disinfection and sterilization of patient-care items. Infect Control Hosp Epidemiol 1996;17:377-384. [ Links ]
26. Babb JR, Bradley CR. Endoscope decontamination: where do we go from here? Journal of Hospital Infection 1995;30(supplement):543-551. [ Links ]
27. Muscarella LF. High-level disinfection or "sterilization" of endoscopes? Infect Control Hosp Epidemiol 1996;17:183-187. [ Links ]
28. Bond WW, Ott BJ, Franke KA, McCracken JE. Effective Use of Liquid Chemical Germicides on Medical Devices: Instrument Design Problems. In: Block SS, ed. Disinfection, Sterilization, and Preservation, 4th Edition. Philadelphia: Lea & Febiger; 1991. [ Links ]
29. Cole EC, Rutala WA, Nessen L, Wannamaker NS, Weber DJ. Effect of methodology, dilution, and exposure time on the tuberculocidal activity of glutaraldehyde-based disinfectants. Appl Environ Microbiol 1990;56:1813-1817. [ Links ]
30. Bond W, Favero M, Petersen N, Ebert J. Inactivation of hepatitis B virus by intermediate to high-level disinfectant chemicals. J Clinical Microbiology 1983;18:535-538. [ Links ]
31. Merighi A, Contato E. Quality improvement in gastrointestinal endoscopy: microbiologic surveillance of desinfection. Gastrointest Endosc 1996;43:457-462. [ Links ]
32. Gorse GJ, Messner RL. Infection control practices in gastrointestinal endoscopy in the Unites States. Infect Control Hosp Epidemiol 1991; 12: 289-296. [ Links ]
33. Kaczmarek RG, Moore RM. Multi-state investigation of actual disinfection and sterilization. Am J Med 1992; 92:257-261. [ Links ]
34. Silverstein FE. Design considerations of solution to endoscopic contamination: the sheathed endoscope (abstrac). Gastrointest Endosc 1992; 38:277. [ Links ] 35. Rothstein R.I. Littenberg B. Disposable sheat flexible sigmoidoscopy. Gastrointest Endosc 1995;41:566-572. [ Links ] Utilidad de un protector deshechable para la endoscopia digestiva alta Formulario Fecha:_____________________. Número:_________ Nombre:__________________________. Edad:_________ Sexo:________________. Peso:_________. Talla :__________________. Tel:_____________ Estrato de servicios públicos:--------- Antecedentes:_______________________. Indicación:___________________________. Previa EVDA No:________ Si:______. 1. Sabe usted como se desinfectan los equipos de endoscopia: Si------ No----- 2. Tiene dudas sobre la desinfección del equipo?: Si------ No----- 3. Le gustaría que se usara un equipo diferente para cada paciente?. Si------ No----- 4. Le gustaría que se usara al menos un protector externo? Si------ No----- 5. Ansiedad antes del procedimiento. Ninguna=0, severa=100. 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Hallazgos EVDA: 1.__________________________2.______________________ 3.__________________ Se completó el examen:____________. Complicaciones:________________. Duración del examen: ________________, segundos. 6. Tolerancia del procedimiento por el paciente(cuantitativa);0, buena 100, pobre. 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Tolerancia del procedimiento por el paciente (cualitativa): 1. No sintió----- 2. Se sintió bien----- 3. Sintió alguna molestia------- 4. Sintió mucha molestia 5. Incapaz de tolerar------------ Durante el procedimiento: Ansiedad: 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Tos: Si------ No----- Dolor: 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Arcadas: (0 no 100, máximas). 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Tolerancia del paciente valorada por el medico; 0, buena 100, pobre. 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100 Duración de la limpieza mecánica___________. Duración de la desinfección____________. Facilidad de la limpieza (enfermera). 0¦¦¦¦¦¦¦¦¦10¦¦¦¦¦¦¦¦¦20¦¦¦¦¦¦¦¦¦30¦¦¦¦¦¦¦¦¦40¦¦¦¦¦¦¦¦¦50¦¦¦¦¦¦¦¦¦60 ¦¦¦¦¦¦¦¦¦70¦¦¦¦¦¦¦¦¦80¦¦¦¦¦¦¦¦¦90¦¦¦¦¦¦¦¦¦100