Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.18 n.2 Bogotá abr./jun. 2003
Stent esofágico de nitinol en el manejo de las fístulas esofagorrespiratorias malignas
Rodrigo Castaño (1), Eugenio Sanín (2), Mario H. Ruiz (3)
(1) MD. Profesor grupo de Cirugía y Gastrohepatología - Universidad de Antioquia y Hospital Pablo Tobón Uribe. Medellín. Correspondencia: rcastanoll@hotmail.com
(2) MD. Gastroenterólogo clínico. Profesor grupo de Gastrohepatología - Universidad de Antioquia. Medellín.
(3) MD. Cirujano endoscopista. Gastrohepatología Hospital Pablo Tobón Uribe. Medellín, Antioquia.
Resumen.
Objetivo: Las fístulas esofagorrespiratorias (FER) malignas son una grave complicación del cáncer de esófago. La eficacia de las prótesis autoexpandibles de nitinol para la paliación de estas FER malignas es investigada de manera prospectiva.
Métodos: Diez pacientes con FER malignas fueron tratados con stents autoexpandibles de nitinol. En 2 pacientes la lesión se ubicó en el tercio proximal de esófago. Dada la presencia de la fístula, la totalidad de los pacientes presentaban disfagia severa, incluso para líquidos.
Resultados: No se presentaron dificultades técnicas durante la colocación de las prótesis. En el control radiológico con medio hidrosoluble, luego de la colocación del stent, se documentó el sellamiento de la fístula en todos los pacientes. Igualmente, la disfagia mejoró en forma significativa. Todos los stents mostraron una suficiente expansión en el control radiológico. No se encontraron complicaciones serias tempranas ni tardías, excepto por la colonización tumoral de un stent a las 15 semanas de haberse colocado. En tres pacientes en corto término (3-6 días) se observó dolor retroesternal y en uno con sensación de cuerpo extraño. Un año más tarde todos los pacientes han muerto por la progresión de la enfermedad, con un tiempo promedio de sobrevida de 106 días (rango de 17 a 216 días)
Conclusiones: El stent autoexpandible de nitinol es altamente efectivo para el manejo paliativo de las FER malignas, con una baja tasa de complicaciones. El uso de estos stents se considera un buen método en la paliación endoscópica de este grupo de pacientes con un alto riesgo.
Palabras claves: Stent, cáncer de esófago, fístula esofagorrespiratoria malign
Summary
Objective. Esophagorespiratory fistulas, are a complication of malignant esophageal tumours. The efficacy of nitinol, self-expanding metal stents for palliation of malignant esophagorespiratory fistulas was investigated prospectively.
Methods. Ten patients with malignant esophagorespiratory fistulas were treated with nitinol stents. In two patients the lesion was located in the proximal part of the esophagus. Because of the fistula all patients suffered from dysphagia even for liquids.
Results. No technical problems during the implantation procedure of the stents occurred. In the control radiography with water-soluble contrast media, the fistulas were completely sealed in all patients. Therefore the dysphagia improved significantly. All nitinol stents showed a sufficient expansion within 24 h after placement. Severe early or late complications were not encountered, with the exception of tumor overgrowth in one patient about 15 weeks after stent placement. In three patients short term (3 - 6 days) retrosternal pain was observed, and one patient complained of slight foreign body sensation. One year later all 10 patients had died of advanced disease, with a median survival time of 106 days (range, 17-216 days).
Conclusions. Nitinol stents are highly effective for palliative treatment of esophagorespiratory fistula and have a low complication rate. It seems that use of the nitinol stent can be considered a good therapeutic method for palliative endoscopic treatment of this high risk patient group.
Key Words. Stent, Esophageal cancer, Malignant tracheoesophageal fistula.
Introducción
El cáncer de esófago (CE) inoperable o recurrente presenta un pobre pronóstico, con una sobrevida menor a 1% a 5 años (1-3). Una vez una fístula esófago-respiratoria (FER) se ha establecido, la condición del paciente se deteriora rápidamente con una sobrevida de solo 2-3 semanas, a no ser que se logre el cierre de la fístula (4-6). Esta comunicación maligna entre el esófago y la vía aérea viene a empeorar la deteriorada condición clínica del paciente, quien tiene otros problemas como dolor, disfagia y caquexia. Cada vez que el paciente deglute, se produce la aspiración del contenido esofágico al árbol bronquial, con tos severa y neumonía.
Se describen diferentes opciones de manejo paliativo en el CE como la terapia con láser (7), braquiterapia (8) terapia fotodinámica (9) la cirugía (10) e incluso reportes de casos con quimiorradioterapia (11,12) sin embargo, la terapia paliativa más extendida es la colocación de stents (13-18) los cuales se han utilizado también en la paliación de las FER (19-22).
La terapia paliativa de las FER es a menudo difícil no obstante las diferentes alternativas endoscópicas planteadas. Las prótesis o stents metálicos autoexpandibles, al contrario de las prótesis plásticas, tienen una baja y poco severa tasa de complicaciones (23-34).
A continuación se presenta nuestra experiencia con el uso de estas prótesis en el manejo de la compleja patología de las FER.
Materiales y Métodos
Pacientes
Desde enero de 1999 hasta diciembre de 2002, 10 pacientes con FER fueron tratados con diez stents autoexpandibles de nitinol (Biomed y Corpaúl, Medellín), en las unidades de gastrohepatología de la Universidad de Antioquia y del Hospital Pablo Tobón Uribe. Todos los datos antes, durante y después de la colocación del stent fueron registrados en forma prospectiva en un formulario diseñado para tal fin. El seguimiento se hizo mensualmente por entrevistas personales o por seguimiento telefónico. Ocho pacientes eran hombres, con una edad que osciló entre 47 y 83 años, con una media de 62 años.
La biopsia demostró la presencia de un carcinoma escamocelular en nueve pacientes y solo un caso correspondió a un adenocarcinoma. El tumor se ubicó en el esófago proximal (a 25 cm de la arcada dentaria) en dos pacientes y los otros ocho lo presentaron en esófago medio. La longitud del tumor osciló entre 4 y 9 cm (promedio 6,5 cm). Todos los pacientes presentaban un componente estenótico notable y en todos era común la queja de disfagia incluso para líquidos. La disfagia se clasificó como: 0=Sin disfagia, 1=disfagia para sólidos, 2=disfagia para dieta blanda, 3= disfagia para líquidos. Todos los pacientes tenían disfagia clasificación 3 al momento de la intervención. La suma de todas las clasificaciones de la disfagia luego de la colocación del stent, dividido por el número de pacientes determinó la clasificación de la disfagia después de la colocación del stent.
Se determinó la presencia de una neumonía concomitante en un paciente. En dos pacientes existía una gastrostomía, una quirúrgica y la otra endoscópica.
En dos pacientes había el antecedente de radioterapia en el año previo a la presentación de la FER.
Todos los pacientes tenían evaluación previa por endoscopia y esófago-estómago y duodeno con medio de contraste hidrosoluble cuando se sospechaba la fístula.
El stent
Existen diferentes tipos de stents esofágicos disponibles (Figura 1).
Figura 1. Diferentes tipos de stents seofágicos: A: Esopha-Coil, B: Song (usado en la presente serie), C: Ultraflex, D: Wallstent, E: Gianturco
El utilizado en la presente serie fue el de nitinol, con tecnología para su fabricación desarrollada localmente con el aval de su casa productora matriz: Stentech (Seúl, Corea). El stent de nitinol está fabricado por alambres entrelazados en zig-zag, con base en una mezcla de 45% de titanio y 55% de níquel. La longitud del stent varía entre 8, 10 ó 12 cm.
El stent esofágico fue desarrollado en forma manual en el laboratorio de investigación biomédica de acuerdo con las instrucciones del fabricante original (Stentech, Seúl, Corea). Brevemente, los stents fueron fabricados con un filamento único de 0,2 mm de nitinol de configuración tubular.
El diámetro del cuerpo del stent es de 16 mm y los extremos son de 26 mm. La longitud del stent varía de 80 a 120 mm. Los stents fueron cubiertos con una solución al 12% de poliuretano (Chronoflex; Cardiotech International, Woburn Massachussets) por el método de inmersión. Se fabricaron dejando los 10 mm proximales y distales del stent descubierto. Los extremos del stent tienen marcas de oro para mejorar la visualización fluoroscópica (Figura 1). El introductor se hizo con un tubo de teflón con un diámetro externo de 6 mm y el "pusher" o empujador también se hizo de teflón con un diámetro de 4 mm. La punta del introductor es una pieza de nylon semejante a una bala con punta aguzada suavemente. El sistema es avanzado sobre una guía de 0,038 pulgadas (Figura 2).
Figura 2. Fotografía del sistema introductor. El sistema tiene una bala desprendible con un aro metálico en su punta (flecha abierta). El empujador también, tiene una marca metálica (punta de flecha). Nótese el stent esofágico montado (flechas).
Técnica de colocación
La serie gastroduodenal superior sirve para evaluar la longitud y localización de la estenosis en todos los pacientes. No se utilizaron antibióticos profilácticos de rutina. El procedimiento se ejecutó bajo sedación consciente, inducida por la mezcla de midazolan (3 a 5 mg IV) más meperidina (30 a 50 mg IV), sin que se presentara ningún efecto adverso con la mezcla. Con el endoscopio diagnóstico (GIF-P30; Olympus, Tokio) y con anestesia faríngea con xilocaina en aerosol, la lesión fue visualizada y cuando era posible fue franqueada con el endoscopio.
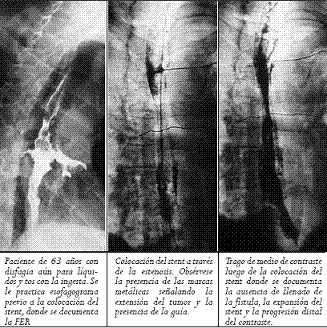
El material de contraste fue aplicado y el extremo proximal y distal de la estenosis se marcó en la piel del paciente con clips metálicos. La longitud de la estenosis y la ubicación de la fístula siempre se determinaron por endoscopia. Sí no se lograba franquear la estenosis con el endoscopio, una guía hidrofílica de 260 cm (Glidewire; Terumo, Tokio, Japón) se usó para atravesar la estenosis y se dilataba hasta permitir el paso del endoscopio (máximo hasta 12,8 mm). Un stent con 4 cm más largo que la estenosis es escogido para prevenir el crecimiento tumoral en los extremos. Luego de la lubricación con xilocaina, el sistema introductor con el stent montado y bajo visión fluoroscópica en los primeros siete pacientes se colocaba a través de la estenosis. Para la liberación del stent, el tubo introductor era retirado mientras el catéter empujador era dejado in situ. Esta maniobra libera el stent, lo cual se hizo sin necesidad de fluoroscopia en los últimos tres pacientes. La bala plástica es dejada dentro del paciente y expulsada después. No se hizo dilatación con balón ni antes ni después de colocar el stent. El seguimiento endoscópico o con fluoroscopia y medio de contraste se hizo para evaluar la permeabilidad, el sellamiento de la FER, así como la ubicación del stent (Figura 3).
Figura 3. Secuencia en la colocación del stent en un paciente con FER.
A los pacientes se les restringía la ingesta a sólo líquidos el primer día, con progresión a dieta líquida completa, blanda o regular según su tolerancia. No había una rutina de seguimiento endoscópico en estos pacientes y sólo se realizó ésta en caso de sospecha de oclusión del stent, como en un caso por ingesta de material cárnico y en otro por colonización tumoral 15 semanas después de colocada la prótesis.
Resultados
Evaluación técnica y clínica
No hubo problemas técnicos o complicaciones durante la colocación de las prótesis. Sólo un paciente se manejó con un stent de 8 cm, siete con stents de 10 cm y dos con prótesis de 12 cm de longitud. Se encontró en el control radiográfico el sellamiento de la fístula en los 10 pacientes.
La totalidad de los pacientes reportaron el alivio de la disfagia, mejorando la puntuación de un promedio de 3 antes del stent a 1,6 luego del mismo. El control radiológico mostró la expansión total del stent en todos los pacientes y no se requirió de otras intervenciones como dilataciones con balón o reubicarlos.
Complicaciones No se presentaron complicaciones severas tempranas como el sangrado, perforación o la migración. Un problema menor observado en la primera semana es el dolor retroesternal en tres pacientes, e incluso sensación transitoria de cuerpo extraño en uno de los pacientes con stent más proximal (23-24 cm).Seguimiento Las fístulas permanecieron cerradas durante todo el seguimiento. El seguimiento se hizo en la consulta de cirugía oncológica del Hospital Pablo Tobón Uribe y la Universidad de Antioquia en el Hospital San Vicente de Paúl y por vía telefónica. Se hizo endoscopia en caso de oclusión del stent que se dio por ingesta de material cárnico y sobrecrecimiento tumoral que fue manejado con inyecciones de alcohol absoluto (Figura 4).
Figura 4. Colonización tumoral del extremo distal del stent en un paciente con CE avanzado.
Discusión
Desde los comienzos de la década del 90, la experiencia con el manejo de las estenosis malignas del esófago y la región cardial con las prótesis autoexpandibles se ha acrecentado notablemente. Una de las mayores ventajas de las prótesis autoexpandibles con respecto a las plásticas es el menor índice y la menor gravedad de estas complicaciones (22-25).
En el momento, no hay duda de las bondades del uso del stent en la paliación de las neoplasias esófagocardiales; aunque aún no se cuenta con el stent ideal, los stents de nitinol presentan una tasa baja de complicaciones, con escasas reintervenciones, equiparables a otros productos más costosos como el Wallstent, Ultraflex o el Gianturco.
Las FER que presentan un difícil manejo con una pobre calidad de vida y una expectativa de sobrevida corta, son una seria complicación del CE. Las series mayores con el uso de estos stents en las FER no sobrepasan los 13 pacientes (Tabla 1).
Tabla 1. Experiencias publicadas con los stents autoexpandibles en el manejo de las FER.
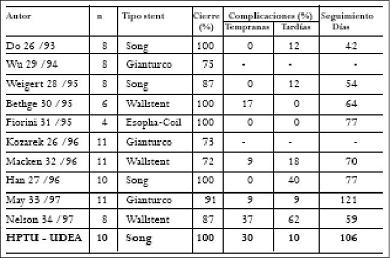
En los diferentes reportes de la literatura no se demuestra la superioridad de un tipo de stent en especial en el manejo de las FER. La tasa de éxito en el manejo de las FER oscila entre 73 y 100%, con el reinicio de la vía oral en la gran mayoría de los pacientes.
Estos resultados reportados en la literatura mundial son concordantes con lo encontrado en la presente serie. Al igual que en otras series las complicaciones tempranas y tardías son bajas tras la colocación de las prótesis de nitinol.
Sólo se encontró un caso de colonización tumoral. Weigert (28) reporta sólo un caso de sangrado severo originado por el stent.
Se destaca en la presente serie la ausencia de migraciones sean proximales o distales. Esto se puede explicar por la ubicación alta de las fístulas, lo que no permitía franquear el cardias por parte del stent. Los stent que cruzan la unión gastroesofágica y tienen su mitad distal en la cámara gástrica pierden la opción del anclaje por el tejido esofágico. Otra justificación es el estado avanzado de estos tumores fistulizados, con estenosis generalmente severas lo que facilita la fijación del stent al tumor.
Una variedad de stent es el esopha-coil, el cual no es cubierto pero su tramado es muy cerrado lo que permite una protección adecuada de la vía aérea como lo demuestra el trabajo de Fiorini (31), aunque el número de casos no es muy representativo.
Más recientemente, se está promoviendo la colocación de stents paralelos en vía aérea y digestiva para un mejor control de las fístulas (35), pero esta opción terapéutica no se debe considerar en forma rutinaria, sino para aquellos casos en los que prima el componente estenótico respiratorio, en cuyo caso se preferirá la colocación inicialmente del stent de la vía aérea (36).
Conclusiones
Se puede afirmar con base en estos resultados y lo reportado en la literatura que la paliación de las FER malignas con el stent autoexpandible de nitinol es una alternativa segura y eficaz. Con este stent, las fístulas pueden ser efectivamente manejadas y los altos índices de disfagia en estos pacientes mejoran notablemente, con un bajo riesgo de complicaciones.
Referencias
1. Leon W, Strug LH, Brickman ID. Carcinoma of the esophagus: a disaster. Ann Thorac Surg 1971; 11:583-592 . [ Links ]
2. Parker EF, Gregorie HB, Prileau WH, et al. Carcinoma of the esophagus: observation of 40 years. Ann Surg 1982; 195:618-23 . [ Links ]
3. Katlic MR, Wilkins EW, Grillo HC. Three decades of treatment of esophageal squamous carcinoma at the Massachusetts General Hospital. J Thorac Cardiovasc Surg 1990; 99:929-938. [ Links ]
4. Martini N, Goodner JT, D’Angio G, et al. Tracheoesophageal fistula due to cancer. J Thorac Cardiovasc Surg 1970; 59:319-325. [ Links ]
5. Duranceau A, Jamieson GG. Malignant tracheoesophageal fistula. Ann Thorac Surg 1984; 37:346-354. [ Links ]
6. Gudovsky LM, Koroleva NS, Biryukov YB, et al. Tracheoesophageal fistulas. Ann Thorac Surg 1993; 55:868-875. [ Links ]
7. Alexander P, Mayoral W, Reilly HF 3rd, Wadleigh R, Trachiotis G, Lipman TO. Endoscopic Nd:YAG laser with aggressive multimodality therapy for locally advanced esophageal cancer. Gastrointest Endosc 2002;55:674-679. [ Links ]
8. Iwasa M, Ohmori Y, Iwasa Y, et al. Effect of multidisciplinary treatment with high dose rate intraluminal brachytherapy on survival in patients with unresectable esophageal cancer. Dig Surg 1998;15:227-235. [ Links ]
9. Greenwald BD. Photodynamic therapy for esophageal cancer. Update. Chest Surg Clin N Am 2000; 10: 625-637. [ Links ]
10. Whooley BP, Law S, Murthy SC, Alexandrou A, Chu KM, Wong J. The Kirschner operation in unresectable esophageal cancer: current application. Arch Surg 2002;137:1228-1232. [ Links ]
11. Ahmed HF, Hussain MA, Grant CH, Wadleigh RG.Closure of Tracheoesophageal Fistulas With Chemotherapy and Radiotherapy. Am J Clin Oncol 1998; 21: 177-179. [ Links ]
12. Allum WH, Griffin SM, Watson A, Colin-Jones D. Guidelines for the management of oesophageal and gastric cancer. Gut 2002;50(Suppl V):v1-v23. [ Links ]
13. Lewis RJ, Kunderman PJ, Sisler GE, et al. Peroral esophageal intubation for obstructive carcinoma of the esophagus. Ann Thorac Surg 1973; 16:148-157. [ Links ]
14. Tytgat GNJ, den Hartog J, Bartelsman JF. Endoscopic prosthesis for advanced esophageal cancer. Endoscopy 1986; 18(suppl 3):32-39. [ Links ]
15. Chavy AL, Rougier M, Pieddeloup C, et al. Esophageal prosthesis for neoplastic stenosis: a prognostic study of 77 cases. Cancer 1986; 57:1426-1431. [ Links ]
16. Cusomano A, Ruol A, Segalin A, et al. Push-through intubation: effective palliation in 409 patients with cancer of the esophagus and cardia. Ann Thorac Surg 1992; 53:1010-1014. [ Links ]
17. Schaer J, Katon RM, Ivancev K, et al. Treatment of malignant esophageal obstruction with silicone-coated metallic self-expanding stents. Gastrointest Endosc 1992; 38:7-11. [ Links ]
18. Knyrim K, Wagner HJ, Bethge N, et al. A controlled trial of an expansile metal stent for palliation of esophageal obstruction due to inoperable cancer. N Engl J Med 1993; 329:1302-1307. [ Links ]
19. Hegarty MM, Angorn IB, Bryer JV, et al. Palliation of malignant esophago-respiratory fistulae by a permanent indwelling prosthetic tube. Ann Surg 1977; 185:88-93 . [ Links ]
20. Buess G, Schellong H, Kometz B, et al. A modified prosthesis for the treatment of malignant esophago-tracheal fistula. Cancer 1988; 61:1679-1684. [ Links ]
21. Hordijk ML, Dees J, van Blankenstein M. The management of malignant esophago-respiratory fistulas with a cuffed prosthesis. Endoscopy 1990; 22:241-244. [ Links ]
22. Do YS, Song HY, Lee BH, et al. Esophagorespiratory fistula associated with esophageal cancer: treatment with a Gianturco stent tube. Radiology 1993; 187:673-677. [ Links ]
23. May A, Hahn EG, Ell C, Self-expanding metal stents for palliation of malignant obstruction of the upper gastrointestinal tract. J Clin Gastroenterol 1996; 22: 261-266. [ Links ]
24. Ell C, Hochberger J, May A, et al. Coated and uncoated self-expanding metal stents for malignant stenosis in the upper GI-tract. Am J Gastroenterol 1994; 89: 1496-1500. [ Links ]
25. May A, Selmaier M, Hochberg J, et al. Memory metal stents for palliation of malignant obstruction of the esophagus and cardia. Gut 1995; 37: 309-313. [ Links ]
26. Kozarek RA, S Raltz, WR Brugge, et al. Prospective multicenter trial of esophageal Z stent placement for malignant dysphagia and tracheoesophageal fistula. Gastrointest Endosc 1996; 44: 562-567. [ Links ]
27. Han YM, Song HY, Lee JM, et al. Esophagorespiratory fistula due to esophageal carcinoma: Palliation with a covered Gianturco-Stent. Radiology 1996; 199: 65-79. [ Links ]
28. Weigert N, Neuhaus H, Rösch T, et al. Treatment of esophagorespiratory fistula with silicone-coated self-expanding metallic stents. Gastrointest Endosc 1995; 41: 490-496. [ Links ]
29. Wu WC, Katon RM, Uchida T, et al. Silicone-covered self-expanding metallic stents for the palliation of malignant esophageal obstruction and esophagorespiraotry fistulas: experience in 32 patients and a review of the literature. Gastroint Endosc 1994; 40: 22-33. [ Links ]
30. Bethge N, Sommer A, Vakil N. Treatment of esophageal fistulas with a new polyurethane-covered, self-expanding mesh stent: A prospective study. Am J Gastroenterol 1995; 90: 2143-2146. [ Links ]
31. Fiorini AB, Goldin E, Valero JL, et al. Expandable metal coil stent for treatment of broncho-esophageal fistula. Gastrointest Endosc 1995; 42: 81-83. [ Links ]
32. Macken E, Gevers A, Hiele M, et al. Treatment of esophagorespiratory fistulas with polyurethane-covered self-expanding metallic mesh stent. Gastrointest Endosc 1996, 44: 324-326. [ Links ]
33. May A, Ell C. Palliative Treatment of Malignant Esophagorespiratory Fistulas With Gianturco-Z Stents A Prospective Clinical Trial and Review of the Literature on Covered Metal Stents Am J Gastroenterol 1998; 93: 532-535. [ Links ]
34. Nelson DB, Axelrad AM, Fleischer DE, et al. Silicone covered Wallstent prototypes for palliation of malignant esophageal obstruction and digestive respiratory fistulas. Gastrointest Endosc 1997; 45: 31-37. [ Links ]
35. van den Bongard HJ, Boot H, Baas P, Taal BG. The role of parallel stent insertion in patients with esophagorespiratory fistulas. Gastrointest Endosc 2002; 55:110-115. [ Links ]
36. Nomori H, Horio H, Imazu Y, Suemasu K.C. Double stenting for esophageal and tracheobronchial stenoses. Ann Thorac Surg 2000; 70: 1803-1807. [ Links ]