Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.18 no.2 Bogotá Apr./June 2003
Enfoque perioperatorio de pacientes sometidos a trasplante hepático previamente
Leopoldo Ferrer (1), Fernando Raffan (2)
(1) M.D. Anestesiólogo Clínica Colsubsidio - Fundación Santa Fé de Bogotá. Intensivista Clínica Confiarsalud.
(2) M.D. Anestesiólogo Trasplantes e Intensivista Fundación Santa Fé de Bogotá. Profesor Asistente de Anestesia Universidad del Bosque.
Introducción
La cirugía de trasplante de órganos ha avanzado en forma significativa en las últimas dos décadas, incrementándose la tasa de sobrevida y la duración de esta misma. Varios factores han contribuído en este empeño entre los cuales encontramos las drogas inmunosupresoras, las técnicas quirúrgicas, las técnicas anestésicas y el soporte postoperatorio en cuidado intensivo. En solo E.E.U.U. se someten anualmente a trasplante de órganos mas de 25000 pacientes con una sobrevida en el primer año mayor de 80-90% y a 5 años mayor de 60% (1).
De esta forma el equipo médico se enfrentará con mayor frecuencia a pacientes que tienen como antecedente un órgano trasplantado previamente, lo que nos obliga a conocer todo acerca de ello, desde su patología de base, funcionamiento del órgano trasplantado, estado de órganos principales y todo lo relacionado con las drogas inmunosupresoras; siendo concientes del delicado balance entre adecuada inmunosupresión para prevenir el rechazo de órgano y la mayor susceptibilidad a infecciones por esa inmunosupresión, con lo cual podremos plantearnos un enfoque anestésico claro y efectivo y obtener mejores resultados postoperatorios en este grupo de pacientes.
El trasplante de hígado se considera un tratamiento de elección para la enfermedad hepática terminal con una mejoría dramática de la calidad de vida después del trasplante. Durante el primer año postrasplante la tasa de mortalidad es de 15 - 20% la cual disminuye en forma significativa para los años siguientes. El porcentaje de pacientes con trasplante hepático previo que se someten a una cirugía posteriormente es de 10 - 30% aproximadamente, con unos resultados clínicos similares a la población gene ral en las cirugías electivas; pero con una tasa de complicaciones mayor en los procedimientos de urgencia (2).
Evaluación preoperatoria
Los pacientes trasplantados de hígado pueden llegar nuevamente a salas de cirugía para un procedimiento relacionado con el transplante previo, una cirugía electiva no relacionada con el transplante, una cirugía de urgencia o un procedimiento en radiología invasiva, y siempre necesitan una adecuada valoración preoperatoria. Los objetivos de la valoración incluyen: conocer la función del órgano trasplantado, descartar rechazo del mismo, conocer la función de otros órganos, en particular, aquellos que pueden estar afectados por la terapia inmunosupresora o por la disfunción del órgano trasplantado; y finalmente descartar la evidencia de cualquier signo o síntoma que haga sospechar la presencia de una posible infección. La valoración parte como siempre del interrogatorio y el examen físico, pero siempre trataremos de obtener la información proveniente de la institución donde se realizó el trasplante, para conocer lo que más se pueda acerca de ello y los diferentes esquemas de inmunosupresión a los que se haya sometido, paraclínicos recientes y comportamiento en el tiempo del estado general del paciente trasplantado.
El rechazo del órgano sucede principalmente en los tres primeros meses del período postrasplante, pero puede observarse en cualquier momento, resultando en un deterioro progresivo de la función del mismo. El rechazo del órgano es la principal causa de mortalidad tardía en estos pacientes y debería sospecharse si las pruebas funcionales del hígado trasplantado son anormales (1). Los signos de rechazo son muy similares a los de infección. El aumento de peso progresivo, prurito, fiebre y aumento de bilirrubinas séricas podrían indicarnos disfunción de hígado trasplantado (2). La presencia de rechazo siempre contraindica cualquier cirugía electiva y la evidencia sugiere que los pacientes sometidos a cirugías electi vas durante período de rechazo tienen una morbilidad mayor (1).
Igualmente siempre se debe descartar la presencia de infección, la cual es más frecuente en las primeras 8 (ocho) semanas postrasplante por el régimen inmunosupresivo más agresivo en ese período. La infección, que puede ser bacteriana, viral (citomegalovirus y herpes simple), micótica (candida) o por parásito (pneumocystis carinii) aumenta considerablemente la morbimortalidad en los pacientes después del trasplante y también contraindica cualquier cirugía electiva. No se debe alterar el esquema de inmunosupresión durante el período perioperatorio, a no ser que los niveles sanguíneos medidos así lo sugiera, pues si estos regímenes se alteran, aumenta el riesgo de rechazo.
La función renal puede estar comprometida por la terapia inmunosupresora y debe ser evaluada en todos estos pacientes. En dosis terapéuticas, la ciclosporina y tacrolimus, pueden llevar a un descenso del flujo sanguíneo renal y de la tasa de filtración glomerular, por vasoconstricción renal, lo cual discutiremos mas adelante.
Desde el punto de vista gastrointestinal, puede presentarse hemorragia de vías digestivas secundaria a úlcera pética, gastritis o gastroenteritis por citomegalovirus. Las alteraciones hepatobiliares y pancreáticas también son comunes después de un trasplante y siempre debemos asegurarnos que la función de estos órganos no se encuentre alterada. En cuanto a los paraclínicos, en todo paciente con trasplante hepático previo deben obtenerse (3) (Tabla 1).
Tabla 1. Paraclínicos preoperatorios solicitados a todos los pacientes con trasplante hepático previo.
Mecanismos de rechazo de injertos y agentes inmunosupresores
Como mencionábamos previamente, uno de los factores que ha contribuído en forma significativa con la mejoría del desenlace en el paciente con trasplante hepático previo ha sido el avance e los regímenes de inmunosupresión. Hay varios fármacos que se han utilizado para ello y cada día se investigan drogas inmunosupresoras con las cuales se obtenga un nivel de inmunosupresión tal, que favorezca la aceptación del órgano trasplantado, pero que al mismo tiempo tenga los mínimos efectos adversos lo cual ha sido la limitante más grande de estos medicamentos. Las dosis y esquemas que se han utilizado varían mucho, según el tipo de trasplante, condiciones del paciente y de cada centro clínico. En este punto revisaremos los mecanismos inmunológicos asociados que desencadenan la reacción de rechazo al nuevo tejido para entender mejor los diferentes inmunosupresores utilizados, de los cuales describiremos los más comunes, los creados recientemente y en forma breve algunos que están actualmente en investigación con los efectos adversos más frecuentemente vistos (Tabla 2).
Tabla 2. Inmunosupresores y efectos adversos asociados.
Mecanismos de rechazo de injerto: Papel de los CD4.
Las células CD4 son cruciales en el proceso de rechazo de injerto. El reconocimento inicial de antígenos extraños puede darse en dos formas: Un aloreconocimiento directo, donde los CD4 pueden reconocer moléculas asociadas al complejo mayor de histocompatibilidad (CMH) de las células donadoras y un aloreconocimeinto indirecto, donde los antígenos son procesados por células presentadoras de antígeno y luego los péptidos resultantes son mostrados junto con moléculas del CMH a los CD4. El aloreconocimiento directo activa en mayor proporción y con mayor intensidad los CD4, ocasionando una respuesta de rechazo agudo mayor; en cambio el aloreconocimiento indirecto desencadena una activación menor de CD4 y se asocia al rechazo crónico (4).
Los CD4 necesitan de una segunda señal, un coestímulo, para ser activados totalmente. El mejor coestímulo lo provee la unión de moléculas CD28 en la superficie del CD4 con moléculas de la familia B7 de la célula presentadora de antígeno y la interacción de moléculas CD40-CD154. En la ausencia de una señal coestimulatoria, los CD4 no responden adecuadamente a la exposición de antígenos, no secretan citocinas y pueden iniciar la apoptosis. Esta vía de bloqueo de segunda señal es utilizada por algunos inmunosupresores para ejercer su acción. Una vez activados los CD4 inician la secrección de interleucina 2 (Il 2) que induce la proliferación de CD4, la expansión clonal y la secreción de citocinas (4). Por otro lado los CD4 una vez activados, pueden activar otras células inmunológicas (células B, CD 8 citotóxicas y monocitos-macrófagos) por contacto directo célula-célula o vía citocinas, y de ese modo amplificar la respuesta de rechazo. Además los CD4 promueven la producción de anticuerpos, lisis celular antígeno específico y respuesta de hipersensibilidad tipo tardía. Todos estos mecanismos culminan con el rechazo del tejido trasplantado.
El proceso de activación de células Tiene varios puntos específicos de regulación (4):
- La estimulación del receptor de células T resulta en la activación de calcineurina, la cual a su vez desfosforila al factor nuclear de células T activadas; de esa forma incapacita al factor nuclear para entrar al núcleo y poder unirse con el promotor de Il 2. Esta vía de inhibición de la calcineurina es utilizada por la ciclosporina y tacrolimus. Los esteroides bloquean la producción de citocinas, lisan linfocitos T y alteran la función de los restantes linfocitos T.
- La señal coestimulatoria se requiere para la adecuada respuesta de células T como se describió previamente. Actualmente, están en experimento varios fármacos que actúan por esta vía.
- El efecto de Il 2 induce la proliferación celular T y los anticuerpos contra receptor de Il 2 o el sirolimus pueden bloquear esta respuesta. En un paso más adelante actúan la azatioprina, micofenolato, leflunomida, mizoribin y brequinar al inhibir la replicación del DNA por inhibir la síntesis de purinas.
Tradicionalmente, los regímenes de inmunosupresión incluyen ciclosporina, azatioprina y prednisona; pero el uso de nuevos agentes como el tacrolimus y el micofenolato está aumentando progresivamente. Algunos centros adicionan anticuerpos policlonales o monoclonales por un período corto de inducción, como veremos adelante.
Inhibidores de calcineurina
Ciclosporina. La ciclosporina es un endecapéptido de origen micótico y ha sido la droga pilar para la inmunosupresión clínica desde que se introdujo en 1981 por Roy Calne en Inglaterra, reduciendo la frecuencia de episodios de rechazo a injerto y la severidad de los mismos (3,5). Es altamente liposoluble, su efecto parece deberse principalmente por bloquear la secreción de interleucina 2 y de otras citocinas al inhibir la calcineurina, suprimiendo el desarrollo de células T citotóxicas e interfiriendo con la presentación de antígeno de células dendríticas y con la función de las células B.
La gran mayoría del fármaco es metabolizado en el hígado por el sistema citocromo P-450, por lo que las drogas que afectan este sistema puede alterar sus niveles plasmáticos (Tabla 3). La disfunción renal no afecta los niveles plasmáticos de la droga, pues menos de 1% de la droga completa y menos de 10% de sus metabolitos son excretados por el riñón (6).
Tabla 3. Drogas que alteran el sistema citocromo P 450.
Efectos adversos. Tiene un rango terapéutico estrecho y debemos tener en cuenta cualquier droga que puede alterar el metabolismo de la ciclosporina. El efecto adverso más frecuente e importante es la nefrotoxicidad, que puede ser aguda o crónica. En la nefrotoxicidad aguda se observa elevación de creatinina e hiperkalemia secundaria a una disminución de la tasa de filtración glomerular y a una alteración en el flujo sanguíneo medular y cortical; el efecto es dosis dependiente y mejora al disminuir la dosis y los niveles plasmáticos de la droga. La nefrotoxicidad crónica es un problema de mayor magnitud y se ha relacionado a una hiperactividad simpática y aproximadamente 20% de los pacientes tienen enfermedad renal crónica. En los hallazgos de biopsias se encuentra esclerosis vascular, fibrosis intersticial, atrofia tubular y engrosamiento de la membrana basal glomerular y tubular (7,8). El efecto nefrotóxico agudo es reversible, pero el efecto nefrotóxico crónico no lo es. En pacientes que han sido sometidos a trasplante renal debe diferenciarse por biopsia renal entre nefrotoxicidad por ciclosporina versus rechazo del órgano trasplantado. Además, si se sospecha compromiso renal deben tenerse en mente todos aquellos factores que pueden empeorar la función de ese órgano (hipotensión, medios de contraste, aminoglicósidos, etc.).
Se observa hepatotoxicidad como un fenómeno dosis-dependiente y se manifiesta con elevación transitoria de la bilirrubina, enzimas hepáticas y fosfatasa alcalina; en la mayoría de los casos resuelve disminuyendo la dosis de la droga. La ciclosporina también puede predisponer a la producción de colelitiasis. No deprime la medula ósea, pero por un efecto sobre la secrección del factor estimulante de colonia del eritrocito, parece favorecer el desarrollo de anemia hipocrómica.
Otro de los efectos colaterales es la hipertensión arterial, la cual se observa con el tiempo en 50-70% de éstos pacientes sin aclararse su etiología; se asocia a una elevación en la resistencia vascular sistémica y se maneja con antagonistas de calcio (8). A nivel del sistema nervioso disminuye el umbral de convulsión y pueden observarse convulsiones tónico-clónicas generalizadas, las cuales son una complicación perioperatoria significativa, por lo que recomendamos evitar hiperventilación en estos pacientes; además se puede encontrar neuropatía periférica e hipertofia gingival, la cual puede llevar a sangrado significativo al manipular la vía aérea, y alteraciones del estado mental, específicamente confusión (1).
Por otro lado, Vaziri y col han sugerido un mayor riesgo de enfermedad trombótica en pacientes que reciben esta droga, soportándose en los hallazgos de un aumento en las concentraciones de factor de von Willebrand y productos de degradación de fibrina (9).
Por todo esto se debe obtener un control estricto de los niveles séricos de la ciclosporina, y si en la valoración se sospecha alguna alteración de ellos, se sugiere solicitar los niveles séricos correpondientes durante el perioperatorio y obtenerse un control diario de estos niveles. La droga debe administrarse 4 a 7 horas antes de la cirugía, en los pacientes en que se administró en menos de 4 horas los niveles plasmáticos fueron subterapeúticos (3).
Cirella y col demostraron una tendencia a potenciar la anestesia con tiopental y la analgesia del fentanyl en ratones, sin demostrarse esto claramente en humanos. La interacción con los relajantes musculares no despolarizantes de la ciclosporina y de su solvente el cremophor, ha sido estudiada por muchos; entre ellos Gramstad y col quienes observaron en gatos una potenciación del efecto en intensidad y duración del vecuronio y atracurium; posteriormente se han reportado varios casos donde se observa potenciación del pancuronio y vecuronio, pero el mecanismo de acción de esta interacción no está claro. Por ello se recomienda una monitoria estricta con estimulador de nervio periférico en todos los pacientes que reciben ciclosporina y se utilice relajante no despolarizante (10).
Tacrolimus (FK506). Es un antibiótico macrólido inhibidor de calcineurina. Es 10 a 100 veces más potente que la ciclosporina, ha sido utilizado en pacientes refractarios a terapias comunes de inmunosupresión. Es metabolizado por el sistema citocromo P 450 e igual que la ciclosporina su metabolismo se afecta con las drogas que alteren este sistema y presenta un rango terapéutico estrecho, por lo que se requieren controles de niveles plasmáticos (11). El tacrolimus se une en 70 - 80% a los eritrocitos, por lo que las concentraciones en sangre total son 15 a 30 veces más altas que las de plasma. Es excretado principalmente en bilis y una muy pequeña fracción se excreta a nivel renal (12).
La frecuencia de efectos adversos es rara después de la administración por vía oral. La administración IV se asocia a náusea y vómito en los siguientes 30 minutos y puede durar una hora. Puede observarse nefrotoxidad, hiperkalemia e hipomagnesemia secundaria y resistencia a insulina. Menos frecuentemente, se puede asociar a convulsiones por lo que se recomienda evitar hiperventilación perioperatoria; además, podemos encontrar neuropatía o alteraciones psicológicas las cuales deben ser descartadas en el preoperatorio. La alopecia, hiperglicemia y alteraciones del estado mental se observan más frecuentemente que con la ciclosporina (12). El tacrolimus ha sido utilizado como un agente de rescate en pacientes con rechazo recurrente o persistente. Como con la ciclosporina se recomienda un control diario perioperatorio de los niveles plasmáticos (1).
No se ha descrito una interacción específica con los anestésicos.
Inhibidores de síntesis de ADN
Azatioprina. Es una tiopurina sintetizada en 1951, derivado del antimetabolito 6-mercaptopurina el cual es el metabolito activo. Es un antimetabolito que actúa sobre la fase sintética del DNA, bloqueando la síntesis normal del DNA y RNA, pues se transforma en un ribonucleótido en el cuerpo. De esta forma ejerce su efecto inmunosupresor por prevenir la proliferación de las células inmunes en respuesta a un estímulo antigénico y por ser un antimetabolito es más activo contra células que están proliferando. La azatioprina ha reducido la incidencia de mortalidad por bronquiolitis obliterante en pacientes sometidos a trasplante pulmonar (3). La biodisponibilidad por vía oral es alta y se encuentra entre 40 - 50%.
Entre los efectos adversos más frecuentes tenemos la supresión de medula ósea, lo que lleva a leucopenia y trombocitopenia (inicia entre los primeros 7 a 14 días) e incluso puede presentarse aplasia de medula ósea, incrementando el riesgo de infección y hemorragia (12). En pacientes que reciben ciclosporina puede presentarse como efecto adverso la hiperuricemia y franco cuadro de gota, requiriendo manejo con alopurinol, el cual inhibe el metabolismo de 6-mercaptopurina e incrementa cuatro veces los niveles plasmáticos y favorece la probabilidad de sobredosis por azatioprina con severa pancitopenia que puede comprometer la vida del paciente. Esta situación se puede manejar disminuyendo la dosis de azatioprina o reemplazando la ciclosporina por tacrolimus. Otros efectos adversos observados son: alopecia, anemia megaloblástica, disfunción hepática, neoplasias y debe descartarse hepatitis, colestasis y pancreatitis en el preoperatorio (3).
En animales se ha observado que inhibe la acción de la colinesterasa aumentando el tiempo de acción de la succinilcolina, pero esto no se ha observado en humanos. Dretchen y col describieron un marcado antagonismo entre la azatioprina y los relajantes musculares no despolarizantes, pero no parece tener importancia clínica en humanos (13). La azatioprina está siendo reemplazada, cada vez con mayor frecuencia, por el micofenolato o el sirolimus.
Mofetil micofenolato (IMM 125). Es una prodroga que rápidamente se hidroliza a ácido micofenólico, el cual es el componente activo, con un efecto anti células T y células B, con menor toxicidad sobre la médula ósea que la azatioprina. Este efecto lo logra por inhibir en forma reversible y competitiva la deshidrogenasa inosina monofosfato y de esa forma bloquear la síntesis de nucleótidos de guanosina. Entre los efectos adversos más comunes tenemos el dolor abdominal, náusea, dispepsia, gastroenteritis, vómito, supresión de médula ósea e infecciones oportunísticas (12). No se requiere la monitoria estricta de los niveles plasmáticos en forma rutinaria, pero si se busca optimizar la respuesta terapéutica y minimizar los efectos adversos, posiblemente si lo requiera.
El uso de micofenolato en trasplante renal se aprobó en 1995, en trasplante cardíaco en 1998 y trasplante hepático en 2000, como una alternativa a la azatioprina. En trasplante renal, cardíaco y pulmonar ha demostrado menor incidencia de rechazo y de efectos adversos. Se utiliza como fármaco de mantenimiento o de rescate en episodios de rechazo.
Rapamycina (Sirolimus). Macrólido relacionado estructuralmente al tacrolimus, pero con un meca nismo de acción y un espectro de efectos adversos diferentes. Inhibe la proliferación celular mediada por citocina entre la fase G1 y S de las células B y T por bloquear la actividad de una enzima cinasa que se une a la rapamycina. El sirolimus fue aprobado en 1999 para uso en trasplante, con una biodisponibilidad por vía oral de 15%, se excreta principalmente por heces y sólo 2% se excreta a nivel renal (12). Los efectos adversos más frecuentes son hiperlipidemia, hipertensión, rash, depresión de medula ósea; potencia la nefrotoxicidad causada por ciclosporina y en pacientes con trasplante renal se ha descrito neumonitis intersticial. Como lo descrito para la ciclosporina, debe tenerse cuidado con la interacción con inhibidores de HMG-CoA reductasa, pues compiten por el metabolismo a nivel hepático y puede incrementar en forma significativa los niveles plasmáticos y un mayor riesgo de miopatia y rabdomiolisis (4).
Los estudios experimentales demuestran que probablemente el sirolymus previene el desarrollo de ateroscleroisis en el órgano trasplantado, lo cual es común en estados de rechazo.
La medición de los niveles plasmáticos no es necesaria. En Europa es aprobado su uso para los casos que requieren retirar la ciclosporina en los primeros 3 meses de trasplante.
No se describe interacción con agente anestésico.
Anticuerpos monoclonales y policlonales
OKT3. Es un Ig G monoclonal dirigido contra el complejo proteico de CD3 de las células T humanas, convirtiéndolas en inmunológicamente incompetentes e incapaces de responder ante un antígeno; además favorece la lisis vía complemento de los linfocitos y la opsonización de ellos. Las moléculas CD3 se conservan disminuídas en las primeras 48 horas después de descontinuar el anticuerpo, por lo que debe tenerse niveles plasmáticos adecuados de los otros inmunosupresores cuando se descontinúa este anti-CD3. Se ha utilizado para episodio de rechazo agudo y también es de elección en casos de rechazo agudo resistentes a esteroides. En la mayoría de los casos se utiliza un solo ciclo durante la primera semana postrasplante (14).
El principal efecto adverso se relaciona con la capacidad de liberar citocina desde el linfocito lo que genera el síndrome de liberación de citocinas, los signos y síntomas incluyen fiebre y escalofrío durante los 30 minutos después de la administración, mientras que la nausea y el vómito ocurren menos frecuentemente. Otros efectos adversos menos frecuentes son hipotensión, hipertensión, taquicardia, angina, edema pulmonar, meningitis aséptica, convulsiones, encefalopatía y disfunción renal. La meningitis aséptica ha sido descrita en 6% de los pacientes y siempre debe descartarse infección asociada (3,12).
Muchos intentos se han hecho para reducir sus efectos adversos y se recomienda una dosis de metilpredinisolona 500 mg IV y difenhidramina 50 mg IV 60 a 90 minutos y 30 minutos, respectivamente, antes de aplicar el OKT3.
No se ha descrito una interacción directa del OKT3 con ninguno de los anestésicos.
Globulina Antitimocito. Son anticuerpos dirigidos contra los linfocitos. Las dos presentaciones actuales utilizadas son el atgam y timoglobulina. Su acción inmunosupresora se manifiesta a través de una depleción marcada de linfocitos periféricos. Este efecto lo alcanzan por lisis de linfocitos mediada por complemento o por depuración de ellos por el sistema retículo endotelial, además pueden alterar la proliferación de linfocitos T (4,12).
La vida media de ambos agentes es prolongada (Atgam: 5,7días y Timoglobulina: 30 días). Se administran en un ciclo corto de 14 días y requieren premedicación 4 horas antes de administrarlos con acetaminofén, difenhidramina y metilprednisolona, para disminuir los efectos adversos. Los efectos adversos más comunes son: leucopenia (mayor con timoglobulina), trombocitopenia, fiebre, náusea, diarrea, artralgias, cefalea, riesgo aumentado de enfermedades malignas e infecciones oportunistas, escalofríos, flebitis local y eritema, enfermedad del suero y anafilaxis. Actualmente se describe un síndrome de disfunción renal reversible asociado a la liberación de citocinas inducida por ellos. Se utilizan para inducir inmunosupresión en todos los tipos de trasplante de órgano sólido y para episodios de rechazo agudo, pero se utilizan más frecuentemente para el tratamiento de rechazo resistente a esteroides o para retardar o estabilizar una bronquiolitis obliterante en pacientes con trasplante pulmonar, convirtiéndose casi en el patrón para el manejo de esta última entidad (3).
Antagonistas del receptor de Il 2. Los representantes de este grupo son el Basiliximab ( Ac monoclonal murino-humano) y el Daclizumab ( Ac monoclonal humanizado ). El anticuerpo está dirigido contra la subunidad alfa del receptor de Il 2, el cual se expresa en la superficie de linfocitos T activados, y al bloquearlo se inhibe la proliferación y diferenciación de los linfocitos T. El efecto inmunosupresor es prolongado por tener ambos una vida media prolongada (basiliximab: 13 días y daclizumab: 20-40 días) con un efecto de bloqueo del receptor de Il 2 más prolongado (basiliximab: 30 días y daclizumab: 120 días) (12).
Por ser los agentes más recientemente sintetizados no se tienen grandes estudios que nos puedan dejar claro la incidencia de efectos laterales y su principal utilidad; pero lo que se ha observado es una tendencia a muy pocos efectos adversos, no se han asociado a síndrome de liberación de citocinas y por afectar solo los linfocitos activos, la incidencia de infección o malignidad a un período de seguimiento de un año es casi nula. Se ha descrito un síndrome como el SDRA con la primera dosis de basiliximab, pero no se ha confirmado por otros investigadores (4). De todas formas se requieren más estudios para aceptar el uso de estos agentes como agentes de inducción o para el manejo de rechazo agudo o de difícil manejo.
Esteroides
Son potentes antiinflamatorios y son los agentes inmunosupresores más comúnmente utilizados. Actúan en diferentes puntos de la respuesta inmunológica, alteran la función linfocitaria y disminuyen el número circulante de linfocitos; el grado de linfopenia es dependiente de dosis y una dosis alta puede llevar a una reducción de 50 - 70 %; bloquean la síntesis de los mediadores citodestructivos e inflamatorios (Il-2, Il-1 e Il-6) por mecanismos intracelulares y además bloquean otras citocinas, incluyendo leucotrienos y prostaglandinas (8). Se utilizan para la prevención del rechazo y para el tratamiento de episodios de rechazo agudo. A pesar de la vida media corta de la prednisona, la inhibición de las linfocinas alcanza las 24 horas, por eso se puede suministrar una vez al día (4).
Entre los efectos adversos más frecuentes tenemos la retención de agua y sodio, lo cual puede llevar a hipertensión arterial y exacerbar un episodio de insuficiencia cardíaca; también se observa hiperglicemia, lo cual puede inducir diabetes o exacerbar una ya existente; hipokalemia e hipocalcemia; alteraciones psicológicas (insomnio, euforia, depresión, psicosis por esteroides), cambios cushinoides, alteración de la capacidad de cicatrización tisular, aumento de la suceptibilidad a infecciones, cataratas, miopatía por esteroides y osteoporosis (12). Todos estos efectos se observan más frecuentemente cuando se utilizan dosis elevadas de estas drogas, pero ceden cuando se bajan o descontinúan. Algunas alteraciones psicológicas, como la psicosis pueden limitar el uso de neuroleptoanestesia o de anestesia regional. Por lo tanto, dentro de la valoración preoperatoria debe conocerse el sodio, potasio cloro, calcio, magnesio y glicemia.
Los pacientes que han recibido terapia con esteroides por lo menos durante una semana en los últimos seis meses previos a la cirugía tienen un riesgo mayor de desarrollar insuficiencia suprarrenal en el período perioperatorio, por lo que se recomienda en esos pacientes colocar una dosis estrés de esteroides, siendo el más frecuentemente utilizado la hidrocortisona. La dosis de estrés dependerá de la respuesta fisiológica esperada de la glándula suprarrenal al estrés quirúrgico. Son múltiples los esquemas que se utilizan y uno de ellos es el establecido por Nicholson y Salem según la severidad del estrés perioperatorio (Tabla 4) (15).
Tabla 4. Dosis de esteroides según estrés perioperatorio
Por otro lado estas drogas predisponen a un retardo en el proceso de cicatrización tisular, además con una menor calidad del tejido restaurado. En modelos animales, la estructura de las heridas cicatrizadas se mejoró en piel y anastomosis colónicas con la administración de factor de crecimiento como la insulina y de prostaglandina E1 respectivamente. En humanos se recomienda utilizar vitamina A para mejorar la calidad de la cicatrización en estas circunstancias, este fenómeno no se describe con ciclosporina y azatioprina (16).
Fases de la terapia inmunosupresora
La terapia inmunosupresora tiene dos fases: Fase de inducción y de mantenimiento (4).
Fase de inducción. Se suministran dosis altas de inmunosupresores en el período postrasplante inmediato, cuando el riesgo de rechazo es más alto. En la mayoría de los pacientes se utilizan las mismas drogas que las de mantenimiento, pero algunos centros utilizan los agentes de inducción (anticuerpos policlonales o monoclonales) descritos previamente. El uso de éstos últimos agentes se recomienda en pacientes con alto riesgo de rechazo como niños, pacientes previamente sensibilizados (embarazo previo, antecedente de trasplante o transfusiones múltiples de sangre o derivados) y se consideran en casos de necrosis tubular aguda postrasplante donde se requiere disminuir la dosis de ciclosporina o tacrolimus para prevenir el efecto aditivo nefrotóxico de estos fármacos; pues ellos tienen un efecto inmunosupresor potente que aumenta en forma significativa el riesgo de infección o enfermedades malignas, por lo que cada día se buscan agentes inmunosupresores potentes que se suministren por vía oral y no tengan efectos tan prolongados sobre la inmunidad celular.
La terapia de inducción dura 7 a 14 días con anticuerpos antilinfocito policlonal o anti CD3 monoclonal, buscando reducir la incidencia de rechazo agudo temprano y la severidad del mismo.
Fase de mantenimiento. En esta fase se busca mantener el nivel de inmunosupresión necesaria para conservar la tolerancia al órgano trasplantado, pero con el menor estado de inmunosupresión posible. Actualmente tenemos limitantes para conocer la respuesta inmunológica individual a un trasplante y algunos factores de riesgo pueden sugerir la probable intensidad de esta respuesta. En esta fase, generalmente se utiliza un tratamiento triconjugado donde se bloquea en diferentes puntos la proliferación de los linfocitos T, para ello se utilizan un esteroide, un agente inhibidor de calcineurina y un agente antiproliferativo; el nivel total de inmunosupresión buscado depende de factores como órgano trasplantado, grado de incompatibilidad HLA, raza del receptor e historia previa del rechazo agudo.
A largo plazo se espera que las estrategias inmunosupresoras incluyan el bloqueo de la coestimulación de células T y el reconocimiento de antígenos con el objetivo de que la función molecular accesoria module la respuesta inmune y se alcance la aceptación clínica del órgano o tejido trasplantado, sin comprometer otro tipo de inmunidad local o sistémica.
En conclusión, son varios los agentes inmunosupresores con los que nos podemos encontrar, y aunque afectan muy poco la farmacocinética y farmacodinámica de los anestésicos utilizados frecuentemente, sus niveles séricos se pueden ver afectados por otros medicamentos utilizados en el perioperatorio, alterando la efectividad de la droga o aumentando sus efectos tóxicos. Los inmunosupresores deben continuarse durante el perioperatorio y la mayoría de los pacientes pueden mantenerse con su régimen oral, sin embargo; en aquellos procedimientos en los cuales se va alterar significativamente la función gastrointestinal es probable que la ciclosporina tenga que suministrarse por vía intravenosa, pues su absorción depende mucho de la emulsificación por la bilis y la dosis endovenosa debe ajustarse. Con la introducción de una nueva presentación de ciclosporina quizás, se venza esta anotación y se pueda seguir suministrando por vía oral sin problemas. La dosis de metilprednisolona es igual a la dosis oral de prednisona y las dosis orales y endovenosas de la azatioprina son equivalentes. Por último, debemos recordar el control de los niveles séricos perioperatorios diarios de la ciclosporina y el tacrolimus.
Consideraciones generales perioperatorias
La mayoría de los pacientes no tiene limitación funcional para su vida después del trasplante alcanzando 50% de ellos su capacidad de trabajo previa, con una capacidad total para el trabajo de solo 38-64% de lo normal y logrando valores cerca de lo normal con un buen entrenamiento (2).
Después del trasplante hepático se desarrolla diabetes mellitus en 4 - 20% de los pacientes, con la incidencia más alta durante el primer año; hiperlipidemia en 6 - 15% de estos pacientes.
La hipertensión arterial y enfermedad coronaria no incrementa en forma significativa (1).
Como se mencionó se observa un incremento de enfermedades neoplásicas, que incluyen: enfermedad linfoproliferativa, sarcoma de Kapossi y tumores malignos de piel, periné, hígado y cuello uterino. En general, este riesgo se incrementa 3 - 4 veces, pero para neoplasias linfoproliferativas el riesgo puede ser 30 - 40 veces mayor que la población general con un incremento de 37 - 50% en la mortalidad (1,17).
Las complicaciones neurológicas se presentan en 30-60% de los pacientes trasplantados e incluyen: infartos, hemorragias, infecciones, hipoxia, convulsiones y neuropatía periférica asociadas a los inmunosupresores. Se ha descrito miastenia gravis como consecuencia de la reacción injerto vs huésped y aproximadamente 20% de los pacientes trasplantados de hígado pueden presentar mutismo por varias semanas después del trasplante (1,2).
Se considera que 80% de los pacientes sometidos a trasplante hepático presenten por lo menos 1 - 2 episodios de infección secundario a su estado de inmunosupresión (2). Durante el primer mes postoperatorio son más comunes las infecciones bacterianas asociadas a los catéteres, las heridas y las vias respiratorias (S.Aureus, E. Coli y S. Pneumoniae respectivamente). Durante el período del segundo al sexto mes la inmunosupresión es intensa y predominan infecciones virales, micóticas y micobacterianas oportunistas, como P. Carinni, Herpes virus, Citomegalovirus, Cándida y Aspergillus. Cuando se presenta neutropenia severa las infecciones se pueden asociar a cocos gram positivos, Enterobacterias y Pseudomonas (17).
La profilaxis antibiótica para el procedimiento quirúrgico no se modifica y se realiza en común acuerdo entre el cirujano y el anestesiólogo, según el tipo de cirugía.
Los antiinflamatorios no esteroideos deberían evitarse, pues potencian algunos efectos adversos de inmunosupresores como hemorragia gastrointestinal, nefrotoxicidad y disfunción hepática (1). No se requiere dosis estrés de esteroides, a no ser que los haya suspendido por un tiempo, y se utilizan según el esquema manejado por cada institución (Tabla 4).
Aunque los efectos del transplante y, en particular, de la ciclosporina sobre la coagulación (aumento de la liberación de tromboxano, generación de tromboplastina y aumento en la actividad del factor VII) y un mayor riego de fenómenos trombóticos son controversiales deben tenerse las consideraciones especiales para la profilaxis antitrombóticas, en especial si varios factores de riesgo están presentes (18). Las complicaciones tromboembólicas están aumentadas durante los primeros meses después del trasplante renal y cardíaco, encontrándose en estos últimos una mayor incidencia de trombo en aurícula izquierda.
Ante cualquier signo de infección o rechazo el procedimiento electivo debe cancelarse.
Premedicación
Continuar dosis de inmunosupresores (suministrar ciclosporina 4-7 horas antes del procedimiento para evitar niveles subterapéuticos). La premedicación usual se puede suministrar en la mayoría de estos pacientes, pero en pacientes trasplantados de pulmón se recomienda no usar opiodes para evitar el riesgo de depresión ventilatoria.
Monitoría
En la mayoría de los casos es suficiente con pulsooximetria, capnografía, presión arterial no invasiva y electrocardiograma. Se recomienda limitar el uso de monitoría invasiva a la estrictamente necesaria según la condición lo requiera para disminuir el riesgo de infecciones; se deben agudizar las medidas de asepsia y antisepsia durante cualquier instrumentación que se les realice y se puede utilizar una dosis profiláctica de antibiótico contra S. Aureus, previo a la colocación de catéteres (3,18). El uso de catéteres impregnados con antiséptico redujo la colonización y la infección por catéter en 60% de este grupo de pacientes (2). La sonda vesical se utiliza si la función renal está en riesgo, en cirugías de alto recambio de volumen o en cirugías prolongadas. El ultrasonido esofágico puede ser una buena opción en los casos que requieren monitoría hemodinámica, con el objetivo de disminuir el grado de invasión y de esa forma disminuir el riego de infección.
Manejo de vía aérea
La intubación endotraqueal por vía oral se prefiere a la vía nasal, debido al mayor riesgo de bacteremias en esta última y siempre se recomienda utilizar filtros antibacterianos en los circuitos anestésicos (18).
El riesgo de broncoaspiración puede estar aumentado en este grupo de pacientes. En los pacientes diabéticos puede haber un contenido gástrico significativo aún después de 24 horas de ayuno (2). La ciclosporina puede ocasionar atonia gástrica que responde con metoclopramida. La ventilación positiva con máscara facial o máscara laríngea es mejor evitarla, especialmente en posición de Trendelemburg, pero pueden ser utilizadas para procedimientos cortos o broncoscopias. Estos pacientes pueden tener varios factores que los convierte en potencial vía aérea difícil: paciente diabético con limitación articular en mandíbula y cuello, crecimiento linfoproliferativo que puede causar obstrucciones que comprometan la vida y estenosis subglótica o compromiso endobronquial en granulomatosis de Wegener (19).
Una variedad de técnicas anestésicas han sido utilizadas en forma exitosa en estos pacientes (general, regional y neuroleptoanestesia). Ninguna técnica anestésica ha demostrado ser superior (1,2).
Anestésicos inhalatorios. Todos los anestésicos inhalatorios han sido estudiados en pacientes trasplantados. Teóricamente, la liberación de fluoruros inorgánicos nefrotóxicos por el enfluorane y sevofluorane los convierte en poco deseados. El halotano no se recomienda para uso repetitivo. La experiencia con el desfluorane en este grupo de pacientes es limitada y el isoflourane, a pesar de teoricamente disminuir la absorción intestinal de ciclosporina, se considera el agente inhalatorio preferido (3).
Anestésicos endovenosos. En general se puede utilizar cualquiera de ellos, el etomidato se prefiere en pacientes inestables hemodinámicamente y la ketamina no se recomienda utilizar en casos de disfunción renal (5).
Anestésicos locales. En caso de utilizar técnica regional, tener en cuenta que la azatioprina y el antitimocito pueden llevar a trombocitopenia, por lo que se requiere un control de la pruebas de coagulación y conteo plaquetario. No se ha encontrado ninguna asociación específica adversa de los anestésicos locales en los pacientes trasplantados previamente (2,6).
Relajantes neuromusculares. En teoría la azatioprina podría incrementar la dosis necesaria de estos agentes y la ciclosporina podría prolongar su acción, los cuales son efectos que clínicamente no tienen relevancia. El atracurium y cisatracurium son los agentes recomendados en pacientes con trasplante hepático. El rocuronio se recomienda para secuencia rápida en casos de contraindicación de la succinilcolina. Debe tenerse en cuenta la función renal en caso de utilizar pancuronio, pues sus niveles aumentan si hay disfunción renal; lo mismo sucede con el vecuronio.
En conclusión, no solo se considera el hecho de haber sido trasplantado o de cual órgano se trasplantó, cobra más importancia el estado metabólico y la función hepática y renal, por si mismas, al momento de escoger los agentes anestésicos.
Consideraciones específicas perioperatorias
El hígado es el segundo órgano más frecuentemente trasplantado. En el período postrasplante inmediato se encuentra un aumento significativo de las enzimas hepáticas, las cuales se normalizan durante las primeras dos semanas si el trasplante funciona adecuadamente (1). Las bilirrubinas séricas se normalizan aproximadamente a los tres meses postrasplante a no ser que se presente rechazo crónico, obstrucción biliar o hepatitis C. Los niveles de glutamato oxalacético transaminasa (GOT) son un determinante primario de adecuada inmunosupresión y se utilizan para modificar el esquema de agentes inmunosupresores. Las pruebas de capacidad sintética son usualmente normales a menos que se presente rechazo crónico o trombosis de la arteria hepática, esta última se asocia a una mortalidad mayor de 70% y se asocia a sobretransfusión de glóbulos rojos, por ello se recomienda que estos pacientes conserven un hematocrito de mas o menos 28 - 34% durante el perioperatorio (1). La fosfatasa alcalina y la gamma-glutamil transferasa son indicadores de colestasis, y no se normalizan tan fácilmente después del trasplante, por lo que no nos interesa el valor absoluto de ellos, sino la tendencia (3).
Un tiempo de protombina prolongado o una albúmina sérica baja por más de tres meses es sugestivo de rechazo crónico o complicación del tracto biliar (estenosis de los ductos biliares).
Cualquier desviación de las pruebas de función hepática sugiere la investigación de cualquier etiología para que el órgano trasplantado no funcione bien y la cirugía electiva debe cancelarse hasta que ello se estudie adecuadamente. Debe considerarse infección por citomegalovirus (generalmente en los primeros dos meses), hepatitis viral postranfusión o recurrencia de infección pretrasplante.
La capacidad de metabolismo se alcanza en forma considerable inmediatamente después de la reperfusión. Cuando la función hepática es normal no hay contraindicación para cualquier agente anestésico y no hay evidencia de aumento en la incidencia de hepatitis asociada a halogenados. La disfunción renal es común en estos pacientes y siempre debe tenerse en cuenta para las drogas que se van a utilizar (3,19).
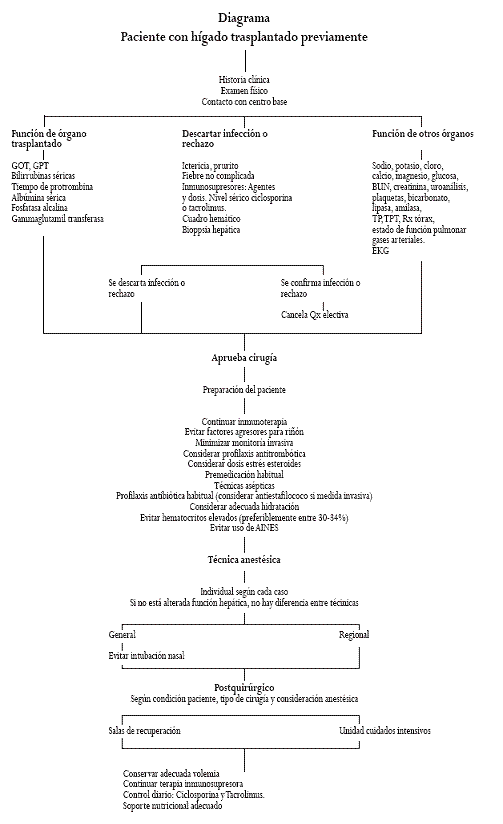
En cuanto a las alteraciones pulmonares asociadas, todos conocemos que en pacientes con enfermedad hepática terminal puede encontrarse hipoxemia por varias causas: shunt intrapulmonar, alteración de la ventilación/perfusión por ascitis, derrame pleural y disfunción diafragmática; difusión anormal por neumonitis o hipertensión pulmonar y alteración de la vasoconstricción pulmonar hipóxica. Después de un trasplante exitoso la oxigenación mejora en la mayoría de ellos y la hipoxemia por alteraciones de la relación ventilación/perfusión se corrige en los primeros meses postoperatorios, pero los verdaderos shunt pueden requerir más tiempo para corregir y alcanzar la reversión de la hipoxemia o ésta puede no lograrse nunca (1). Por eso se recomienda obtener por lo menos una saturación arterial de oxígeno por pulso-oximetría al aire ambiente y conocer su estado basal (20). Ver diagrama de flujo. (Figura 1)
Figura 1. Diagrama Paciente con hígado trasplantado previamente
Cuidados postoperatorios
Las principales metas durante este período son: control del dolor, evitar complicaciones de la vía aérea y controlar las condiciones que aumenten el riesgo de infección.
Después de cirugía los pacientes requieren el cuidado correspondiente a la complejidad de su estado mórbido, quirúrgico y anestésico, como en todos los pacientes. Pero en general debe tenerse en cuenta las alteraciones electrolíticas secundarias y tener un control estricto de los mismos, con un manejo óptimo de los líquidos suministrados. Como hemos visto previamente, estos pacientes tienen un riesgo aumentado de lesión renal y deben tomarse todas las precauciones perioperatoprias para disminuir esta agresión; recientemente se ha utilizado la urodilatina para conservar mejor función renal perioperatoria y se han obtenido buenos resultados, con una disminución en los niveles plasmáticos de creatinina más precozmente comparados con los pacientes que no la recibieron (21). El riesgo aumentado a infecciones refuerza la necesidad de balancear continuamente el riesgo-beneficio de cualquier procedimiento invasivo que se desea utilizar, cuidado estricto de las heridas y adecuada protección antibiótica según cada caso. Debe continuarse con la terapia inmunosupresora preferiblemente por vía oral, pero si no se puede, utilizar la vía endovenosa con las dosis equivalentes correspondientes, y lo más pronto posible utilizar la vía oral. Debe asegurarse un adecuado soporte nutricional balanceado de acuerdo a las necesidades calóricas y proteicas, utilizando preferiblemente el tracto gastrointestinal, y por último recordar que una movilización temprana minimiza el riesgo de trombosis venosa profunda y embolismo pulmonar. No se requiere el uso de cuidados intensivos en forma indiscriminada y el paciente no debe ser expuesto a este medio hostil en forma innecesaria. En caso de disfunción del sistema nervioso autonómico se recomienda vigilancia estricta, pues se han descrito casos de colapso cardiovascular hasta las 48 horas después de la cirugía (2).
Tendencias futuras
Los trasplantes hepáticos han sido posibles por el mejor entendimiento de la respuesta inmune al rechazo del injerto, pero todavía tres problemas continúan enfrentándose: rechazo, infección y toxicidad de las drogas inmunosupresoras. En la actualidad se están realizando múltiples experimentos para optimizar estas tres situaciones, uno de los cuales es la inducción de tolerancia que consiste en el trasplante celular en el que células en buen estado son inyectadas a pacientes recipientes para lograr algo que se podría llamar una inmunoadaptación y se puede observar una tolerancia a antígenos extraños promo viendo la migración celular y el quimerismo (adaptación a los elementos más críticos de la histocompatibilidad); pero quién nos puede negar que pronto se alcance, a través de la ingeniería genética con cultivo celular y tisular, el desarrollo de órganos totalmente compatibles con el receptor (4,12). Por último, se puede intentar radiación del tejido linfoideo total con manipulación del medio tímico del paciente receptor, lo cual lleva a severa linfopenia, aumentando el riesgo de infección y neoplasia en forma significativa. La fotoféresis se ha utilizado en un número pequeño de pacientes para tratar rechazo pulmonar refractario al manejo usual y para detener la progresión de bronquiolitis obliterante, pero se requieren más estudios (2). Todas estas propuestas están en desarrollo y se pretende que pronto se le pueda ofrecer a estos pacientes la mejor forma de llevar a cabo todo el proceso de trasplante de órgano.
Conclusiones
En conclusión, los pacientes sometidos a trasplante hepático previo tienen consideraciones médicas, fisiológicas y farmacológicas que deben entenderse muy claramente para poder tener un enfoque integral de ellos cuando van a ser sometidos a cualquier cirugía. Debe conocerse el estado funcional del órgano trasplantado, la farmacología de las drogas inmunosupresoras y las condiciones mórbidas asociadas. Cualquier tipo de anestesia puede utilizarse en estos pacientes, teniendo en cuenta las consideraciones individuales para cada caso. Si se sospecha infección o rechazo de injerto se debe cancelar todo procedimiento electivo y manejar estas condiciones; además en lo posible debe tenerse contacto con el centro en el cual el paciente se realizó el transplante y conocer lo que más se puede del historial clínico. Por último, debemos ser concientes de que muchos de los problemas perioperatorios de ellos no se han estudiado exhaustivamente y en muchos no se tiene un manejo claramente establecido, por lo que se recomienda tener un registro de los problemas perioperatorios encontrados, para que con el tiempo se puedan establecer guías de manejo apropiadas.
Referencias
1. Kostopanagiotou G, Smyrniotis V, Arkadopoulus N, et al. Anesthetic and Perioperative Management of Adult Transplant Recipients in nontransplant surgery. Anesth Analg 1999; 89: 613-622.
2. Toivonen H. Anaesthesia for patients with a transplanted organ. Acta Anaesth Scand 2000; 44: 812-833.
3. Sharpe M, Gelb A. Anesthetic Considerations for the previously transplanted patient. Anesth Clin N Am 1994; 12: 827-843.
4. Denton M, Magee C, Sayegh M. Immunosuppressive strategies in transplantation. Lancet 1999; 353; 1083-1091.
5. De Hoyos AL, Petterson GA, Maurer JR, et al. Pulmonary Transplantation: early and late results. J Thorac Cardiovasc Surg 1992; 103: 295 - 306.
6. Brown HR, Biajtbord D, Johnson DW, et al. Efficacy of oral ciclosporine given prior to liver transplantation. Anesth Analg 1989; 69: 773-775.
7. Adu D, Turnery J, Michael J, et al. Hiperkalemia in ciclosporina treated renal allograft recipients. Lancet 1983; 2: 370-372.
8. Simmons RL, Wang SC. New horizons in immunosuppression. Transplant Proc 1991; 23 (4): 2152 - 2156.
9. Bailey P, Stanley T. Anesthesia for patients with with a prior cardiac transplant. J Cardiothorac Anesth 1990; 4: 38 - 47.
10. Cirella UN, Pantuck CB, Lee Y, et al. Effects of cyclosporine on anesthetic action. Anesth Analg 1987; 66: 703 - 706.
11. Starz JE, Todo S, Fung J, et al. FK 506 for liver, kidney and pancreas transplantation. Lancet 1989; 2: 1000-1004.
12. Lake K. Immunosuppressive Drugs and Novel Strategies to Prevent Acute and Chronic Allograft Rejection. Sem Resp Crit Care Med 2001; 22: 559-580.
13. Dretchen K, Morgenrotn VH, Standaert FC, et al. Azathioprine: Effects on neuromuscular transmission. Anesthesiology 1976; 45: 604-609.
14. Ortho Multicentre transplant study group: A randomized clinical trial of OKT3 monoclonal antibody for acute rejections of cadaveric renal transplants. N Engl J Med 1985; 313: 337-342.
15. Graham G, Unger B, Coursin D. Perioperative management of selested endocrines disorders. Exp Clin Endocrinol 1995; 102:333 - 358.
16. Jhonston T, Katz S. Special considerations in the transplant patient requiring other surgery. Surg Clin N Am 1994; 74: 1211 - 1219.
17. Sharpe MD. Anesthesia and the transplanted patient. Can J Anaesth 1996; 43: R89-98.
18. Hammer GB, Cao S, Boltz MG, Messner A. Post-transplant lymphoproliferative disease may present with severe airway obstruction. Anesthesiology 1998; 89: 263-265.
19. Cheng DC, Ong DD. Anaesthesia for noncardiac surgery in heart-transplanted patients. Can J Anaesth 1993; 40: 981-986.
20. Firestone L, Firestone S. Anesthesia for organ transplantation. Clinical Anesthesia. 2nd ed. Philadelphia: Ed. Lippincott, Raven Publishers; 1996;52; 1249-1276.
21. Shaw I, Kirk J, Conacher Z. Anesthesia for patients with transplanted hearts and lungs undergoing non cardiac surgery. Br J Anaesth 1991; 67: 772-778.