Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev Col Gastroenterol v.19 n.1 Bogotá jan./mar. 2004
Enfermedad hepática grasa no alcohólica: nafld
Victor Idrovo Cubides (1), Luis Gonzalo Guevara (2)
(1) MD. Internista y gastroenterólogo. Hepatólogo clínico y de transplante hepático. Fundación Santa Fé de Bogotá, D.C. Colombia.
(2) MD. Internista y gastroenterólogo. Hepatólogo clínico y de transplante hepático. Hospital Universitario de la Samaritana. Bogotá, D.C. Colombia.
Introducción
La enfermedad hepática grasa no alcohólica (NAFLD) es una condición médica ampliamente reconocida en la actualidad, y aunque en la mayoría de situaciones tiene un comportamiento benigno, ocasionalmente puede evolucionar a hepatopatía crónica avanzada y cirrosis. Se presenta generalmente en individuos diabéticos, obesos o con hipertrigliceridemia, a veces con hipertensión, hiperuricemia y enfermedad poliquística ovárica, y está ampliamente asociada con el síndrome metabólico de resistencia a la insulina (NAFLD primario). No obstante, existen otras situaciones secundarias en las cuales se puede presentar esta entidad (NAFLD secundario) (Tablas 1 y 2).
Tabla 1. Condiciones asociadas a NAFLD Primario
| Síndrome de resistencia a la insulina Obesidad Diabetes mellitas II Dislipidemia: Trig HDL Niños: obesidad | 39-93% 21-55% variable 83-100% |
Tabla 2. Factores secundarios de NAFLD.
| Quirúrgicos | Otros | |
| Corticoides Estrógenos-tamoxifen Amiodarona Diltiazem-nifedipina | Gastropexia para la obesidad Resección intestinal externa Bypass yeyuno-ileal Derivación biliopancreática | Abetalipoproteinemia Sobrecrecimiento bacteriano Toxinas ambientales Nutrición parenteral |
| Desconocido: 10-15% |
Se define NAFLD como la acumulación de grasa en el hígado que excede 5 a 10% de su peso, y que se correlaciona con la cantidad de hepatocitos llenos de grasa en el citoplasma cuando se hace estudio por biopsia.
Debido a su similitud histopatológica con la enfermedad hepática alcohólica, es indispensable descartar el consumo importante de alcohol para el diagnóstico de NAFLD (menos de 20 gr/día para mujeres y menos de 40 gr/día para hombres, o menos de 14 a 28 unidades de alcohol por semana).
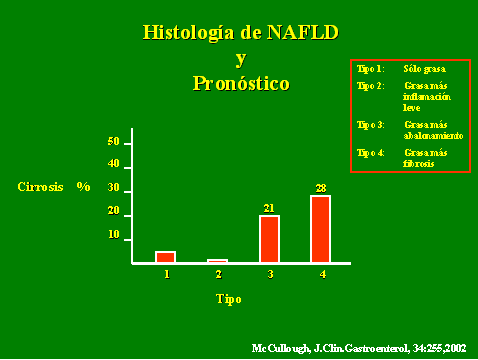
El espectro de la enfermedad va desde la presencia de esteatosis hepática únicamente o con inflamación inespecífica leve sin fibrosis (hígado graso no alcohólico o NAFL - non alcoholic fatty liver), que es de evolución benigna y sin riesgo de enfermedad hepática avanzada, hasta el desarrollo de esteatohepatitis no alcohólica (NASH - non alcoholic steatohepatitis), con riesgo de progresión a cirrosis, insuficiencia hepática e incluso hepatocarcinoma. NAFLD presenta alteraciones histológicas idénticas a la hepatopatía alcohólica: 1. degeneración por abalonamiento hepatocitario, 2. fibrosis perisinusoidal, 3. esteatosis de macrovacuola y 4. cuerpos hialinos de Mallory en la zona 3 del acino hepático. Basándose en estos hallazgos histopatológicos, se puede clasificar NAFLD en cuatro tipos, con implicaciones pronósticas para el riesgo de cirrosis (Figura 1). El espectro benigno de NAFL lo conforman los tipos 1 y 2, mientras el NASH lo constituyen los grupos 3 y 4.
Figura 1. Histología de NAFLD y pronóstico
La prevalencia estimada de NAFL es de 20% en la población general, constituyéndose en el principal motivo de consulta en hepatología, mientras la prevalencia de NASH es de 2% a 3%. Pacientes con elevación crónica de aminotransferasas pueden tener una prevalencia NAFL hasta de 21% a 63%, y si son obesos hasta de 95%. La prevalencia de NASH en obesos es de 25% y en diabéticos tipo II es de 63%.
Los seguimientos hasta por diez años ha demostrado que los pacientes con NASH pueden progresar a cirrosis en 25% de casos, con una mortalidad hepática de 12%. Muchos de los pacientes diagnosticados como cirrosis criptogénica (hasta 80%) eventualmente tenían NASH, y cuando son trasplantados frecuentemente recidivan en el hígado trasplantado con cambios idénticos a NASH. Generalmente, estos pacientes criptogénicos tenían asociado una diabetes mellitus tipo II o eran obesos.
Factores predictores de severidad y fisiopatogenia en NAFLD
No se tiene muy claro por qué la mayoría de pacientes tienen una enfermedad de evolución benigna (NAFL), mientras otros presentan una enfermedad progresiva y avanzada (NASH). Sin embargo, se han identificado algunos factores predictores de severidad que permiten sospechar qué individuos están en riesgo de enfermedad severa en el futuro. Se consideran de importancia para severidad:
1. Edad mayor de 45 años
2. Relación AST/ALT mayor de 1.0
3. Obesidad
4. Diabetes mellitus tipo II
5. Niveles de albúmina
6. Grado de fibrosis en la biopsia hepática.
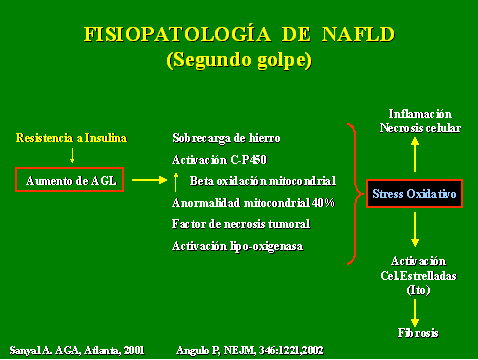
Fisiopatológicamente, se ha identificado la presencia de stress oxidativo como punto inicial para la progresión de NAFL a NASH. Tradicionalmente se expone la fisiopatología del NAFLD como un proceso de doble golpe (double hit). Inicialmente, el aumento de lipólisis periférica en individuos con resistencia a la insulina produce un incremento de los ácidos grasos libres, que al ser captados por el hepatocito aumentarán los niveles de triglicéridos en el citoplasma y producirán esteatosis de macrovacuola con desplazamiento del núcleo a la periferia (primer golpe) (Figura 2).
Figura 2. Fisiopatología de NAFLD (Primer golpe).
Por otra parte, este incremento de los ácidos grasos libres en el hepatocito desencadenan mecanismos de stress oxidativo (aumento de hierro, activación de citocromo P450, aumento de beta oxidación mitocondrial, estimulación de lipo-oxigenasa y factor de necrosis tumoral). Este incremento del stress oxidativo llevará a activación de factores proinflamatorios y de necrosis celular y activará las células estrelladas (Ito) que son precursoras de fibrosis hepatocitaria, desarrollándose así el estadío de NASH (segundo golpe) (Figura 3).
Figura 3. Fisiopatología de NAFLD (Segundo golpe).
Diagnóstico
NAFLD es una entidad frecuentemente asintomática y es motivo de consulta por el hallazgo de anormalidades en las pruebas enzimáticas hepáticas. Frecuentemente se identifica el cuadro en la evaluación de rutina en individuos obesos, diabéticos o con hipertrigliceridemia.
Clínicamente se presenta a veces fatigabilidad, dolor en hipocondrio derecho y hepatomegalia, pero estos hallazgos son inespecíficos y se pueden presentar en cualquier enfermedad hepática. Los estigmas de hepatopatía crónica son evidentes cuando ya hay cirrosis (eritema palmar, telangiectasias, esplenomegalia).
La historia clínica, los antecedentes médicos y el examen físico permiten identificar la mayoría de pacientes con NAFLD. Sin embargo, es necesario realizar estudios de laboratorio para descartar otras etiologías de elevación crónica de aminotransferasas (serologías para hepatitis viral B y C; estudios para enfermedades metabólicas como la sobrecarga de hierro, enfermedad de Wilson y deficiencia de alfa 1 antitripsina; y estudios para hepatopatías autoinmunes: hepatitis autoinmune y cirrosis biliar primaria). Es indispensable interrogar al paciente sobre el uso de medicamentos o sustancias potencialmente hepatotóxicas, y obviamente hay que descartar el consumo importante de alcohol.
Es razonable realizar pruebas de resistencia a la insulina durante la evaluación de estos pacientes si se tiene en cuenta que esta alteración metabólica es la base fisiopatológica para el desarrollo de le enfermedad hepática. La más sencilla de las pruebas de insulina es la determinación basal de la misma, pero también son útiles pruebas de tolerancia a la glucosa tanto por vía oral como por infusión intravenosa. Existen modelos matemáticos para determinar resistencia a la insulina como son el QUICKI o el HOMA, que son más dispendiosos de realizar y no se hacen de rutina.
Las imágenes diagnósticas (ultrasonido, tomografía axial computarizada y resonancia magnética) permiten identificar la presencia de exceso de grasa a nivel hepático, siendo el ultrasonido el método menos costoso y más fácilmente disponible. No obstante, la sensibilidad no es muy buena cuando la esteatosis es menor de 25 a 30%. Por otra parte, ninguna prueba de imágenes puede determinar el estadío de la enfermedad en forma precisa, y tampoco puede identificar la presencia de fibrosis.
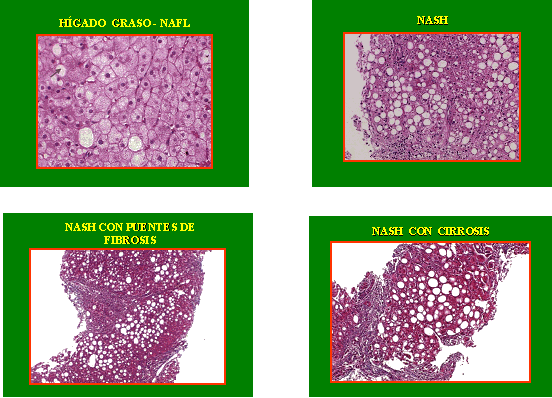
La biopsia hepática es sin duda la prueba de oro para confirmar el diagnóstico de NAFLD, y en especial de NASH (Figura 4).
Figura 4. Aspecto histológico de NAFL y NASH.
Existe controversia para decidir cuándo se debe realizar biopsia hepática en los pacientes con NAFLD. Sin duda, hay consenso para no hacer biopsia en aquellos individuos con aminotransferasas persistentemente normales. Incluso, en aquellos con aminotransferasas elevadas, si responden favorablemente al tratamiento y se normalizan las pruebas en un lapso no superior a 6 meses, la biopsia hepática es controvertida. Se debe individualizar cada caso, y se recomienda en general que si no hay normalización de las aminotransferasas, o si existen factores de riesgo altos para NASH (Tabla 3), la biopsia hepática está indicada para establecer la progresión y el pronóstico de la enfermedad.
| Obesidad AST: ALT mayor de 1 Diabetes mellitus tipo II |
| Angulo P, NEJM, 346: 1221. 2002 |
Tabla 3. Factores de riesgo para fibrosis e indicación para biopsia hepática.
Tratamiento
No hay tratamiento de comprobada efectividad en pacientes con NAFLD. En general se recomienda modificar aquellas circunstancias que se asocian con esta entidad, con lo cual la mayoría de los pacientes se logran controlar. Primero, hay que disminuir el aporte de grasa hacia el hígado. Por eso, es necesario iniciar un tratamiento adecuado para el control de la diabetes y de la resistencia a la insulina, así como la disminución progresiva y programada de peso en los obesos. La dieta hipocalórica, baja en carbohidratos y en grasa, y el ejercicio supervisado son indispensables para lograr un beneficio inicial en estos pacientes. Lograr un descenso de peso de al menos 10% ha demostrado ser ventajoso. Sin embargo, no es aconsejable una reducción muy rápida de peso (más de 1.6 kg por semana) pues se ha evidenciado empeoramiento de NAFLD si esto sucede. Terapias reductoras de peso como el orlistat y la sibutramina o la cirugía bariártrica pueden tener algún puesto en el tratamiento de NAFLD, pero se debe tener en cuenta que la reducción muy rápida de peso no es aconsejable.
Si se están consumiendo medicamentos asociados con NASH, estos se deben descontinuar en lo posible (p.ej. corticoides, estrógenos, amiodarona, nifedipina, salicilatos, tamoxifen), haciendo un análisis del verdadero riesgo beneficio al no tomarlos.
La otra meta primordial en el manejo de NAFLD es mejorar la resistencia a la insulina, lo cual se logra con metformin y tiazolidinedionas como el troglitazone, roziglitazone, o pioglitazone. Estos fármacos han demostrado disminuír la esteatosis y normalizar las aminotransferasas. También se logra reducir el tamaño hepático, pero aún está por definirse en estudios con poblaciones significativas y con biopsias seriadas si hay o no mejoría histológica.
El uso de hipolipemiantes es controvertido, especialmente los inhibidores de HMG CoA reductasa que aunque no son hepatotóxicos, no son los ideales para disminuír el nivel de triglicéridos. No obstante, estos pueden aumentar los niveles de lipoproteínas de alta densidad (HDL) con algún efecto benéfico. Los fibratos (gemfibrozil y clofibrato) parecen ser más seguros y útiles en la hipertrigliceridemia que se asocia con NAFLD.
Neutralizar el stress oxidativo con antioxidantes como la vitamina E 400 a 1200 unidades diarias y el ácido ursodeoxicólico 10 a 15 mg/kg/día ha demostrado algún efecto protector hepatocitario contra el exceso de grasa (Tablas 4 y 5).
Tabla 4. Tratamiento de NAFLD.
Tabla 5. Tratamiento de NAFLD.
Otros medicamentos con propiedades antioxidantes están en investigación y pueden ser útiles en el futuro (p.ej. betaína y N-acetil cisteína).
Si se evidencia la presencia de sobrecarga de hierro en pacientes con NAFLD, las flebotomías pueden tener un efecto favorable aditivo.
Por último, se ha investigado el uso de una hormona derivada de los adipocitos (leptina) con diversos efectos metabólicos, entre estos el control de la resistencia a la insulina y el control de la obesidad. Aunque los estudios preliminares en estas entidades son prometedores, se ha visto que esta hormona también tiene efecto profibrogénico y estimula las células estrelladas, lo cual puede tener resultados adversos en el tratamiento de NASH, y por lo tanto no se recomienda su uso.
Se requiere de más estudios multicéntricos, aleatorios y con grandes poblaciones para poder determinar la verdadera efectividad de estas terapias en el manejo de NAFLD.
Bibliografía
- Angulo P. Nonalcoholic Fatty Liver Disease. N Engl J Med 346:1221, 2002.
- Angulo P, Keach JC, Batts KP, Lindor KD. Independent Predictors of Liver Fibrosis in Patients with Nonalcoholic Steatohepatitis. Hepatology 30:1356, 1999.
- Chitturi S, Farrell GC. Etiopathogenesis of Nonalcoholic Steatohepatitis. Semin Liver Dis 21:27, 2001.
- Clark JM, Brancati FL, Diehl AM. Nonalcoholic Fatty Liver Disease. Gastroenterology 122:1649, 2002.
- Day CP, James OF. Steatohepatitis: A Tale of Two "Hits". Gastroenterology 114:842, 1998.
- Dixon JB, Bhathal PS, O´Brien PE. Nonalcoholic Fatty Liver Disease: Predictors of Nonalcoholic Steatohepatitis and Liver Fibrosis in the Severely Obese. Gastroenterology 121:91, 2001.
- Laurin J, Lindor KD, Crippin JS, et al. Ursodeoxycholic Acid or Clofibrate in the Treatment of Nonalcohol-induced Steatohepatitis. Hepatology 23:1464, 1996.
- Lavine JE. Vitamin E Treatment of Nonalcoholic Steatohepatitis in Children: A Pilot Study. J Pediatr 136:734, 2000.
- McCullough AJ. Update on Nonalcoholic Fatty Liver Disease. J Clin Gastroenterol 34:255, 2002.
- Mendez-Sanchez N, Gonzalez V, Pichardo-Bahena R, et al. Weight Reduction and Ursodeoxycholic Acid in Subjects with Nonalcoholic Fatty Liver Disease: A Randomized, Double-blind, Placebo-controlled Trial. Hepatology 36:412A, 2002.
- Neuschwander-Tetri B, Caldwell SH. Nonalcoholic Steatohepatitis: Summary of an AASLD Single Topic Conference. Hepatology 37:1202, 2003.
- Ong J, Younossi ZM, Reddy V, et al. Cryptogenic Cirrhosis and Posttransplantation Nonalcoholic Fatty Liver Disease. Liver Transpl 7:797, 2001.
- Poonawala A, Nair SP, Thuluvath PJ. Prevalence of Obesity and Diabetes in Patients with Cryptogenic Cirrhosis: A Case-control Study. Hepatology 32:689, 2000.
- Ratziu V, Bonyhay L, Di Martino V, et al. Survival, Liver Failure, and Hepatocellular Carcinoma in Obesity-related Cryptogenic Cirrosis. Hepatology 35:1485, 2002.
- Saadeh S, Younossi ZM, Remer EM, et al. The Utility of Radiological Imaging in Nonalcoholic Fatty Liver Disease. Gastroenterology 123:745, 2002.
- Saksena S, Johnson J, Ouiff SP, Elias E. Diet and Exercise: Important First Steps in Therapy of NASH. Hepatology 30:436A, 1999.
- Sanyal AJ, Campbell-Sargent C, Mirshani F, et al. Nonalcoholic Steatohepatitis: Association of Insuline Resistance and Mitochondrial Abnormalities. Gastroenterology 120:1183, 2001.
- Saxena NK, Ikeda K, Rockey DC, et al. Leptin in Hepatic Fibrosis: Evidence for Increased Collagen Production in Stellate Cells and Lean Littermates of Ob/Ob Mice. Hepatology 35:762, 2002.
- Siegelman ES, Rosen MA. Imaging of Hepatic Steatosis. Semin Liver Dis 21:71, 2001.
- Soltys K, Dikdan G, Koneru B. Oxidative Stress in Fatty Livers of Obese Zucker Rats: Rapid Amelioration and Improved Tolerance to Warm Isquemia with Tocopherol. Hepatology 34:13, 2001.
- Ueno T, Sugawara H, Sujaku K, et al. Therapeutic Effects of Restricted Diet and Exercise in Obese Patients with Fatty Liver. J Hepatol 27:103, 1997.
- Younossi ZM, Diehl AM, Ong JP. Nonalcoholic Fatty Liver Disease: An Agenda for Clinical Research. Hepatology, 35:746, 2002.