Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Acessos
Acessos
Links relacionados
 Citado por Google
Citado por Google -
 Similares em
SciELO
Similares em
SciELO  Similares em Google
Similares em Google
Compartilhar
Revista colombiana de Gastroenterología
versão impressa ISSN 0120-9957versão On-line ISSN 2500-7440
Rev Col Gastroenterol v.19 n.1 Bogotá jan./mar. 2004
Alternativa no quirúrgica para el manejo de cáncer esofágico
Gustavo Landazábal Bernal (1)
(1) MD. Cirugía Gastrointestinal – Endoscopia Digestiva. Clínica Nueva – Hospital Central Policía Nacional. Correo Electrónico: galbmtz@cable.net.co
El cáncer esofágico es la sexta causa de muerte por cáncer en el mundo; mas de 90% de estos son escamo celulares o adenocarcinomas. Setenta y cinco por ciento de los adenocarcinomas se ubican en el tercio distal del esófago y los escamo celulares se distribuyen entre el tercio medio e inferior. El esófago cervical es un sitio inusual para esta enfermedad (1). El pronóstico del cáncer esofágico es desalentador pues menos de 50% de los pacientes son curables al momento del diagnóstico y la sobrevida a 5 años es menor a 10 %. Algunas complicaciones como la fístula traqueo esofágica se da en más de 10 % de los pacientes; cuando se logra realizar la esofaguectomía se observa recidiva en la anastomosis en aproximadamente 20 % de los casos (2). Excelentes resultados se logran solo en 10 % a 20 % de los casos con lesiones tempranas (3).
El manejo clásico del cáncer esofágico ha sido la cirugía abierta con esofaguectomía y reemplazo esofágico ya sea con estómago, intestino delgado o colon complementado con radioterapia y/o quimioterapia preoperatoria y/o postoperatoria. En la actualidad se abren otras posibilidades de tratamientos curativos o paliativos dependiendo del momento en que se realiza el diagnóstico. Como tratamiento curativo menos agresivo se describen las resecciones mucosas endoscópicas para lo que se requiere ausencia de metástasis a ganglios linfáticos e invasión a vasos linfáticos lo cual se da en los casos en que la lesión es intraepitelial [M1] o mucosa propiamente dicha [M2] donde la incidencia de metástasis a ganglios o invasión a vasos linfáticos es 0 % (Tabla 1). Para establecer estos límites histológicos se pueden utilizar unos criterios endoscópicos o de endosonografía realizada con mini sonda de muy alta frecuencia sobre los 20 MHz (4).
Tabla 1. Relación entre profundidad de invasión del tumor y presencia de metástasis a nódulos linfáticos o invasión a vasos linfáticos
| No Casos | Metastasis a nódulos linfáticos (%) | Invasión a Vasos linfáticos (%) | |
| M1 M2 M3 Sm1 Sm2 Sm3 | 17 15 11 13 20 34 | 0 0 9.1 15.4 40 44.1 | 0 0 54.3 61.5 80 82.4 |
El ultrasonido endoscopico es más preciso para establecer el compromiso locoregional que la TAC con una agudeza de 90 % y 60 % respectivamente para el estado del tumor y de 80 % y 50% respectivamente para los nódulos linfaticos. Con la adición de la aspiración con aguja fina la agudeza del ultrasonido endoscopico se eleva a 93 % para definir los nódulos linfaticos. Se debe recordar que las lesiones T2 se asocian a un compromiso nodal de 40 % a 50 % y las lesiones T3 o T4 tienen una incidencia de compromiso nodal mayor a 80 % (3). En el momento actual se considera a la endosonografia el método más preciso para establecer el grado de profundidad de una lesión sobre la pared esofágica (5); al ayudar a clasificar con mayor precisión las lesiones tumorales del esófago evita la combinación de terapias innecesarias por ejemplo en los estadios I y IV ahorrando costos en el manejo de estos pacientes (6).
La tomografía con emisión de positrones (PET) ha sido descrita recientemente como modalidad para establecer el estadio ya que detecta la captación de fluorodeoxyglucosa por las células tumorales; algunos estudios sugieren que puede ser más sensible que el ultrasonido endoscopico solo para determinar la presencia de adenopatías comprometidas por tumor y rivaliza la sensibilidad con el ultrasonido asociado a la aspiración con aguja fina (3).
Se han descrito criterios diagnósticos para establecer la profundidad de invasión por los hallazgos endoscópicos (Tabla 2):
Tabla 2. Criterios para establecer la profundidad de la invasión.
| Tipo | Hallazgos endoscópicos | |
| M1 | 0 - II b
0 - II a 0 - II c | - Lesión absolutamente plana - No hallazgos en tinción - Lesión pequeña con elevación no > de 1mm - Lesión ligeramente deprimida difícil de distinguir de una lesión plana cuya superficie es lisa. |
| M2 | 0 - II a
0 - II c
0 - II b | - Lesión elevada plana cuya elevación no es > de 1.5 mm. - Lesión ligeramente deprimida con superficie finamente granular y relativamente lisa < de 30 mm - Lesión absolutamente plana con membrana de células básales no clara |
El tamaño de la lesión también se relaciona con la presencia de metástasis; en los casos de lesiones M2 o M3 menores de 2cm usualmente no tienen metástasis, el riesgo de metástasis se presenta cuando la lesión excede los 3cm y es cercana a 20% cuando llega a los 5 cm.
El compromiso de la circunferencia esofágica tiene que ver con el mayor riesgo de estenosis, después de la resección endoscópica; lesiones que ocupan menos de 2/3 de la circunferencia se pueden resecar pero lesiones que ocupan mas de 3/4 de la circunferencia usualmente no se recomienda la resección mucosa endoscópica por el riesgo de estenosis, aun cuando algunos autores colocan prótesis metálicas autoexpandibles en los casos en que ésta se presenta.
El número de lesiones que presenta el paciente también influye en la decisión ya que más de 20 % de los pacientes presentan múltiples lesiones, cuando éstas son pequeñas se pueden resecar hasta 3 - 4 lesiones en una sola sesión y se recomiendan varias sesiones cuando son 5 o más lesiones.
Con todos los parámetros descritos se establecen unas indicaciones absolutas y relativas de resección endoscópica (Tabla 3). En la Tabla 4 se mencionan las complicaciones de la resección endoscópica de la mucosa (7).
La cromo endoscopia ayuda a reconocer correctamente las lesiones, en el caso de neoplasias escamosas se utiliza el lugol a 2.5% y en las neoplasias glandulares se utiliza el índigo carmín a 0.5% (8).
En los pacientes bien seleccionados la sobrevida no varia significativamente independiente de la técnica de resección que se escoja, la sobrevida a los 5 años con resección de la mucosa es de 86 % y a 5 años con esofaguectomía es de 83.2 %.
Tabla 3. Indicaciones de resección endoscópica.
Tabla 4. Complicaciones de la resección mucosa endoscópica
Se deben seleccionar muy bien los pacientes ya que se describe hasta 62% de lesión residual en casos de adenocarcinoma y una proporción importante en los casos de lesiones escamo celulares (5), otro factor importante a tener presente es la alta incidencia de hasta 30% de lesión metacronica recurrente descrita en pacientes con displasia de alto grado o adenocarcinoma temprano tratados con resección mucosa endoscópica (9).
Paliación
Se habla de terapia paliativa cuando el tumor se considera irresecable particularmente cuando hay enfermedad metastasica o cuando el paciente no tolera un tratamiento agresivo con intención curativa (3). En las neoplasias esofágicas se realiza paliación de uno de los dos síntomas secundarios a éstas: La disfagia y el dolor.
La disfagia para un adecuado control de su evolución se clasifica en 5 grados:
Grado 0 No hay disfagia.
Grado I Disfagia para sólidos
Grado II Disfagia para dieta blanda
Grado III Disfagia para líquidos
Grado IV Afagia
Las alternativas de tratamiento son: cirugía, radioterapia, quimioterapia y las terapias endoscópicas.
Cirugía
Se puede utilizar la esofaguectomía o el "bypass" quirúrgico siendo la mortalidad de estos procedimientos mayor a 40% (3), la sobrevida es menor a 12 meses, por lo que no se recomiendan en caso de paliación. Los factores de mal pronóstico son: desviación del eje esofágico, gran compromiso mediastinal, múltiples nódulos linfáticos agrandados y tumor mayor de 8 cm de longitud. La cirugía usualmente se reserva para los casos con intención curativa.
Radioterapia
La radiación sola a dosis de 30 a 40 Gy tiene una respuesta de 70 % a 80 % para mejorar la disfagia, pero usualmente es incompleta y la tasa de recaída es alta por esto se suele asociar a terapia endoscópica con lo que se incrementa 2 a 3 veces la sobrevida comparado con el tratamiento endoscópico solo.
La irradiación intracavitaria (Braquiterapia) se asocia con una incidencia de estenosis por fibrosis de 10% que puede progresar a fístulas esófago bronquiales (3).
Quimioterapia
Produce una mejoría de la disfagia sólo en 15% a 40% por lo que se considera una mala opción, se suele proponer para intentar controlar la enfermedad sistémica.
La quimioterapia utilizada como terapia neoadyudante ej: 2 ciclos de cisplatino y 5FU previo a la cirugía mejora ligeramente la sobrevida a 2 años cuando se compara con la cirugía sola de 43 % a 34 % a favor del grupo con terapia neoadyudante. Otros agentes como: epirubicin, paclitaxel y el irinotecam parece tendrán resultados promisorios.
La quimioradiación parece aumentar el tiempo libre de enfermedad pero no afecta la sobrevida teniendo una recurrencia local de 40 % a 60 % cuando se usa sola comparada con recurrencia de 19% cuando se adiciona un procedimiento quirúrgico (3).
Procedimientos endoscópicos
Para el alivio de la disfagia podemos dividir los procedimientos endoscópicos en mecánicos, químicos y térmicos.
Procedimientos mecánicos
Existen las dilataciones, las prótesis esofágicas e incluimos en este grupo la gastrostomía cuya indicación estaría en las lesiones localizadas en el esfínter esofágico superior o cricofaringeo que no han respondido a otras terapias; también estaría indicada cuando la anorexia como síntoma presente en los pacientes con neoplasia prima sobre la disfagia.
Dilataciones
Las dilataciones se realizan mediante bujías conducidas con guía (Savary Guillard) o balones hidrostáticos, estos últimos tienen la ventaja de realizar una fuerza radiada más uniforme con similares resultados a los dilatadores de Savary, pero a un mayor costo. Se recomienda la utilización de guías angiográficas semiflexibles por ser menos traumáticas y más adaptables que las guías metálicas (8). El inconveniente de las dilataciones es que su efecto favorable solo dura unos pocos días por lo que se indicaría 2 - 3 veces por semana según necesidad lo que incrementa sus costos y riesgos.
Prótesis
Actualmente se usan las prótesis metálicas autoexpandibles en reemplazo de las prótesis plásticas premoldeadas que implicaban la necesidad de dilataciones mayores previas a su colocación con lo que el riesgo de perforación o sangrado era mayor. Las prótesis metálicas autoexpandibles que se consiguen en el mercado tienen diferentes compuestos:
Ultraflex: Nitinol (Niquel 55% y Titanium 45 % ).
Wallesten: Cobalto 40%, cromo 20%, niquel 16%, hierro 15%, molibdeno 7%, y manganeso 2 %
Z Stent: Acero inoxidable (hierro 65 %, cromo 17 %, niquel 12 %, molibdeno 3 %, manganeso 3 % y silicona 1 %. (10).
En nuestro medio (Medellín) se fabrica el sten de Song compuesto de nitinol.
Se utilizan recubiertas con poliuretano para prevenir la reepitelización de la prótesis que produciría obstrucción de la luz, se prefiere dejar los extremos de la prótesis sin este recubrimiento para permitir en estos puntos la integración de la prótesis al tejido impidiendo de esta forma la migración de la prótesis que llega a 27% cuando se tiene el recubrimiento en toda la extensión de ésta (Figuras 1 - 2 - 3) (11-13).
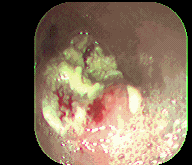
Figura 1. Cáncer esofágico. Instituto de Enfermedades Digestivas Ltda.
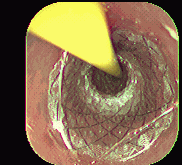
Figura 2. Colocación prótesis autoexpandible. Instituto de Enfermedades Digestivas Ltda.
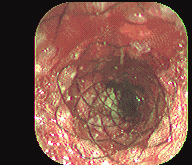
Figura 3. Expansión prótesis de Song. Instituto de Enfermedades Digestivas Ltda.
Las complicaciones globales son significativamente más altas en los pacientes que han recibido radioterapia o quimioterapia previamente (43 %) comparado con (17%) quienes no las han recibido (Tabla 5).
Tabla 5. Complicaciones de las prótesis.
| # pacientes % | Migración % | Sangrado % | Perforación % | Muerte % | |
| Z Stent | 56 | 27 | 7 | 2 | 2 |
| Wallesten | 101 | 2.9 | 6.9 | 0 | 0 |
La altura de la lesión puede generar problemas en las prótesis. La sensación de cuerpo extraño o compromiso de la vía aérea en lesiones del esófago proximal, en las lesiones con compromiso de la unión gastroesofagica las prótesis suelen producir serio reflujo por lo que se han diseñado diferentes mecanismos antireflujo que suelen incrementar el costo de estos elementos, también a nivel de la unión gastroesofagica las prótesis tienden a migrar, producir ulceración o impactación de alimentos (14).
Procedimientos químicos
Inyecciones intratumorales endoscópicas y terapia fotodinámica.
Inyecciones intratumorales endoscópicas
La sustancia más utilizada es el alcohol al 100%, que inyectado en el tejido produce fijación de éste con ulceración y necrosis; se aplica 0.5 a 1.0 ml en las porciones protuberantes de la neoplasia.
En un estudio con 36 pacientes en quienes se manejó la paliación de la disfagia secundaria a obstrucción mediante inyecciones de alcohol, el número de tratamientos requeridos para recanalizar el tumor fue 1.8 y el volumen medio de alcohol inyectado por sesión fue de 7.8 ml. Todos los pacientes presentaron fiebre y dolor en el tórax 12 a 24 horas posteriores al procedimiento. La disfagia mejoró en el 81% de los pacientes y recurrió en el 67% de los casos en un promedio de 35 días; se presentaron fístulas en 4 pacientes con mediastinitis y sepsis en 1 paciente (2).
Terapia fotodinámica
La terapia fotodinámica es una técnica ablativa no térmica que usa agentes fotosensibles, estos agentes se acumulan en el tejido maligno pero son inactivos a menos que se expongan a determinadas ondas de luz, cuando se activan generan oxígeno citotóxico causando la muerte celular del tejido involucrado; los tejidos malignos retienen selectivamente compuestos fotosensibles de hematoporfirina.
En cáncer esofágico se utiliza Porfirmer sodium (Photofrin) a dosis de 2 mgr / kilos en una sola dosis IV durante 3 a 5 minutos, después de 40 a 50 horas el área del cáncer es tratada mediante endoscopia pasando un catéter por el canal de biopsia del endoscopio el cual transmite luz (roja) con una longitud de onda de 630 nm, durante 12.5 min, la profundidad del tejido lesionado es de 2 a 5 mm, a los 2 ó 3 días se realiza endoscopia para desbridar el tumor necrótico y detectar tumor residual, entre las 90 y 120 horas de la inyección se puede tratar con una segunda aplicación de luz láser; la paliación de la disfagia se obtiene entre los 5 a 7 días siguientes, las respuestas completas se ven en tumores menores de 4 a 5 cm de longitud. El mayor problema de la terapia fotodinámica es la retención de estas sustancias en la piel hasta 6 semanas después de la inyección, por lo que se debe evitar la exposición a la luz solar durante este tiempo para evitar quemaduras. Otras complicaciones de la terapia fotodinámica: dolor subesternal, odinofagia, fiebre, derrame pleural, leucocitosis, fístula traqueo esofágica 10 % - 30 %, lesiones de piel 60 - 70 %.
Para nuestro medio tiene un alto costo, la ampolla de Porfimer sodium x 75 mgr tiene un costo de US. 2000, como la dosis es de 2 mgr / kilo se utilizan 1 o 2 viales por cada sesión de tratamiento.
Hay otras drogas como el Acido Aminolevulínico (ALA), que endógenamente se transforma en protoporfirina IX, se puede utilizar por vía oral a dosis de 60 mgr / kgr 4 a 6 horas antes de la foto radiación, la profundidad del tejido tratado llega a 2mm y la fotosensibilidad cutánea es limitada a un periodo de 24 - 48 horas; se estudian nuevas generaciones de fotosensibilizadores como el Tetra m-hydroxyphenylchlorin que se administra IV y se activa con luz de 652 nm, el incremento en la longitud de onda produce una penetración mas profunda de la luz y también una lesión más profunda del tejido comprometido; la duración de la fotosensibilidad es menor a una semana (2-15).
Comparación de fototerapia y láser Nd: YAG. Estudio multicéntrico randomizado en 24 centros (14):
Total de pacientes 218. Fototerapia 110 pacientes
Láser Nd: YAG 108 pacientes
Resultados:
A-Respuesta a la primera semana similar en la fototerapia y el láser; al primer mes respuesta completa o parcial (incremento mayor al 50% del diámetro luminal) Fototerapia 32 %
Láser Nd: YAG 30 %.
B-Quemadura solar por fototerapia 19 %
C-Perforación Fototerapia 1 %
Láser Nd: YAG 7%
D-Efectos adversos Fototerapia 3 %
Láser Nd: YAG 19%
Procedimientos térmicos
En los procedimientos térmicos se deben mencionar (9):
Electrocauterio Monopolar
Electrocauterio Bipolar
Sonda caliente
Láser Argón plasma (desecación térmica)
Láser Nd: YAG (Coagulación, vaporización)
Referencias
1. Peter C. Enzinger, Robert J. Mayer. Esophageal Cancer; N Engl J Med 2003;349:2241-52 [ Links ]
2. Douglas G. Adler, Todd H. Baron, Endocopie Palliation of Malignant Dysphagia; Mayo Clin Proc 2001; 76: 731 - 738. [ Links ]
3. Watson Anthony. Diagnosis and therapy for advanced esophageal cancer; Curr Opin Gastroenterol 19(4) 2003:400-405. [ Links ]
4. Koji Matsuda. Introduction to Endoscopic Mucosal Resection; Gastrointest Endosc Clin N Am 2001; 11 (3) : 439 - 443. [ Links ]
5. James M. Scheiman, Kenneth K. Wang. EMR for early stage esophageal cancer: setting the stage for improved patient outcomes. Gastrointestinal Endoscopy 58 (2)2003:244-246. [ Links ]
6. Das Amanya, Chak Amitabh. Role of endoscópica ultrasonography in the staging of esophageal cancer: a review. Curr Opin Gastroenterol 19(5)2003:474-476. [ Links ]
7. Hiroyasu Makuuchi, Endoscopic Mucosal resection for mucosal cancer in the esophagus; Gastrointest Endosc Clin N Am 2001; 11(3): 445-458. [ Links ]
8. Rene Lambert, Am Overview of the management of cancer of esophagus. Gastrointest Endosc Clin N Am 1998; 8 (2): 415 - 434. [ Links ]
9. Richard E. Sampliner. Endoscopic ablative therapy for Barretts esophagus: current status. Gastrointestinal Endoscopy 59(1) 2004:66-69. [ Links ]
10. Brian E. McIntee, The Wallstent Endoprotesthesis. Gastrointest Endosc Clin N Am 1999; 9 (3): 373 - 381. [ Links ]
11. Nimish Vakil, Ulrich Gross, Norbert Bethge. Human Tissue responses to metal stents. Gastrointest Endosc Clin N Am 1999; 9 (3): 359 -365. [ Links ]
12. Douglas Nelson The Wallsttent I and II for malignant esophageal obstruction. Gastrointest Endosc Clin N Am 1999; 9 (3): 403 - 412. [ Links ]
13. Emad Y Rahmani, Douglas K. Rex, Glen A. Lehman, Z Stent for malignant esophageal obstruction. Gastrointest Endosc Clin N Am 1999; 9 (3): 395 - 402. [ Links ]
14. Charles J Lightdale. Role of photodynamic therapy in the management of advanced esophageal cancer. Gastrointest Endosc Clin N Am 2000; 10 (3): 397 - 408 [ Links ]
15.Kenneth K. Wang, Photodynamic therapy of Barretts Esophagus. Gastrointest Endosc Clin N Am 2000; 10 (3): 409 - 419. [ Links ]