Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.19 n.2 Bogotá abr./jun. 2004
Tumores estromales gástricos (gist) malignos. Presentación de dos casos
Germán Gómez Santos (1), Miguel Lombo (2), Germán Prieto Sánchez (3), Fernando Peñaloza Cruz (4).
(1) MD., Cirujano General y Vacular. Hospital de Kennedy, Instructor de Cirugía. Universidad del Rosario
(2) MD. Residente Cirugía General IV año. Hospital Kennedy. Universidad del Rosario.
(3) MD. Cirujano General. Hospital Kennedy. Instructor de Cirugía. Universidad del Rosario.
(4) MD. Gastroenterólogo. Hospital Kenndy.
Resumen
Los tumores gástricos malignos de origen estromal son un grupo poco frecuente de lesiones. Se presentan dos casos y se realiza una revisión de sus características más importantes.
Palabras claves: neoplasias gástricas, GIST.Summary
The malignant gastric tumours are an infrecuent group of lesions.We report two cases and realize a review of it´s more important characteristics.
Key words: stomach neoplams, GIST.
Introducción
Los tumores gástricos de origen estromal son un grupo de lesiones de presentación infrecuente. Las primeras descripciones en la literatura fueron realizadas hace 40 años pero solo fue hasta el advenimiento de la inmuno-histoquímica en la década del 80 que se inició el entendimiento de este tipo de patología, así como el cambio en el manejo dado a estos pacientes.
Se presentan dos pacientes manejados por los servicios de Cirugía y Gastroenterología del Hospital Kennedy.
Presentación de casos
Caso 1
Paciente de sexo femenino de 70 años, que consulta por presentar dolor epigástrico de un año de evolución, de intensidad moderada. irradiado a hipocondrio derecho y a región escapular.
Antecedentes, sin importancia. Examen físico normal.
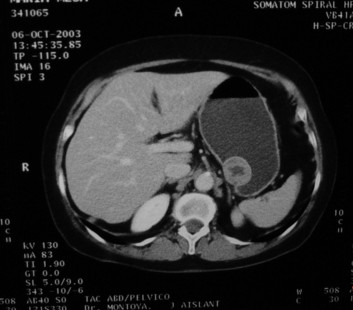
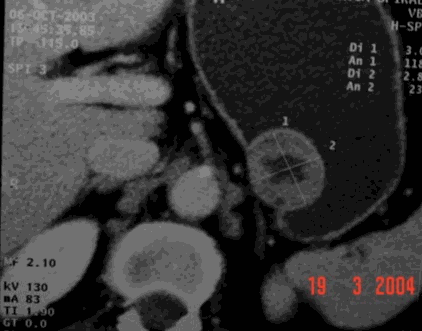
Se realizan los siguientes estudios: endoscopia digestiva alta, donde se evidencia lesión submucosa fúndica (Figura 1); endosonografia, que reporta una lesión hipo-ecóica dependiente de la cuarta capa, no adenopatías. La TAC abdominal (Figuras 2 y 3) demuestra lesión en el cuerpo gástrico hacia la curvatura menor, de 7 cm, con centro de aspecto necrótico que sugiere por el tamaño y aspecto, patología maligna. Se realiza estudio de vías digestivas altas con hallazgo de lesión sésil de 7 cm a nivel de región sub-cardial.
Figura 1. Endoscopia digestiva alta, masa submucosa.
Figura 2. TAC abdominal masa submucosa
Figura 3. TAC abdominal masa submucosa
La paciente es llevada a cirugía donde se encuentra masa en cara posterior de estómago, en la región sub-cardial. Se toma biopsia por congelación reportada como positiva para malignidad y compatible con sarcoma, por lo cual se realiza gastrectomía total con reconstrucción en "Y" de Roux.
En el postoperatorio presenta neumonía nosocomial que responde en forma adecuada al manejo antibiótico. Al octavo día postoperatorio se realiza esofagogagrama con medio hidrosoluble sin evidenciarse fugas, la paciente evoluciona sin otras complicaciones y se da salida.
La patología es reportada como "Tumor Estromal Gástrico (GIST) de alto riesgo histológico", con 10 - 11 figuras mitóticas por 50 campos; reactividad para CD117 (C-KIT ), CD34 y focalmente para S100, índice de proliferación celular (Ki 67) de 5 %, marcador actina muscular negativo.
Caso 2
Paciente de sexo masculino de 83 años, quien asiste al servicio de urgencias por deposiciones melénicas.
Antecedentes hipertensión arterial. Examen físico normal.
Se realizó endoscopia digestiva alta que mostró masa antral con ulcera Forrest IIB, por lo cual el paciente es manejado médicamente en espera del resultado de las biopsias. Al siguiente día presenta re-sangrado masivo, se realiza nueva endoscopia que muestra la masa anteriormente descrita con ulcera Forrest IA, sin poder realizarse control endoscópico del sangrado.
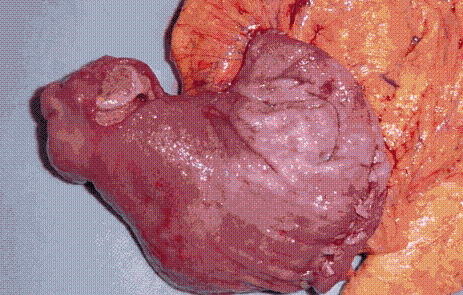
Es llevado a cirugía de manera urgente, donde se encuentra masa submucosa ulcerada (Figura 4) con vaso expuesto a nivel de antro gástrico. Se realiza gastrectomía subtotal con reconstrucción en BII.
Figura 4. Pieza quirúrgica
En el postoperatorio el paciente es manejado en la Unidad de Cuidado Intensivo, presenta neumonía nosocomial y evoluciona a falla multiorgánica, y fallece al día 20 de su postoperatorio.
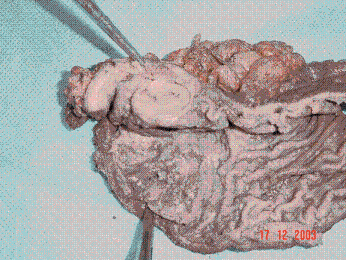
La patología (Figuras 5 y 6) es reportada como "Tumor Estromal Gástrico (GIST) Maligno". CD117 ( C-KIT ) altamente positivo, CD34 positivo, S 100 y actina de músculo liso negativos, Ki 67 bajo índice de proliferación.
Figura 5. Patología macroscópica
Figura 6. Patología microscópica
Discusión
Los tumores estromales fueron inicialmente descritos por Martín en 1960, quien los denominó tumores miogénicos gástricos de células redondas. Stout en 1962 hace mención de un grupo de lesiones que nacían del músculo liso, designándose inicialmente como: leiomiomas, leiomioblastoma, leiomiosarcoma y leiomioblastoma bizarro.
Al desarrollarse la microscopía electrónica se encuentra que son muy pocos los tumores que presentan diferenciación en músculo liso y para los años ochentas, con el desarrollo de la inmunohistoquímica, se evidenció que algunas lesiones no tenían características exclusivas de diferenciación de músculo liso, lo que llevó en 1983 a Mazur y Clark a clasificar estas lesiones como tumores estromales. Estos mismos autores encontraron que algunos tumores expresaban antígenos de la cresta neural y que en algunos casos demostraban diferenciación neuro-axonal. Con estas características se subdividen las lesiones en tumores gastrointestinales de nervios autónomos (GANT) y tumores estromales del tracto gastrointestinal (GIST), estos últimos de origen miogénico (1).
Actualmente, se definen los GIST como tumores originados en las células intestinales de Cajal, (células que son marcapasos fisiológicos en el tracto digestivo) que demuestran expresión fuerte de C-KIT proto-oncogene (CD117), y su desarrollo parece ser dependiente del C-KIT normal (1-3).
Epidemiología
Su incidencia actualmente es desconocida. En los Estados Unidos, se ha calculado que se presentan de 5.000 a 6.000 casos por año. En Finlandia, en aproximadamente 4 pacientes por millón de habitantes.
Se presentan en pacientes de edad (entre la quinta a séptima décadas de la vida) y son más frecuentes en el sexo masculino. Entre 10 y 30% son malignos (1).
Los GIST constituyen entre 1 y 3% de las neoplasias del estómago, siendo este el sitio de mayor frecuencia (60-70 %) del tracto digestivo. En el intestino delgado se presentan 25 - 35%; en el colon, recto y apéndice menos de 5%; y en el esófago 2-3%. Algunos GIST se han reportado como primarios del epiplón, mesenterio o retroperitoneo, pero, la gran mayoría de los tumores en estas localizaciones son metástasis del estómago o del intestino delgado (1,4).
Inmunohistoquimica y patogénesis
La proteína C-KIT también conocida como CD 117, es reconocida como marcador sensible y específico para GIST. El proto-oncogene del C-KIT se localiza en el brazo largo del cromosoma 4 y pone en código un receptor de trans-membrana de 145 KD con actividad de tirosin-kinasa. El receptor que liga el C-KIT es un factor de crecimiento de células madre, y al llenarse el receptor se activa, se fosforila subsecuentemente con una serie de moléculas de transducción que controlan el proceso intracelular, incluso la trascripción del gen, división celular, reorganización y quimiotaxis.
El CD 117 se expresa en gran variedad de tipos celulares como las células intersticiales de Cajal, las células madre hematopoyéticas, células de los mastocitos, los melanocitos, células germinales, células epiteliales de la mama, células basales de la piel y cáncer de pulmón de célula pequeña. Las células intersticiales de Cajal (ICC), como los GIST, demuestran expresión fuerte de CD 117, y su desarrollo parece ser dependiente en la actividad del C-KIT normal. Estudios inmunohistoquímicos que comparan las ICC y los GIST han demostrado patrones de coloración idénticos de una variedad de antígenos celulares, incluyendo CD 117. Debido a estas similitudes estructurales e inmunofenotípicas, Kindblom et al en 1998 proponen que los GIST se originaban de las ICC o evolucionaban a células madres pluripotenciales diferenciándose hacia un fenotipo celular (1,3).
Además de expresar C-KIT, los GIST co-expresan CD 34, una glicoproteína trans-membrana de sialilato que es una progenitora hematopoyética del antígeno celular encontrado en las células mesenquimales. Aproximadamente 60 a 70% de los GIST son positivas para CD34.
Actualmente, la coloración inmunohistoquímica para CD34 y CD117 es positiva para diagnostico de GIST. Miettinen et al, en un estudio de casi 300 GIST, encontraron que más de 90% de los GIST gástricos, esofágicos y rectales son positivos para CD 34. Solamente, se encontró 50% de positividad de CD34 para los GIST de intestino delgado.
A diferencia del leiomioma típico, los GIST son negativos para la desmina y principalmente negativos para la actina del músculo liso (SMA), aunque un subconjunto de GIST, normalmente en el intestino delgado, pueden expresar SMA.
Los leiomiomas verdaderos son tumores mesenquimales benignos, típicamente son positivos para desmina y SMA y negativos para CD 117 y CD 34.
Los tumores estromales con diferenciación neuronal GANT en el tracto digestivo normalmente se desarrollan en el estómago, son positivos para S100 y negativos para CD 117 y CD 34 (1).
Histopatología
Se dividen en tres categorías:
• Fusiformes: 70 a 80%, células eosinofílicas uniformes colocadas en orden en pequeños fascículos o espirales. Tienen márgenes celulares indistintos y núcleos uniformes en forma ovoide.
• Epiteliodes: 20 a 30%, células redondas con citoplasma eosinofílico claro, núcleos uniformes redondeados a ovoides, su arquitectura aparece con aspecto carcinoide.
• Mixtas: Menos de 10%, células mezcladas.
Las características ultraestructurales han recibido poca atención en la literatura.
Clínica
Son asintomáticos en 10 a 30% de los pacientes. Se pueden encontrar de forma incidental durante estudios endoscópicos, radiográficos o en cirugía.
Los síntomas dependen de la ubicación de la lesión y del tamaño.
En el esófago son muy raros, la gran mayoría corresponde a verdaderos leiomiomas. Se presentan con disfagia y pérdida de peso y se pueden presentar además como una masa mediastinal en una radiografía de tórax. En el estómago se presentan por sangrado gastro-intestinal en 20 a 50%; dolor abdominal en 40 a 50% y se encuentra una masa palpable en 25 a 40%.
La localización más frecuente en el intestino delgado es el yeyuno seguido por el íleon y duodeno; también se manifiestan por sangrado gastrointestinal y dolor abdominal. Las lesiones en duodeno pueden causar ictericia por obstrucción de la vía biliar. Pueden presentarse además, cuadros de obstrucción intestinal parcial o completa, e incluso intususcepción. En el colon se manifiestan por sangrado digestivo bajo, dolor abdominal, cambios en el hábito intestinal y masa palpable. Los GIST en el recto se presentan con hematoquesia y dolor rectal.
Los GIST primarios de omento, mesenterio o retroperitoneo son raros y pueden presentarse sin compromiso del tracto digestivo. Su presentación puede ser masa intra-abdominal solitaria, así como lesiones nodulares en el epiplón por lo general de tipo metastático.
En 1977, Carney describe la tríada que lleva su nombre, la cual consta de tumores estromales de origen gástrico asociadas a paragangliomas extra-adrenales y condromas pulmonares. Estos pacientes presentan un mejor pronóstico con una sobrevida cercana a 80% a 20 años (1,4).
Malignidad
Ha habido diferentes controversias acerca de la determinación de la malignidad de los GIST, Miettinen et al. estiman que 30% de los GIST son malignos.
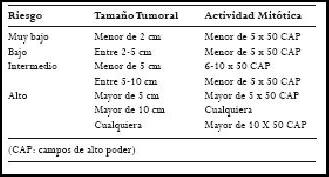
El consenso americano de 2002 sugirió clasificar las lesiones como de muy bajo, bajo, intermedio y alto riesgo de acuerdo con el tamaño tumoral y la actividad mitótica (Tabla 1) (1,4).
Tabla 1. Clasificación del riesgo de los tumores estromales de acuerdo con su tamaño.
La conducta maligna es definida, además, por diseminación al epiplón, mesenterio o retroperitoneo, la invasión a órganos adyacentes, la recurrencia del tumor luego de resección quirúrgica; o metástasis a órganos extra-intestinales o a la pared abdominal (1,4).
La localización del tumor es un factor pronóstico independiente. La sobrevida a 5 años de un tumor gástrico estromal es de 85% cuando la malignidad es de bajo grado y de 55% cuando es de alto grado. Los tumores estromales del intestino delgado tienen un peor pronóstico, a cinco años la sobrevida es de 60% si son de bajo grado y de 45% si son de alto grado.
El sitio más común de metástasis extra-intestinal es el hígado comprometido un 50%, sigue pulmón en 10% y en menos de 10% el hueso. En general, los GIST no tienen compromiso linfático y es raro encontrar linfadenopatías.
Los factores patológicos usados para determinar la malignidad y por ende mayor riesgo de metástasis o recurrencia son pleomorfismo nuclear, actividad mitótica, grado de celularidad, radio núcleo-citoplasma, invasión de la mucosa, tamaño del tumor, ulceración y necrosis del tumor (1).
Se han encontrado mutaciones del gen C-KIT en el exon 11 en 50 a 60% de los casos, teniendo significativamente mas riesgo de recurrencia y disminución de sobrevida a 5 años comparado con los pacientes con mutaciones negativas. Se ha propuesto esta mutación en el exon 11 como un factor pronóstico negativo. Además, se han encontrado mutaciones adicionales en los exones 9 y 13, los cuales se han descrito en 4 a 8% de los GIST en ausencia de mutación del exon 11. Los pacientes con mutaciones en exon 9 y 13 también parecen tener tumores agresivos clínicamente y pobre pronóstico.
En un estudio de Corless et al de 13 tumores benignos, tamaño pequeño (menor de 10 mm) en pacientes con GIST asintomáticos, 85% de los tumores tenían mutaciones del C-KIT, incluyendo la del exon 11 en 77% de los casos. Se ha sugerido que estas mutaciones podrían adquirirse tempranamente e influenciar en el pronóstico del GIST.
Estudios diagnósticos
En la endoscopia, aparecen como una lesión submucosa o una masa que protuye en la luz, con cubrimiento de mucosa normal. Puede haber una umbilicación.
Gracias a la aparición de la Endosonografía se puede realizar una adecuada evaluación de la lesión, que además puede sugerir el manejo del GIST. Característicamente, en la endosonografia se encuentra una masa hipoeicóica que proviene de la cuarta capa de la pared gastrointestinal (muscularis propia). La mayoría de los GIST son ovoides o elípticos, aunque también se pueden presentar en forma multilobular o ser pedunculados.
Los rasgos endosonográficos pueden ser útiles en identificar los tumores malignos. Los tumores mayores de 5 cm, con bordes extraluminales irregulares, focos ecogénicos y espacios quísticos fueron hallazgos asociados con malignidad. Si se presentan 2 de los 3 rasgos indicados la sensibilidad de la endosonografía para la detección de malignidad es tan alta como de 80 a 100%. En contraste, las lesiones menores de 3 cm, con patrón ecográfico homogéneo y márgenes regulares están relacionadas con tumores benignos y la presencia de los 3 rasgos tiene una especificidad de 100% para los tumores benignos (1,5).
La biopsia dirigida por endoscopia no es útil debido a que la localización de la lesión no permite alcanzar el tejido con las pinzas. Una alternativa puede ser la resección de mucosa y submucosa por vía endoscópica lo que es un buen método y permite un modo de tratamiento definitivo para lesiones menores de 2 cm. Esta técnica no se debe usar en aquellos tumores que involucran la muscularis propia por el alto riesgo de perforación.
En época reciente ha surgido un método para el diagnóstico de GIST y es la punción con aguja fina guiada por endosonografia, lo que permite con la muestra valorar la expresión de CD 117. La endosonografía con biopsia guiada por aguja fina es útil para diferenciar los GIST benignos de los malignos.
Tratamiento
La resección quirúrgica sigue siendo el tratamiento primario de los GIST, está indicada para aquellas lesiones que causan síntomas y en aquellas sospechosas de malignidad o potencialmente malignas.
El objetivo del tratamiento es la resección completa de la masa, lo cual permite mejorar los resultados. Los grandes márgenes de resección y la linfadenectomía no parecen ser necesarios ya que, como hemos dicho, las metástasis a los nódulos linfáticos son raras.
No hay pautas, ni estudios formales para la valoración de aquellas lesiones pequeñas, que causan síntomas y que tienen rasgos de bajo riesgo para malignidad en la histopatología y en la endosonografía. Se recomienda la vigilancia clínica con endosonografía y ante un aumento en el tamaño del tumor o el desarrollo de rasgos endosonográficos asociados con malignidad, debe considerarse la resección quirúrgica. Además, se deben tener en cuenta los estudios adicionales para las lesiones pequeñas, como la valoración de las mutaciones del C-KIT que pueden predecir malignidad (1).
La supervivencia a cinco años de todos los pacientes sometidos a resección curativa, oscila entre 20 y 78% en las diferentes publicaciones quirúrgicas.
Clary, en el Memorial Sloan Kettering Cancer Center, afirma que la sobrevida en los pacientes con GIST depende de la presentación clínica y de la resección completa de la lesión. El tamaño del tumor es menos importante, al igual que el género del paciente y el sitio en el tracto gastrointestinal. En el Massachussets General Hospital, en un estudio de 69 pacientes, se encontró que la resección incompleta, la edad mayor de 50 años, el no compromiso del músculo liso del tumor, el riesgo alto y el tamaño del tumor mayor de 5 cms estaban asociados con una menor supervivencia.
La recurrencia del tumor luego de resección quirúrgica es común, se presenta localmente comprometiendo el peritoneo regional, o con metástasis hepáticas. Estas últimas comprometen ambos lóbulos o se presentan como lesiones multifocales que pueden definirse con estudios de TAC o RM o en forma intraoperatoria con ultrasonido.
Lamentablemente, hay pocos estudios que valoran el papel de la cirugía en el manejo de las recurrencias abdominales. Al parecer, la reoperación no parece tener beneficio para la supervivencia, pero se ha recomendado para el control de los síntomas. La sobrevida no cambia con la resección. El único determinante significativo de sobrevida fue el intervalo libre de enfermedad entre el inicio del tumor y su recurrencia.
Estos tumores son altamente resistentes a la quimioterapia convencional y puede estar relacionado con la alta expresión de una glicoproteína P resistente a las diferentes drogas. El tratamiento de las metástasis o de los GIST irresecables con radioterapia no ha demostrado ser eficaz.
El grupo de Oncología del American College of Surgeons recomienda la terapia con STI-571 (mesilato de imatinib: Glivec ®, Novartis) en los pacientes con reseccion completa de GIST de alto grado en ausencia de metástasis.
Los efectos adversos del STI-571 incluyen edema (74%), náuseas (52%), diarrea (45%), mialgias (40%), y fatiga (35%). Los efectos adversos más importantes son gastrointestinales o hemorragia intra-abdominal, y se presentan en pacientes con tumores voluminosos, ocurren aproximadamente en 5% de los pacientes.
El mesilato de imatinib (STI-571) es aceptado por la F.D.A. para tratamiento de los GIST irresecables y para manejo de las metástasis desde mayo del 2002. Se están realizando estudios para identificar la dosis óptima y valorar el papel del medicamento en terapia neoadyuvante (1,6).
Referencias
1. Dávila R., Fardel D.G I Stromal Tumors. Gastrointest Endosc 2003; 58: 80-88. [ Links ]
2. Rosai J. Stromal Tumors. In: Ackerman´s Surgical Pathology. Vol 1. 8th Edition Mosby; 1996: 1642-1692. [ Links ]
3. Kindblom L-G, Remotti HE, Aldenborg F, Meis-Kindblom JM. Gastrointestinal Pacemaker cell Tumor (GIPACT) Gastrointestinal Stromal Tumors Show Phenotypic Characteristics of the Interstitial Cells of Cajal. Am J Pathol 1998; 152: 1259-1269. [ Links ]
4. Domínguez LC, Torregrosa L. Tumores gástricos estromales. Rev Colomb Cir 2003; 18: 110-115. [ Links ]
5. Shen EF, Arnott IDR, Plevris J, Penman ID. Endoscopic ultrasonography in the diagnosis and management of suspected upper gastrointestinal submucosal tumours. British J Surg 2002; 89: 231-235. [ Links ]
6. Demetri GD, von Mehren M, Blanke CD, et al. Efficacy and Safety of Imatinib Mesylate in Advanced Gastrointestinal Stromal Tumors. N Engl J Med 2002; 347: 472-480. [ Links ]