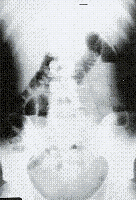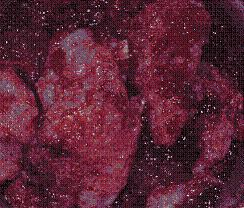Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.19 no.2 Bogotá Apr./June 2004
Masa post apendicectomia (pseudomixoma peritoneal).
A propósito de un caso
Juan Carlos Hoyos Valdemar (1), Andrés Muñoz Mora (2)
(1) Instructor Cirugía Gastrointestinal y Endoscopia Digestiva, II año.
(2) Cirujano Gastroenterólogo y Endoscopista, Jefe del Servicio de Gastroenterología. Instituto Nacional de Cancerología, Bogotá, D.C. Colombia.
Resumen
Se presenta un caso de pseudomixoma peritoneal originado en un adenocarcinoma mucinoso del apéndice cecal manejado en el Instituto Nacional de Cancerología (I.N.C.), Bogotá, Colombia.
Se revisa la literatura disponible sobre el tema haciendo énfasis en los aspectos etiopatogénicos y patológicos, y en las diferentes modalidades de tratamiento de esta rara y enigmática entidad cuyo diagnóstico casi siempre es inesperado durante la laparotomía.
Palabras claves: pseudomixoma peritoneal, ascitis gelatinosa, adenomucinosis peritoneal diseminada, carcinomatosis mucinosa peritoneal.
Summary
A case of Pseudomyxoma Peritonei originated in a mucinous adenocarcinoma of the appendix is presented. The patient was attended at the National Cancer Institute of Bogotá, Colombia.
Literature is reviewed, making emphasis on the etiopathogenic and pathology aspects, and treatment modalities of this infrequent and enigmatic entity.
Key Words: Pseudomyxoma Peritonei, Mucinous ascites, "jelly belly", peritoneal diseminated adenomucinosis, peritoneal mucinous carcinomatosis.
Introducción
El pseudomixoma peritoneal (PMP) es una entidad inusual que algunos han denominado enigmática y que se presenta como consecuencia de un tumor primario productor de mucina ya sea en el apéndice cecal o en el ovario.
Desde su primera descripción en 1842 por Rokitansky (1) hasta nuestros días, aún persisten controversias en cuanto a su etiopatiogenia y manejo, tal vez, debido a su baja incidencia, lo que no permite estudios prospectivos. Se ha definido el PMP como "la presencia de masas de contenido mucinoso en la cavidad peritoneal (ascitis mucinosa - "Jelly belly"), cuya patogénesis ha sido atribuida a la ruptura o metástasis de una neoplasia mucinosa primaria de un órgano intraperitoneal (apéndice u ovario)" (2-6).
Literalmente, el PMP es definido como un falso tumor mucinoso del peritoneo ya que casi siempre es identificado un tumor mucinoso del apéndice como sitio primario de la enfermedad.
Caso clínico
Hombre de 44 años, quien consulta a clínica particular en septiembre 19 del 2002 por cuadro de 24 horas de evolución consistente en dolor en la fosa iliaca derecha que luego se irradia a todo el abdomen, acompañado de náuseas y vómito. Al examen físico presenta como datos positivos, dolor abdominal generalizado con signos de irritación peritoneal. El cuadro hemático presenta leucocitosis (12.800/ml), con neutrofilia. Se llega a la impresión diagnóstica de apendicitis aguda y es llevado a una laparotomía exploratoria encontrando apéndice cecal inflamada con perforación en la punta, escaso material purulento en cavidad y engrosamiento a nivel del omento mayor. Se maneja con apendicetomía, lavado de cavidad y biopsia del omento mayor. El reporte anatomopatológico reveló adenocarcinoma mucinoso con compromiso de todas las capas y la grasa adyacente (apéndice), adenocarcinoma mucinoso metastásico (epiplón). Con base en este reporte es reintervenido diez días después para ampliación de márgenes (hemicolectomía derecha más omentectomía), encontrando siembras tumorales diseminadas en toda la superficie de los epiplones mayor y menor, por lo que se decide cerrar al paciente sin manejo adicional.
Tres días después es conocido en el INC a donde fue remitido para una segunda opinión médica. Analizado el caso se propone relaparotomía (citorreducción) y quimioterapia intraperitoneal y sistémica. El paciente rechaza el manejo quirúrgico, sometiéndose solo a la quimioterapia sistémica durante un año extra institucionalmente (5 FU - leucovorin, cinco ciclos). Durante tres años permaneció asintomático excepto por aumento progresivo del perímetro abdominal.
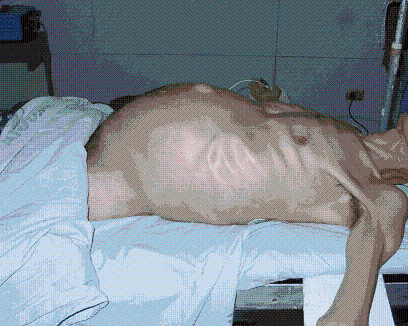
El 9 de septiembre del 2003 el paciente reingresa al INC con cuadro clínico de un mes de evolución consistente en distensión abdominal, vómito, ausencia de flatos y de deposiciones de cuatro días de evolución. Al examen físico presenta mal estado general y nutricional (caquéctico), deshidratado, con palidez muco cutánea y ligero tinte ictérico en escleras. Abdomen globoso, con masa dura multilobulada, fija y no dolorosa que ocupa todos los cuadrantes del abdomen, además de una lesión supraumbilical, móvil, blanda no dolorosa que correspondía a una hernia tumoral post incisional (Figura 1). Edema en miembros inferiores grado II.
Figura 1. Paciente de 44 años con masa intraabdominal de 3 años de evolución que resultó ser un Pseudomixoma peritoneal
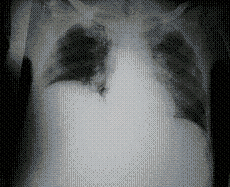
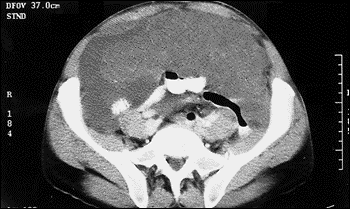
Por el antecedente oncológico se ordenan estudios de extensión que revelan una obstrucción intestinal parcial reflejada en la radiografía de abdomen simple (Figura 2) y que fue manejada médicamente con resolución del cuadro; la radiografía de tórax (Figura 3) revela elevación marcada del hemidiafragma derecho, y un TAC abdomino-pélvico (Figura 4) demostró gran compromiso tumoral que ocupa todos los espacios, rechazando hacia atrás los órganos intraabdominales.
Figura 2. Radiografía simple del abdomen del paciente con cuadro de obstrucción intestinal parcial, causado por Pseudomixoma Peritoneal
Figura 3. Radiografía de tórax PA que muestra marcada elevación del hemidiafragma derecho
Figura 4. TAC Abdomino-pélvico del paciente con Pseudomixoma Peritoneal, que compromete todos los compartimientos abdominales, desplazando hacia atrás las estructuras intraabdominales.
Se inicia nutrición mixta, (enteral y parenteral), valoraciones prequirúrgicas y se lleva a cirugía, encontrando una gran masa tumoral sólida con abundante cantidad de material mucinoso, que cubría los órganos y espacios intraabdominales, con compromiso del íleon. Se resecan 4 kilos de material tumoral y 1.5 metros de ileon, se practica una anastomosis ileo-ileal término -terminal dejando el paciente con bolsa de laparostomía, dado el riesgo de fístula (Figura 5).
Figura 5. Masa sólida blanquecina con contenido mucinoso que al corte daba la apariencia de cristal de roca, producto de paciente con Pseudomixoma Peritoneal maligno (carcinomatosis mucinosa peritoneal).
El paciente evoluciona satisfactoriamente hasta el séptimo día postoperatorio cuando se observa acumulación de materia fecal debajo de la bolsa de laparostomía, por lo que es llevado a lavado de cavidad, encontrando lesión de 1 cm en el colon transverso, y se dejan drenes para favorecer un proceso fistuloso. La evolución posterior es tórpida, con dolor pleural y disnea, derrame pleural bilateral, neumonía basal derecha, aumento progresivo de la ictericia y un cuadro séptico progresivo que desencadena la muerte del paciente días después de la cirugía.
El reporte anatomopatológico de la pieza quirúrgica fue el de un pseudomixoma peritoneal con componente maligno (carcinomatosis mucinosa peritoneal) y compromiso de la serosa del ileon (Figura 6).
Figura 6. Placas histológicas con diferentes coloraciones de paciente con Pseudomixoma Peritoneal originado en un adenocarcinoma mucinoso del apéndice donde se observa marcadas atípias citológicas con formación de glándulas malignas que nadan sobre un fondo mucinoso (carcinomatosis mucinosa peritoneal
Discusión
El pseudomixoma peritoneal es una patología poco frecuente que se caracteriza por la presencia de masas de tejido mucinoso en la cavidad peritoneal (ascitis mucinosa) cuyo origen se atribuye a una neoplasia mucinosa primaria de un órgano intraperitoneal (apéndice) (3-5).
La primera descripción de esta entidad se atribuye a Rokitansky (1) en 1842, pero no fue sino hasta en 1884 cuando Werth (2) acuñó el término de Pseudomixoma Peritoneal (PMP) al describir un caso originado en un carcinoma ovárico. Posteriormente, Frankel (7), en 1901 describió nuevamente la patología, en este caso asociada a un quiste apendicular.
El PMP se presenta más comúnmente en mujeres que en hombres en una proporción de 2-3:1 y aparece como caso inesperado, con una incidencia de 2 por cada 10.000 laparotomías (6).
La patogénesis del PMP es aún punto de controversia debido a la baja frecuencia con que se presenta esta entidad. El número de serie de casos reportados en la literatura es limitado y se trata de estudios descriptivos. Sin embargo, se han propuesto algunas teorías para tratar de explicar el origen del PMP (8-18):
1. Ruptura o metástasis de un tumor mucinoso primario originado en el apéndice (teoría más aceptada). Aunque ha sido difícil determinar el origen del PMP en mujeres debido a la coexistencia de tumores mucinosos tanto en ovario como en apéndice cecal, los defensores de esta teoría se basan en el hecho de que el compromiso ovárico es predominantemente del lado derecho o bilateral en 80% de los casos y tan solo en 20% es del lado izquierdo, lo que sugiere un compromiso por contigüidad (8). Por otra parte, la apariencia histológica de los especímenes ováricos en el PMP sólo muestra implantes tumorales en la superficie del ovario. Además, el compromiso ovárico y apendicular solo es visto en el PMP y teniendo estos dos órganos un origen embriológico diferente se derrumba la teoría de la simultaneidad de las lesiones (6). Estudios de Ronnett (12) utilizando coloraciones con citoqueratina 7 y 20, antigeno carcinoembrionario (ACE) y macrófago alveolar humano - 56 (HAM) en las dos muestras (apéndice y ovario), y estudios de genética por Cuatrecasas (13) por medio de técnica de reacción en cadena de la polimerasa (PCR), hacen pensar que el PMP se trata de un tumor mucinoso primario del apéndice con compromiso metastásico a ovario y superficies peritoneales.
2. Origen en un mucocele del apéndice. Algunos trabajos experimentales y clínicos como el de Cheng (9) y Carr (10) muestran claramente que la ruptura espontánea estéril del mucocele del apéndice sólo produce colecciones mucosas mas no PMP, debido a que son rupturas acelulares, lo que plantea el hecho de que el PMP es debido a una neoplasia con células productoras de moco (adenomas o carcinomas mucosos).
3. Metaplasia mucinosa. Son pocos los datos que avalan el cambio metaplásico de las células mesoteliales del peritoneo a células mucosas.
4. Neoplasias multifocales del peritoneo, apéndice y ovario. Algunos autores como Seidman (11) han intentado demostrar que el PMP representa una neoplasia multifocal originada independientemente en estas tres estructuras, pero son trabajos que carecen de evidencia científica. Por otra parte, se han reportado casos esporádicos en la literatura de PMP asociado a otros tumores intra o extra abdominales: colon, recto y estómago (14), pulmón (15), seno (16), páncreas (17), vía biliar (18).
Ronnett y Sugarbaker (19), en un estudio piloto acuñaron el termino de Síndrome pseudomixoma peritoneal, para designar a una entidad clínico patológica caracterizada por ascitis mucinosa con un epitelio histológicamente benigno y un curso clínico indolente originado en un adenoma apendicular. Para ello dividieron la entidad en las siguientes categorías clínico patológicas:
1. Adenomucinosis peritoneal diseminada (APD). Caracterizada por abundante contenido mucinoso, mínimas atipias citológicas y raras mitosis, originadas en mas de 50% de los casos en un adenoma apendicular, sin compromiso infiltrativo de ganglios u órganos sólidos (mejor pronóstico).
2. Carcinomatosis mucinosa peritoneal (CMP). Caracterizada por marcadas atipias celulares, formación de glándulas malignas y células en anillo de sello, casi siempre originada en un carcinoma del apéndice, con infiltración a ganglios y órganos sólidos (mal pronóstico).
3. Variante mixta. Con patrón histológico variable de las dos categorías (APD/CMP), con un pronóstico intermedio (20,21).
El diagnóstico de pseudomixoma peritoneal es casi siempre inesperado, y se hace durante la laparotomía. Otros casos poco comunes de diagnóstico se hacen en biopsia de masas inguinales o de pared abdominal.
El diagnóstico preoperatorio es con frecuencia apendicitis aguda, masas inguinales o escrotales y tumores ováricos, con sintomatología poco específica (dolor, vómito).
Las zonas intraabdominales más comprometidas además del apéndice y ovarios son el peritoneo diafragmático derecho, espacio retrohepático, goteras parietocólicas, hueco pélvico y omento mayor y menor, respetando asas intestinales y el meso. Esto ha sido explicado por Sugarbaker como un "fenómeno de redistribución" (22).
Los estudios imagenológicos como radiografías de abdomen simple y estudios contrastados, han sido de poca ayuda para el diagnóstico y se utilizan para descartar otras patologías del tracto digestivo. La ecografía muestra un signo clásico "ascitis ecogénica no móvil", y la TAC es el que más ampliamente se utiliza, describiendo las dimensiones de la masa y su relación con los órganos intraabdominales, con una densidad frecuentemente parecida a la de la grasa (23) y alteraciones ondulantes de la superficie de los órganos sólidos dada por la compresión y el compromiso tumoral sobre éstos.
Los estudios citológicos, ya sea por aspirados peritoneales o biopsia por congelación, tienen una sensibilidad para el diagnóstico que varía en las diferentes series generando controversia en cuanto a su utilidad, debido a que muchas veces se encuentra un alto contenido de mucina y no se identifican células malignas.
Los marcadores tumorales como el ACE y Ca 19-9 se pueden encontrar elevados con alguna frecuencia en pacientes con PMP pero en un porcentaje alto estos no son expresados por lo cual no son parámetros sensibles para diagnostico y seguimiento.
Debido a la baja incidencia de esta patología y a la falta de estudios prospectivos randomizados, aún persiste mucha controversia en cuanto a su manejo y pronóstico. Sugarbaker, quien ha publicado numerosos trabajos sobre este tópico, argumenta que el tratamiento quirúrgico agresivo tiene un profundo impacto en la sobrevida y en el tiempo libre de enfermedad, tal como lo demuestra en algunas de sus publicaciones (24). El tratamiento quirúrgico riguroso que propone involucra sistemáticamente la resección de las superficies peritoneales parietales y viscerales asociado a exéresis de algunos órganos tales como estómago, vesícula, colon derecho y recto sigmoide, más terapia adyuvante con quimioterapia intraperitoneal y sistémica postoperatoria con excelentes resultados (24), pese a la alta incidencia de complicaciones mostradas en estas series.
Algunos agentes mucolíticos como las soluciones glucosadas (dextrosa al 5 y 10%), actúan como citorreductores ya que desprenden los depósitos mucosos de las superficies peritoneales y permiten fácilmente su evacuación por drenes tubulares dejados en la cavidad (25). Sin embargo, se han informado casos de coma hiperosmolar secundario a la utilización de estas soluciones.
La quimioterapia intraperitoneal hipertérmica y sistémica tienen utilidad después de la citorreducción, aunque no hay estudios formales que establezcan beneficio de la quimioterapia adyuvante en el PMP. Los agentes quimioterapéuticos mayormente utilizados son: 5 FU, ciclofosfamida y mitomicina C, este último utilizado por vía intraperitoneal.
Los estudios de la clínica Mayo (26), y el Memorial Sloan Kettering Cancer Center (27) son retrospectivos y con un bajo número de pacientes que de igual forma no han mostrado los beneficios de esta terapia sola o después de la citorreducción.
Las tasas de recurrencia en las diferentes series sobrepasan 50% y de estás más de 50% se presentan dentro de los primeros 2,5 años después del manejo. La media de sobrevida es de 53% a 5 años y 32% a 10 años en términos generales (27), pero, cuando se compara la adenomucinosis con la carcinomatosis se observa importante diferencia en las tasas de sobrevida a 5 años (84% versus 6,7% respectivamente) (19).
Conclusión
El pseudomixoma peritoneal es una patología poco frecuente y enigmática que casi siempre se observa inesperadamente durante la laparotomía. Debido a su baja incidencia, a las pocas series publicadas, al reducido número de estas, a la falta de estudios prospectivos y a la variedad de criterios de inclusión en estos estudios, existe mucha controversia en cuanto a su patogenia, manejo y pronóstico. Aunque los pocos estudios han orientado a pensar que el origen es de un tumor mucinoso primario del apéndice cecal, no se puede descartar categóricamente un origen a nivel ovárico cuando se presenta en mujeres.
Referencias
1. Weaver CH. Mucocele of appendix with psedomucinous degeneration. Am J. Surg 1937;36:523-6. [ Links ]
2. Werth R. Klinische und anatomische Untersuchungen zur Lehre von den Bauchgeschwullsten und der Laparotomie. Arch Gynecol Obstet 1884;24: 100-18. [ Links ]
3. Richard A. Prayson, M.D., William R. Hart, M.D., and Robert E. Petras, M.D. Amer J Surg Pathol 1994; 18(6):591-603. [ Links ]
4. Young RH, Gilks CB, Scully RE. Mucinous tumors of the appendix associated with mucinous tumors of the ovary and pseudomyxoma peritonei. A clinicopathologivcal analysis of 22 cases supporting an origin in the appendix. Am J surg Pathol 1991;15:415-29. [ Links ]
5. Osborn, CL. Pseudomyxoma peritonei: a report of seven cases. Gynecoil Oncol 1973;1:195-202. [ Links ]
6. F.L. HINSON and N.S. AMBROSE. British J Surg 1998, 85, 1332-1339. [ Links ]
7. Frankel E. Uber das sogenannte pseudomyxoma peritonei. Med Wochenschr 1901; 48:965-70. [ Links ]
8. Young RH, Gilks CB, Scully RE. Pseudomyxoma peritonei. Am J. surg Pathol 1993; 17: 1068-71. [ Links ]
9. Cheng KK. An experimental study of mucocele of the appendix and pseudomyxoma peritonei. J Pathol Bacterol 1949; 61:217-25. [ Links ]
10. Carr NJ, McCarthy WF, Sobin LH. Epithelial noncarcinoid tumors and tumor-like lesions of the appendix. A clinicopathologic study of 184 patients with a multivariate analysis of prognostic factors. Cancer 1995; 75:757-68. [ Links ]
11. Seidman JD, Elsayed AM, Sobin LH, Tavassoli FA. Association of mucinous tumors of the ovary and appendix. A clinicopathologic study of 25 cases. Am J Surg Pathol 1993; 17:22-34. [ Links ]
12. Ronnett BM, Shmookler BM, Diener-West M, Sugarbaker PH, Kurman RJ. Immunohistochemical evidence supporting the appendiceal origin of pseudomyxoma peritonei in women. Int J Gynecol Pathol 1997; 16:1-9. [ Links ]
13. Cuatrecasas M, Matias-Guiu X, Prat J. Synchronous mucinous tumors of the appendix and the ovary associated with pseudomyxoma peritonei. A clinicopathologic study of six cases with comparative analysis of c-Ki-ras mutations. Am J Surg Pathol 1996; 20:739-46. [ Links ]
14. Costa MJ. Pseudomyxoma peritonei. Histologic predictors of patient survival. Arch Pathol Lab Med 1994; 118: 1215-19. [ Links ]
15. Kurita M, Komatsu H, Hata Y, Shiina S, Ota S, Terano A, et al. Pseudomyxoma peritonei due to adenocarcinoma of the lung: case report. J. Gastroenterol 1994; 29: 344-8. [ Links ]
16. Hawes D, Robinson R, Wira R. Pseudomyxoma peritonei from metastasic colloid carcinoma of the breast. Gastrointest Radiol 1991; 16: 80-2. [ Links ]
17. Chejfec G, Riecker WJ, Jablokow VR, Gould VE. Pseudomyxoma peritonei associated with colloid carcinoma of the pancreas. Gastroenterology 1986;90:202-5. [ Links ]
18. Young RH, Scully RE. Ovarian metastases from carcinoma of the gallbladder and extrahepatic bile ducts simulating primary tumors of the ovary. A report of six cases. Int J. Gynecol Pathol 1990; 9:60-72. [ Links ]
19. Ronnett BM, Zhn CM, Kurman RJ, Kass ME, Sugarbaker PH, Shmookler BM. Disseminated peritoneal adenomucinosis and peritoneal mucinosis carcinomatosis. A clinicopathologic analysis of 109 cases with emphasis on distinguishing pathologic features, site of origin, prognosis, and relationship to "pseudomyxoma peritonei". Am J Surg Pathol 1995; 19:1390-4085. [ Links ]
20. Ronnett BM, Kurman RJ, Shmookler BM, Sugarbaker PH. Patients with pseudomyxoma peritonei associated with disseminated peritoneal adenomucinosis have a significantly more favourable prognosis than patients with peritoneal mucinous carcinomatosis. Cancer 2001; 92 No.1. [ Links ]
21. Jackson SL, Fleming RA, Loggic BW, Geisinger KR. Gelatinous Ascities: A Cytohistologic Study of Pseudomyxoma Peritonei in 67 Patients. Mod Pathol 2001; 14(7):664-671. [ Links ]
22. Sugarbaker PH. Pseudomyxoma peritonei. A cancer whose biology is characterized by a redistribution phenomenon. Ann Surg 1994; 219: 109-11. [ Links ]
23. Fann JI, Vierra M, Fisher D, Oberhelman HA Jr, Cobb L. Pseudomyxoma peritonei. Surg Gynecol Obstet 1993; 177:441-7. [ Links ]
24. Sugarbaker PH. Cytoreduction including total gastrectomy for pseudomyxoma peritonei. British Journal of Surgery 2002; 89: 208-212. [ Links ]
25. Green N, Gancedo H, Smith R, Bernett G. Pseudomyxoma peritonei - non operative management and biochemical findings. A case report. Cancer 1975; 36:1834-7. [ Links ]
26. Gough DB, Donohue JH, Schutt AJ, Gonchoroff N, Goellner JR, Wilson TO et al. Pseudomyxoma peritonei. Long-term patient survival with an aggressive regional approach. Ann Surg 1994;219:112-19. [ Links ]
27. Smith JW, Kemeny N, Caldwell C, Banner P, SigurdsonE, Huvos A. Pseudomyxoma peritonei of appendiceal origin. The Memorial Sloan-Kettering Cancer experience. Cancer 1992; 70:396-401. [ Links ]