Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.19 n.3 Bogotá sep. 2004
Secreción ácida a partir de la heterotopia gástrica en esófago cervical demostrada por pHmetría de 24 horas
Rodrigo Castaño Llano (1) Faruk Erebrie Granados (2), Eugenio Sanín Fonnegra (2), Fabián Juliao Baños (3), Mario H. Ruíz Vélez (4).
(1) MD, Cirugía Gastrointestinal y Endoscopia. Hospital Pablo Tobón Uribe – Universidad de Antioquia. Medellín, Colombia.
(2) MD. Gastroenterólogo. Universidad de Antioquia. Medellín, Colombia.
(3) MD. Internista Gastroenterólogo. Hospital Pablo Tobón Uribe. Medellín, Colombia.
(4) MD. Cirujano general. Hospital Pablo Tobón Uribe. Medellín, Colombia.
Resumen
La mucosa gástrica heterotópica se puede encontrar en cualquier sitio del tracto gastrointestinal, incluyendo el esófago alto. La capacidad de esta mucosa ectópica de producir ácido ha sido sugerida en escasos reportes. Reportamos 10 casos de mucosa gástrica en el esófago superior, con secreción ácida, demostrada por el monitoreo continuo y ambulatorio del pH, y la estrecha correlación de la presencia de Helicobacter pylori en la mucosa heterotópica gástrica y la antral.
Palabras claves : Mucosa gástrica heterotópica, monitoreo pHmetría esofágica, Helicobacter py-lori.
Summary
Heterotopic gastric mucosa may occur throughout the gastrointestinal tract, including the upper esophagus. The capability of this ectopic mucosa to secrete acid has been suggested in scanty reports. We report ten cases of heterotopic gastric mucosa in the upper esophagus, with secretion of acid, demonstrated by continuous ambulatory pH monitoring, and the narrow correlation of the presence of Helicobacter pylori in the gastric inlet patch and the gastric antrum.
Keywords: Gastric inlet patch, Ambulatory pH monitoring, Helicobacter pylori.
Introducción
La mucosa gástrica heterotópica puede encontrarse a lo largo de la totalidad del tracto gastrointestinal (1, 2) La presencia de esta mucosa columnar gástrica heterotópica en el esófago cervical, en los 3 cm que siguen al esfínter esofágico superior, fue descrita desde 1805 por Schmidt, como lo cita Galán (3).
Aunque la mayoría de estos pacientes son asintomáticos, existen diferentes publicaciones que reportan complicaciones como: disfagia (4, 5) estenosis, (6-8) úlceras (9) fístula traqueoesofágica (10) o a la piel (11) perforación aguda esofágica (12) pólipos (13) membranas (14) sangrado (15) condiciones premalignas (16-19) e incluso carcinomas (20-28) con manejo endoscópico (29).
Se ha sugerido que estas complicaciones son secundarias a la producción de ácido por parte de esta mucosa heterotópica (4, 30, 31) y son escasos los reportes que sustentan esta producción ácida en los estudios de monitoreo de pH ambulatorio (3, 32, 33).
El presente estudio demuestra en 10 pacientes la producción ácida de la mucosa gástrica heterotópica, como hallazgo incidental durante un monitoreo de pH de 24 horas con doble censor, por manifestaciones sugestivas de compromiso extraesofágico del reflujo gastroesofágico ácido, destacando que el diagnóstico fue hecho por biopsia del islote mucoso esofágico y se confrontó con los hallazgos de la biopsia antral.
Materiales y métodos
Los diez pacientes con heterotopia gástrica fueron detectados en el servicio de fisiología digestiva del Hospital Pablo Tobón Uribe de Medellín, en el período comprendido entre enero de 2001 y diciembre de 2003. Los pacientes fueron remitidos por diferentes médicos de la ciudad y en general primaban las manifestaciones extraesofágicas como tos, disfonía y sensación de taco en garganta.
El estudio de pHmetría de 24 horas se hizo tras un ayuno nocturno, en forma ambulatoria con doble sensor, el más distal 5 cm por encima de la unión gastroesofágica y el más proximal 15 cm por encima del distal. Se utilizó un catéter de pH monocristalino con 2 electrodos de antimonio (Synetics, Irving, Texas). El electrodo es calibrado antes del procedimiento a temperatura ambiente con una solución tampón a un pH de 7 y de 1 (Fisher Scientific, Fairlawn, New Jersey). Después de la calibración el electrodo distal se pasa por una ventana nasal y posiciona 5 cm por encima del borde superior del esfínter esofágico inferior. Otro electrodo de referencia se coloca en el tórax anterior. Los electrodos se conectaron a una grabadora digital portátil (Mark III Digitrapper, Synetics), la cual graba los datos de pH cada 4 segundos por 24 horas. Los pacientes regresaban a casa con instrucciones precisas para llevar un registro de los síntomas con especial énfasis en la pirosis, tos y períodos de ingesta de comida, posición supina, y el momento de dormir. Se le sugiere al paciente que tenga una actividad lo más parecido al día normal, sin restricciones mayores en la dieta. Los pacientes regresan al día siguiente (después de 18 a 24 horas) se les retira el catéter y se revisa el diario de registro.
Los datos son pasados a un computador para su análisis por un programa llamado Gastrosoft (Gastrosoft Inc, Irving, Texas) El registro ácido de ambos electrodos (porcentaje del tiempo con pH < 4) es analizado por separado para los períodos en posición supina y de pies. El reflujo anormal distal y proximal se definió como aquél que excedía el percentil 95 en posición de pies o supino de acuerdo con los valores predeterminados por el software del programa. Un pH anormal en esófago distal se definió como un pH < 4 por más de 4,2% del tiempo y para el esófago proximal se definió como un pH < 4 por más de 1% del tiempo.
Se sospechó la presencia de la heterotopia gástrica en esófago cervical cuando durante el estudio de monitoreo ambulatorio de pH, se detectaron más reflujos proximales que distales lo que motivó un estudio endoscópico con las biopsias correspondientes del parche de mucosa esofágica y del antro gástrico, las cuales se sometieron a las tinciones convencionales con hematoxilina y eosina. La Tabla 1 recoge las manifestaciones clínicas de los pacientes y el resultado de la biopsia esofágica y antral.
Tabla 1. Descripción de los pacientes
| Sexo | Síntomas | Biopsia esófago | Biopsia antral | |
| 1 | Femenino | Pirosis, regurgitación, disfonía | Mucosa gástrica, Hp positivo | Hp positivo |
| 2 | Femenino | Sensación de taco en garganta | Mucosa gástrica, Hp positivo | Hp positivo |
| 3 | Femenino | Disfonía y tos seca | Mucosa gástrica, Hp negativo | Hp positivo |
| 4 | Masculino | Pirosis, disfonía | Mucosa gástrica, Hp negativo | Hp negativo |
| 5 | Femenino | Pirosis y tos seca | Mucosa gástrica, Hp positivo | Hp positivo |
| 6 | Femenino | Pirosis, epigastralgia y disfonía | Mucosa gástrica, Hp negativo | Hp positivo |
| 7 | Masculino | Sensación de taco en garganta | Mucosa gástrica, Hp negativo | Hp positivo |
| 8 | Femenino | Disfonía y tos seca | Mucosa gástrica, Hp positivo | Hp positivo |
| 9 | Femenino | Pirosis y regurgitación y sensación de taco | Mucosa gástrica, Hp negativo | Hp negativo |
| 10 | Masculino | Tos seca | Mucosa gástrica, Hp positivo | Hp negativo |
Hp: Helicobacter pylori
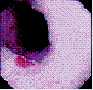
La evaluación endoscópica demostró diferentes áreas, por debajo del cricofaríngeo, con una coloración más rojiza con respecto al color nacarado de la mucosa esofágica normal, con una extensión que va de 5 a 25 mm (Figura 1A, 1B, 1C).
Figura 1A, 1B y 1C. Tres ejemplos de mucosa gástrica heterotópica en esófago cervical.
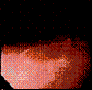
Las biopsias de estas áreas revelaron mucosa del tipo gástrico con una inflamación leve e inespecífica ( Figura 2A y 2B).
Figura 2A y 2B. Microfotografías que demuestran la unión del epitelio escamoso esofágico y la mucosa columnar con las glándulas gástricas (Hematoxilina-Eosina, magnificación 10X (A) y 40X (B).
Las biopsias con Helicobacter pylori en la mucosa gástrica heterotópica se correlacionaron con la presencia del Helicobacter en el antro gástrico en casi todos los casos.
Una paciente tenía una pHmetría de otro centro en la que se demostró un porcentaje de tiempo con ph < 4 en el censor distal de 3,7% (normal menor de 4,2%) y el proximal de 6,7% (normal menor de 1%), lo que se interpretó como una malfunción del catéter y la paciente no aceptó un nuevo estudio de pHmetría. Una endoscopia con evaluación detenida por debajo del cricofaríngeo demostró el parche de mucosa gástrica heterotópica. Igualmente, se evaluó la unión gastroesofágica sin encontrarse cambios que sugirieran un esófago de Barrett.
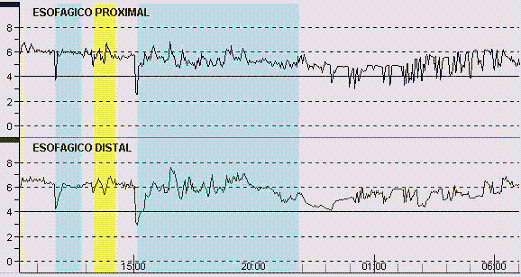
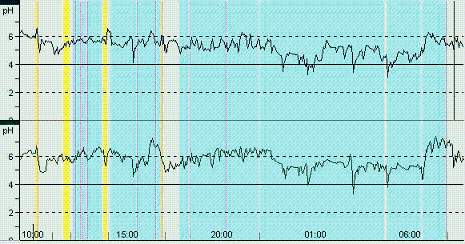
El trazado característico de la pHmetría en estos pacientes se recoge en las Figuras 3A y 3B.
Figura 3A y 3B. Registros gráficos de monitoreo esofágico de 24 horas de dos pacientes en los que se destaca el mayor número de reflujos en el sensor proximal con respecto al distal.
La secreción ácida de estos parches de mucosa heterotópica no mostró un patrón característico como se aprecia en la Tabla 2.
Tabla 2. Resultados de la pHmetría de 24 horas en 10 pacientes con heterotopia gástrica
| Sexo | Reflujos proximales versus distales | Reflujos en supino | Reflujos de pies | |
| 1 | Femenino | 67/45 | 22 | 45 |
| 2 | Femenino | 37/12 | 25 | 12 |
| 3 | Femenino | 78/23 | 54 | 24 |
| 4 | Masculino | 46/12 | 26 | 20 |
| 5 | Femenino | 39/19 | 12 | 17 |
| 6 | Femenino | 54/11 | 40 | 14 |
| 7 | Masculino | 56/35 | 18 | 38 |
| 8 | Femenino | 48/23 | 15 | 23 |
| 9 | Femenino | 42/11 | 22 | 20 |
| 10 | Masculino | 51/26 | 20 | 31 |
Discusión
Se demuestra en el presente estudio la capacidad de la mucosa gástrica heterotópica de producir ácido y generar síntomas e incluso, de acuerdo con lo revisado en la literatura, complicaciones mayores como estenosis, perforación, fístulas 5-12 y hasta carcinoma (20-29).
La prevalencia exacta de la mucosa gástrica heterotópica no se conoce aunque se describe un rango entre 3,8 y 20% en diferentes series endoscópicas 30 y de autopsia.34 En 1941, Rector y Connerly 34 encontraron mucosa gástrica aberrante en el esófago superior en 4,5% de las autopsias de 1000 niños. Jabbari y Goreski (30) encontraron una prevalencia de 3,8% de mucosa gástrica heterotópica en el esófago superior de 420 pacientes adultos.
La mucosa gástrica aberrante que forma el parche, único o múltiple, en el esófago alto parece tener un origen embriológico. Existen dos teorías con relación a la etiología de esta entidad: la primera hace mención a que en el período embrionario (altura de 60 a 130 mm), el esófago presenta un epitelio columnar, el cual gradualmente es reemplazado por epitelio escamoso; este reemplazo se inicia en el esófago medio y se extiende verticalmente en las dos direcciones; el esófago cervical es el último en revestirse de epitelio estratificado, y si existe alguna anomalía, o este proceso es incompleto, persisten los islotes de mucosa gástrica ectópica que pueden contener glándulas mucosas y ocasionalmente células parietales y células principales (27). La segunda teoría se refiere a que la posición cervical del estómago en el período embrionario y su subsiguiente descenso, puede llevar a una permanencia de restos de mucosa gástrica ectópica en el esófago proximal (34). Estos islotes de mucosa gástrica heterotópica pueden localizarse a todo lo largo del esófago, pero se observan con mayor frecuencia en tercio proximal, inmediatamente por debajo del esfínter esofágico superior (50%), seguido por esófago medio (41%) y finalmente en el tercio distal (8%) (22).
Dadas las potenciales y graves complicaciones asociadas con la mucosa gástrica heterotópica, estas se presumen sean por la secreción ácida de esta mucosa ectópica. Algunos investigadores han tratado de demostrar las capacidades secretoras de esta mucosa por diferentes métodos.
Jabbari y Goreski (30) midieron el pH del esófago al estómago 30 minutos después de la administración de 10 µg/kg de pentagastrina intravenosa en 5 pacientes. En dos pacientes con los parches de mucosa de mayor tamaño el pH disminuyó en el área de la mucosa heterotópica. En otro estudio de Hamilton y Thune 4 se usó una tinción con rojo congo para la mucosa ectópica y estimulación con pentagastrina en cuatro pacientes. Se documentó una coloración negra en el área de tinción, relacionada con un pH < de 4,5 en todos los pacientes.
Más recientemente, Nakajima y Munakata (31) midieron el pH del esófago en 5 pacientes con mucosa gástrica heterotópica luego de la estimulación con tetragastrina, usando un censor de pH unido a un endoscopio estándar. Documentaron una disminución significativa del pH en la mucosa heterotópica y áreas vecinas en 3 de 5 pacientes. Esto se confirmó con la tinción con rojo congo.
Por su parte, Galán y colaboradores 3 reportan un caso de disminución del pH durante una hora del monitoreo de pH de 24 horas en un paciente con estenosis a nivel del parche de mucosa y que mejoró con la administración de bloqueadores de bomba.
Los resultados de estos estudios previos sugieren que la mucosa gástrica heterotópica en el esófago alto es capaz de producir ácido y sólo un estudio mostró la secreción ácida independiente del censor proximal del esófago con respecto al distal.
En nuestros pacientes, el monitoreo de 24 horas del pH mostró un pH por debajo de 4 mayor 1% del tiempo evaluado y con un número de reflujos mayor al registrado por el censor inferior. Sin embargo, se considera que hay una gran variabilidad en las mediciones del pH del esófago proximal (35).
En el presente estudio en forma característica los reflujos proximales aparecen en el día y durante la posición de pies lo que desvirtúa la posibilidad de un reflujo distal con exposición proximal prolongada. Cabría entonces especular por qué el ácido secretado proximalmente no es registrado en el censor distal, y una explicación sería la poca cantidad del mismo que es fácilmente neutralizado por la saliva, la cual es rápidamente aclarada.
Este estudio muestra la habilidad de la mucosa gástrica heterotópica de secretar cantidades de ácido capaces de inducir inflamación crónica, ulceración, estenosis, fístulas y otras complicaciones como se ha reportado. No se encontró un patrón único de secreción ácida, determinándose la secreción tanto en el día como en la noche con reflujo tanto de pie como en posición supina.
Que el censor ácido detecte la secreción ácida con predominio en la posición de pies durante el día sugiere que la secreción ácida de la mucosa ectópica gástrica es controlada por mecanismos relacionados con la alimentación en vez de la histamina, como ocurre con la secreción nocturna (3).
La evaluación del Helicobacter pylori en el parche heterotópico (5 casos) se relacionó con la presencia del mismo en el antro gástrico (7 casos), en solo un paciente se encontró Helicobacter pylori en la mucosa gástrica heterotópica sin encontrarse en el antro.
La respuesta al tratamiento médico con bloqueadores de bomba de protones lleva a especular que algún porcentaje de los pacientes con manifestaciones extraesofágicas del reflujo puede explicarse por la heterotopia gástrica en esófago cervical.
Estos fragmentos de mucosa heterotópica contrastan con el epitelio metaplásico del esófago distal, el esófago de Barrett, el cual resulta de un proceso de defensa de epitelio esofágico inferior a una injuria crónica. El adenocarcinoma del esófago proximal es una entidad rara y se explica por la transformación de estos parches de mucosa gástrica heterotópica (menos de 20 reportes en la literatura médica mundial), de un esófago de Barrett alto, o de las glándulas de la mucosa o submucosa. No obstante este potencial de transformación maligna, dada la alta prevalencia de la entidad y los pocos casos de carcinoma en estos parches de mucosa, no puede considerarse esta entidad como una lesión premaligna.
Recientemente, Avidan 16 y colaboradores compararon los hallazgos endoscópicos e histológicos de 53 pacientes con heterotopia gástrica y 4.882 pacientes sin ella (prevalencia de 1,1%). En estos 53 pacientes con heterotopia la endoscopia demostró el esófago de Barrett en 18 (34%), lo que contrasta con el hallazgo de Barrett de sólo 9% en el grupo control (Odds ratio: 5.42, Intervalo de confianza de 95%: 3.04 - 9.66). Como se encontró en nuestro estudio, los pacientes presentaban una sintomatología de reflujo gastroesofágico ácido con compromiso proximal. Los autores concluyen que la alta coincidencia del parche de mucosa gástrica cervical y el esófago de Barrett puede sugerir un origen embriológico compartido.
Conclusiones
El presente estudio demuestra la capacidad de la mucosa gástrica heterotópica de producir ácido y dar manifestaciones extraesofágicas propias del reflujo gastroesofágico, las cuales responden en forma consistente a la terapia con bloqueadores de bomba de protones.
La evaluación de la literatura muestra el potencial papel lesivo del ácido al inducir complicaciones mayores en esófago como estenosis, perforación y la remota posibilidad de carcinoma local sin poder considerar esta entidad como una lesión preneoplásica.
Referencias
1. Avidan B, Sonnenberg A, Chejfec G, Schnell TG, Sontag SJ. Is there a link between cervical inlet patch and Barretts esophagus? Gastrointest Endosc. 2001 Jun;53(7):717-21. [ Links ]
2. Bataller R, Bordas JM, Ordi J, Llach J, Elizalde JI, Mondelo F. Upper gastrointestinal bleeding: a complication of inlet patch mucosa in the upper esophagus. Endoscopy. 1995 Mar;27(3):282. [ Links ]
3. Berkelhammer C, Bhagavan M, Templeton A, Raines R, Walloch J. Gastric inlet patch containing submucosally infiltrating adenocarcinoma. J Clin Gastroenterol. 1997 Dec;25(4):678-81. [ Links ]
4. Byrne M, Sheehan K, Kay E, Patchett S. Symptomatic ulceration of an acid-producing oesophageal inlet patch colonized by helicobacter pylori. Endoscopy. 2002 Jun;34(6):514. [ Links ]
5. Carrie A. Adenocarcinoma of the upper end of the esophagus arising from ectopic gastric epithelium. Br J Surg 1950;37:474-477. [ Links ]
6. Chatelain D, Flejou JF. Hyperplastic polyp in heterotopic gastric mucosa. A rare lesion of the cervical esophagus. Ann Pathol. 1998 Nov;18(5):415-7 [ Links ]
7. Galán A, Katzka D, Castell D. Acid Secretion From an Esophageal Inlet Patch Demonstrated by Ambulatory pH Monitoring Gastroenterology 1998;115:1574-1576 [ Links ]
8. Garcia AO, Mazzadi SA, Raffo L, Bonfanti M, Salis GB, Arra A, Chiocca JC. Heterotopic gastric mucosa in the upper esophagus: report of a case with a fistula. Dis Esophagus. 2002;15(3):262-5. [ Links ]
9. Gutiérrez O, Akamatsu T, Cardona H, Graham DY, El-Zimaity HM. Helicobacter pylori and heterotopic gastric mucosa in the upper esophagus (the inlet patch) Am J Gastroenterol. 2003 Jun;98(6):1266-70. [ Links ]
10. Hamilton J, Thune R. Symptomatic ectopic gastric epithelium of the cervical esophagus. Demonstration of acid production with Congo red. Dig Dis Sci 1986;31:337-342. [ Links ]
11. Hirayama N, Arima M, Miyazaki S, Shimada H, Okazumi S, Matsubara H, Suzuki T, Ochiai T, Kouzu T. Endoscopic mucosal resection of adenocarcinoma arising in ectopic gastric mucosa in the cervical esophagus: case report. Gastrointest Endosc. 2003 Feb;57(2):263-6. [ Links ]
12. Jabbari M, Goresky C. The inlet patch: heterotopic gastric mucosa in the upper esophagus. Gastroenterology 1985;89:352-356. [ Links ]
13. Kim EA, Kang DH, Cho HS, Park DK, Kim YK, Park HC, Kim JH. Acid secretion from a heterotopic gastric mucosa in the upper esophagus demonstrated by dual probe 24-hour ambulatory pH monitoring.Korean J Intern Med. 2001 Mar;16(1):14-7. [ Links ]
14. Klaase JM, Lemaire LC, Rauws EA, Offerhaus GJ, van Lanschot JJ. Heterotopic gastric mucosa of the cervical esophagus: a case of high-grade dysplasia treated with argon plasma coagulation and a case of adenocarcinoma. Gastrointest Endosc. 2001 Jan;53(1):101-4. [ Links ]
15. Kohler B, Kohler G. Spontaneous esophagotracheal fistula resulting from ulcer in heterotopic gastric mucosa. Gastroenterology 1988:95:828-830. [ Links ]
16. Lauwers GY, Scott GV, Vauthey JN. Adenocarcinoma of the upper esophagus arising in cervical ectopic gastric mucosa: rare evidence of malignant potential of so-called inlet patch. Dig Dis Sci. 1998 Apr;43(4):901-7. [ Links ]
17. Maconi G, Pace F, Vago L, Carsana L, Bargiggia S, Porro GB. Prevalence and clinical features of heterotopic gastric mucosa in the upper oesophagus (inlet patch). Eur J Gastroenterol Hepatol. 2000 Jul;12(7):745-9. [ Links ]
18. Maldonado ME, Brady PG, Morgan M. Pancreatic acinar metaplasia in an inlet patch. Gastrointest Endosc. 1998 Jun;47(6):545-6. [ Links ]
19. Malhi-Chowla N, Ringley RK, Wolfsen HC. Gastric metaplasia of the proximal esophagus associated with esophageal adenocarcinoma and Barretts esophagus: what is the connection? Inlet patch revisited. Dig Dis. 2000;18(3):183-5 [ Links ]
20. Mion F, Lambert R, Partensky C, Cherkaoui M, Berger F. High-grade dysplasia in an adenoma of the upper esophagus developing on heterotopic gastric mucosa. Endoscopy. 1996 Sep;28(7):633-5. [ Links ]
21. Nakajima H, Munakata A, Sasaki Y, Yoshida Y. pH profile of esophagus in patients with inlet patch of heterotopic gastric mucosa after tetragastrin stimulation. An endoscopic approach. Dig Dis Sci. 1993 Oct; 38 (10): 1915-9. [ Links ]
22. Nakajima H, Munakata A. pH profile of esophagus in patients with inlet patch of heterotopic gastric mucosa after tetragastrin stimulation. An endoscopic approach. Dig Dis Sci 1993;38:1915-1919. [ Links ]
23. Noguchi T, Takeno S, Takahashi Y, Sato T, Uchida Y, Yokoyama S.J Primary adenocarcinoma of the cervical esophagus arising from heterotopic gastric mucosa. Gastroenterol. 2001 Oct;36(10):704-9. [ Links ]
24. Pai S, Deshpande R, Naresh KN. Adenocarcinoma of cervical esophagus arising in aberrant gastric mucosa. Indian J Gastroenterol. 1997 Oct;16(4):157-8. [ Links ]
25. Pech O, May A, Gossner L, Vieth M, Trump F, Stolte M, Ell C. Early stage adenocarcinoma of the esophagus arising in circular heterotopic gastric mucosa treated by endoscopic mucosal resection. Gastrointest Endosc. 2001 Nov;54(5):656-8 [ Links ]
26. Raine CH. Ectopic gastric mucosa in the upper esophagus as a cause of dysphagia. Ann Otol Rhinol Laryngol 1983;92:65-66. [ Links ]
27. Rector LE, Connerly MI. Aberrant mucosa in the upper esophagus in infants and children. Arch Pathol Lab Med 1941; 31: 285-294. [ Links ]
28. Sanchez-Pernaute A, Hernando F, Diez-Valladares L, Gonzalez O, Perez Aguirre E, Furio V, Remezal M, Torres A, Balibrea JL. >Heterotopic gastric mucosa in the upper esophagus (inlet patch): a rare cause of esophageal perforation. Am J Gastroenterol. 1999 Oct;94(10):3047-50. [ Links ]
29. Sperling RM, Grendell JH. Adenocarcinoma arising in an inlet patch of the esophagus.Am J Gastroenterol. 1995 Jan;90(1):150-2. [ Links ]
30. Steadman C, Kerlin P. High esophageal stricture: a compilation of inlet patch mucosa. Gastroenterology 1988;94:521-524. [ Links ]
31. Takagi A, Ema Y, Horii S, Morishita M, Miyaishi O, Kino I. Early adenocarcinoma arising from ectopic gastric mucosa in the cervical esophagus. Gastrointest Endosc. 1995 Feb;41(2):167-70. [ Links ]
32. Vaezi MF, Schroeder PI, Richter JE. Reproducibility of proximal probe pH parameters in 24-hour ambulatory esophageal pH monitoring. Am J Gastroenterol 1997; 92: 825-829. [ Links ]
33. Ward EM, Achem SR. Gastric heterotopia in the proximal esophagus complicated by stricture. Gastrointest Endosc. 2003 Jan; 57 (1): 131-3. [ Links ]
34. Waring JP, Wo JM. Cervical esophageal web caused by an inlet patch of gastric mucosa. South Med J. 1997 May;90(5):554-5. [ Links ]
35. Yarborough C, Melane R. Stricture related to an inlet patch of the esophagus. Am J Gastroenterol 1993;88:275-276. [ Links ]