Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.19 no.4 Bogotá Sep./Dec. 2004
Angiodisplasias de intestino delgado, presentación de dos casos
María Teresa Galiano (1), Ricardo Cepeda Vásquez (2), Fernando García del Risco (3)
(1) MD. Gastroenteróloga Clínica de Marly, Bogotá.
(2) MD. Gastroenterólogo Clínica Nueva, Bogotá.
(3) MD. Gastroenterólogo, Cartagena, Colombia.
Las angiodisplasias del intestino delgado constituyen una de las principales causas de sangrado digestivo oscuro tanto oculto como visible; la video cápsula endoscópica permite realizar el diagnóstico, localiza las lesiones en el intestino delgado y guía su terapéutica.
Palabras claves. Angiodisplasias, intestino delgado, video capsula endoscópica
Summary
Small intestine angiodysplasias are one of the most important causes of obscure gastrointestinal bleeding, occult and overt; the capsule endoscopy obtains the diagnosis, localises the lesion in the small bowel and guides the therapy.
Key words: Angiodysplasia, small intestine, capsule endoscopy.
Introducción
El sangrado digestivo oscuro manifiesto, definido como la persistencia o recurrencia de sangrado visible en heces o emesis cuya causa no es establecida en endoscopia digestiva alta y colonoscopia iniciales, y el sangrado digestivo oscuro oculto, definido como la persistencia o recurrencia de anemia ferropénica y/o sangre oculta en heces positiva sin sangrado visible en heces o emesis con una fuente no encontrada en endoscopia digestiva alta y colonoscopia iniciales, tienen como factor causal importante las lesiones vasculares del intestino delgado. En el flujograma diagnóstico del sangrado digestivo oscuro, tanto manifiesto como oculto, luego de realizar endoscopia digestiva alta y colonoscopia, el estudio de intestino delgado con video cápsula endoscópica es el examen que ha demostrado mayor rendimiento al permitir la identificación de las lesiones vasculares, las cuales no son diagnosticadas con el tránsito intestinal ni la enteroclisis. La arteriografía tiene un rendimiento muy bajo debido a la intermitencia del sangrado y a la interposición de las asas intestinales, y el estudio de medicina nuclear para sangrado digestivo con glóbulos rojos marcados no ha demostrado gran utilidad. Presentamos dos casos clínicos interinstitucionales en los cuales la video cápsula endoscópica permite realizar el diagnóstico y guía la terapéutica.
Historia clínica paciente #1
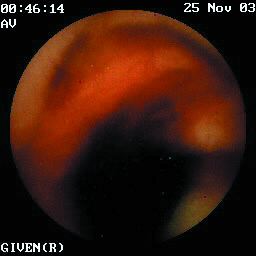
Paciente de sexo femenino de 45 años de edad con historia de tromboastenia de Glanzmann confirmada 11 años antes de su ingreso, quien es hospitalizada en cinco oportunidades durante un lapso de 15 meses, en los cuales se practicaron dos endoscopias de vías digestivas altas, la primera con una gastritis erosiva fúndica a la cual se atribuyó el sangrado, pero durante la segunda hospitalización una semana más tarde, este estudio era normal. Se practica colonoscopia, negativa para fuentes de sangrado, pero durante la ileoscopia terminal se encuentra sangrado fresco en la luz. Se realiza tomografía axial computarizada con énfasis en intestino delgado y tránsito intestinal con doble contraste reportados como normales. En la arteriografía mesentérica realizada en su tercera hospitalización tanto de la rama superior como inferior se aprecia dilatación e irregularidad en la cuarta rama yeyunal de aspecto arrosariado, sugestivo de displasia fibromuscular segmentaria pero sin fuentes de sangrado. No se realizó la enteroscopia intraoperatoria debido a riesgos por su patología hematológica. En su cuarta hospitalización se realiza el estudio con video cápsula de endoscopia en la Clínica de Marly (Bogotá) (Figura 1), que identifica varias lesiones de tipo angiodisplasico en el yeyuno con sangrado activo. Se inició manejo con somatostatina a dosis de 300mcg/hora y terapia hormonal con estrógenos y progestágenos con control del sangrado. Al reducir la medicación hormonal se presenta una nueva hemorragia que motiva una quinta hospitalización, donde se aumentan nuevamente las dosis y se coloca octreótido a 50mcg, sin control del sangrado. Debido al deterioro nutricional progresivo y a la transfusión de 42 unidades de glóbulos rojos empaquetados, con 10 transfusiones de plasma por aféresis, se decidió llevar a enteroscopia intraoperatoria con terapia con argon plasma. En el seguimiento a cinco meses la paciente se encuentra asintomática.
Figura 1. Video cápsula endoscópica. Angiodisplasia de intestino delgado con sangrado activo.
Historia clínica paciente #2
Paciente de sexo femenino, de 86 años de edad, raza mestiza procedente de Cartagena, con cuadro clínico de aproximadamente cinco años de evolución consistente en múltiples episodios de melenas, hospitalizada en múltiples ocasiones con endoscopias digestivas altas, colonoscopias, gamagrafía con glóbulos rojos marcados, tránsito intestinal y hemicolectomía derecha sin resolución del sangrado ni localización del mismo. Se realiza un estudio de video cápsula endoscópica en la Clínica de Marly (Bogotá) que evidencia múltiples angiodisplasias a nivel del intestino delgado en yeyuno e íleon, mayores de 5 mm (Figura 2).
Figura 2. Video cápsula endoscópica. Angiodisplasia del tracto gastrointestinal en intestino delgado.
Con frecuencia se encuentran vasos sanguíneos aberrantes en el tracto gastrointestinal, siendo probablemente el lugar más frecuente de todo el organismo. Algunos están presentes desde el nacimiento o el desarrollo como parte de síndromes hereditarios, pero la gran mayoría son adquiridos tarde en la vida. Las razones para la distorsión de las estructuras vasculares observadas en la edad avanzada son pobremente comprendidas.
La taxonomía de las anormalidades vasculares en el tracto gastrointestinal ha sido inconsistente, es fuente de confusión (1,2) y puede estar basada en características histológicas, apariencia microscópica, o asociación con enfermedades sistémicas. Estas consideraciones permiten la categorización en tres amplios grupos:
. Tumores vasculares, los cuales pueden ser benignos (tales como hemangiomas) o malignos (tales como sarcoma de Kapossi o angiosarcomas).
. Anomalías vasculares asociadas con enfermedades congénitas o sistémicas (tales como el síndrome de blue rubber bleb nevus, síndrome de Klippel-Trenaunay-Weber, síndrome de Ehlers-Danlos, el CREST (variante de esclerodermia) y la telangiectasia hemorrágica hereditaria.
. Lesiones adquiridas y esporádicas tales como angiodisplasias, ectasia vascular gástrica antral, ectasias vasculares inducidas por radiación y lesiones de Dieulafoy.
Las angiodisplasias son las anomalías vasculares más frecuentes del tracto gastrointestinal. Revisaremos la patogénesis, la clínica, el diagnóstico y el tratamiento de estas lesiones. Una de las complicaciones más comunes asociadas con las angiondisplasias es el sangrado, a menudo oculto.
Patogénesis
Las angiodisplasias están compuestas de vasos de paredes delgadas, dilatados, ectásicos, que son recubiertos por endotelio solamente, o por pequeñas cantidades de músculo liso (3).
Los estudios han demostrado que las características más prominentes en angiodisplasias son las venas submucosas, tortuosas, dilatadas. Pequeñas comunicaciones arteriovenosas están presentes debido a la incompetencia del esfínter precapilar, también se presentan grandes arterias asociadas con fístulas arteriovenosas, lo cual explica el sangrado activo en algunos pacientes.
El examen histológico demuestra vasos dilatados en la mucosa y submucosa, algunas veces cubiertos por una capa única de epitelio (4).
La patogénesis de las angiodisplasias no está bien establecida; se han propuesto cuatro teorías:
Las angiodisplasias pueden desarrollarse en respuesta a una obstrucción venosa crónica de bajo grado (3). Esta hipótesis es consistente con la observación de mayor frecuencia de las mismas en el colon derecho en donde la tensión de la pared es más alta.
Las angiodisplasias pueden ser una complicación de isquemia mucosa crónica, la cual puede ocurrir durante episodios de obstrucción intestinal o esfuerzo en la defecación (5).
Las angiodisplasias pueden ser una complicación de isquemia local asociada con enfermedad cardiaca, vascular o pulmonar (6).
Las angiodisplasias pueden ser congénitas, más probablemente en pacientes jóvenes, o asociadas con enfermedades congénitas.
Se ha encontrado un aumento en la expresión de factores angiogénicos, en las angiodisplasias colónicas en humanos (7). El significado de esta información es incierto.
Clasificación
Los términos angiodisplasias, malformaciones arteriovenosas, ectasias vasculares, han sido utilizados como sinónimos. Las angiodisplasias son usualmente diferenciadas de la telangiectasias, que aunque anatómicamente son similares, usualmente son referidas en el contexto de una enfermedad hereditaria o sistémica.
La mayoría de las enfermedades vasculares son detectadas durante la endoscopia y se propone una taxonomía basada en la apariencia endoscópica (8). El sistema de clasificación reconoce la localización, la talla y el número de angiodisplasias (Tabla 1).
Tabla 1. Clasificación de angiodisplasias gastrointestinales.

Epidemiología e historia natural
La prevalencia de angiodisplasias gastrointestinales en la población general no está bien establecida ya que en los individuos asintomáticos usualmente no se realiza una evaluación endoscópica.
Las angiodisplasias ocurren más frecuentemente en el colon, siendo una causa importante de sangrado gastrointestinal bajo, especialmente en los ancianos. Sin embargo las angiodisplasias pueden ser múltiples en una región gastrointestinal o coexistir en múltiples diferentes localizaciones gastrointestinales.
La mayoría de las angiodisplasias son detectadas en pacientes mayores de 60 años (9-12), a pesar de que se ha descrito la presentación en pacientes de 30 años (13).
Más de una angiodisplasia está presente en aproximadamente 40% a 60% de los pacientes (10-14). Estas lesiones tienden a ser agrupadas dentro de un segmento intestinal, sugiriendo que el ambiente local predispone a su desarrollo. Sin embargo, lesiones sincrónicas en cualquier parte del tracto gastrointestinal ocurren en aproximadamente 20% de los casos (15,16).
Manifestaciones clínicas
Las angiodisplasias pueden permanecer clínicamente silenciosas o causar sangrado. Los pacientes típicamente presentan un sangrado oculto, más que uno visible que requiera tratamiento intrahospitalario (17).
Estómago y duodeno
Las angiodisplasias del estómago y el duodeno han sido incriminadas como causa de sangrado gastrointestinal en 4% a 7% (9,10,14). Sin embargo, las angiodisplasias en el estómago o en el duodeno se encuentran incidentalmente en 50% de los casos. Las lesiones están usualmente localizadas en el estómago proximal; fueron asociadas con sangrado visible en 27%, oculto en 22% y se consideraron incidentales en 51% (18).
El riesgo de que una angiodisplasia gástrica o duodenal encontrada incidentalmente pueda sangrar subsecuentemente es incierto. Los pacientes que han sangrado de una angiodisplasia gástrica o duodenal tienen un mayor riesgo de sangrado subsiguiente (10).
Intestino delgado
Las angiodisplasias pueden encontrarse a través de todo el intestino delgado; la mayoría de las series que han evaluado angiodisplasias en intestino delgado han incluido pacientes con sangrado gastrointestinal de etiología no clara a pesar de la realización de endoscopia digestiva alta y colonoscopia. El intestino delgado es evaluado eficientemente con video cápsula endoscópica que permite la visualización de todos los segmentos del mismo. Considerándose las angiodisplasias del intestino delgado la causa más frecuente de sangrado digestivo oscuro en el paciente mayor de 60 años, también debe considerarse en los pacientes más jóvenes con condiciones asociadas que incrementan su prevalencia. En una serie utilizando enteroscopia peroral fueron consideradas el factor responsable de sangrado en 33 de 83 pacientes anémicos con deficiencia de hierro (19).
Colon
El colon es el sitio más común de angiodisplasias en el tracto gastrointestinal, son más frecuentes en el ciego y colon ascendente, con la siguiente distribución (20):
- Ciego: 37%
- Colon ascendente: 17%
- Colon transverso: 7%
- Colon descendente: 7%
- Colon sigmoideo: 18%
- Recto: 14%
Las angiodisplasias del colon se presentan en aproximadamente 20 a 30% del sangrado gastrointestinal agudo bajo (21). El riesgo de sangrado subsiguiente en pacientes a quienes se les han encontrado angiodisplasias colónicas no está bien establecido. El número de lesiones y la presencia de coagulopatía coexistente o disfunción plaquetaria pueden ser determinantes importantes. Los pacientes que han sangrado de angiodisplasias colónicas tienen un riesgo incrementado de sangrado subsiguiente (3, 21-23).
Condiciones con prevalencia incrementada
La prevalencia de angiodisplasias está incrementada en la población mayor con sangrado gastrointestinal y con ciertas condiciones tales como enfermedad renal terminal, enfermedades hematológicas como la enfermedad de von Willebrand y estenosis aórtica, aunque esta última asociación es controvertida.
Enfermedad renal en estado terminal
La razón del incremento en la prevalencia es desconocida. Una explicación posible es que las lesiones son detectadas más frecuentemente por el aumento de riesgo de sangrado asociado con uremia que induce disfunción plaquetaria (24,25).
Enfermedad de von Willebrand
Similar a la anterior, esta asociación puede reflejar un incremento de la tendencia de las angiodisplasias a ser clínicamente evidentes por la coagulopatía subyacente (26-28).
Estenosis aórtica
El sangrado de angiodisplasias en los pacientes con estenosis aórtica (síndrome de Heyde) (29) ha sido informado repetidamente pero es controvertido. Dos explicaciones posibles: 1. Los pacientes con estenosis aórtica pueden desarrollar una forma adquirida de enfermedad de von Willebrand, la cual puede reversarse con el reemplazo de la válvula aórtica; 2. La otra explicación es que las angiodisplasias existentes pueden sangrar como resultado de necrosis isquémica en pacientes con bajo gasto cardiaco; sin embargo esto es inconsistente ya que las angiodisplasias no han sido asociadas a otras formas de enfermedad cardiaca con bajo gasto cardiaco.
Diagnóstico
Se estima que entre 1 y 5 % de los pacientes con sangrado gastrointestinal tiene una fuente hemorrágica más allá del duodeno proximal y que en 40% es secundario a malformaciones vasculares, generando dificultades en algunas unidades de endoscopia digestiva por falta de recursos
En el enfoque diagnóstico es relevante mencionar los estudios de Barkin y Chong (30,31), en los cuales 50 a 60% de las lesiones hemorrágicas en sangrados ocultos se encuentran proximales al ángulo de Treitz y accesibles a la endoscopia convencional. Sin embargo, no es infrecuente el subdiagnóstico inicial de lesiones gastroduodenales, entre 20 y 40%, como se reporta en las series de enteroscopia de OMahoni en 1996 (32) y Hayat (33), en probable relación a lesiones no sangrantes durante el acto endoscópico o a palidecimiento de lesiones vasculares cuando hay anemia y contracción del volumen. La repetición de la esofagogastroduodenoscopia y la colonoscopia realizadas con esmerado cuidado pueden evitar exploraciones costosas e innecesarias del intestino delgado, reduciendo el subdiagnóstico a 3 a 5% (34).
En el abordaje diagnóstico la realización de exámenes endoscópicos muy cerca del periodo del sangrado aumenta significativamente el éxito en la detección, por lo cual se debe estar preparado para los signos semiológicos endoscópicos de estas anormalidades vasculares, las cuales son múltiples y a veces difusas en 30 a 70% de los casos, generalmente consistentes en lesiones de tipo plano o sutilmente levantadas, de color rojo brillante entre 2 y 10mm de diámetro, en particular las del intestino delgado proximal, las cuales se asemejan a las encontradas a nivel gastroduodenal. Algunas veces se ven como lesiones puntiformes que pueden ser confundidas con hemorragias intramucosas o submucosas que pueden pasar inadvertidas.
Dentro de las diferentes técnicas diagnósticas se encuentran la introducción peroral de un colonoscopio idealmente pediátrico, que permite revisar 20 a 60 cm más allá del ligamento de Treitz, incrementando la identificación de lesiones sangrantes entre 17 y 46% (35); los enteroscopios dedicados aumentan la profundidad de inserción entre l00 y 140 cm más allá del Treitz dependiendo de la longitud del equipo, con una capacidad diagnóstica promedio de 59% (31,36,37); la enteroscopia intraoperatoria con revisión de la totalidad del intestino tiene una tasa de efectividad cercana a 70% (33,38,39).
La video cápsula endoscópica ha demostrado ser el examen con mejor rendimiento en el estudio del sangrado digestivo oscuro tanto manifiesto como oculto, permitiendo la visualización de todos los segmentos del intestino delgado. En el sangrado oscuro manifiesto, debe realizarse de manera temprana cercana al sangrado, preferiblemente en los primeros 10 días obteniéndose un rendimiento de 92,3% con una sensibilidad de 88,9% y especificidad de 95%, con un valor predicativo positivo de 97% y valor predictivo negativo de 82,6% (40).
Angiografía
La arteriografía puede detectar angiodisplasias, pero su eficiencia en sangrado activo depende de la velocidad de la hemorragia de al menos 0,5 ml/minuto. Sin embargo algunos signos radiológicos pueden sugerir la lesión, como la presencia en la fase venosa de un vaso dilatado densamente opacificado, con vaciamiento lento a nivel de la pared y en la fase arterial un penacho vascular producto de la extensión de la dilatación a las vénulas mucosas o en ocasiones, en la misma fase un llenamiento venoso temprano por una comunicación arteriovenosa (41, 42).
Gamagrafía
Debido a la naturaleza intermitente del sangrado de este tipo de malformaciones, la gamagrafía con glóbulos rojos marcados se prefiere realizar con 99mTc, cuya vida media permite repetir el estudio sin necesidad de reinyección del isótopo, pero sólo es útil para confirmar hemorragias en segmentos del intestino delgado distales al ligamento de Treitz con tasas de sangrado mayor a los 0,1 a 0,4 ml/minuto; además, debe tenerse en cuenta que no permite localizar con exactitud el sitio de sangrado, pero puede en algunos casos dirigir la arteriografía y en ocasiones el manejo quirúrgico (43).
Terapéutica
Las lesiones angiodisplásicas asintomáticas tienen una baja incidencia de sangrado, por lo cual el consenso general es de no efectuar ningún tipo de tratamiento. En los casos de hemorragia el tratamiento depende del modo de presentación y del curso del sangrado, además de las enfermedades coexistentes que pueda presentar el paciente; debe recordarse que entre un tercio y la mitad de los pacientes con sangrado no parece repetir episodios de sangrado en los primeros dos años después del primer evento y el manejo podría ser conservador, después de haberse descartado una patología orgánica mayor, con suplementos de hierro o transfusiones. Si la evolución es tórpida, con sangrados recurrentes o crónicos, se puede intentar la terapia endoscópica o quirúrgica si el estado del paciente lo permite; de lo contrario la terapia hormonal o vasoactiva puede ayudar en algunos casos.
Terapia endoscópica
La endoscopia terapéutica fue mencionada desde el año de 1976 para una lesión vascular del ciego (44). Desde entonces se han reportado multiples técnicas, cuyo éxito depende en buena parte no solo del método sino de la localización y el número de malformaciones encontradas, con una tasa de éxito variable de 50 a 85% (45). Entre las opciones de manejo se encuentran:
Escleroterapia: el uso de esclerosantes como el tetradecil sulfato de sodio o algunos otros equivalentes, en inyecciones de 0,5 a 1ml han sido inicialmente exitosos, pero la tasa de resangrado es cercana a 50%. Su ventaja radica en la fácil disponibilidad en cualquier unidad de endoscopia, pero la tangencialidad de su aplicación en el intestino delgado dificulta su aplicación.
Coagulación monopolar con sonda caliente: la electrocoagulación monopolar parece ser relativamente segura, pero su eficacia a largo plazo se mantiene cuestionada. En el estudio de Hayat y Axon (33), 23 pacientes con malformaciones del intestino delgado y gástricas fueron manejados con ablación con esta técnica; 7 de los 23 (30%) resangraron y requirieron nuevamente transfusiones y nueva enteroscopia. Más tarde 3 de los 7 resangraron una vez más y requirieron una tercera terapia de coagulación.
Fotocoagulación con láser: los láser de Neodymium- YAG (yttrium-aluminum-garnet) o argón aplicados al campo de la endoscopia desde hace 25años, siguen siendo útiles para el manejo de las lesiones vasculares del tracto gastrointestinal en particular a nivel del colon. Sin embargo su uso en el intestino delgado ha evidenciado, como en el estudio de Cello y colaboradores (46), un mayor riesgo de resangrado cercano a 50%. En el trabajo de Bown y colaboradores (47) se comparó la efectividad de ambos láser teniendo el Nd YAG mayor eficacia a largo plazo, quizás por una mayor penetración a la submucosa, aunque con mayor riesgo de resangrado en los primeros días posteriores al tratamiento. Sargeanti y colaboradores trataron 41 pacientes con lesiones vasculares del tracto gastrointestinal superior, 16 de ellos con angiodisplasias únicas o múltiples del intestino delgado. En el seguimiento promedio a 34 meses, 25 pacientes del grupo total (61%) no requirió o necesitó mínima cantidad de transfusiones; 9 pacientes (22%), después de haber sido controlados, resangraron pero una nueva terapia con láser fue exitosa, con una efectividad global de 83% (48). Dentro de las desventajas de esta técnica se encuentran los altos costos y la dificultad para su transporte.
Argón plasma: utiliza una técnica innovadora que permite la coagulación de los tejidos a través de una corriente alterna monopolar de alta frecuencia aportada a los tejidos sin tocarlos a través de gas de argón ionizado; sus ventajas radican en una penetración en profundidad limitada hasta de 2,4mm y un diámetro máximo de 1,1cm, lo cual reduce el riesgo de perforación (49). Comparado con el láser, su costo es muy inferior y puede ser transportado fácilmente. En el estudio de Grund la tasa de éxito en la primera sesión fue de 99% aunque fueron incluidos pacientes no sólo con lesiones angiodiplásicas, sino con trastornos de la coagulación, complicaciones de cirugía endoscópica y tumores; la tasa de resangrado fue de 1,6% y la tasa de complicación menor de 1% , sin ninguna mortalidad (50). En el estudio de Rolachon y Papillon del año 2000, 22 pacientes con malformaciones angiodisplásicas hemorrágicas fueron controlados con argón plasma en una sola sesión, sin complicaciones ni recurrencia de sangrado durante un periodo de seguimiento de seis meses, demostrando que es una técnica simple, segura y efectiva (51).
Cuando Johston y Jensen compararon los métodos de electrocoagulación y fotocoagulación con láser en relación con la facilidad de su aplicación, en primer lugar estuvo el láser YAG, seguido del láser de argón y después la electrocoagulación monopolar y la bipolar. Se hizo la misma comparación en relación a la seguridad; en primer lugar estuvo el láser argón, luego la electrocoagulación bipolar, el laser Yag y en última instancia la electrocoagulación monopolar (52). Es probable que en el presente el uso de argón plasma con sondas endoscópicas de fácil aplicación tanto frontales como laterales, con una baja penetración en el tejido, se convierta en la técnica de mayor facilidad y seguridad.
Terapia hormonal
En 1979 Mc Gee informó el primer éxito al utilizar una mezcla de estrógenos y progestágenos para un sangrado gastrointestinal en un paciente con enfermedad de Osler-Weber-Rendu (53); desde entonces se han publicado múltiples artículos no controlados sobre de la eficacia de la terapia. Si bien su mecanismo no está claro, los estrógenos parecen tener un efecto directo sobre el endotelio vascular, reduciendo la proliferación celular y la formación de radicales libres, promoviendo así la integridad de endotelio (54). Sin embargo Lewis y colaboradores en 1990 no pudieron demostrar su efectividad (55), situación similar a la planteada en el trabajo de Junquera y Papo en el año 2001 donde randomizaron 72 pacientes con angiodisplasia para recibir manejo con etinilestradiol más norestirona o placebo, obteniendo resultados negativos para el uso de la terapia, con falla del manejo hormonal en 39% de los pacientes comparado con el placebo, de 46%; las tasas de resangrado y requerimiento transfusional fueron similares en ambos grupos y la posibilidad de mantenerse libre de sangrado a dos años fue 55% (95% CI 36-74) para el grupo tratado y 36% (95% CI 14-58) para el grupo placebo (56). Sin tener en cuenta los efectos colaterales de la terapia, según estos datos, el manejo sólo debe iniciarse en aquellos pacientes con altos requerimientos tranfusionales después de haber fracasado el manejo no farmacológico. La dosis recomendada de etinilestradiol es de 0,050 mg y de norestirona de 1mg al día, en combinación con hierro.
Octreótido
Torsoli y colaboradores en 1991 informaron el uso exitoso de este análogo de la somatostatina en el tratamiento de un paciente con sangrado a partir de angiodisplasia intestinal difusa (57); desde entonces la medicación se ha usado en múltiples reportes, observándose una respuesta sorprendentemente rápida a infusiones de 50 mcg/hora, disminuyendo el número de transfusiones en la terapia crónica con el uso subcutáneo a dosis de 0,1mg tres veces al día. El mecanismo de acción probablemente es múltiple. Con base en su rapidez terapéutica se sugiere un efecto hemodinámico sobre la circulación esplácnica, pero se ha visto además que inhibe los factores de crecimiento EGF, b-FGF e IGF-1; igualmente se propugna un efecto inhibitorio sobre la angiogénesis al observarse desaparición de algunas de las lesiones o reducción del tamaño en otras. Finalmente, se aprecia una disminución en la contractilidad del músculo liso y de acuerdo con la teoría fisiopatológica de Boley, contrarrestaría la obstrucción crónica inducida por la capa muscularis sobre las venas submucosas. En el estudio de Nardone y Roco se reportan 17 pacientes tratados por 6 meses con octreótido, con un seguimiento entre 48 y 84 meses; la droga modificó el curso natural de la enfermedad en 14, 10 de ellos se mantuvieron estables durante el periodo de seguimiento, 4 resangraron al parar la terapia y requirieron terapia cíclica; los pacientes restantes no respondieron (58). El mayor inconveniente de la terapia es el costo, pero puede ser de gran utilidad en pacientes que no se pueden manejar con terapia endoscópica y no son candidatos a cirugía por la edad o enfermedades concomitantes (59).
Cirugía
El manejo quirúrgico, si bien es una última alternativa, tiene una alta morbilidad, con mortalidad de 10 a 20% y una recurrencia del sangrado en 30 a 40% de los casos; además, dada la alta incidencia de lesiones múltiples y a veces difusas en el intestino delgado, el manejo quirúrgico, a diferencia de las lesiones gástricas o colónicas, es desalentador (60). Su indicación principal estaría dada en el sangrado agudo severo, en el sangrado crónico refractario con lesiones limitadas a segmentos bien definidos o como apoyo a la enteroscopia intraoperatoria.
Referencias
1. Moore JD, Thompson NW, Appleman, HD, Foley D. Arteriovenous malformation of the gastrointestinal tract. Arch Surg 1976; 111:381. [ Links ]
2. Duray PH, Marcel JM Jr, Livolsi VA, et al. Small intestinal angiodysplasia in the elderly. J Clin Gastroenterol 1984; 6:311. [ Links ]
3. Boley SJ, DiBiase A, Brandt L J, et al. Lower intestinal bleeding in the elderly. Am J Surg 1979; 137: 57. [ Links ]
4. Weaver GA, Alpern HD, Davis JS, et al. Gastrointestinal angiodysplasia associated with aortic valve disease: Part of a spectrum of angiodysplasia of the gut. Gastroenterology 1979; 77:1. [ Links ]
5. Baum S, Athanasoulis CA, Waltman AC, et al. Angiodysplasia of the right colon: A cause of gastrointestinal bleeding. AJR Am J Roentgenol 1977; 129:789. [ Links ]
6. Rogers BH. Endoscopic diagnosis and therapy of mucosal vascular abnormalities of the gastrointestinal tract occurring in elderly patients and associated with cardiac, vascular and pulmonary disease. Gastrointest Endosc 1980; 26:134. [ Links ]
7. Junquera F, Saperas E, de Torres I, et al. Increased expression of angiogenic factors in human colonic angiodysplasia. Am J Gastroenterol 1999; 94:1070. [ Links ]
8. Schmit A, van Gossum A. Proposal for an endoscopic classification of digestive angiodysplasias for therapeutic trials. Gastrointest Endosc 1998; 48:659. [ Links ]
9. Gunnlaugsson O. Angiodysplasia of the stomach and duodenum. Gastrointest Endosc 1985; 31:251. [ Links ]
10. Clouse RE, Costigan DJ, Mills BA, Zuckerman GR. Angiodysplasia as a cause of upper gastrointestinal bleeding. Arch Intern Med 1985; 145:458. [ Links ]
11. Richter JM, Hedberg SE, Athanasoulis CA, Schapiro, RH. Angiodysplasia: Clinical presentation and colonoscopic diagnosis. Dig Dis Sci 1984; 29:481. [ Links ]
12. Boley SJ, Sammartano R, Brandt L J, Sprayregen S. Vascular ectasias of the colon. Surg Gynecol Obstet 1979; 149:353. [ Links ]
13. Jesudason SR, Devasia A, Mathen VI, et al. The pattern of angiodysplasia of the gastrointestinal tract in a tropical country. Surg Gynecol Obstet 1985; 161:525. [ Links ]
14. Moreto M, Figa M, Ojembarrena E, Zaballa M. Vascular malformations of the stomach and duodenum: An endoscopic classification. Endoscopy 1986; 18:227. [ Links ]
15. Cappell MS. Spatial clustering of simultaneous nonhereditary gastrointestinal angiodysplasia. Small but significant correlation between nonhereditary colonic and upper gastrointestinal angiodysplasias. Dig Dis Sci 1992; 37:1072. [ Links ]
16. Steger AC, Galland RB, Hemingway A, et al. Gastrointestinal haemorrhage from a second source in patients with chronic angiodysplasia. Br J Surg 1987; 74:726. [ Links ]
17. Cappell MS, Gupta A. Changing epidemiology of gastrointestinal angiodysplasia with increasing recognition of clinically milder cases: Angiodysplasia tend to produce mild chronic gastrointestinal bleeding in a study of 47 consecutive patients admitted from 1980 to 1989. Am J Gastroenterol 1992; 87:201. [ Links ]
18. Marwick T, Kerlin P. Angiodysplasia of the upper gastrointestinal tract. Clinical spectrum in 41 cases. J Clin Gastroenterol 1986; 8:404. [ Links ]
19. Schmit A, Gay F, Adler M, et al. Diagnostic efficacy of push-enteroscopy and long-term follow-up of patients with small bowel angiodysplasias. Dig Dis Sci 1996; 41:2348. [ Links ]
20. Hochter W, Weingart J, Kuhner W, et al. Angiodysplasia in the colon and rectum. Endoscopic morphology, localisation and frequency. Endoscopy 1985; 17:182. [ Links ]
21. Browder W, Cerise EJ, Litwin MS. Impact of emergency angiography in massive lower gastrointestinal bleeding. Ann Surg 1986; 204:530. [ Links ]
22. Boley SJ, Sammartano R, Adams A, et al. On the nature and etiology of vascular ectasias of the colon. Degenerative lesions of aging. Gastroenterology 1977; 72:650. [ Links ]
23. Foutch PG, Rex DK, Lieberman DA. Prevalence and natural history of colonic angiodysplasia among healthy asymptomatic people. Am J Gastroenterol 1995; 90:564. [ Links ]
24. Porush JG, Faubert PF. Chronic renal failure. In: Renal Disease in the Aged, Porush, JG, Faubert, PF (Eds), Little, Brown, Boston 1991. p.285. [ Links ]
25. Zuckerman GR, Cornette GL, Clouse RE, et al. Upper gastrointestinal bleeding in patients with chronic renal failure. Ann Intern Med 1985; 102:588. [ Links ]
26. Duray PH, Marcal JM Jr, LiVolsi VA, et al. Gastrointestinal angiodysplasia: A possible component of von Willebrands disease. Hum Pathol 1984; 15:539. [ Links ]
27. Alhumood SA, Devine DV, Lawson L, et al. Idiopathic immune-mediated acquired von Willebrands disease in a patient with angiodysplasia: Demonstration of an unusual inhibitor causing a functional defect and rapid clearance of von Willebrand factor. Am J Hematol 1999; 60:151. [ Links ]
28. Veyradier A, Balian A, Wolf, M, et al. Abnormal von Willebrand factor in bleeding angiodysplasias of the digestive tract. Gastroenterology 2001; 120:346. [ Links ]
29. Heyde EC. Gastrointestinal bleeding in aortic stenosis (letter). N Engl J Med 1958; 259:196. [ Links ]
30. Barkin JS, Lewis BS, Reiner D, et al.: diagnostic and therapeutic jejunoscopy with a new, long enteroscope. Gastrointestinal Endosc 38:55-28. [ Links ]
31. Chong J, .Tagle M, BarkinJS, et al. Small bowel push-type enteroscopy for patients with occult gastrointestinal bleeding of suspected small bowel pathology. Am J Gastoenteroly 1994;89:2143-2146. [ Links ]
32. OMahony S, Morris AJ, et al: push enteroscopy in the investigation of small-intestinal disease QJM, 1996 Sep;89(9): 685-690. [ Links ]
33. Hayat M, Axon AT, O Mahony S. Diagnostic yield and effect on clinical outcomes of push enteroscopy in suspected small bowel bleeding. Endoscopy 200 May;32(5):369-372. [ Links ]
34. Thompson JN, Slaeim RR, Hemingway AP, et al. specialist investigation of obscure gastrointestinal bleeding. Gut 1987;28:47-51. [ Links ]
35. Messer J, Romeu J, Waye JD, et al: the value of proximal jejunoscopy in unexplained gastrointestinal bleeding. Gastrointestinal Endosc 1984;30:151. [ Links ]
36. Barkin JS, Chong J, Reiner DK. first-generation video enteroscope: fourth generation push-type small bowell enteroscopy utilizing an overtube. Gastrointestinal Endosc 1994;40:743-747. [ Links ]
37. Harris A, Dabezies M, Catalano M, et al. Early experience with a video push enteroscope. Gastrointestinal Endosc 1994;40:62-64. [ Links ]
38. Scott-Conner CE, Subramony C. Localization of small intestinal bleeding. The role of intraoperative endoscopy. Surg Endosc 1994; 8: 915-917. [ Links ]
39. Lau WY, Wong SY, et al. Intraoperative enteroscopy for bleeding angiodysplasias of small intestine. Surg Gynecol Obstet 1989 Apr;168(4)341-344. [ Links ]
40. Pennazio M. Santucci R. Rondonotti E. Abbiati C. Beccari G. et al. Outcome of patients with obscure gastrointestinal bleeding after capsule endoscopy: report of 100 consecutive cases. Gastroenterology 2004; 126:643-653. [ Links ]
41. Clouse RE. Vascular lesion; ectasias, tumors and malformation. Text book of Gastroenterology Tadataka Yamada Chapter III, 2475-2476. [ Links ]
42. Gordon FH, Watkinson A, Hodgson H. Vascular malformations of the gastrointestinal tract. Best Pact Res Clin Gastroenterol 2001; 15:41-58. [ Links ]
43. Alavi A, Dann RW, Baum S, et al. Scintigraphy detection of acute gastrointestinal bleeding. Radiology 1977;124:753-756. [ Links ]
44. Rogers B, Adler F. Hemangiomas of the cecum. Gastroenterology 1976:71;1079-1082. [ Links ]
45. Rutgeerts P, Van Gompel F, Geboes K, et al: long term results of treatment of vascular malformations of the gastrointestinal tract by Neodymium-Yag Laser. Gut 1985;26: 586-593. [ Links ]
46. Cello J, Grendell J: Endoscopic laser treatment for gastrointestinal vascular ectasias. Ann Intern Med 1986;104:352-354. [ Links ]
47. Bown SG , Swain Cp, Sorey DW et al: Endoscopic laser treatment of vascular anomalies of the upper gastrointestinal tract. Gut 1985; 26:1338-1348. [ Links ]
48. Sargeant IR, Loizou LA, Rampton D, Tulloch M, et al. Laser ablation of upper gastrointestinal vascular ectasias: long term results. Gut 1993; 34(4):470-475. [ Links ]
49. Johanns W, Luis W, Hanssen J, et al. Argon plasma coagulation (APC) in gastroenterology: experimental and clinical experiences. Eur J Gastroenterol Hepatol 1997;9(6):581-587. [ Links ]
50. Grund KE, Straub T, Faroin G. New haemostatic techniques: argon plasma coagulation. Baillieres best Pract res Clin Gastroenterol 1999;13:67-84. [ Links ]
51. Rolacho A, PapillonE, Fournet J. Is argon plasma Coagulation an efficiente treatment for digestive system vascular malformation and radiation proctitis?. Gastroenterol Clin Biol 2000;24:1205-1210. [ Links ]
52. Johnston JH, Jensen DM, Mautner W. Comparisón of endoscopic electrocoagulation an laser photocoagulation of bleeding canine gastric ulcers. Gastroenterology 1982;82:904-910. [ Links ]
53. McGee R. Estrogen-progestogen therapy for gastrointestinal bleeding in hereditary hemorrhagic telangiectasis. SouthMed J 72: 1503-1979. [ Links ]
54. Alarcón MC. , Fernández M, Teruel J. L. et al. Terapia hormonal con parches de estrógenos para el tratamiento de la hemorragia digestiva recurrente en los pacientes urémicos. Nefrología 2002. Vol. XXII. Número 2. 208-209. [ Links ]
55. Lewis BS, Kornbluth A. Hormonal therapy for bleeding from angiodysplasia: Chronic renal failure. Am J Gastroenterol 85:1649-1651,1990 [ Links ]
56. Junquera F, Feu F, Papo M, et al. A multicenter, randomised, clinical trial of hormonal therapy in the prevention of rebleeding from gastrointestinal angiodysplasia. Gastroenterology 2001; 121:1073-1079. [ Links ]
57. Torsoli A, Annibale B, Viscardi A, et al. Treatment of bleeding due to diffuse angiodysplasia of the small intestine with somatostatine analogue. Eur J Gastroenterol Hepatol 1991;3:785-797. [ Links ]
58. Nardone G, Roco A, Balzano T, et al. The efficacy of octreotide therapy in chronic bleeding due to vascular abnormalities of the gastrointestinal tract. Aliment Pharmacol Ther 1999:13:1429-1436 [ Links ]
59. Coppola A, De Stefano V, Tufano A, et al. Long-lasting intestinal bleeding in an old with multiple mucosal vascular abnormalities an Glanzmanns thrombasthenia: 3 year pharmacological management. Journal of internal Medicine 2002: 252:271-275. [ Links ]
60. Richter JM, Christensen MR, Colditz GA, et al. Angiodysplasia: Natural history and efficacy of therapeutic interventions. Dig. Dis Sci 1989;34: 1542-1546. [ Links ]