Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.20 no.2 Bogotá June 2005
Ecoendoscopia
Indicaciones de la A a la Z
(1) MD., Gastroenterólogo. Docente ocasional de Gastroenterología, Universidad Nacional, Servicio de Gastroenterología Hospital El Tunal. Bogotá, Colombia.
(2) MD., Internista, Gastroenterólogo, Epidemiólogo, Profesor de Gastroenterología Universidad Nacional. Servicio de Gastroenterología, Clínica Fundadores. Bogotá Colombia.
(3) MD., Internista Gastroenterólogo. Centro de Enfermedades Digestivas. Endosono Ltda. Hospital El Tunal. Bogotá, Colombia.
(4) MD., Internista Gastroenterólogo. Centro de Enfermedades Digestivas. Endosono Ltda.. Clínica Palermo. Bogotá, Colombia.
RESUMEN
La ecoendoscopia, ultrasonido endoscópico o endosonografía es un examen que combina las imágenes endoscópicas y ecográficas con el fin de evaluar las lesiones que se encuentran no solo en la pared del tracto gastrointestinal sino también alrededor del mismo. Este examen permite además estadificar los pacientes con cáncer gastrointestinal, tumores del páncreas y de pulmón entre otros. Por lo tanto, las indicaciones de la ecoendoscopia son muy amplias (unas más respaldadas por la literatura que otras) y sus utilidades son múltiples, siendo éste un medio diagnóstico utilizado de rutina en muchos centros de gastroenterología en el mundo. La tendencia actual es pasar de la ecoendoscopia diagnóstica a la terapéutica, ya que se está utilizando para múltiples propósitos como guiar cirugías mínimamente invasivas, tomar biopsias a todos los niveles y aplicar terapias biológicas; de éste modo los alcances de este examen son impresionantes. Se realizó una revisión concisa de la literatura para resumir todas las aplicaciones de la ecoendoscopia, con el fin de familiarizar a los gastroenterólogos con sus indicaciones y posibles aplicaciones terapéuticas.
Palabras Clave
Ecoendoscopia radial, Ecoendoscopia lineal, ultrasonido endoscópico, endosonografía, cáncer gastrointestinal, cáncer páncreas, punción biopsia con ecoendoscopia (EE – PAAF), coledocolitiasis, GIST.
SUMMARY
The echoendoscopy, endoscopic ultrasound or endosonography is an exam which combines the endoscopic and ultrasound images, with the purpose of evaluating the lesions that are not only in the wall of the gastrointestinal tract but also around it. This exam also allows to stadify the patients with gastrointestinal cancer, tumors of the pancreas, lungs, etc. Therefore, the indications of the echoendoscopy are very wide, (some, better supported by the literature than others) and its purposes multiple, being this a diagnostic tool used as a routine exam in many centers of gastroenterology around the world. The current tendency is to pass from the diagnostic to the therapeutic echoendoscopy since it is being used for multiple purposes, like guiding minimally invasive surgeries, taking biopsies at all levels and for the application of biological therapies; therefore, the usefulness of this exam is really impressive. A concise review of the literature was made to summarize all the applications of the echoendoscopy with the purpose of familiarizing gastroenterologists with the indications and possible therapeutic applications.
Key Words
Radial echoendoscopy, linear echoendoscopy, endoscopic ultrasound, endosonography, gastrointestinal cancer, pancreas cancer, fine-needle aspiration biopsy (EUS-FNA), coledocholitiasis, GIST.
La ecoendoscopia (EE), denominada también como endosonografía (ES) y ultrasonido endoscópico (UE), es un examen que combina la imagen endoscópica con la imagen ecográfica para evaluar lesiones localizadas en la pared del tracto gastrointestinal y alrededor del mismo. Aunque fue descrito hace más de 20 años (1), sus indicaciones, tanto diagnósticas como terapéuticas siguen siendo desconocidas por la mayoría de médicos especialistas o generales, incluidos los de nuestro medio, donde aún se considera que el examen sólo es útil para valorar las lesiones de la pared gástrica que estén en una de las 5 capas ecográficas.
Cada día son más numerosas las publicaciones sobre EE, describiendo nuevas indicaciones de este interesante examen y ratificando las previamente descritas, convirtiéndolo en una herramienta indispensable dentro de un servicio de gastroenterología. En el presente artículo se revisarán las indicaciones del procedimiento, que en los últimos años se han expandido tanto, que pueden agruparse didácticamente utilizando prácticamente todas las letras del abecedario, desde la A hasta la Z.
Instrumentos y técnica
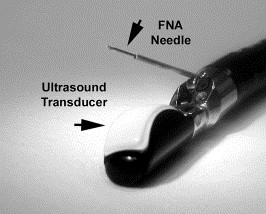
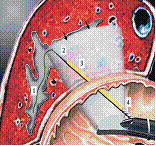
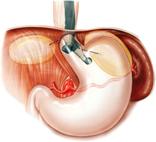
La EE utiliza equipos radiales, lineales o minisondas de acuerdo a las características de la lesión o a las necesidades del examen. (Figura 1) Los equipos radiales permiten obtener una visión oblicua (la cual dificulta ligeramente la visión endoscópica) y una imagen ecográfica de 360 grados (2). Los equipos iniciales tienen frecuencias de 7,5 y 12 MHz, pero actualmente los hay con frecuencias hasta de 20MHz, las cuales siempre están situadas en la punta del equipo (3). El endosonógrafo radial es el más utilizado para los exámenes diagnósticos y la ecografía con este equipo identifica cinco capas en la pared de todo el tracto digestivo, cuando se realiza con las frecuencias de 7,5 o 12 MHz (4). (Figura 2)
Figura 1. Existen diferentes equipos para realizar la ecoendoscopia de acuerdo con la indicación del exámen.
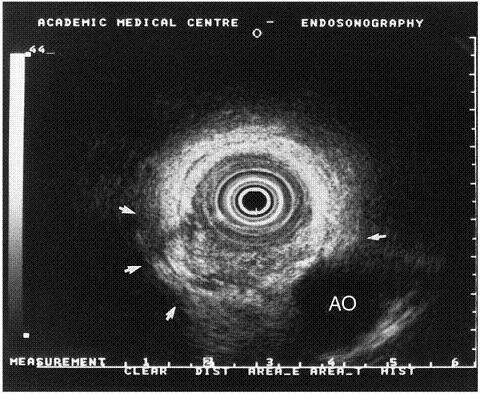
Figura 2. A la izquierda se observan las capas de la pared del tracto gastrointestinal, correlacionadas con las 5 capas vistas en la ecoendoscopia a la derecha. Tomado de la referencia 2.
1. La primera capa hiperecoica corresponde a la parte más superficial de la mucosa gástrica.
2. La segunda capa hipoecoica corresponde a la parte profunda de la mucosa que puede correlacionarse con la muscular mucosa.
3. Tercera capa hiperecoica corresponde a la capa submucosa.
4. Cuarta capa hipoecoica corresponde a la muscular propia.
5. Quinta capa hiperecoica corresponde a la capa serosa o adventicia.
Cuando se utilizan transductores de mayor frecuencia, la resolución del eco es mayor y se pueden observar hasta 9 capas detallando principalmente la capa mucosa y la muscular (5).
El endosonógrafo lineal trabaja con una frecuencia de 7,5MHz y permite también una visión endoscópica oblicua pero la imagen ecográfica es de sólo 160 grados con el fin de seguir la orientación de la aguja de punción (6). (Figura 3) En nuestro concepto, éste es el equipo más completo porque permite no sólo hacer EE diagnóstica sino también terapéutica, ya que se pueden utilizar agujas de 22G o 19G para tomar biopsias de lesiones de la pared o adyacentes a la misma, tales como mediastino, páncreas, glándula adrenal, etc. (Tablas 1 y 2) De igual manera, también es posible drenar diferentes colecciones incluidas las de la vía biliar.
Figura 3. El ecoendoscopio lineal permite seguir la orientación de la aguja para realizar la punción.
Tomado de www.sepd.org
Tabla 1. Posibilidades terapéuticas de la ecoendoscopia (niveles de evidencia)
| Adenopatías | Masas extramurales | Lesiones intramurales | |
| Sensibilidad | 92% | 88% | 61% |
| Especificidad | 93% | 95% | 79% |
| Precisión | 92% | 90% | 67% |
Tomado de www.sepd.org/formar.es
Tabla 2. Rendimiento diagnóstico dependiendo de la naturaleza de la lesión.
Las minisondas son una especie de catéter que en la punta tiene un transductor de ecografía y que, dado su tamaño, puede ser introducida por el canal de trabajo de los endoscopios (idealmente de doble canal); son muy útiles para el diagnóstico de lesiones menores de un cm que estén en la pared del tracto gastrointestinal o para pasarlas por el colédoco para evaluar la vía biliar (7, 8).
El examen endosonográfico no difiere mucho en cuanto a la preparación de la endoscopia digestiva alta; el paciente debe tener un ayuno de por lo menos 8 horas y si se le va a realizar un procedimiento terapéutico debe tener un TP y un TPT normal. El paciente se coloca en decúbito lateral izquierdo, con oxígeno por vía nasal, monitoría de signos vitales y oximetría antes de iniciar la sedación, la cual, en nuestra práctica, realizamos bien sea con propofol endovenoso o una combinación de fentanyl con midazolan. Es importante anotar que si la EE es diagnóstica del esófago, estómago o recto, se puede realizar sin sedación, dado el corto tiempo del examen, si el paciente lo acepta. La EE biliopancreática o con punción demora de 30 a 45 minutos de acuerdo a la dificultad del examen y por ello siempre se hacen con sedación (9).
Indicaciones
Existen indicaciones tanto diagnósticas como terapéuticas. (Tabla 3) Se describirán cada una de las indicaciones, utilizando como guía el abecedario, haciendo énfasis en las más importantes, utilizando ejemplos de la literatura y de nuestra experiencia con este interesante examen.
|
|
|
|
|
|
|
|
|
|
Tabla 3. Indicaciones de la punción-aspiración biopsia
• A: acalasia, adenopatías, adenoma de papila
• B: Barret y cáncer de esófago temprano
• C: cáncer: esófago, gástrico, páncreas, pulmón, papila, recto. Cálculos
• D: drenaje biliar – abscesos
• E: engrosamiento de pliegues
• F: fístula
• G: glándula adrenal – gist
• H: hígado - ht portal, fenolizaciones de tumores
• I: incontinencia – insulinoma
• K: Klatskin
• L: linfomas
• M: mediastino – metástasis
• N: neurólisis plexo celiaco
• O: otras aplicaciones
• P: pancreatitis, pólipos
• Q: quistes – drenaje
• R: recurrencias tumorales
• S: subepiteliales - seguimiento.
• T: trombosis portal
• V: vesícula biliar – várices
• W: Wirsung
• X: tumores no establecidos
• Z: Zolinger-Ellison
A
Acalasia
La acalasia es un trastorno idiopático de la motilidad esofágica caracterizado por atonía del esófago, aumento de la presión y alteración en la relajación del esfínter esofágico inferior, el cual generalmente está engrosado (10). Enfermedades estructurales como los tumores de la unión esófago gástrica, primarios, metastáticos o la amiloidosis pueden producir un cuadro clínico similar, denominado seudoacalasia. (Figura 4) La EE permite determinar si el cuadro se debe a una seudoacalasia, al poder evaluar si sólo existe engrosamiento de la capa muscular propia o si hay infiltración por otra patología. Se han reportado múltiples casos, los cuales inicialmente se pensaba eran acalasia primaria del esófago pero con los estudios se demostró que se trataba de seudoacalasia; las principales causas reportadas son tumores gastrointestinales, pulmonares y el linfoma (11).
Figura 4. Obsérvese en la parte inferior de la imagen una lesión hipoecoica que infiltra el esófago inferior, la cual es secundaria a un cáncer que produce una seudoacalasia. (Tomado de la referencia 1.)
Desde la perspectiva terapéutica, la toxina botulínica es una alternativa para pacientes ancianos o con alto riesgo quirúrgico que tienen esta enfermedad y para una aplicación exacta de la toxina, en el esfínter esofágico inferior, existe la posibilidad de hacerla guiada por EE (12).
Adenopatías
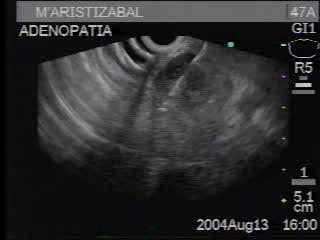
Las adenopatías que se ubican en el mediastino o en el retroperitoneo cuyo origen no está claro o no es evidente, pueden ser evaluadas por EE. Usualmente, las adenopatías inflamatorias son menores a un cm, irregulares e hiperecoicas y las adenopatías malignas son redondeadas, regulares e hipoecoicas. Sin embargo, estas características no siempre son exactas y por ello algunos recomiendan que, para determinar su etiología, se realicen punciones guiadas por EE, cuando estén al alcance de la aguja de punción (13). (Figura 5)
Figura 5. Paciente con adenopatías subcarinales de origen desconocido; en la parte superior derecha de la foto se observa la aguja de punción con la cual tomamos la biopsia. La patología descartó malignidad.
B
Esófago de Barrett y cáncer temprano del esófago
Aunque la EE no está indicada como método de tamización en cáncer de esófago, existen informes sobre el uso potencial de la misma para detectar cáncer en pacientes con esófago de Barrett (EB), especialmente en casos de disfagia, nódulos esofágicos, estenosis o displasia de alto grado, en quienes la endoscopia digestiva alta fue negativa (14). Cuando el paciente tiene un cáncer temprano hay un engrosamiento focal en las ecocapas 2 y 3 y si el paciente tiene EB la presencia de un adenocarcinoma es altamente sugestiva cuando hay una disrupción en la ecocapa 3, que en este contexto, sugiere una invasión submucosa (15).
Sin embargo, cuando el paciente tiene displasia de alto grado pero no cáncer, puede demostrarse un engrosamiento focal o una irregularidad de la ecocapa 2 con o sin disrupción de la capa 3, especialmente cuando se utilizan minisondas con frecuencias de 20MHz. En una reciente serie de casos, la especificidad de la EE para excluir un adenocarcinoma oculto fue casi del 100% (16). Por lo anterior, sería razonable realizar una EE en pacientes con EB que tienen displasia de alto grado, por el alto riesgo de adenocarcinoma, ya que este procedimiento permitiría una mayor exactitud diagnóstica y simultáneamente estadificación del mismo. Es importante aclarar que, idealmente, el paciente debe tener una lesión focal para que el rendimiento de la EE sea el mejor.
C
Cáncer
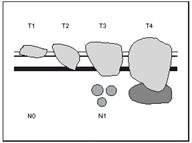
Tal vez la principal indicación de la EE es la evaluación y estadificación de pacientes con cáncer del tracto gastrointestinal. (Figura 6) Para propósitos prácticos, en el tubo digestivo, desde el esófago hasta el recto, la pared está formada por 4 capas histológicas que en EE convencional son 5 capas ecográficas las cuales fueron descritas anteriormente. La EE permite identificar con claridad estas capas y las estructuras localizadas a sus alrededores, lo cual nos lleva a una mejor estadificación preoperatoria de diversas neoplasias del tracto digestivo superando a los métodos diagnósticos tradicionales (17, 18). Este avance, además, ha coincidido con el desarrollo de nuevas opciones terapéuticas mínimamente invasivas (mucosectomías endoscópicas, plasma argon, cirugía laparoscópica, etc.) y con la aplicación de estrategias terapéuticas combinadas (tratamientos neoadyuvantes y multimodales) derivados de un mejor conocimiento de la historia natural y los factores pronósticos de los tumores digestivos, cuya aplicación exige efectuar un diagnóstico de extensión preoperatorio con un elevado grado de precisión (19, 20). La EE proporciona, una información clínica, difícilmente obtenible por otros medios, en las neoplasias de esófago, estómago, páncreas, vías biliares, y recto, modificando las decisiones terapéuticas subsiguientes, por lo que se ha hecho acreedora de un lugar indiscutible en las estrategias de estadificación y/o seguimiento de estas enfermedades (21).
Figura 6. La invasión del tumor a travésde las diferentes capas de la pared es lo que determina el estadio T, la gráfica indica cada uno de ellos y el estado N1 cuando hay compromiso de ganglios. (Tomado de la referencia 21).
Cáncer del esófago
La evaluación por EE de los pacientes con cáncer esofágico es de fundamental importancia tanto para los de tipo escamoso como para los de tipo adenocarcinoma. Cuando por EE los tumores están limitados a la capa mucosa, es decir tumores tempranos, (figura 7) éstos son susceptibles de tratamiento endoscópico, mediante mucosectomía endoscópica. Pero en los casos de neoplasias avanzadas, (figura 8) desde el punto de vista locorregional (estadios IIB y III), la aplicación de tratamiento neoadyuvante mediante la combinación de radioterapia y quimioterapia ha demostrado ser superior a la cirugía aislada o asociada a radioterapia en términos de efecto antitumoral, resecabilidad, desarrollo de metástasis a distancia y probabilidad de supervivencia libre de enfermedad (22).
Figura 7: En la parte inferior de la foto se observa una lesión hipoecoica que solo compromete la ecocapa uno y dos, es decir la mucosa y respeta la capa muscular propia. Tomado del video: cáncer staging dr. Anand Sahai.
Figura 8. En el lado izquierdo de la foto se observa una masa hipoecoica que ha invadido la pleura (la cual es la banda hiperecoica) esdecir que la lesión es tipo T4. Tomado del video: cáncer staging Dr Anand Sahai.
Por tanto, para clasificar a cada paciente, dentro del grupo de tratamiento que le corresponde, es imprescindible realizar una estadificación lo más correcta posible en el momento del diagnóstico de la neoplasia. Clásicamente, múltiples estudios han demostrado la superioridad de la EE con respecto a la TAC no helicoidal en el diagnóstico de extensión locorregional de esta neoplasia (23). En los últimos años, la aparición de la TAC helicoidal ha acortado estas diferencias, aunque más recientemente, la posibilidad de realizar punción guiada por eco de las adenopatías ha demostrado que esta técnica sigue siendo superior a las técnicas clásicas, incluso en la estadificación N (24).
La precisión diagnóstica de la EE para el estadio T es de 75 al 90% y entre el 70 y el 80% para el estadio N (25). Algunos fenómenos, como la inflamación peritumoral, pueden dificultar la correcta valoración del grado de infiltración del tumor y condicionar una supraestadificación T.
¿Qué podemos identificar con la ecoendoscopia en cáncer de esófago que no identificamos con otras técnicas?
1. Determinación de la extensión en longitud del tumor: la extensión submucosa del mismo puede subvalorarse en endoscopia convencional (especialmente en tercio inferior y región cardial).
2. Determinación de la relación del tumor con la carina (supracarinal o infracarinal). Esta información, puede tener implicaciones en el abordaje quirúrgico de la neoplasia.
3. Contraindicación de la cirugía en tumores que invadan órganos vecinos (estadio T4).
4. Identificación de adenopatías, en especial las de tamaño inferior a 1 cm, las cuales no son detectadas por la TAC. Así mismo, si está indicado, se puede realizar punción, con mínima morbilidad.
Cáncer gástrico
Dada la alta prevalencia del cáncer gástrico en Colombia (26) y la mayor experiencia que hemos ido adquiriendo para detectarlos en estadios tempranos, la EE tiene una gran utilidad en la evaluación de los mismos. Es importante aclarar que no existen datos ecográficos que permitan distinguir con fiabilidad suficiente las lesiones gástricas benignas de las malignas, especialmente si existen ulceraciones, pues los fenómenos inflamatorios pueden tener una imagen idéntica a la infiltración neoplásica. Por tanto, el examen endosonográfico sólo debe realizarse después de la confirmación histológica de neoplasia (27). La excepción a esta regla ocurre en los pacientes con linitis plástica, en quienes la imagen endosonográfica es muy sugestiva y las biopsias superficiales suelen ser negativas. Aun en estos casos debe intentarse la confirmación histológica mediante biopsia sobre biopsia o macrobiopsia.
La EE ha demostrado su superioridad frente a la TAC en el diagnóstico de extensión locorregional del cáncer gástrico (aproximadamente 85% en la estadificación T y un 80% en la N), (28-29) permitiendo diferenciar si estamos ante un paciente con un cáncer gástrico temprano (es decir que la lesión sólo compromete hasta la submucosa sin infiltrar la capa muscular), (figura 9) lo cual permite hacer una mucosectomía endoscópica con curación del paciente. Además, nos proporciona información valiosa, como la afectación de órganos vecinos (páncreas, lóbulo hepático izquierdo), o la existencia de adenopatías metastásicas a distancia que requerirían una gastrectomía D3 (30).
Figura 9. Obsérvese la lesión hipoecoica que está al lado izquierdo de la imagen y detalle como sólo compromete la primera ecocapa o mucosa superficial, lo que hace un diagnóstico de un cáncer temprano; después, al paciente le realizamos una mucosectomía que confirmó los hallazgos.
Existen algunas dificultades adicionales para la correcta estadificación de esta neoplasia, tales como la imposibilidad de distinguir entre infiltración de la subserosa (T2) o de la serosa (T3) (figura 10) en la estadificación T y la frecuencia de micrometástasis que aumenta el porcentaje de error en la estadificación N (31). La existencia frecuente de fenómenos inflamatorios, especialmente en las neoplasias ulceradas, añade dificultad a la exploración, como se ha comentado anteriormente.
Figura 10. En el lado superior de la foto se observa como el tumor ha invadido la capa muscular propia, estadio T2.
¿Qué podemos identificar con la ecoendoscopia en cáncer gástrico que no identificamos con otras técnicas?
1. Cáncer temprano. La EE es fundamental para establecer si una lesión que es positiva para cáncer gástrico sólo se extiende hasta la submucosa. En estos casos es necesario utilizar frecuencias de exploración elevadas, del orden de 12, 15 ó 20 MHz o minisondas (32, 33).
2. Cáncer avanzado de esófago proximal. La EE es fundamental para descartar la extensión del tumor a esófago distal, lo que tiene importantes implicaciones terapéuticas, puesto que obliga a realizar una esofaguectomía.
3. Evaluación de los pacientes con sospecha de linitis plástica. (Figura 11a y b)
Figura 11a y b: En la foto de la izquierda se observa el engrosamiento y destrucción de las ecocapas compatible con una linitis plástica, lo cual es más evidente cuando se compara con la pared normal en la foto de la derecha.
En la linitis plástica, la infiltración neoplásica se caracteriza porque confiere una importante rigidez a la pared gástrica debida a la reacción fibrosa de la capa submucosa, característica que se traduce en dificultad a la distensión con aire (endoscopia) o agua (EE). En esta patología, si la imagen ecoendoscópica es típica, no suele plantear problemas y permite indicar la cirugía aun en ausencia de confirmación histológica. Se presenta como un marcado engrosamiento de la pared gástrica a expensas de todas las capas o especialmente de la submucosa, (34). Algunas infiltraciones metastásicas del estómago (neoplasia de mama) adoptan un aspecto linítico indistinguible de una neoplasia primaria (35).
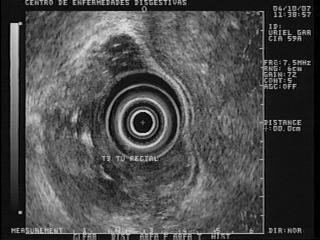
Cáncer rectal
El diagnóstico y el manejo del cáncer rectal han evolucionado de forma importante en los últimos años mejorando el pronóstico de los pacientes. Un aspecto fundamental en el tratamiento de esta neoplasia es una adecuada estadificación de la lesión preterapéutica, dada la importancia del tratamiento neoadyuvante (36). Las indicaciones de la EE en otras áreas del colon son escasas debido a la baja incidencia de lesiones subepiteliales y a que, en ausencia de metástasis, la estadificación locorregional del tumor del colon no modifica el manejo terapéutico del paciente (37).
Los tumores colorrectales se presentan endosonográficamente en forma de una masa hipoecogénica de crecimiento transmural, con o sin afectación de la grasa perirrectal (38). Existen numerosos estudios que han demostrado una alta precisión de la ecoendoscopia en el diagnóstico de extensión T-N de los tumores de recto (aproximadamente del 85%, tanto para la estadificación T como para la N) (39, 40), superior a otras técnicas de imagen, como la TAC (41, 42). Si la lesión es clasificada como T1, (figura 12) se aconseja mucosectomía endoscópica o resección transanal. Si es T2, (figura 13) se recomienda resección quirúrgica con posterior radioterapia. Si es T3 o T4, (figura 14) se recomienda quimiorradiación preoperatoria (43). El principal problema de la EE en la interpretación endosonográfica de las imágenes en la neoplasia de recto procede de los cambios inflamatorios peritumorales que a menudo acompañan a esta neoplasia y que son difíciles de distinguir de la infiltración tumoral (44).
Figura 12. En la parte superior e izquierda de la foto se observa una lesión hipoecoica de la pared que solo compromete la ecocapa 1 - 3 y respeta claramente la ecocapa 4 o muscular propia, que es la banda negra que pasa por detrás de la lesión.
Figura 13. En la parte inferior de la foto se observa una lesión hipoecoica que invade la capa muscular propia, la cual está marcada con el número 4 por lo cual la clasificamos como T2.
Figura 14. En la parte izquierda de la foto se observa una lesión hipoecoica que destruye todas las capas de la pared rectal. Compare en el lado derecho la pared normal.
El valor de la EE en la reevaluación de la respuesta al tratamiento neoadyuvante es limitado, puesto que los cambios inflamatorios inducidos por la neoplasia provocan variaciones morfológicas importantes en la pared rectal (45, 46). En cambio, tiene un papel destacado en la detección de recidivas precoces anastomóticas que suelen afectar tardíamente a la mucosa, por lo tanto, no se visualizan en la endoscopia convencional. Para ello es muy importante disponer de una exploración basal que permita establecer comparaciones y que se aconseja no practicar antes de los 3 meses postintervención (47, 48).
La utilidad de la punción aspirativa con aguja fina guiada por EE (EE-PAAF), en la neoplasia colorrectal se centra en la punción de adenopatías locorregionales para confirmar su naturaleza neoplásica, de manera especial en aquellos casos en los que el manejo del paciente depende de ello, como es el caso de las neoplasias T2 con adenopatías sospechosas. Otra indicación muy interesante de la USE-PAAF es la confirmación de las recidivas paraanastomósicas.
La EE es también de utilidad en la confirmación del carácter superficial de las lesiones rectales elevadas (Ej. adenomas), lo cual es imprescindible para realizar una resección endoscópica con éxito. Finalmente, la EE puede ser útil para descartar la afectación de planos profundos y la presencia de adenopatías en los pacientes en quienes se comprueba el carácter neoplásico de un pólipo extirpado en el curso de una endoscopia. Sólo la negatividad de las biopsias de la base y la normalidad de la EE ofrecen garantías suficientes para considerar que la resección ha sido oncológicamente correcta (49).
Cáncer de páncreas
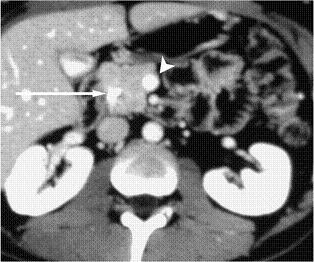
Este tumor tiene un mal pronóstico no sólo por su agresividad sino porque se diagnostica en estados avanzados debido a su ubicación retroperitoneal que no está al alcance de la mayoría de exámenes diagnósticos. Para intentar mejorar su detección temprana fue que se inventó hace más de 20 años la EE ya que permite colocar el transductor ecográfico más cerca de este órgano y hacer la evaluación de toda clase de tumores pancreáticos (50). La TAC abdominal, (figura 15) posee también una precisión diagnóstica en la evaluación del paciente con sospecha de tumor pancreático con una sensibilidad y especificidad del 83 y 93%, respectivamente, y presenta evidentes ventajas en la estadificación de la lesión (51, 52) pero la EE, (figura 16) tiene un rendimiento diagnóstico superior al de la TAC, con una sensibilidad y especificidad del 94 y 100%, respectivamente (53). Es así como la EE se ha convertido en el examen de elección para la evaluación de pacientes en quienes se sospecha una masa o lesión del páncreas; en nuestra práctica clínica, con la EE hemos encontrado muchas masas de la cabeza del páncreas que no fueron detectadas por la TAC, incluso con tomógrafos modernos como los que utilizan técnica helicoidal.
Figura 15. La flecha larga señala la masa ubicada en la cabeza del páncreas y la flecha corta señala cómo los vasos están respetados por la lesión. (Tomado de referencia 53).
Figura 16. En el centro de la imágen se observa una masa teherogénea ubicada en la cabeza del páncreas la cual invade el colédoco distal y a la porta que está detrás de él.
El diagnóstico del cáncer de páncreas idealmente debería tener una confirmación citohistológica antes de tomar una conducta quirúrgica u oncológica. Para ello es necesario obtener una muestra de tejido tumoral, la cual puede realizarse mediante punción con aguja fina (PAAF) por vía percutánea, ecoendoscópica, o biopsia abierta.
En los pacientes con masas pancreáticas o metástasis hepáticas, la PAAF percutánea bajo control ultrasonográfico o por TAC es la aproximación que proporcionaba un mayor rendimiento hasta ahora, pero resultados recientes sugieren que la punción guiada por ecoendoscopia (EE-PAAF), (figura 17) presenta un mayor rendimiento para la confirmación citológica (54). Esta técnica está especialmente indicada en las lesiones irresecables para confirmar su naturaleza neoplásica antes de aplicar quimioterapia y/o radioterapia o cuando se sospechan determinadas etiologías, como linfoma, tuberculosis, carcinoides, metástasis, etc. Chang y cols (55), en un estudio multicéntrico llevado a cabo en 164 pacientes con sospecha de neoplasia de páncreas, demostraron unos índices de sensibilidad, especificidad, precisión diagnóstica, y valor predictivo positivo y negativo para la EE-PAAF del 83, 90,85, 80 y 100%, respectivamente. Las contraindicaciones de la punción son las mismas para los procedimientos invasivos. (Tabla 4)
Figura 17. En el centro de la imagen se observa una masa hipoecoica que corresponde al tumor y en la parte superior derecha de una línea blanca que corresponde a la aguja de punción con la cual tomamos la biopsia y confirmamos un adenocarcinoma del páncreas.
|
|
|
|
Tabla 4. Contraindicaciones de la punción-aspiración biopsia
Cuando hay una alta sospecha de cáncer pancreático es imprescindible efectuar una correcta estadificación de la lesión, con el fin de establecer la opción terapéutica más adecuada. Para ello se pueden utilizar los exámenes tradicionales para el diagnóstico inicial de esta lesión como son la ecografía o la TAC, así como la arteriografía o la ultrasonografía abdominal con registro Doppler para la evaluación de la afectación vascular. El objetivo fundamental de la estadificación es establecer la resecabilidad del tumor. En este sentido, se consideran resecables aquellas lesiones que no afectan a estructuras vecinas, como grandes vasos (tronco celiaco, origen de la arteria hepática, arteria o vena mesentérica superior, o vena porta), colon y estómago, y que no presenten diseminación metastásica (56, 57). Es importante señalar que no existe ninguna exploración que, por sí sola, sea capaz de predecir la resecabilidad del tumor con absoluta certeza (58, 59). Así, la mayoría de autores coinciden en la necesidad de combinar diferentes técnicas que proporcionen información complementaria o que confirmen los datos en caso de discrepancia. Un estudio prospectivo, en el que se comparó el rendimiento de las diferentes técnicas de imagen en la estadificación del cáncer de páncreas, concluyó que la combinación de la TAC abdominal con la EE, es la aproximación más útil para predecir la resecabilidad del tumor (60). Cuando ambas exploraciones coinciden en la irresecabilidad de la lesión, la especificidad es del 100%. En este esquema, la utilidad de la arteriografía quedaría limitada a los casos en los que existiese discrepancia entre las 2 pruebas mencionadas.
Por otra parte, es bien conocido que los pacientes con carcinoma de páncreas presentan a menudo dolor abdominal de moderada a gran intensidad, ya sea como manifestación inicial o a lo largo de su curso clínico (61). Por ello, la paliación del dolor adquiere una especial relevancia con el fin de mejorar la calidad de vida de estos pacientes. Entre las diferentes opciones puede plantearse la administración de analgésicos menores (paracetamol, ácido acetilsalicílico y antiinflamatorios no esteroides) u opiáceos (metadona, sulfato de morfina, meperidina). No obstante, en una proporción no despreciable de casos, estas medidas no logran un control adecuado del dolor, por lo que deben plantearse otras alternativas terapéuticas. Entre éstas destacan, por su gran efectividad, la esplacnicectomía por vía toracoscópica y la neurólisis mediante punción guiada por EE (62), que se describirá más adelante.
Cáncer pulmonar
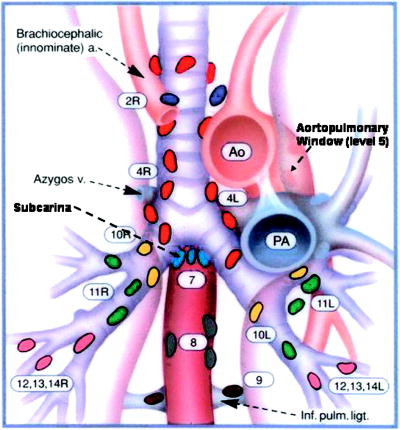
El cáncer del pulmón es la causa más común de mortalidad relacionada con cáncer en los Estados Unidos con una incidencia anual de 170.000 casos y 154.000 muertes (63). Las estrategias de manejo se basan en el tipo histológico (carcinoma de células pequeñas y de células no pequeñas) y en la presencia de invasión mediastinal o a distancia del tumor. La estatificación de la lesión es fundamental no sólo para establecer el pronóstico sino para guiar la conducta terapéutica. Usualmente se adopta la clasificación del comité americano para el cáncer (64), la cual la podemos resumir así: cuando la lesión no invade el mediastino se clasifica como estado I o II y son candidatos para manejo quirúrgico si hay compromiso de ganglios ipsilaterales es un estado IIIA; su manejo es controversial, algunos grupos dan manejo quirúrgico y otros dan quimiorradioterapia. Si hay compromiso de ganglios contralaterales o invasión directa al mediastino es un estado IIIB y son enviados a quimiorradioterapia con una sobrevida a 5 años menor del 5% (65). Esta clasificación nos deja ver la importancia de detectar el número y localización de las adenopatías mediastinales, (figura 18) asociadas al cáncer pulmonar; existen múltiples métodos diagnósticos para estatificar a los pacientes con cáncer pulmonar, entre otros, está la TAC, pero su utilidad para caracterizar el tamaño y la localización de las adenopatías asociadas al tumor tienen una sensibilidad y especificidad de sólo el 70% (66). La tomografía por emisión de positrones (PET) tiene una precisión del 85% (67), sin embargo, tiene limitaciones por el gran número de falso negativos en tumores que tienen poca actividad metabólica o que tengan ganglios menores a un cm. La broncoscopia con biopsia transbronquial es muy segura y bien tolerada con una sensibilidad del 60 al 70% (68) pero sólo puede acceder a ganglios ubicados en el espacio subcarinal o en el hilio, siendo incapaz de llegar a la ventana aortopulmonar o al mediastino posterior. La mediastinoscopia y la toracoscopia son métodos diagnósticos muy precisos de estadificación pero son costosos e invasivos requiriendo anestesia general (69).
Figura 18. Esta figura señala los sitios en los que deben buscarse los grupos ganglionares en el cáncer de pulmón. (Tomado de la referencia 70)
En la estadificación de cáncer del pulmón la EE adquiere una gran importancia ya que al colocar el transductor en el mediastino por vía esofágica nos permite una adecuada valoración de grupos ganglionares que no están fácilmente al alcance de las otras técnicas, permitiéndonos evaluar si hay compromiso de los ganglios, (figura 19) ubicados en el espacio subcarinal, la ventana aortopulmonar o el mediastino posterior ya que la EE no sólo identifica ganglios no detectados por las otras técnicas, sino que los puede biopsiar, lo cual puede cambiar la conducta del manejo del paciente (70).
Figura 19. Estas 4 fotos señalan la evaluación de una adenopatía secundaria a un cáncer pulmonar. En la parte superior izquierda hasta la TAC en la derecha está la ecoendoscopia radial que ubica la lesión, en la parte inferior izquierda está la ecoendoscoipa lineal que realiza la punción y en la derecha el resultado histológico. (Tomado de referencia 71)
Estudios iniciales en pacientes con cáncer pulmonar que tenían adenopatías en el mediastino posterior demostraron la superioridad de la EE con punción sobre la TAC en detectar malignidad con una sensibilidad y especificidad de 90 y 100% respectivamente (71). En la serie más grande reportada la EE-PAAF identificó enfermedad mediastinal avanzada en 75 de 97 pacientes (77%) que tenían carcinoma pulmonar y adenopatías por el TAC, lo cual evitó otros exámenes más invasivos. De igual forma detectó invasión mediastinal en 10 de 24 pacientes sin adenopatía mediastinal por la TAC. Este estudio reportó una sensibilidad total del 87% y una especificidad del 100% para detectar nódulos linfoides mediastinales (72). En conclusión, la EE es un método preciso, seguro y costo-efectivo para determinar si los pacientes con cáncer pulmonar tienen compromiso mediastinal, especialmente cuando la TAC es negativa. Además, es útil para confirmar histológicamente el cáncer cuando la broncoscopia es negativa.
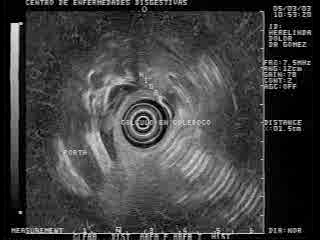
Coledocolitiasis
La EE biliopancreática es una de las principales aplicaciones de este examen. Usualmente la exploración se realiza de forma retrógrada colocando el transductor en la tercera porción del duodeno y después se retira de forma progresiva; si la exploración es completa, la visualización del páncreas y la vía biliar extrahepática es posible en prácticamente el 100% de los pacientes (73). Además, la exploración de los grandes vasos adyacentes al páncreas es posible también de forma casi constante (73). La proximidad de la sonda de ultrasonido al área biliopancreática, (figura 20) permite utilizar sondas de frecuencia elevada (7,5 y 12 mHz), con lo que se consigue una excelente definición de esta área. De esta forma, es posible visualizar lesiones parenquimatosas de diámetro inferior a 10 mm (74). Por el contrario, hay limitaciones en la profundidad de campo, por lo que la exploración de la región del hilio hepático sólo es posible en una cuarta parte de los casos.
Figura 20. Obsérvese cómo el transductor de eco se puede colocar muy cerca de la región biliopancreática. (Tomado de T. Rosch y cols. Longitudinal endosonography.)
Existen otros factores que pueden dificultar o incluso imposibilitar la realización de la exploración, tales como las estenosis duodenales infranqueables y la presencia de reconstrucciones quirúrgicas (especialmente gastrectomía total o gastroenteroanastomosis tipo Billroth II), las cuales hacen casi imposible explorar la vía biliar. Otra causa de dificultades adicionales es la esfinterotomía previa o la presencia de una prótesis en el interior de la vía biliar que también puede implicar dificultades en la interpretación de las imágenes (aerobilia, sombra acústica producida por la prótesis, etc.)
La ecoendoscopia biliopancreática ha demostrado ser superior en cuanto a precisión y rentabilidad diagnóstica a la ecografía convencional y a la TAC, y al menos igual a la colangiopancreatografía retrógrada endoscópica (CPRE) (75). Recientemente, la aparición de la TAC helicoidal y de la colangiografía por resonancia magnética (colangio-RNM) han abierto de nuevo la polémica sobre la mayor o menor eficacia de cada una de estas técnicas en el campo de la enfermedad biliopancreática. Por otra parte, las posibilidades ya conocidas de la EE se han visto aumentadas por la posibilidad de realizar EE-PAAF, así como por la disponibilidad de minisondas, que introducidas por vía transpapilar o transhepática, permiten una exploración endoluminal de la vía biliar (76). (Figura 21) En el momento actual, la mayor utilidad de una u otra de estas técnicas sigue dependiendo aún de condiciones locales (experiencia del ecoendoscopista, disponibilidad o no de la técnica, etc.).
Figura 21. En el dibujo de la izquierda se muestra cómo puede introducirse la minisonda al colédoco y en la foto de la derecha se muestra una imágen de su interior. (Tomado del video Miniprobe EUS: Chan-Sup Shim MD).
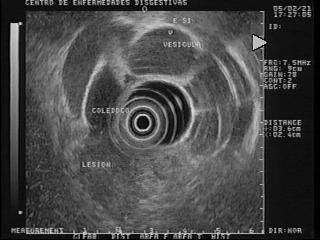
Actualmente, la ecoendoscopia, la colangio-RM y la colangiografía (CPRE o peroperatoria) son las técnicas que han demostrado una mayor utilidad en el diagnóstico de la coledocolitiasis (77). En un estudio comparativo entre la EE y la colangio-RM realizado en un número limitado de pacientes con sospecha de coledocolitiasis, la USE tuvo una especificidad superior a la colangio-RM (78). (Figura 22) De hecho, la EE ha demostrado ser superior tanto a la RM como a la CPRE (79, 80) en el diagnóstico de la microlitiasis, (figura 23) por lo cual se considera que es la técnica con mayor precisión en el diagnóstico de colédoco litiasis (81, 82). Además, no hay que olvidar que la EE evita CPRE no indicadas en el 87% de los casos, como se demostró en un estudio con seguimiento clínico durante un año (83).
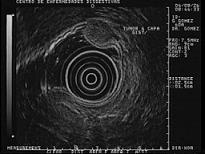
Figura 22. Imagen hiperecoica en el centro del colédoco que deja sombra acústica posterior, compatible con col´doco litiasis.
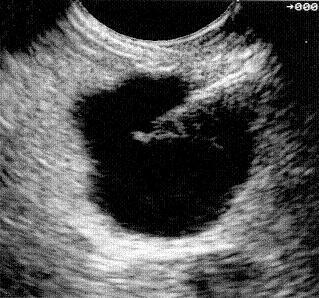
Figura 23. En la parte superior de la foto se observa una microlitiasis en la vesícula.
La EE probablemente es la mejor técnica disponible para esta indicación, el cuadro clínico del paciente debe guiar la elección del examen inicial. Una aproximación general al problema podría ser la siguiente:
1. Realizar CPRE como primera opción cuando se considera la práctica de una esfinterotomía independientemente del diagnóstico final, como en el caso de los pacientes con antecedentes de colangitis (84), pancreatitis agudas biliares graves o en pacientes de edad avanzada y/o con riesgo elevado para la cirugía.
2. En aquellos casos de pancreatitis aguda menos grave, es probable que esté indicada la EE como primera opción, reservando la CPRE para los pacientes a quienes se diagnostique coledocolitiasis (85, 86). Sin embargo, no hay estudios sobre la eficacia de este abordaje en el manejo de este grupo de pacientes.
3. En caso de que se plantee una colecistectomía no hay indicación para un examen previo de la vía biliar por EE. Si se encuentra un cálculo en la colangiografía intraoperatoria, se puede realizar papilotomía endoscópica en el mismo acto quirúrgico con un gran éxito, como lo hemos demostrado en el Hospital el Tunal (87).
4. Se practicará de entrada CPRE en aquellos pacientes con alta probabilidad o diagnóstico ya establecido de coledocolitiasis (cálculo en el colédoco visible por ecografía convencional, antecedente de colangitis, etc.) En estos casos, y puesto que la presencia de un cálculo en la vía biliar se confirma en cerca del 60% de los pacientes, no se considera necesaria la EE (88).
5. En los pacientes con riesgo intermedio (clínica o exámenes sugestivos de migración) lo ideal es realizar EE como examen inicial, seguida de CPRE y esfinterotomía en la misma sesión en caso de demostrar coledocolitiasis. En este grupo de pacientes, la probabilidad de coledocolitiasis varía del 5-20%, por lo que las demás estrategias diagnósticas (CPRE sola o colangio-RM seguida de CPRE) es probable que no tengan una clara indicación (89, 90).
6. En pacientes con riesgo bajo de coledocolitiasis (sin elementos clínicos, exámenes de laboratorio ni de imagen sugestivos) no se considera necesario practicar ninguna exploración previa a la cirugía.
D
Drenaje vía biliar
En pacientes con tumores de la vía biliar o de la cabeza del páncreas, en quienes no es posible hacer un drenaje de la vía biliar por CPRE, la EE intervencionista es una excelente opción al permitir detectar la vía biliar intrahepática guiados por el eco y el Doppler, luego avanzamos una guía a través de una aguja de punción 19 ó 22 que se coloca por vía transgástrica, (figura 24) o transduodenal y posteriormente, sobre ésta se coloca un stent para que el líquido biliar drene al duodeno a la cavidad gástrica o se avanza la guía hasta la papila para que se recupere y sobre ésta se avance el stent por la CPRE, (figura 25) como lo demostró recientemente Kahaleh y col (91) en una serie de casos.
Figura 24. La imagen nos muestra cómo la ecoendoscopia lineal puede avnazar una guía a través de la pared gástrica y alcanzar la vía biliar intrahepática para dejar un stent que la drene. (Tomado de referencia 91).
Figura 25. Con el ecoendoscopio lineal se ha pasado una aguja para puncionar la vía biliar intrahepática ya través de ella se inyecta medio de contraste para realizar una colangiografía. (Tomado de referencia 91).
Drenaje de absceso
Prácticamente cualquier colección que esté alrededor del tracto gastrointestinal puede ser drenada mediante EE y hay informes sobre drenajes exitosos de abscesos hepáticos, mediastinales, pancreáticos, perirrectales y esplénicos. La imagen de las colecciones o los abscesos puede ser diferenciada claramente de las estructuras normales y existen diferentes accesorios que permiten acceder a ellos y drenarlos, complementando el procedimiento con antibióticos, evitando en muchos una intervención quirúrgica, que hasta el momento era la conducta tradicional. En la literatura hay varios reportes exitosos de esta aproximación como el del grupo de Virginia (92) que logró un drenaje exitoso de un absceso mediastinal y el de Seedwald y cols (93) que drenaron exitosamente dos pacientes con abscesos subfrénicos. (Figura 26a y 26b)
Figura 26a y b. La imagen de la izquierda muestra la forma en que se puede drenar un absceso esplénico y la de la derecha cómo drenar un absceso hepático izquierdo. (Tomado de referencia 93).
E
Engrosamiento de pliegues
En casos de pliegues gástricos engrosados, la EE permite identificar claramente las diferentes capas de la pared y evaluar no sólo la estructura de cada una de ellas sino determinar cuales están involucradas y complementar los hallazgos de la endoscopia. La EE también puede excluir que tal engrosamiento sea de origen vascular y de esta manera evitar una biopsia que implicaría un altísimo riesgo de complicaciones hemorrágicas. La Sociedad Europea de Endoscopia recomienda que la EE preceda la toma de biopsias en todos los casos de pliegues gástricos engrosados, que puedan sugerir la existencia de vasos grandes subepiteliales.
Los pliegues hiperplásicos y la enfermedad de Menetrier, usualmente sólo engrosan la capa mucosa, mientras que procesos malignos como linfomas y linitis plástica, involucran todas las capas destruyendo la pared (94).
Si la EE demuestra engrosamiento mucoso se podrían hacer macro biopsias para el diagnóstico. Si en la EE se encuentran alteraciones sugestivas de malignidad se podría estar en presencia de linitis plástica y se recomendaría tratamiento quirúrgico (95).
F
Fístulas y abscesos perianales
Es fundamental caracterizar con precisión las enfermedades perianales ya que si la anatomía de la fístula no es adecuadamente delineada o un absceso no es detectado, existe riesgo de una cicatrización incompleta, con recurrencia de la fístula, así como de lesión del esfínter anal. Un examen diagnóstico idealmente debería suministrar un mapa virtual de la lesión, susceptible de ser utilizado para planear la terapia y en tales casos la EE es el examen ideal (96, 97). Aunque usualmente es muy difícil describir el tracto fistuloso, la aplicación previa de agua oxigenada, facilita la exactitud de la EE, al identificar la presencia de ésta, al aparecer como un trayecto hiperecoico (que representan aire) dentro de un gran tracto hipoecoico que corresponde a la inflamación que lo rodea. (Figura 27).
Figura 27. Las flechas en la parte inferior de la foto señalan el trayecto fistuloso. (Tomado de referencia 96).
La precisión de la EE en la enfermedad perianal ha sido demostrada en varios estudios (98, 99); en éstos, la sonda rígida rectal fue la más utilizada como medio de exploración, pero el ecoendoscopio flexible radial también ha sido usado con similar eficacia en dos estudios prospectivos que evaluaron la enfermedad perianal. Uno comparó la EE con TAC en 25 pacientes sospechosos de tener enfermedad de Crohn perianal (100) y encontró que la EE fue superior a la TAC en la evaluación de fístulas perianales con exactitudes de 82% vs. 24% respectivamente. En el otro estudio se comparó la EE con RNM en pacientes con Enfermedad de Crohn (101), se utilizó EE rectal, RNM pélvica, y examen físico bajo anestesia general, en 22 pacientes con fístulas. En este trabajo, también se demostró la superioridad de la EE para describir las fístulas causadas por esta enfermedad.
La correlación de la EE rectal y de la RNM pélvica, comparada con cirugía es del 82% y 50% respectivamente (102). Además, como la actividad de la enfermedad es muy importante para decidir el tratamiento, la EE tiene la ventaja de lograr esta información ya que la colonoscopia se puede realizar al mismo tiempo.
G
Glándula adrenal
Cuando se realiza una EE gástrica, se puede observar claramente la glándula adrenal izquierda, que está en continuidad con el riñón. Esta glándula puede verse comprometida por metástasis de tumores pulmonares o mamarios y con el endosonógrafo lineal se pueden tomar biopsias de la misma y hacer un diagnóstico. Esta posibilidad fue descrita por Eloubeidi y cols (103), quienes durante un período de tres años evaluaron 31 pacientes con diferentes neoplasias que tenían además un aumento en el tamaño de la glándula adrenal, encontraron metástasis en el 41% al realizarles punción guiada por EE.
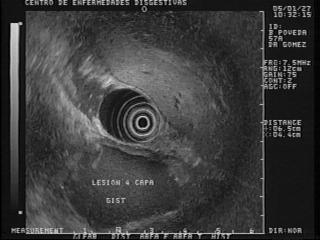
GIST
Estas siglas corresponde a las palabras inglesas: Gastro Intestinal Stromal Tumor (104, 105). Identifica tumores que al parecer se originan en las llamadas células intersticiales de Cajal y su diferenciación puede ser hacia grupos eminentemente musculares, grupos neurales o una combinación de los dos (104, 105). El diagnóstico se hace al identificar por inmunohistoquímica la proteína CD-117, también conocida como proteína c-kit, la cual es un receptor de membrana con actividad de tirosin kinasa (106). La importancia de estas lesiones se debe a que en un 30% pueden tener un comportamiento maligno y dar lugar a metástasis. En Estados Unidos (EU) se reportan cada año de 5.000 a 6.000 casos de GIST (107). La localización de estos tumores en los diferentes segmentos del tracto gastrointestinal es el siguiente: estómago (40-70%), intestino delgado (20-40%), colon y recto (5-15%) y esófago (< 5%) (108). Como puede verse, es un tumor infrecuente en el esófago y por ello, ante un paciente con una lesión esofágica subepitelial y que a la EE se observe una lesión hipoecoica de la cuarta capa, lo más probable es que se trate de un leiomioma; en cambio, si está en el estómago, lo más probable es que sea un GIST, (figura 28). La mayoría de los pacientes con esta patología están en la 5ª o 6ª década de la vida y usualmente la lesión se ubica en la 4ª capa o muscular propia pero también se puede ubicar en la muscularis mucosae o 2ª ecocapa (109). La mayoría de los pacientes son asintomáticos hasta que el tumor crece lo suficiente para ulcerarse, sangrar o producir metástasis. Cuando el GIST es mayor de 3 cm, se recomienda tratamiento quirúrgico aunque sea asintomático, otros autores sugieren un límite de 4 cm (110). Las lesiones menores de 3 cm representan un reto para su manejo ya que la gran mayoría son benignos, pero debe aclararse que todos los GIST tienen un potencial maligno ya que incluso GIST pequeños han sido reportados con metástasis especialmente los localizados en el tracto digestivo inferior. En la actualidad no es posible predecir con exactitud el potencial maligno de un GIST, pero la probabilidad es alta cuando la lesión tiene las siguientes características: diámetro mayor de 4 cm, bordes irregulares, espacios quísticos en el interior o focos ecogénicos (111). Utilizando la EE-PAAF, se puede diagnosticar un GIST al identificar el CD-117 y determinar su naturaleza maligna si la proteína kit-67 es positiva, ya que ésta indica proliferación y por tanto sugiere un comportamiento maligno (112). Es muy importante enfatizar que los GIST son lesiones muy peligrosas que deben ser seguidas continuamente para descartar las características mencionadas, así como la tasa de proliferación de las mismas. Incluso después de una resección completa estos tumores pueden hacer recurrencia en 40% a 90% de los casos, principalmente en el sitio de origen pero también en el peritoneo o en el hígado. El 50% de las recurrencias que involucran el hígado y los GIST del intestino tienen 4 veces más riesgo de recurrencia que los del estómago (113).
Figura 28. En la parte inferior de la foto se observa una lesión hipoecoica gigante que depende de la capa muscular propia. La patología reportó un GIST maligno.
H
Hígado
El hígado es un órgano que está en estrecha vecindad con la cavidad gástrica especialmente en su lóbulo izquierdo el cual es completamente valorado por la EE. El lóbulo derecho puede evaluarse parcialmente desde el bulbo duodenal y el antro, por lo tanto podemos evaluar lesiones focales hepáticas y en muchas ocasiones tomarles biopsias y determinar su naturaleza maligna. En un estudio de Prasad y cols que incluyó 222 pacientes con cáncer se encontraron 27 lesiones hepáticas de las cuales 17 no habían sido detectadas por otros métodos, a 21 pacientes se le realizó punción y en 15 de ellos se encontró malignidad (114).
I
Incontinencia anal
La incontinencia anal es una enfermedad que genera gran incapacidad no sólo física sino social, además es muy difícil de evaluar dada sus múltiples etiologías. Hasta hace muy poco no existía ningún examen que pudiera obtener evidencia directa de la lesión estructural de los esfínteres y se recurría a la electromiografía (EMG). Este abordaje cambió radicalmente con la aparición de la EE, al demostrarse que es superior a la EMG (115, 116) para identificar lesiones de los esfínteres. La EE puede describir el esfínter anal interno y el externo con gran precisión, permitiendo detectar lesiones o alteraciones pararrectales que puedan explicar este síntoma. Múltiples estudios han evaluado la sensibilidad de esta técnica y la han comparado también con la RNM (117-119) pero los resultados son contradictorios. En la EE las lesiones del esfínter anal interno se ven hiperecoicas en el anillo hipoecoico normal del esfínter anal interno; en contraste, las lesiones del esfínter externo aparecen como lesiones hipoecoicas en el anillo que normalmente es hiperecoico. (Figura 29)
Figura 29. En el lado izquierdo de la foto se observa claramente una lesión que compromete el esfínter externo (EE) y el esfínter interno (EI).
La precisión de la EE para detectar defectos del esfínter anal también se ha comparado con la cirugía (esfinteroplastia) (120-122). En el estudio más grande reportado a la fecha, con 44 pacientes (123), la EE tuvo sensibilidad del 100% para detectar defectos de los esfínteres. La EE también es útil para predecir los resultados de la esfinteroplastia (124).
K
Klastkin
Los tumores de la vía biliar son lesiones no sólo difíciles de tratar sino de evaluar. La EE permite valorar la vía biliar sobre todo en su parte extrahepática porque a nivel de la vía intrahepática pierde sensibilidad. Sin embargo, cuando se utilizan las minisondas, éstas se pueden avanzar por el duodenoscopio al interior mismo de la vía biliar con una excelente valoración de las diferentes capas de la pared no sólo del colédoco sino de los segmentos intrahepáticos (125). Un aspecto controvertido y difícil es tomar biopsias en estos tumores. El cepillado a través de la CPRE tiene una baja sensibilidad y muchas dificultades técnicas. Recientemente Raven y col (126), describieron una serie de casos en la cual se utilizó el endosonógrafo lineal para tomar biopsias en estos tumores encontrando una alta sensibilidad diagnóstica. Estos resultados son muy alentadores y colocan a la EE como una excelente alternativa en el diagnóstico de pacientes con colangiocarcinomas.
L
Linfomas
La EE gástrica es en la actualidad el método más preciso de imagen para la evaluación y estadificación de las lesiones gástricas infiltrativas. Existen en la literatura varios estudios (127-129) que confirman la superioridad de este examen sobre otras técnicas para este propósito, así como para el seguimiento de los pacientes con linfomas tipo MALT. La sensibilidad, especificidad y precisión diagnostica del USE es de 89, 97 y 95% respectivamente para evaluar la invasión en profundidad del linfoma (130).
Con la EE este linfoma puede ser clasificado T1m si sólo compromete la mucosa, T1sm si compromete hasta la submucosa y T2 cuando compromete la muscular, T3 cuando compromete la serosa y T4 cuando invade órganos vecinos. Si el linfoma es clasificado histológicamente como tipo MALT de bajo grado de malignidad, las lesiones clasificadas como T1m o T1sm pueden ser tratadas con antibióticos para erradicar Helicobacter pylori (131). Las lesiones T2-T4 requieren un tratamiento más agresivo. La EE además es útil para el seguimiento de estos pacientes.
M
Mediastino
Uno de las aplicaciones más apasionantes de la EE es la evaluación del mediastino. Esta área anatómica es difícil de evaluar por las múltiples estructuras que la atraviesan, pero la EE permite su valoración especialmente a nivel del mediastino posterior, el espacio subcarinal y la ventada aortopulmonar. Todas las lesiones que se ubiquen en estas áreas son accesibles a la aguja de punción y se pueden obtener muestras para su diagnóstico histológico. Un estudio reciente evaluó la utilidad de la EE con punción en la evaluación de masas mediastinales (132), se incluyeron 49 pacientes, de los cuales, la EE diagnosticó malignidad en 22 casos (45%), un proceso benigno en 24 casos y no conclusiva o ningún diagnóstico en 3 pacientes. Los autores concluyeron que la EE es una técnica mínimamente invasiva que facilita la detección y la biopsia de masas mediastinales, con la ventaja de que puede realizarse bajo sedación y de manera ambulatoria.
N
Neurólisis del plexo celiaco
El control del dolor a través de la neurólisis del plexo celiaco es una técnica descrita hace muchos años y tradicionalmente se ha realizado a través de rutas quirúrgicas o radiológicas (133), sin embargo, estos accesos tienen múltiples complicaciones. La EE ofrece un acceso mínimamente invasivo y altamente efectivo para realizar la neurólisis especialmente en pacientes con dolor crónico por cáncer de páncreas. (Figura 30) Fue descrito inicialmente por Wiersema y cols (134). La localización de los ganglios celiacos en la raíz del tronco celiaco es fácil por EE debido a la proximidad de este con la pared gástrica. Este hecho permite colocar la aguja bajo control ecográfico en los ganglios celiacos usando un abordaje anterior e inyectando alcohol para obtener una neurólisis química. En un estudio piloto (135) se realizó un bloqueo con etanol absoluto en 25 pacientes con cáncer de páncreas y se obtuvo una mejoría del dolor en el 88%, la cual se prolongó en promedio por 10 semanas. Informes posteriores, han demostrado un éxito similar (136). Es importante señalar que aunque esta técnica también se ha utilizado en el manejo del dolor asociado a la pancreatitis crónica, sus resultados no han sido tan buenos como los obtenidos en cáncer de páncreas, por lo cual no se recomienda para esta enfermedad.
Figura 30. El dibujo señala la ubicación del plexo celiaco y cómo con una aguja guiada por el ecoendoscopio lineal se puede llegar al mismo. (Tomado de Techniques in gastrointestinal endoscopy. Vol. 2, No. 3; 2000; 166).
O
Otras aplicaciones
La EE se ha venido utilizando para otras aplicaciones tales como: colocación de terapias biológicas para el manejo del cáncer de páncreas (137), aplicación de radiofrecuencia (138), realización de múltiples cirugías endoscópicas como reparación de hernia hiatal (139) y gastroplastia guiada por ecografía, inyección de diferentes sustancias, como toxina botulínica (140) o para la aplicación de alcohol para fenolizaciones de quistes o tumores (141).
P
Pancreatitis
Pancreatitis aguda: La pancreatitis aguda tiene muchas etiologías, las más frecuentes son la litiasis biliar y el alcohol pero hasta en un 30% de los pacientes no se encuentra una etiología en su valoración inicial (142). La EE es muy útil en la evaluación de estos pacientes porque permite encontrar cálculos en el colédoco y confirmar la etiología biliar, en cuyo caso permite decidir la intervención endoscópica. También puede detectar tumores especialmente en ancianos, o encontrar que el paciente tiene de base una pancreatitis crónica (143). Además puede detectar complicaciones tempranas de la pancreatitis aguda como son los abscesos o los seudoquistes. Es importante aclarar que es prudente dejar pasar 4 semanas antes de realizar una EE en un paciente con pancreatitis idiopática ya que, por los hallazgos endosonográficos, es imposible diferenciar una colección pancreática de un tumor, a no ser que se realice una punción guiada por la eco (144).
Pancreatitis crónica: Afortunadamente en nuestro medio, la pancreatitis crónica es una enfermedad infrecuente, ya que es difícil para diagnosticar y tratar. La EE ha contribuido ha facilitar su evaluación al permitir descartar otras causas de dolor abdominal crónico como por ejemplo un cáncer pancreático. Existen criterios endosonográficos de pancreatitis crónica que se pueden dividir en criterios parenquimatosos y ductales (145). (Figura 31)
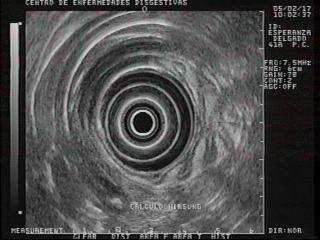
Figura 31. Paciente con pancreatitis crónica. En la parte inferior de la foto se observa un cálculo en el Wirsung.
Criterios parenquimatosos
1. Disminución de la ecogenicidad.
2. Pérdida de la diferencia entre el páncreas ventral y el dorsal.
3. Focos hiperecoicos.
4. Bandas hiperecoicas.
5. Atrofia.
6. Lobularidad.
Criterios ductales
1. Dilatación del conducto pancreático principal.
2. Pared del conducto pancreático principal hiperecoico.
3. Conducto pancreático irregular.
4. Conductos pancreáticos secundarios visibles.
Cuando el paciente tiene cinco o más criterios y no tiene un episodio de pancreatitis aguda, existe una alta probabilidad que se trate de un caso de pancreatitis crónica.
Q
QUISTES
Las lesiones quísticas, o cuyo contenido es principalmente líquido, se pueden encontrar en cualquier sitio del tracto digestivo o de sus órganos adyacentes como el hígado o el páncreas pero es en este último órgano donde tienen mayor relevancia clínica (146). Es muy importante diferenciar las lesiones quísticas de los seudoquistes. Estos últimos no tienen pared o epitelio y representan la mayoría de las lesiones que encontramos en la práctica clínica. Los quistes a su vez se pueden dividir para propósitos prácticos en (147):
1. Lesiones que no tienen potencial maligno quistes simples, cistoadenoma serosos, linfangioma, teratoma quístico, hemangioma o paraganglioma.
2. Lesiones que tienen potencial maligno como son: cistoadenoma mucinoso, el tumor mucinoso papilar intraductal (IPMT), el tumor seudopapilar.
3. Lesiones malignas como: el cistoadenocarcinoma o tumores neuroendocrinos que pueden tener presentación quística.
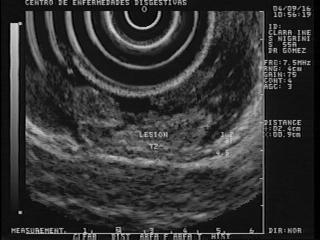
La EE permite distinguir cada uno de estos tumores de acuerdo a sus características endosonográficas, (figura 32) y con la punción (148) se puede obtener material para estudio del contenido líquido no sólo de sus marcadores bioquímicos sino de sus marcadores tumorales siendo el antígeno carcinoembrionario el principal de ellos, el cual nos permite orientar si la lesión es maligna o tiene un potencial maligno.
Figura 32. La foto muestra un quiste en el cuerpo del páncreas que está siendo puncionado para estudio del líquido.
R
Recidivas o recurrencias tumorales
La EE puede utilizarse para el seguimiento de los tumores de esófago y recto que previamente han sido tratados con quimio o radioterapia. Sin embargo, su utilidad en estas circunstancias es limitada, porque se pueden sobreestimar las lesiones residuales debido a las reacciones inflamatorias y fibrosas asociadas con estas terapias. Por ello es ideal tener un registro previo a la intervención con quimiorradioterapia para comparar con los estudios posteriores (149).
S
Subepiteliales: Tumores o lesiones
Existen muchos tipos de lesiones en el tracto gastrointestinal que pueden ser catalogadas como subepiteliales y su etiología va a depender en gran parte si la lesión está ubicada en el esófago, estómago, duodeno o recto. El siguiente punto a considerar es si se trata verdaderamente de una lesión de la pared o si es una compresión extrínseca ya que a lo largo de todo el tracto gastrointestinal hay diferentes estructuras que de manera normal o patológica pueden producir compresión (150), (tabla 5). La estructura normal, que más frecuentemente produce compresión en el estómago es el bazo o los vasos esplénicos, la cual usualmente se identifica en el fundus gástrico. Las alteraciones patológicas que producen compresión extrínseca pueden ser los tumores pulmonares en el esófago y los tumores pancreáticos en el estómago o duodeno. Las lesiones pancreáticas generalmente comprimen la pared posterior del estómago, las hepáticas comprimen la pared anterior del estómago y una vesícula muy dilatada puede causar compresión del antro o del duodeno (151).
Todas las lesiones subepiteliales deben ser valoradas por EE. Aunque algunos autores (152) señalan que si una lesión es menor de un cm y es de coloración amarilla no ameritan ser valoradas por la alta probabilidad de que sea un lipoma, en nuestra práctica clínica hemos valorado muchas lesiones de este tipo y han resultado ser tumores carcinoides (observaciones no publicadas).
Cuando se ha determinado que la lesión depende de la pared y no es una compresión extrínseca, es necesario evaluar a qué capa corresponde.
Normalmente no hay lesiones en la capa uno ni en la capa cinco, por lo cual las lesiones sólo se limitan a tres capas y usualmente son hipoecoicas, anecoicas o hiperecoicas (153).
Ecocapa dos. Corresponde a la parte más profunda de la mucosa o a la lámina propia y a la muscularis de la mucosa. Las lesiones que se originan en esta capa son poco frecuentes y generalmente son hipoecoicas (154). La mayoría de tumores que se originan en esta capa son musculares, usualmente leiomiomas, y generalmente son benignos. (Figuras 33a y 33b) También se pueden originar en esta capa los carcinoides que generalmente pueden estar en el fondo gástrico o en el recto. Las lesiones anecoicas de esta capa pueden corresponder a quistes de inclusión o de retención.
Figuras 33a y 33b: La foto de la izquierda señala una lesión hipoecoica que depende de la cuarta capa gástrica compatible con un GIST; la foto de la derecha es un acercamiento de la lesión.
Ecocapa tres. Es una banda de tejido que se ve hiperecogénica de la cual se pueden originar numerosos tumores (155).
Lesiones hiperecogénicas. La lesión que más frecuentemente se encuentra es el lipoma, el cual se caracteriza por ser hiperecogénico, homogéneo y usualmente tiene el llamado signo de la almohada a la endoscopia. (Figuras 34a y 34b) Otras lesiones hiperecogénicas que se pueden encontrar en esta capa son: adenoma de las glándulas de Brunner, linfoma gástrico, fibromas granulomas y metástasis.
Figuras 34a y 34b: La foto de la izquierda muestra una lesión subepitelial gástrica y la foto de la derecha señala una lesión hiperecoica que depende de la 3a. capa compatible con un lipoma. Este ejemplo demuestra que con el equipo lineal también se puede hacer exámenes diagnósticos.
Lesiones hipoecoicas. Una lesión hipoecoica en esta capa puede corresponder a un páncreas ectópico o aberrante. Usualmente estas lesiones son heterogéneas y ocasionalmente puede uno observar una estructura ductal anecoica en el centro, que puede corresponder a un conducto; en la endoscopia podemos observar una lesión umbilicada en el antro. También podemos encontrar lesiones hipoecoicas que corresponden a tumores carcinoides, usualmente la lesión se extiende hacia la mucosa.
Los linfomas gástricos también se pueden presentar como lesiones hipo o hiperecoicas que depende de la submucosa; otras lesiones menos frecuentes que son hipoecoicas y que dependen de la 3ª capa son: tumor de células granulares, neurofibromas y metástasis.
Lesiones anecoicas. Cuando observamos lesiones anecoicas en esta capa debemos pensar en estructuras vasculares o quistes; una forma de diferenciarlos es que con el movimiento del equipo los vasos se vuelven de forma tubular y los quistes tienden a aparecer y desaparecer. Otra forma es cuando existe eco Doppler activarlo para evaluar si hay flujo. Los quistes que se observan dentro de la pared del tracto gastrointestinal son generalmente benignos y pueden ser quistes de inclusión, duplicación o retención. Muy raramente se han descrito quistes gástricos malignos.
Ecocapa cuatro. Esta capa corresponde a la muscular propia por lo cual la mayoría de tumores en ésta son de origen muscular (156).
Lesiones hipoecoicas. La mayoría de los tumores de esta capa son hipoecoicos y, de éstos, la mayoría son tumores estromales (GIST) si se ubican en el estómago, y leiomiomas si se ubican en el esófago. Otras lesiones que pueden tener esta apariencia son las metástasis (pulmón o seno) y el tumor del glomus. Los linfomas también pueden comprometer esta capa pero generalmente asociados al compromiso de las capas más superficiales.
Lesiones hiperecoicas. Son lesiones muy raras, pero puede corresponder a linfomas, tumores nuerogénicos o metástasis.
Precisión de la EE
Múltiples estudios han demostrado que la EE tiene una gran precisión para determinar si una lesión es de la pared o si está fuera de ella, y para establecer de qué capa de la pared proviene la lesión. Esta información permite hacer una aproximación diagnóstica. Un estudio determinó la capa de origen en 48 de 50 pacientes (96%) con correlación quirúrgica (157). El acuerdo interobservador es muy bueno, principalmente para identificación de lesiones como los leiomiomas y las lesiones vasculares. Es importante aclarar que la apariencia ecográfica de las lesiones no nos permite determinar su etiología con seguridad.
Dado que los criterios ecográficos pueden ser imprecisos, parece razonable que debemos, en lo posible, obtener un diagnóstico etiológico, lo cual se puede lograr con la punción con EE-PAAF, o con la resección mucosa de la lesión. Algunos estudios señalan que se puede obtener un diagnóstico tisular en 50-80% de los casos y la punción puede llegar a identificar lesiones malignas no sospechadas (158).
En resumen, si nos enfrentamos a una lesión subepitelial es mandatario realizar EE. Si la lesión es pequeña y depende de la ecocapa 1, 2 ó 3, se puede realizar una resección mucosa la cual es diagnóstica y terapéutica. Pero si la lesión es grande es ideal hacer una punción guiada por ecografía endoscópica. Si se establece que se trata de una lesión benigna sugiero que puede realizarse un control a los 6 meses y si no ha crecido no necesitaría más control pero si ha crecido o se trata de una lesión maligna se dará tratamiento.
T
Trombosis de la porta
A través de la ecoendoscopia radial o lineal podemos valorar los grandes vasos del abdomen, arteriales y venosos; se puede evaluar toda la vena esplénica y la vena mesentérica superior hasta donde se unen para formar la vena porta, la cual se puede evaluar casi en su totalidad, unido a que con los equipos lineales podemos tener efecto Doppler se puede evaluar el flujo de estos vasos lo cual nos permite saber si hay obstrucciones en algunos de sus segmentos; de allí que se haya utilizado para la evaluación de la trombosis portal. En un estudio se encontró que la sensibilidad de la EE para trombosis de la porta fue de 81% y la especificidad de 91% con una precisión de 89% (159).
V
Vesícula biliar
Aunque el examen de elección para evaluar la vesícula biliar es la ecografía abdominal, la EE, al poder colocar el transductor más cerca de este órgano, puede evitar las interferencias de la pared abdominal o el gas intestinal. Se han publicado algunos estudios sobre la utilidad en esta indicación especialmente en la valoración de los pólipos vesiculares donde hay incluso una clasificación que permite diferenciar su potencial maligno (160). (Figura 35) Por ello, actualmente este es el examen de elección cuando se sospecha un pólipo de la vesícula biliar o un carcinoma. Se ha diseñado una clasificación endosonográfica, que permite correlacionar la invasión histológica en profundidad y el estadio T. Los autores de este estudio concluyen que la EE es un examen que, de una manera precisa, puede establecer el estadio T en el cáncer de vesícula y permite tomar decisiones terapéuticas efectivas (161).
Figura 35. Se observa un pólipo en la luz de la vesícula el cual no infiltra las paredes de la vesícula, corresponde a un tipo A. (Tomado de la referencia 161).
W
Wirsung: Valoración
Aunque nunca se indica un examen para sólo valorar el conducto pancreático principal. La EE permite seguir este conducto desde la cabeza hasta la cola y evaluar o descartar la existencia de páncreas divisum (162), en el cual el Wirsung desemboca a la papila menor. Así mismo, también puede descartar si hay estenosis, dilataciones o tumores, o hallazgos que sugiriera pancreatitis crónica. Este conducto no debe medir más de 3mm en la cabeza, 2mm en el cuerpo o 1mm en la cola.
X
Búsqueda de tumores no establecidos
Existen situaciones donde nos enfrentamos a pacientes con múltiples adenopatías tumorales o metastásicas, pero no encontramos el tumor primario. La EE nos puede ayudar a valorar zonas que son muy poco abordables por otros métodos como el mediastino o el retroperitoneo y si la lesión está al alcance de la aguja de punción podemos obtener una muestra.
Z
Zollinger-Ellison
Este síndrome se caracteriza por la secreción no controlada de gastrina, hipersecreción de ácido y enfermedad ulceropéptica severa, ocasionado por un tumor productor de gastrina. La mayoría de casos están en la cabeza del páncreas o en la región duodenal adyacente a ésta; usualmente son tumores pequeños difícilmente evaluables.
La EE, al valorar estrechamente el páncreas, permite detectar estos tumores incluso menores a un cm (163). Éstos hacen parte de los llamados tumores neuroendocrinos, (figura 36) dentro de los cuales también están los insulinomas, vipomas, etc., que también pueden ser valorados por EE. Además de permitir tomar biopsias guiadas por eco, puede diferenciar cada uno de estos tumores. En un estudio publicado recientemente (164) se evaluaron 33 pacientes con lesiones peri o pancreáticas las cuales posteriormente fueron resecadas. La EE con punción detectó 32 de las 33 lesiones (96,9%) de los cuales 16 fueron tumores neuroendocrinos funcionales, 7 no funcionales y 5 ganglios peripancreáticos. La sensibilidad, especificidad, valor predictivo positivo, negativo y precisión del examen fue respectivamente: 82,6%, 85,7%, 95%, 60%, y 83,3%. Los autores concluyeron que la EE con punción es precisa y segura para el diagnóstico de tumores pancreáticos neuroendocrinos y puede guiar las estrategias de manejo.
Figura 36. En el centro de la foto se observa una lesión hipoecoica que está ubicada en el cuerpo del páncreas la cual es compatible con un tumor neuroendocrino. (Tomado de referencia 164)
En conclusión, las indicaciones de la ecoendoscopia son muy amplias, unas más respaldadas por la literatura que otras, pero ya es un examen de rutina en muchos centros de gastroenterología del mundo. La tendencia actual es pasar de la ecoendoscopia diagnóstica a la terapéutica; en el reciente congreso de la American Gastroenterology Asociation (AGA-2005) pudimos observar múltiples trabajos en los cuales la EE se utiliza para guiar cirugías mínimamente invasivas, para la toma de biopsias a todos los niveles, para la aplicación de terapias biológicas e incluso, se está hablando sobre la aplicación que podría tener para tratamientos cardiovasculares lo cual nos indica que las potencialidades de este examen son impresionantes y los gastroenterólogos debemos familiarizarnos más con sus indicaciones y posibles aplicaciones terapéuticas. Esperamos que esta revisión concisa haya contribuido a un mejor conocimiento del procedimiento.
Favor enviar correspondencia al Dr. Martín Gómez, espolon@tutopia.com
Referencias
1. Armengol JR, Benjamin S, Binmoeller K, et al. Consensus Conference. Clinical applications of endoscopic ultrasonography in gastroenterology: state of the art 1993. Endoscopy 1993; 25: 358-66. [ Links ]
2. Rösch T, Classen M. Gastroenterologic endosonography. Textbook and Atlas. Stuttgart: Thieme; 1992. [ Links ]
3. Nick N, Behling C, McClave S, et al. Specific EUS features can identify hypoechoic masses which are not benign stromal cell tumors. Gastrointest Endosc 1999; 49: A609. [ Links ]
4. Rösch T, Kapfer B, Will U, et al. Influence of endoscopic ultrasound (EUS) on the management of upper GI submucosal lesions: a prospective study in 150 patients. Gastrointest Endosc 1999; 49: A613. [ Links ]
5. Binmoeller KF, Thul R, Rathod V.EUS-guided fine needle aspiration biopsy using an 18G needle. Gastrointest Endosc 1997; 45: AB168. [ Links ]
6. Wiersema MJ, Vilmann P, Giovannini M, Chang KJ, Wiersema LM. Endosonography-guided fine-needle aspiration biopsy: diagnostic accuracy and complication assessment. Gastroenterology 1997; 112: 1087-95. [ Links ]
7. Kanemaki N, Nakazawa S, Inui K, Yoshino J, Yamao K, Okushima K. Three-dimensional intraductal ultrasonography: preliminary results of a new technique for the diagnosis of diseases of the pancreatobiliary system. Endoscopy 1997; 29: 726-31. [ Links ]
8. Menzel J, Foerster EC, Ubrig B, Keller R, Kerber S, Domschke W. Ex vivo examination of the pancreas by intraductal ultrasonography (IDUS). Endoscopy 1993; 25: 571-6. [ Links ]
9. Lazzaroni M, Bianco-Porro G. Premedication, preparation and surveillance [review]. Endoscopy 1999; 31: 2-8. [ Links ]
10. Van Dam J. Endosconographic evaluation of the patient with achalasia. Endoscopy 1998; 30 (Suppl 1): A48-50. [ Links ]
11. Posat P, Chaussade S, Palazzo L, et al. Endoscopic ultrasonography in achalasia. Gastroenterology 1990; 98: 253. [ Links ]
12. Brugge W, Endoscopic ultrasonography: The current status. Gastroenterology 1998; 115: 1577-83. [ Links ]
13. Hawes RH. Indications for EUS-Directed FNA. Endoscopy 1998; A155-6. [ Links ]
14. Scotiniotis IA, Kochman ML, Lewis JD, Furth EE, Rosato EF, Ginsberg GG. Accuracy of EUS in the evaluation of Barrett’s esophagus and high-grade dysplasia or intramucosal carcinoma. Gastrointest Endosc 2001; 54: 689-96. [ Links ]
15. Parent J, Levine DS, Haggitt RC, Wood DE, Reid BJ, Kimmey MB. Accuracy of endoscopic ultrasound staging in patients with Barrett’s esophagus and intramucosal carcinoma [abstract]. Gastrointest Endosc 1997; 45: AB76.
16. Botet JF, Lightdale CJ, Zauber AG, Gerdes H, Urmacher C, Brennan MF. Preoperative staging of esophageal cancer: comparison of endoscopic US and dynamic CT. Radiology 1991; 181: 419-25. [ Links ]
17. Sobin LH, Hermanek P, Hutter RP. TNM classification of malignant tumors. Cancer 1988; 61: 2310-4. [ Links ]
18. Kimmey MB, Martin RW, Haggit RC, Wang KY, Franklin KW, Silverstein FE. Histologic correlates with gastrointestinal ultrasound images. Gastroenterology 1989; 96: 433-41. [ Links ]
19. Van Dam J. Endosonography of the esophagus. Gastrointest Endosc Clin N Am 1994; 4: 803-826. [ Links ]
20. Lightdale CJ, Botet JF, Kelsen DP, Turnbull AD, Brennan MF, et al. Diagnosis of recurrent upper gastrointestinal cancer at the surgical anastomosis by endoscopic ultrasound. Gastrointest Endosc 1989; 35: 407-12. [ Links ]
21. Elizalde JJ, Piñol V. Papel de la ultrasonografía endoscópica en las estrategias diagnóstico-terapéuticas en oncología digestiva. Gastroenterolol Hepatolol 2002; 25: 60-69. [ Links ]
22. Walsh TN, Noonan N, Hollywood D, Kelly A, Keeling N, Hennessy TPJ. A comparison of multimodal therapy and surgery for esophageal adenocarcinoma. N Engl J Med 1996; 335: 462-7. [ Links ]
23. Botet JF, Lightdale CJ, Zauber AG, Gerdes H, Urmacher C,Brennan MF. Preoperative staging of esophageal cancer: comparison of endoscopic US and dynamic CT. Radiology 1991; 181: 419-425. [ Links ]
24. Ziegler K, Sanft C, Zeitz M, Friedrich M, Stein H, Haring R, Riecken EO. Evaluation of endosonography in TN staging of oesophageal cancer. Gut 1991; 32: 16-320. [ Links ]
25. Giovannini M, Monges G, Seitz JF, et al. Distant lymph node metastases in esophageal cancer: Impact of endoscopic ultrasound-guided biopsy. Endoscopy 1999; 31: 536-40. [ Links ]
26. Gómez M. Características epidemiológicas del cáncer gástrico. Act Med Col 1998; 23(supl): 229. [ Links ]
27. Siewert JR, Fink U, Sendler A, Becker K, Bottcher K, Feldmann HJ, et al. Gastric cancer. Curr Probl Surg 1997; 34: 835-942. [ Links ]
28. Botet JF, Lightdale CJ, Zauber AG, Gerdes H, Winaver SJ, Urmacher C, et al. Preoperative staging of gastric cancer: comparison of endoscopic US and dynamic CT. Radiology 1991; 181: 426-32. [ Links ]
29. Akahoshi K, Misawa T, Fujishima H, Chijiiwa Y, Maruoka A, Ohkubo A, et al. Preoperative evaluation of gastric cancer by endoscopic ultrasound. Gut 1991; 32: 479-82. [ Links ]
30. Caletti G, Ferrari A, Brocchi E, Barbara L. Accuracy of endoscopic ultrasonography in the diagnosis and staging of gastric cancer and lymphoma. Surgery 1993; 113: 14–27. [ Links ]
31. Grimm H, Hamper K, Maydeo A, Maas R, Noar M, Soehendra N. Accuracy of endoscopic ultrasound and computed tomography in determining local/regional spread in gastric cancer: results of a prospective controlled study. Gastrointest Endosc 1991; 37: 229. [ Links ]
32. Akahoshi K, Chijiiwa Y, Sasaki I, Hamada S, Iwakiri Y, Nawata H, et al. Pre-operative TN staging of gastric cancer using a 15 mHz ultrasound probe. Br J Radiol 1997; 70: 703-7. [ Links ]
33. Takemoto T, Yanai H, Tada M, Aibe T, Fujimura H, Murata Y, et al. Applications of ultrasonic probes to endoscopic resection of early gastric cancer. Endoscopy 1992; 24: 329-33. [ Links ]
34. Andriulli A, Recchia S, de Angelis C. Endoscopic ultrasonography evaluation of patients with biopsy negative gastric linitis plastic. Gastrointest Endosc 1990; 36: 611-5. [ Links ]
35. Taal BG, den Hartog Jager FCA, Steinmetz R, Peterse H. The spectrum of gastrointestinal metastases of breast carcinoma: I. Stomach. Gastrointest Endosc 1992; 38: 130-5. [ Links ]
36. Beynon J, McMortensen NJ, Foy DMA, Channer JL, Rigby H, Virjee J. Preoperative assessment of mesorectal lymph node involvement in rectal cancer. Br J Surg 1989; 76: 276-9. [ Links ]
37. Hildebrandt U, Feifel G. Preoperative staging of rectal cancer by intrarectal ultrasound. Dis Colon Rectum 1985; 28: 42-6. [ Links ]
38. Catalano MF. Indications for endoscopic ultrasonography in colorectal lesions. Endoscopy 1998; 30 (Suppl 1): A79-84. [ Links ]
39. Beynon J, McMortensen NJ, Rigby HS. Rectal endosonography, a new technique for the preoperative staging of rectal carcinoma. Eur J Surg Oncol 1988; 14: 297-309. [ Links ]
40. Glaser F, Schlag P, Herfarth C. Endorectal ultrasonography for the assessment of the invasion of rectal tumors and lymph node involvement. Br J Surg 1990; 77: 883-7. [ Links ]
41. Goldman S, Arvidsson H, Norming U, Lagerstedt U, Magnuson I, Frisell J. Transrectal ultrasound and computed tomography in the preoperative staging of lower rectal adenocarcinoma. Gastrointest Radiol 1991; 16: 259-63. [ Links ]
42. Rifkin MD, Ehrlich SM, Marks G. Staging of rectal carcinoma: prospective comparison of endorectal
43. Heintz A, Bluess G, Frank K, Kreitner K, Junginger JH. Endoluminal sonography in follow-up of rectal carcinoma. Surg Endosc 1989; 3: 199-202 [ Links ]
44. Maier AG, Barton PP, Neuhold NR, Herbst F, Teleky BK, Lechner GL. Peritumoral tissue reaction at transrectal US as a possible cause of overstaging in rectal cancer: histopathologic correlation. Radiology 1997; 203: 785-9. [ Links ]
45. Napoleon B, Pujol B, Berger F, Valette PJ, Gerard JP, Souquet JC. Accuracy of endosonography in the staging of rectal cancer treated by radiotherapy. Br J Surg 1991; 78: 785-8. [ Links ]
46. Fleshman JW, Myerson RJ, Fryer R, Kodner IJ. Accuracy of transrectal ultrasound in predicting pathologic stage of rectal cancer before and after preoperative radiation therapy. Dis Colon Rectum 1992; 35: 823-9. [ Links ]
47. Romano G, de Rosa P, Vallone G, Rotondo A, Grassi R, Santangelo ML. Intrarectal ultrasound and computed tomography in the pre- and postoperative assessment of patients with rectal cancer. Br J Surg 1985; 72(Supl): 117-9. [ Links ]
48. Beynon J, McMortensen NJ, Goy DMA, Channer JL, Rigby H, Virjee J. The detection and evaluation of locally recurrent rectal cancer endosonography. Dis Colon Rectum 1989; 32: 509-17. [ Links ]
49. Harada N, Hamada S, Kubo H, Oda S, Chijiiwa Y, Kabemura T, et al. Preoperative evaluation of submucosal invasive colorectal cancer using a 15-MHz ultrasound miniprobe. Endoscopy 2001; 33: 237-40. [ Links ]
50. Soetikno RM, Chang K. Endoscopic ultrasound-guided diagnosis and therapy in pancreatic disease. Gastrointes Endosc Clin N Am 1998; 8(1): 237-247. [ Links ]
51. Muller MF, Meyenberger C, Bertschinger P, Schaer R, Marincek B. Pancreatic tumors: evaluation with endoscopic US, CT and MR imaging. Radiology 1994; 190: 745-51. [ Links ]
52. Warshaw AL, Fernández del Castillo C. Pancreatic carcinoma. N Engl J Med 1992; 326: 455-65. [ Links ]
53. Rösch T, Braig C, Gain T, Fenerbach S, Siewert JR, Schusdziarra V, et al. Staging of pancreatic and ampullary carcinoma by endoscopic ultrasonography. Gastroenterology 1992; 102: 188-99. [ Links ]
54. Suits J, Frazee R, Erikson RS. Endoscopic ultrasound and fine needle aspiration for the evaluation of pancreatic masses. Arch Surg 1999; 134: 639-43. [ Links ]
55. Chang KY, Nguyen P, Erikson RA, Durbin TE, Katz KD. The clinical utility of endoscopic ultrasound-guided fine-needle aspiration in the diagnosis and staging of pancreatic carcinoma. Gastrointest Endosc 1997; 45: 387-93. [ Links ]
56. Legmann P, Vignaux O, Dousset B, Baraza AJ, Palazzo L, Dumontier I, Coste J, Louvel A, Roseau G, Couturier D, Bonnin A. Pancreatic tumors: comparison of dual-phase helical CT and endoscopic sonography. AJR Am J Roentgenol 1998; 170: 1315-1322. [ Links ]
57. Brennan MF, Kinsella TJ, Casper ES. Cancer of the pancreas. En DeVita VT, Hellman S, Rosenberg SA, editors. Cancer: principles and practice oncology. 4th ed. Philadelphia: JB Lippincott, 1993; 849-82. [ Links ]
58. Fondevila C, Cubiella J, Sans M, Sabater L, Ayuso C, Castells A, et al. Utilidad de la ultrasonografía y la tomografía computarizada en la predicción de la resecabilidad del carcinoma de páncreas. Med Clin (Barc) 1998; 111: 604-47. [ Links ]
59. Muller MF, Meyenberger C, Bertschinger P, Schaer R, Marincek B. Pancreatic tumors: evaluation with endoscopic US, CT, and MR imaging. Radiology 1994; 190: 745-751. [ Links ]
60. Soriano A, Ayuso MC, Ayuso JR, De Caralt MT, Gilabert R, Ginès MA, et al. Preoperative staging and tumor resectability assessment in pancreatic cancer. Prospective study comparing endoscopic ultrasonography, compute tomography, ma-gnetic resonance imaging and angiography. Gastroenterology 2001; 120: A760. [ Links ]
61. Alter CL. Palliative and supportive care of patients with pancreatic cancer. Sem Oncol 1996; 23: 229-40. [ Links ]
62. Wiersema MJ, Wiersema LM. Endosonographically-guided celiac plexus neurolysis.Gastrointest Endosc 1996; 44: 656-62. [ Links ]
63. Jemal A, Thomas A, Murray T, Thun M. Cancer statistics, 2002. CA Cancer J Clin 2002; 52: 23-47. [ Links ]
64. Mountain CF, Dresler CM. Regional lymph node classification for lung cancer staging. Chest 1997; 111: 1718-23. [ Links ]
65. McKenna RJ Jr, Libshitz HI, Mountain CE, McMurtrey MJ. Roentgenographic evaluation of mediastinal nodes for preoperative assessment in lung cancer. Chest 1985; 88: 206-10. [ Links ]
66. Bhutani MS, Hawes RH, Hoffman BJ. A comparison of the accuracy of echo features during endoscopic ultrasound (EUS) and EUS-guided fine-needle aspiration for diagnosis of malignant lymph node invasion. Gastrointest Endosc 1997; 45(6): 474-479. [ Links ]
67. Vansteenkiste JF, Mortelmans LA. FDG-PET in the locoregional lymph node staging of non-small cell lung cancer. A comprehensive review of the Leuven Lung Cancer Group experience. Clin Pos Imaging 1999; 2: 223-31. [ Links ]
68. Toloza EM, Harpole L, Detterbeck F, McCrory DC. Invasive staging of nonsmall cell lung cancer: a review of the current evidence. Chest 2003; 123(Suppl 1): 157S-66S. [ Links ]
69. Harrow EM, Abi-Saleh W, Blum J, Harkin T, Gasparini S, Addrizzo-Harris DJ, et al. The utility of transbronchial needle aspiration in the staging of bronchogenic carcinoma. Am J Respir Crit Care Med 2000; 161: 601-7. [ Links ]
70. Silvestri GA, Hoffman BJ, Bhutani MS, Hawes RH, Coppage L, Sanders-Cliette A, et al. Endoscopic ultrasound with fine needle aspiration in the diagnosis and staging of lung cancer. Ann Thorac Surg 1996; 61: 1441-6. [ Links ]
71. Aabakken L, Silvestri GA, Hawes R, Reed CE, Marsi V, Hoffman B. Cost-efficacy of endoscopic ultrasonography with fine-needle aspiration vs. mediastinotomy in patients with lung cancer and suspected mediastinal adenopathy. Endoscopy 1999; 31: 707-711. [ Links ]
72. Gress FG, Savides TJ, Sandler A, Kesler K, Conces D, Cummings O, et al. Endoscopic ultrasonography, fine-needle aspiration biopsy guided by endoscopic ultrasonography, and computed tomography in the preoperative staging of non small-cell lung cancer: a comparison study. Ann Intern Med 1997; 127: 604-12. [ Links ]
73. International workshop on the clinical impact of endoscopic ultrasound in Gastroenterology. Working Party Report. Endoscopy 2000; 32: 549-84. [ Links ]
74. Ugiyama M, Atomi Y. Acute biliary pancreatitis: the roles of endoscopic ultrasonography and endoscopic retrograde cholangiopancreatography. Surgery 1998; 124: 14-21. [ Links ]
75. Canto MI, Chak A, Stellato T, Sivak MV Jr. Endoscopic ultrasonography versus cholangiography for the diagnosis of choledocholithiasis. Gastrointest Endosc Clin N Am 1998; 47: 439-48. [ Links ]
76. Tamada K, Inui K, Menzel J. Intraductal ultrasonography of the bile duct system. Endoscopy 2001; 33: 878-85. [ Links ]
77. Erickson RA, Chavez A. EUS versus ERCP for choledocolithiasis, how much additional information is provided by EUS [abstract]. Endoscopy 2000; 32: A38.
78. De Ledinghen V, Lecesne R, Raymond JM, Gense V, Amouretti M, Drouillard J, et al. Diagnosis of choledocolithiasis: EUS or magnetic resonance cholangiography? A prospective controlled study. Gastrointest Endosc 1999; 49: 26-31. [ Links ]
79. Prat F, Amouyal G, Amouyal P, Pelletier G, Fritsch J, Choury AD, et al. Prospective controlled study of EUS and ERC in patients with suspected common bile duct lithiasis. Lancet 1996; 347: 75-9. [ Links ]
80. Palazzo L, Girollet PP, Salmeron M, Silvain C, Roseau G, Canard JM, et al. Value of endoscopic ultrasonography in the diagnosis of common bile duct stones: comparison with surgical exploration and ERCP. Gastrointest Endosc 1995; 42: 225-31. [ Links ]
81. Erickson RA, Chang KJ. ERCP, EUS+ERCP or MRCP+ERCP prior to laparoscopic cholecystectomy: a cost-benefit analysis [abstract]. Gastrointest Endosc 1996; 43: 311.
82. Materne R, Van Beers BE, Gigot JF, Jamart J, Geubel A, Pringot J, et al. Extrahepatic biliary obstruction: magnetic resonance imaging compared with endoscopic ultrasonography. Endoscopy 2000; 32: 3-9. [ Links ]
83. Napoléon B, Keriven-Souquet O, Pujol B, Souquet JC, Ponchon T. Does normal endoscopic ultrasound really avoid ERCP in patients with suspicion of common bile duct stone? Study in 238 patients [abstract]. Gastrointest Endosc 1996; 43: 426.
84. Canto MI, Chak A, Stellato T, Sivak MV. Endoscopic ultrasonography versus cholangiography for the diagnosis of choledocolithiasis. Gastrointest Endosc 1998; 47: 439-48. [ Links ]
85. Liu CL, Lo CM, Chan JKF, Poon RTP, Fan ST. EUS for detection of occult cholelithiasis in patients with idiopathic pancreatitis. Gastrointest Endosc 2000; 51: 28-32. [ Links ]
86. Chak A, Hawes RH, Cooper GS, Hoffman B, Catalano MF, Wong RC, et al. Prospective assessment of the utility of EUS in the evaluation of gallstones pancreatitis. Gastrointest Endosc 1999; 49: 599-604. [ Links ]
87. Arbeláez V, Pineda L, Gonzáles R, Gómez M. Papilotomía endoscópica intraoperatoria durante colecistectomía en el tratamiento de la colecistocoledocolitiasis. Rev Col Gastroenterol 2002; 17: 184-189. [ Links ]
88. Mark DH, Flamm CR, Aronson N. Evidence-based assessment of diagnostic modalities for common bile duct stones. Gastrointest Endosc 2002; 56(6 Suppl 2): S190-S194. [ Links ]
89.Wright BE, Freeman ML, Cumming JK, Quickel RR, Mandal AK. Current management of common bile duct stones: is there a role for laparoscopic cholecystectomy plus intraoperative ERCP as a single-stage procedure? Surgery 2002; 132: 729-735. [ Links ]
90. Baillie J. Treatment of acute biliary pancreatitis. N Engl J Med 1997; 336: 286-287. [ Links ]
91. Kahaleh M, Yoshida C. Interventional EUS cholangiography: a report of five cases. Gastrointest Endosc 2004; 60: 138-141. [ Links ]
92. Kahaleh M, Yoshida C. EUS drainage of a mediastinal abscess. Gastrointest Endosc 2005; 60: 158-159. [ Links ]
93. Seewald S, Brand B, Omar S, Yasuda I. EUS-guided drainage of subphrenic abscess. Gastrointest Endosc 2004; 59: 178-180. [ Links ]
94. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35. [ Links ]
95. Rösch T, Classen M. Gastroenterologic Endosonograpy. New York: Thieme Stuttgart; 1992. [ Links ]
96. Sultan AH, Kamm MA, Hudson CN, Nicholls JR, Bartram CI. Endosonography of the anal sphincters: normal anatomy and comparison with. Clin Radiol 1994; 49: 368-74. [ Links ]
97. Frudinger A, Bartram CI, Halligan S, Kamm M. Examination techniques for endosonography of the anal canal. Abdominal Imaging 1998; 23: 301-3. [ Links ]
98. Law PJ, Talbot RW, Bartram CI, Northover JM. Anal endosonography in the evaluation of perianal sepsis and fistula in ano. Br J Surg 1989; 76: 752-5. [ Links ]
99. Schwartz DA, Wiersema MJ, Dudiak KM, Fletcher JG, Clain JE, Tremaine WJ, et al. A comparison of endoscopic ultrasound, magnetic resonance imaging, and exam under anesthesia for evaluation of Crohn’s perianal fistulas. Gastroenterology 2001; 121: 1064-72. [ Links ]
100. Schratter-Sehn AU, Lochs H, Vogelsang H, Schurawitzki H, Herold C, Schratter M. Endoscopic ultrasonography versus computed tomography in the differential diagnosis of perianorectal complications in Crohn’s disease. Endoscopy 1993; 25: 582-6. [ Links ]
101. Orsoni P, Barthet M, Portier F, Panuel M, Desjeux A, Grimaud JC. Prospective comparison of endosonography, magnetic resonance imaging and surgical findings in anorectal fistula and abscess complicating Crohn’s disease. Br J Surg 1999; 86: 360-4. [ Links ]
102. Hussain SM, Stoker J, Schouten WR, Hop WC, Lameris JS. Fistula in ano: endoanal sonography versus endoanal MR imaging in classification. Radiology 1996; 200: 475-81. [ Links ]
103. Eloubeidi M, Seewald S, Tamhane A. EUS-guided FNA of the left adrenal gland in patients with thoracic or GI malignancies. Gastrointest Endosc 2004; 59: 627-33. [ Links ]
104. Miettinen M, Majidi M, Lasota J. Pathology and diagnostic criteria of gastrointestinalstromal tumors (GISTs): A review. Eur J Cancer 2002; 38(suppl5): S39-S51. [ Links ]
105. Greenson JK. Gastrointestinal stromal tumors and other mesenchymal lesions of the gut. Mod Pathol 2003, 16: 366-375. [ Links ]
106. Rossi CR, Mocelin S, Mencarelli R, et al.: Gastrointestinal stromal tumors: From a surgical to a molecular approach. Int J Cancer 2003; 107: 171-176. [ Links ]
107. Joensuu H, Fletcher C, Dimitrijevic S, et al.: Management of malignant gastrointestinal stromal tumours. Lancet Oncol 2002; 3: 655-664. [ Links ]
108. Davila RE, Faigel DO. GI stromal tumors. Gastrointest Endosc 2003; 58: 80-88. [ Links ]
109. Rösch T. Endoscopic ultrasonography in upper gastrointestinal Submucosal tumours: a literature review. Gastrointest Endosc Clin North Am 1995; 5: 609-14. [ Links ]
110. Roberts PJ, Eisenberg B. Clinical presentation of gastrointestinal stromal tumors and treatment of operable disease. Eur J Cancer 2002; 38(suppl5): S37-S38. [ Links ]
111. Yamada Y, Kida M, Sakaguchi. A study on myogenic tumors of the upper gastrointestinal tract by endoscopic ultrasonography with special reference to the differential diagnosis of benign and malignant lesions. Dig Endosc 1992; 4: 396-408. [ Links ]
112. Yan H, Marchettini P, Acherman YI, et al. Prognostic assessment of gastrointestinal stromal tumor. Am J Clin Oncol 2003; 26: 221-228. [ Links ]
113. Trupiano JK, Stewart RE, Misick C, Appleman HD, Goldblum JR. Gastric stromal tumors. A clinicopathologic study of 77 cases with correlation of features with nonagressive and aggressive clinical behaviors. Am J Surg Pathol 2002; 26: 705-714. [ Links ]
114. Prasad P, Schmulewitz N, Patel a. Detection of occult liver metastases during EUS for staging of malignancies. Gastrointest Endosc 2004; 59: 49-53. [ Links ]
115. Law PJ, Kamm MA, Bartram CI. A comparison between lectromyography and anal endosonography in mapping. Dis Colon Rectum 1990; 33: 370-3. [ Links ]
116. Law PJ,Kamm MA, Bartram CI. Anal endosonography in the investigation of fecal incontinence. Br J Surg 1991; 78: 312-4. [ Links ]
117. Eckardt VF, Jung B, Fischer B, Lierse W. Anal endosonography in healthy subjects and patients with idiopathic fecal incontinence. Dis Colon Rectum 1994; 37: 235-42. [ Links ]
118. Karoui S, Savoye-Collet C, Koning E, Leroi AM, Denis P. Prevalence of anal sphincter defects revealed by sonography in 335 incontinent patients and 115 continent patients. AJR Am J Roentgenol 1999; 173: 389-92. [ Links ]
119. Rieger NA, Sweeney JL, Hoffmann DC, Young JF, Hunter A. Investigation of fecal incontinence with endoanal ultrasound. Dis Colon Rectum 1996; 39: 860-4. [ Links ]
120. Damon H, Henry L, Valette PJ, Mion F. Incidence of sphincter ruptures in anal incontinence: ultrasound study [in French with English abstract]. Annales de Chirurgie 2000; 125: 643-7. [ Links ]
121. Meyenberger C, Bertschinger P, Zala GF, Buchmann P. Anal sphincter defects in fecal incontinence: correlation between endosonography and surgery. Endoscopy 1996; 28: 217-24. [ Links ]
122. Malouf AJ,Williams AB, Halligan S, Bartram CI, Dhillon S, Kamm MA. Prospective assessment of accuracy of endoanal MR imaging and endosonography in patients with fecal incontinence. AJR Am J Roentgenol 2000; 175: 741-5. [ Links ]
123. Deen K, Kumar D, Williams J, Olliff J, Keighley M. Anal sphincter defects. Correlation between endoanal ultrasound and surgery. Ann Surg 1993; 218: 201-5. [ Links ]
124. Ternent CA, Shashidharan M, Blatchford GJ, Christensen MA, Thorson AG, Sentovich SM. Transanal ultrasound and anorectal physiology findings affecting continence after sphincteroplasty. Dis Colon Rectum 1997; 40: 462-7. [ Links ]
125. Wiersema MJ, Sandusky D, Carr R, Wiersema LM, Erdel WC, Frederick PK. Endosonography-guided cholangiopancreatography. Gastrointest Endosc 1996; 43: 102-6. [ Links ]
126 Fictcher-Ravens A, Broering D. USE-guide fine-needle aspiration of suspected hiliar cholangiocarciona. Am J Gastro 2003; 59: 45-51. [ Links ]
127. Isaacson PG. Mucosa-associated lymphoid tissue lymphoma. Semin Hematol 1999; 36: 139-47. [ Links ]
128. Crump M, Gospodarowicz M, Shapherd FA. Lymphoma of the gastrointestinal tract. Semin Oncol 1999; 126: 324-37. [ Links ]
129. Hussel T, Isaacson PG, Crabtree JE, Spencer J. Helicobacter pylori-specific tumour-infiltrating T cells provide contact dependent help for the growth of malignant B-cells in low grade gastric lymphoma of mucosa-associated lymphoid tissue. J Pathol 1996; 178: 122-7. [ Links ]
130. Caletti G, Ferrari A, Brocchi E, Barbara L. Accuracy of endoscopio ultrasonography in the diagnosis and staging of gastric cancer and lymphoma. Surgery 1993; 113: 14-27. [ Links ]
131. Nagashima R, Takeda H, Maeda K, Ohno S, Takahashi T. Regression of duodenal mucosa-associated lymphoid tissue lymphoma after eradication of Helicobacter pylori. Gastroenterology 1996; 111: 1674-8. [ Links ]
132. Devereaux BM, Leblanc JK, Yousif E, Kesler K, Brooks J, Mathur P, et al. Clinical utility of EUS-guided fine-needle aspiration of mediastinal masses in the absence of known pulmonary malignancy. Gastrointest Endosc 2002; 56: 397-401. [ Links ]
133. Gress F, Schmitt C, Sherman S, et al. A prospective randomized comparison of endoscopic ultrasound- and computed tomography-guided celiac plexus block for managing chronic pancreatitis pain. Am J Gastroenterol 1999; 94: 900-5. [ Links ]
134. Wiersema MJ, Wiersema LM. Endosonography-guided celiac plexus neurolysis. Gastrointest Endosc 1996; 44: 656-662. [ Links ]
135. Gunaratnam NT, Sarma AV, Norton ID, et al. A prospective study of EUS-guided celiac plexus neurolysis for pancreatic cancer pain. Gastrointest Endosc 2001; 54: 316-24. [ Links ]
136. Harada N, Wiersema MJ, Wiersema LM. Endosonographyguided celiac plexus neurolysis. Gastrointest Endosc Clin N Am 1997; 7: 237-245. [ Links ]
137. Chang KJ, Nguyen PT, Thompson JA, et al. Phase I clinical trial of local immunotherapy (cytoimplant) delivered by endoscopic ultrasound (EUS)-guided fine needle injection (FNI) in patients with advanced pancreatic carcinoma. Gastrointest Endosc 1998; 47: A480. [ Links ]
138. Goldberg SN, Mallery S, Gazelle GS, Brugge WR. EUS-guided radiofrequency ablation in the pancreas: results in a porcine model. Gastrointest Endosc 1999; 50: 392-401. [ Links ]
139. Fritscher-Ravens A, Mosse A, Mukherjee D. Transgastric gastropexy and hiatal hernia repair for GERD under EUS control: a porcine model. . Gastrointest Endosc 2004; 59: 89-95. [ Links ]
140. Hoffman BJ, Knapple WL, Bhutani MS, Verne GN, Hawes RH. Treatment of achalasia by injection of botulinum toxin under endoscopic ultrasound guidance. Gastrointest Endosc 1997; 45: 77-79. [ Links ]
141. Barclay RL, Perez-Miranda M, Giovannini M. EUS-guided treatment of solid hepatic metastasis. Gastrointest Endosc 2002; 55: 266-70. [ Links ]
142. Seidensticker F, Otto J, Lankisch PG. Recovery of the pancreas after acute pancreatitis is not necessarily complete. Int J Pancreatol 1995; 17: 225-229. [ Links ]
143. Liu CL, Lo CM, Chan JK, Poon RT, Lam CM, Fan ST, Wong J. Detection of choledocholithiasis by EUS in acute pancreatitis: a prospective evaluation in 100 consecutive patients. Gastrointest Endosc 2001; 54: 325-330. [ Links ]
144. Liu CL, Lo CM, Chan JK, Poon RT, Fan ST. EUS for detection of occult cholelithiasis in patients with idiopathic pancreatitis. Gastrointest Endosc 2000; 51: 28-32. [ Links ]
145. Bhutani MS. Endoscopic ultrasonography: changes of chronic pancreatitis in asymptomatic and symptomatic alcoholic patients. J Ultrasound Med 1999; 18; 455-62. [ Links ]
146. Lees WR. Endoscopic ultrasonography of chronic pancreatitis and pancreatic pseudocysts. Scand J Gastroenterol 1986; 123: 123-9. [ Links ]
147. Lees WR, Vallon AG, Denyer ME, Vahl SP, Cotton PB. Prospective study of ultrasonography in chronic pancreatic disease. BMJ 1979; 1: 162-4. [ Links ]
148. Wiersema MJ, Hawes RH, Lehman GA, Kochman ML, Sherman S, Kopecky KK. Prospective evaluation of endoscopicultrasonography and endoscopic retrograde cholangiopancreatography in patients with chronic abdominal pain of suspected pancreatic origin. Endoscopy 1993; 25: 555-64. [ Links ]
149. Adam IJ, Mohamdee MO, Martin IG, Scott N, Finan PJ, Johnston D, et al. Role of circumferential involvement in the local recurrence of rectal cancer. Lancet 1994; 344: 707-11. [ Links ]
150. Boyce GA, Sivak MV, Rösch T, Classen M, Fleischer D,Boyce HW, et al. Evaluation of submucosal upper gastrointestinaltract lesions by endoscopic ultrasound. Gastrointestinal Endosc1991; 37: 449-54. [ Links ]
151. Chak A, Canto MI, Rösch T, Dittler HJ, Hawes R, Tio TL, etal. Endosonographic differentation of benign and malignantstromal cell tumors. Gastrointestinal Endoscop 1997; 45: 468-73. [ Links ]
152. Catalano MF. Endoscopic ultrasonography in the diagnosis of submucosal tumors: need for biopsy. Endoscopy 1994; 26: 788. [ Links ]
153. Caletti G, Zani L, Bolondi L, Brocchi E, Rollo V, Barbara L. Endoscopic ultrasonography in the diagnosis of gastric submucosal tumor. Gastroint Endosc 1989; 35: 413-8. [ Links ]
154. Souquet JC, Bobichon R. Role of endoscopic ultrasound in the management of submucosal tumours in the esophagus and stomach. Acta Endoscop 1996; 26: 307-12. [ Links ]
155. Tio TL, Tytgat GN, den Hartog Jager FC. Endoscopic ultrasonography for the evaluation of smooth muscle tumors in the upper gastrointestinal tract: an experience with 42 cases. Gastrointest Endosc1990; 36: 342-50. [ Links ]
156. Fusaroli P, Caletti G. Endoscopic ultrasonography. Endoscopy 2003; 35: 127-35. [ Links ]
157. Mallery S. Submucosal tumors and thick gastric folds. ASGE 2002; 77-81. [ Links ]
158. Hunt GC, Rader A, Faigel DO. EUS features of CD-117 (C-KIT) positive gastrointestinal stromal tumors. Gastrointest Endosc 2002; 55: AB251. [ Links ]
159. Lai L, Brugge W. Endoscopic ultrasound is a sensitive and specific test to dianose portal venous system thombosis. A J Gastroenterol 2003: 99: 40-44. [ Links ]
160. Sugiyama M, Atomi Y, Kuroda A, Muto T,Wada N. Large cholesterol polyp of the gallbladder: diagnosis by means of US and endoscopic US. Radiology 1995; 196: 493-7. [ Links ]
161. Sadamoto Y, Kubo H. Preoperative diagnosis and staging of gallbladder. Gastrointest Endosc 2003; 58: 536-41. [ Links ]
162. Bank S, Indaram A. Causes of acute and recurrent pancreatitis. Clinical considerations and clues to diagnosis. Gastroenterol Clin North Am 1999; 28: 571-89. [ Links ]
163. Jensen RT, Norton JA. Pancreatic endocrine tumors. In: Feldman M, Scharschmidt BF, Sleisenger MH, editors. Sleisenger and Fordtran’s gastrointestinal and liver disease: pathophysiology-diagnosis-management. 7th ed. Philadelphia: WB Saunders 2002; 988-1016. [ Links ]
164. Ardengh JC, Andrade de Paulo G. EUS-guided FNA in the diagnosis of pancreatic neuroendocrine tumors before surgery. Gastrointest Endosc 2004; 60: 378-84. [ Links ]
Recibido: 01-05-2005 Aceptado: 08-06-2005