Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO  Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.20 n.4 Bogotá dic. 2005
Estudio multicéntrico de quimiorradioterapia pre y postoperatoria en estados II y III de cáncer de recto
Rodrigo Castaño Ll. MD,1 Juan D. Puerta D. MD,2 José I. Restrepo R. MD,3Mario H. Ruiz V. MD,4 Rubén D. Salazar C. MD,5 Deiser Suárez V. MD,6 Juan R. Márquez MD.7
Trabajo ganador del Premio Nacional de Coloproctología Ernesto Andrade Valderrama
Congreso de enfermedades digestivas, Cartegena, noviembre de 2005
(1) Cirugía Gastrointestinal y Endoscopia - Hospital Pablo Tobón Uribe, Profesor Universidad de Antioquia, Grupo de Gastrohepatología - Universidad de Antioquia
(2) Cirujano General y Coloproctólogo, Profesor Universidad Pontificia Bolivariana
(3) Cirujano General y Coloproctólogo, Profesor de Cirugía CES
(4) Cirugía General y Endoscopia, Grupo de Gastrohepatología - Hospital Pablo Tobón Uribe
(5) Médico Oncólogo - Hospital Pablo Tobón Uribe
(6) Médica Oncóloga - Hospital San Vicente de Paúl
(7) Cirujano General y Coloproctólogo, Profesor de Cirugía CES
Correspondencia: rcastanoll@epm.net.co
Fecha recibido: 25/09/05 - Fecha aceptado: 09/11/2005
RESUMEN
OBJETIVO. El tratamiento estándar para el cáncer de recto (CR) es la cirugía. Dado el alto índice de recaídas en los estados avanzados del CR, se pretende determinar si la quimiorradioterapia (QRT) neoadyuvante es mejor a la adyuvante en términos de período libre de enfermedad, sobrevida y morbimortalidad postoperatoria. Además, se compara este tratamiento con un grupo de pacientes con QRT postoperatoria y sin QRT.
DISEÑO. Un grupo de pacientes con carcinoma de recto medio y bajo en estados II o III que recibieron QRT preoperatoria fueron seguidos prospectivamente y comparados en una forma no aleatorizada con una cohorte de pacientes sin este tratamiento o con QRT postoperatoria.
ESCENARIO. Unidades oncológicas del Hospital Pablo Tobón Uribe y el Hospital San Vicente de Paúl, Medellín-Colombia, centros médicos académicos de cuarto nivel.
PACIENTES Y MÉTODOS. Entre enero de 1999 y diciembre de 2004, una cohorte de 40 pacientes con carcinoma rectal localmente avanzado (T 2, T3, T4 y/o N1, N2), recibieron QRT neoadyuvante y fueron comparados con 38 pacientes que no recibieron QRT ni pre ni postoperatoria y con 38 pacientes que recibieron QRT postoperatoria. Se consideraron pacientes con radioterapia externa, mayor a 45 Gy, se administró concomitantemente con leucovorin (20 mg/m2) y 5 fluoruracilo (450 mg/m2/d) por infusión continua 4 a 6 semanas antes de la resección quirúrgica. La QRT postoperatoria se administró concomitantemente con ciclos de quimioterapia con similares dosis cada 3 semanas.
PRINCIPALES MEDICIONES. Los pacientes fueron seguidos en una forma regular para determinar la recaída del tumor o la muerte. Además, en el grupo que recibió QRT se evaluó la morbilidad perioperatoria. Objetivos secundarios de evaluación incluyen la tasa de resecciones curativas (R0), los procedimientos preservadores del esfínter, la toxicidad por QRT y las complicaciones quirúrgicas.
RESULTADOS. Los pacientes aceptaron y completaron la QRT pre y postoperatoria. La toxicidad aguda y severa por la QRT fue poco frecuente y lo más común fueron las náuseas y vómitos seguidos por la diarrea, sin diferencias estadísticas entre los dos grupos. La morbilidad perioperatoria fue del 35% y 42% para los pacientes con QRT en el pre y postoperatorio y del 34% en los que no recibieron QRT. Se dejó tumor residual microscópico en los tres tratamientos, sin embargo no hubo tumor residual macro en la QRT preoperatorio ni márgenes positivos a diferencia de la QRT postoperatoria (16% márgenes positivos) y sin QRT (5% márgenes positivos). Se encontraron más procedimientos preservadores del esfínter en la QRT preoperatoria (80%) que en la QRT postoperatoria (55%) o los que no recibieron QRT (50%). Recayeron y murieron en la QRT preoperatoria 10 y 3 pacientes, en la QRT postoperatoria 10 y 7 pacientes, y en los que no recibieron QRT 8 y 7 pacientes. La sobrevida libre de enfermedad para la QRT pre, QRT postoperatoria y sin QRT fue de 26, 26 y 35 meses y la sobrevida global fue de 28, 29 y 35 meses respectivamente.
CONCLUSIONES. La QRT preoperatoria en el tratamiento del cáncer de recto medio y bajo estados II y III es bien tolerada y no se asocia a una morbilidad mayor postoperatoria. Además, el control local, la morbilidad postoperatoria, el período libre de enfermedad y la sobrevida global favorecen al grupo con QRT preoperatoria en un grupo no aleatorizado de pacientes, al compararlos con los pacientes que reciben la QRT postoperatoria o sin QRT.
Palabras Clave
Cáncer de recto, quimioterapia, radioterapia, neoadyuvancia, cirugía preservadora de esfínteres.
ABSTRACT
OBJECTIVE. To determine whether preoperative adminis-tration of combination chemotherapy and external beam irradiation (chemoradiation) for patients with stage II or stage III rectal carcinoma had an impact on perioperative morbidity or oncologic outcome, as compared with patients not receiving preoperative chemoradiation or postoperative chemoradiation.
DESIGN. A group of patients with stage II or stage III middle or low rectal carcinoma receiving preoperative chemoradiation were followed up prospectively and compared in a nonrandomized fashion with an inception cohort group of similar patients without chemoradiation or postoperative radiation.
SETTING. Oncologic units of Hospital Pablo Tobón Uribe and Hospital San Vicente de Paúl, Medellín-Colombia, tertiary care academic medical centers.
PATIENTS AND METHODS. Between January 1999 and December 2004 forty patients with advanced rectal carcinoma (T2, T3, T4, and/or N1, N2) undergoing preoperative chemoradiation were compared with 38 patients not undergoing preoperative chemoradiation and 38 patients with postoperative chemoradiotherapy. External beam radiation, 45 to 50 Gy, was delivered concurrently with fluorouracil (450 mg/m2) and leucovorin (20 mg/m2) 4 to 8 weeks prior to surgical resection. Postoperative chemoradiotherapy was administered every 3 weeks simultaneous with cycles of chemotherapy with similar doses.
MAIN OUTCOME MEASURES. Patients were followed up at regular intervals for either tumour recurrence or death. In addition, the group receiving chemoradiation was evaluated for major perioperative morbidity. Secondary targets include the evaluation of curative resections (R0), sphincter-preserving procedures, toxicity for chemoradiotherapy and surgical complications.
RESULTS. All patients agreeing to preoperative chemoradiation completed therapy. Severe toxicity for chemoradiotherapy was slightly frequent and the most common were nauseas and vomiting followed by diarrhoea, without statistical differences between two groups. The postoperative morbidity was 35% and 42% for the patients with chemoradiation in the pre and postoperative and of 34% in which not receive chemoradiation. Preoperative chemoradiation left residual microscopic tumour in three patients, nevertheless there was residual tumour macro neither in the preoperative chemoradiation nor positive margins in contrast to the postoperative chemoradiation (16% positive margins) and without chemoradiation (5% positive margins). Sphincter-preserving procedures found more procedures in the preoperative chemoradiation (80%) that in the postoperative QRT (55 %) or those that there did not receive chemoradiation (50%). Relapsed and died in the preoperative chemoradiation 10 and 3 patients, in the postoperative chemoradiation 10 and 7 patients and in that they did not receive chemoradiation 8 and 7 patient. Free survival period for the chemoradiation pre, postoperative chemoradiation and without chemoradiation was 26, 26 and 35 months and the global survival was 28, 29 and 35 months respectively.
CONCLUSIONS. The preoperative chemoradiation in the treatment of the low and middle rectal cancer, stage II and III is tolerated well and it does not collaborate to a major postoperative morbidity. Also, the local control, the postoperative morbidity, the free period of illness and the global survival favours the group with preoperative QRT in a not randomized group of patients, on having compared them with the patients who receive the postoperative QRT or without QRT.
Key words
Rectal cancer, chemotherapy, radiotherapy, neoadjuvant, sphincter-preserving procedures.
INTRODUCCIÓN
La alta tasa de recaídas locorregionales en el cáncer de recto (CR) ha promovido la implementación de terapias complementarias a la cirugía e incluso mejoras a la técnica operatoria. La recaída locorregional a 5 años para pacientes con estado II y III, tratados sólo con cirugía con intención curativa es de 30 y 50% respectivamente (1, 2) siendo estas tasas más altas cuando hay márgenes positivos (2, 3).Además, las recaídas locales cursan con síntomas devastadores que afectan severamente la calidad de vida de estos pacientes. Por tal motivo el control local es un factor primordial en el CR (4, 5).
En los pacientes con CR resecables estado II (T2-T3) o estado III (N1-2) se ha discutido sobre cuál es la terapia neo o adyuvante óptima, para evitar la alta tasa de recaída en esta neoplasia. Tradicionalmente, estos pacientes sólo recibían radioterapia postoperatoria demostrando un mejor control locorregional pero sin mejorar la sobreviva (6-8).Este pobre impacto en la sobrevida motivó la terapia combinada de quimio y radioterapia (QRT) postoperatoria. Un trabajo aleatorizado mostró una mejor sobrevida global y mejor control local con la QRT postoperatoria comparado con la cirugía sola (9). La terapia combinada postoperatoria con 5-Fluoruracilo de base y radioterapia ha demostrado ser más eficaz para el control local y a distancia en el cáncer de recto que la radioterapia o la quimioterapia por separado en pacientes con CR estados II y III (9-12). No obstante este favorable impacto en la sobrevida y el control local, estos estudios demuestran serios efectos colaterales hematológicos (cercanos al 30%) y de enteritis por radiación a largo plazo (casi del 5%) como factores adversos con esta terapia. Además, la morbilidad de la la RT postoperatoria se relaciona con la extensión de la disección pélvica (13) sugiriendo un posible beneficio para la administración preoperatoria de la radioterapia al disminuir el estadiaje del tumor, disminuir las complicaciones agudas y cursar con una menor hipoperfusión/hipoxia tumoral (14, 15).
La administración preoperatoria de bajas a moderadas dosis de radioterapia en CR ha mostrado en diferentes centros un mejor control local (14, 16). Un estudio piloto con dosis plenas de RT preoperatoria y QT sistémica sugirió una respuesta alta del tumor y con poca morbilidad (17).La recaída locorregional pélvica tras la terapia combinada para el CR es del 10-25% (9-12, 15, 18-21),afectando la sobrevida y como se comentó, la calidad de vida.
La QRT cursa con mayores factores adversos que la administración separada de la QT y la RT. Una técnica de RT y unas dosis de QT inapropiadas llevan a una alta toxicidad. La alta toxicidad de los estudios iniciales enmascaró el potencial beneficio de la QRT. Mejores técnicas de RT, el ajuste de los agentes quimioterápicos, dosis y rutas de administración han mejorado el perfil tóxico en la terapia combinada (22).
La escisión total del mesorrecto (ETM), una disección meticulosa, neta y precisa del mesenterio del recto, el cual se remueve en monobloque con el recto ampliando el margen circunferencial, ha mostrado en instituciones con experiencia en la técnica (23-25), recaídas menores al 10% sin necesidad de QRT. Existen sólo estudios retrospectivos que sustentan el mejor comportamiento de los pacientes con ETM que con la QRT y la cirugía convencional (26-28), por lo tanto si la ETM es la forma óptima de manejo en estos pacientes permanece controvertido(29-32).
PACIENTES Y MÉTODOS
En el período comprendido entre enero de 1999 y diciembre de 2004 en dos instituciones de cuarto nivel, de sus servicios de oncología se obtuvieron 40 pacientes con CR tratados con QRT preoperatoria, 38 con QRT postoperatoria y 38 pacientes sin QRT pre ni postoperatoria. Los pacientes cumplieron con los siguientes criterios de inclusión: adenocarcinoma de recto determinado por estudio histopatológico, compromiso de recto medio o bajo (en o por debajo de la reflexión peritoneal), estados II o III según el American Joint Committee on Cancer, basados en los hallazgos clínicos e imaginológicos (TAC, Rayos X de tórax).
Se excluyeron pacientes con lesiones tumorales diferentes al adenocarcinoma, ubicaciones proximales al recto, enfermedad irresecable o metastásica.
El diagnóstico y la estadificación inicial se hicieron con el examen digital rectal, la endoscopia con biopsia, rayos X de tórax y la tomografía de abdomen contrastada de abdomen y pelvis en todos los pacientes. No se contó con la evaluación por ultrasonido rectal en ningún paciente.
Después del diagnóstico inicial y la estadificación, la opción de la QRT preoperatoria quedó sujeta al criterio y conocimiento del cirujano o coloproctólogo tratante o bien del oncólogo clínico y la disponibilidad de la QRT en la institución respectiva. La radiación por megavoltaje externo (10-15 mV) se administró utilizando múltiples técnicas de campo (P/A, +/- AP, 2 laterales). En general, la totalidad de la pelvis más el grupo ganglionar primario recibieron 50 Gy en 25 fracciones diarias, 5 veces por semana.
La quimioterapia sistémica se hizo con 5 Fluoruracilo (5 FU) y leucovorin. El 5 FU se administró a dosis de 425 mg/m2 diariamente y 20 mg/m2 diariamente de leucovorin, por infusión intravenosa continua, los primeros y últimos 5 días de la radioterapia. Luego del tratamiento con QRT la cirugía se realizó entre 4 y 6 semanas después. La elección del tratamiento quirúrgico se hizo criterio del cirujano tratante por lo que no se evalua la disección del mesorrecto como objetivo del presente estudio. Todas las resecciones se hicieron con la intención de tener márgenes patológicos negativos.
Se evaluó cuidadosamente la aparición de efectos tóxicos con la QRT preoperatoria, así como la potencial mayor morbilidad en el postoperatorio. Se utilizaron los criterios de toxicidad del Instituto Nacional del Cáncer americano para medir los efectos tóxicos durante y después de la terapia. Se revisaron los registros en las historias clínicas para determinar las complicaciones postoperatorias tempranas y/o tardías.
En esta serie de casos se comparó 40 pacientes sometidos a QRT preoperatoria con una cohorte de pacientes que sirvieron como grupo de comparación. Consiste en 38 pacientes con CR con estadificación por histología en estados II y III, tratados quirúrgicamente en las mismas instituciones y durante el mismo período. Este grupo recibió el mismo esquema de radioterapia con similar fraccionamiento y campos (50,4 a 54 Gy) La quimioterapia postoperatoria se hizo con 5 FU y leucovorin en las mismas dosis.
Además, un grupo de 38 pacientes con hallazgo histológico de CR estado II y III que no recibieron quimio o radioterapia ni en el pre ni el postoperatorio se sometieron al análisis con los dos grupos descritos.
Todos los pacientes tuvieron un seguimiento cada 3 a 4 meses los primeros 2 años del postoperatorio y luego cada 4 a 6 meses hasta el quinto año de postoperatorio y a partir de allí cada año. El seguimiento también se hizo en forma independiente por los servicios de radioterapia y oncología clínica. La recurrencia local se definió como pélvica o perineal. La sobrevida libre de recurrencia, el período libre de enfermedad y la sobrevida global fueron calculados para cada grupo. El valor de p fue comparado usando la prueba de log-rank y la significancia se definió con una p<0,05.
RESULTADOS
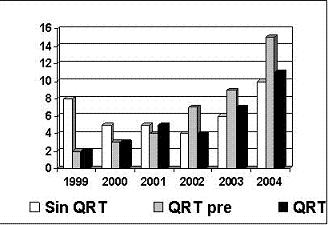
La distribución de los tratamientos adyuvantes ha presentado un interesante cambio en los últimos seis años en los servicios de oncología de dos hospitales de cuarto nivel con servicio de oncología clínica y quirúrgica, encontrándose un viraje en la administración de las terapias adyuvantes inicialmente de no ofrecer estas terapias a la actualidad en que se recomienda mayormente la QRT preoperatoria. (Figura 1).
Figura 1. Cambio en el tiempo en la administración de las terapias complementarias adyuvantes en el cáncer de recto.
En la actualidad se presentan problemas logísticos (cada vez menos, afortunadamente) con la administración en el preoperatorio de la QRT por falta de aprobación de las entidades administradoras del servicio de salud (SISBEN-ARS y las EPS) y lo que es más preocupante, los pacientes que no reciben ninguna terapia es porque se presentan más de tres meses después de haber sido intervenidos (morbilidad postoperatoria o nuevamente problemas logísticos para acceder al especialista oncólogo), cuando los beneficios de la terapia ya se han perdido y por esto aún tenemos un alto número de estos pacientes sin terapia complementaria.
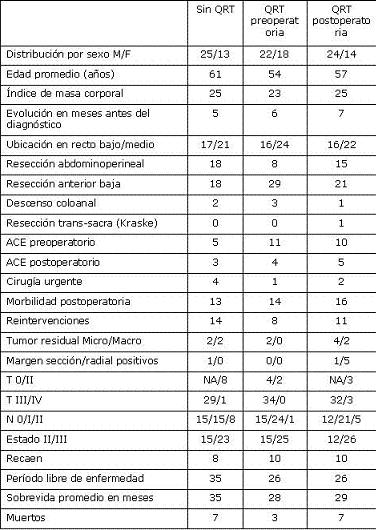
El la tabla 1 se recogen las diferencias demográficas, epidemiológicas, clínicas y de las características del tumor y su manejo y respuesta al tratamiento en los tres grupos sometidos a comparación.
Tabla 1. Comparación de los tres grupos.
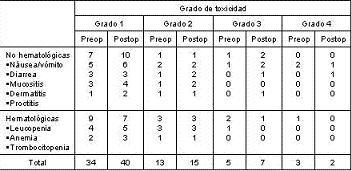
En el presente estudio sólo se evalúan los pacientes que recibieron la totalidad de las dosis presupuestadas para la QRT pre como postoperatoria. En la tabla 2 se recogen las complicaciones que se presentaron con la terapia complementaria en los dos grupos que la recibieron. En 5 pacientes (12,5%) con QRT preoperatorio se encontraron reacciones tóxicas adversas grado 3 de acuerdo a los criterios de clasificación del Instituto Nacional de Cáncer americano (2 hematológicos y 3 gastrointestinales) que requirieron posponer la QRT por no más de 2 semanas, sin embargo, todos los pacientes completaron el esquema de quimio y radioterapia. Reacciones adversas grado 4 que requirieran hospitalización ocurrieron en 3 pacientes, uno por neutropenia febril y sepsis y 2 por diarrea (con 1 reingreso más), con una rápida y completa recuperación. En la tabla 2 se recoge la toxicidad asociada a la QRT pre y postoperatoria.
Tabla 2. Toxicidad aguda por la quimiorradioterapia pre y postoperatoria en pacientes con cáncer de recto.
Pacientes sin terapia neo o adyuvante
El grupo de 38 pacientes con estado II y III de cáncer de recto que no recibió QRT pre ni postoperatoria presentó un rango de edad de 24 a 73 años, con un promedio de 61 años. Había 25 mujeres y 13 hombres en este grupo y el seguimiento osciló entre 2 y 81 meses, con un promedio de 36 meses.
Característicamente, en este grupo de pacientes se encontró una tendencia a tener un compromiso en la pared del tumor (T) menos avanzada y un estado tumoral menor que los sometidos a la intervención (QRT pre o postoperatoria).
Pacientes con terapia neoadyuvante
En este grupo de 40 pacientes (22 hombres) la edad osciló entre 28 y 74 años. La evaluación clínica postratamiento demostró una respuesta clínica parcial (reducción del tumor mayor al 50%) en 26 pacientes (65%) y total en 8 pacientes (20%), 4 de estos pacientes al saber que no tenían el tumor no se dejaron intervenir y son motivo de seguimiento en la actualidad sin evidenciarse recaída tumoral (seguimiento entre 8 y 22 meses). Dos de los 4 pacientes con abolición del tumor, al estudio histológico mostraron ganglios positivos.
Todos los pacientes se sometieron a cirugía 3 a 6 semanas después de terminada la QRT. Se les practicó: 29 resecciones anteriores bajas (73%), 3 anastomosis coloanales (7%) y 8 resecciones abdominoperineales (20%). Las resecciones abdominoperineales se hicieron en pacientes en los que se encontraba compromiso tumoral del esfínter externo o del músculo puborrectal.
La evaluación patológica final de los especímenes resecados revelaron un estado 0 (sin enfermedad residual) en 4 pacientes (10%), estado II (T1 o T2 y N0) en 2 pacientes (5%) y estado III (N1, N2) en 34 pacientes (85%). Los márgenes microscópicos proximales y distales estaban respetados en todos los pacientes y no hubo tampoco compromiso del margen radial.
La morbilidad mayor postoperatoria ocurrió en 14 pacientes (35%), con 3 filtraciones de anastomosis, 6 abscesos pélvicos, 2 estenosis de la anastomosis (manejo endoscópico), 7 infecciones de la herida quirúrgica una con fascitis y evisceración que ameritó cirugía y 1 absceso perineal (algunos pacientes presentaron varias complicaciones). Se practicaron 8 reintervenciones, 6 de ellas por colecciones intraabdominales, una corrección de evisceración y un drenaje perineal. La sobrevida osciló entre 2 y 81 meses con un promedio de 28 meses.
Pacientes con terapia adyuvante
En estos 38 pacientes (24 hombres) a edad osciló entre 28 y 75 años con un promedio de 57 años. La QRT postoperatoria se inició de 3 a 6 semanas después de la cirugía. La sobrevida osciló entre 6 y 81 meses con un promedio de 29 meses. No se demostró una mayor incidencia de complicaciones tóxicas por la QRT comparándolas con la QRT preoperatoria. En este grupo particular de pacientes se demuestra un estado del tumor más avanzado lo que se explica porque la decisión de dar QRT se tomó luego de la cirugía y el estudio anatomopatológico demostraba más compromiso de márgenes de sección o radial y/o mayor compromiso ganglionar. Sin embargo, dado lo pequeño de la muestra estudiada, estas diferencias no alcanzan a tener una significancia estadística.
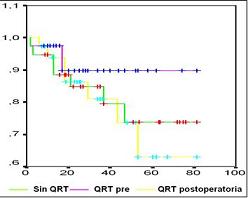
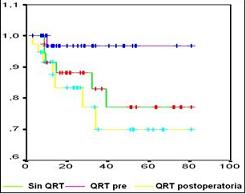
En la figura 2 se observa la curva de sobrevida de los tres grupos de estudio, la cual no mostró una diferencia estadísticamente significativa, aunque la tendencia de las cifras favorece la sobrevida en el brazo de pacientes con QRT preoperatoria.
Figura 2. Sobrevida con los diferentes tratamientos
En la figura 3 se aprecia el período libre de enfermedad para los diferentes tratamientos. Igualmente el número de pacientes no permitió demostrar unas diferencias estadísticamente significativas, aunque la tendencia de la gráfica igualmente favorece a los pacientes que recibieron QRT preoperatoria.
Figura 3. Período libre de enfermedad de los diferentes tratamientos
Aunque no se demostró una diferencia estadísticamente significativa en la sobrevida y el período libre de enfermedad entre las diferentes opciones de tratamiento, se nota una tendencia que favorece a los pacientes que la recibieron la QRT en el preoperatorio, se destaca el mejor comportamiento de los pacientes sin QRT, pero existe un sesgo de selección al dársele la QRT postoperatoria a los pacientes con mayor estado tumoral.
DISCUSIÓN
La resección quirúrgica se considera la piedra angular del tratamiento del cáncer de recto, la QRT postoperatoria del CR localmente avanzado y resecable ha demostrado beneficios al mejorar el período libre de enfermedad y la sobrevida global (9, 10). Sin embargo, se presentaron significativos efectos secundarios con el tratamiento en el período de recuperación de la cirugía lo que motivó la implementación de la QRT preoperatoria. Además de intentar disminuir los efectos tóxicos, otras potenciales ventajas de la administración preoperatoria sería la facilidad de administrarla a todos los pacientes, una mayor posibilidad de completar el tratamiento, evitar el retraso en el inicio de la terapia, implementar terapias que preservan el esfínter e incrementar el período libre de enfermedad y la sobrevida.
Resultados de un estudio no aleatorizado del Memorial Sloan-Kettering Cancer Center (33)mostró menos efectos tóxicos con la QRT preoperatoria (Fluoruracilo más leucovorin a altas dosis) comparada con QRT postoperatoria (13% versus 48%) En otro estudio de la clínica Mayo (10) se comparó la radioterapia postoperatoria sola con la QRT para estados II y III del CR, el 20% (19/95) no completaron el ciclo de los pacientes con QRT postoperatoria. Igualmente, en un estudio sueco (34), la radiación postoperatoria se retrasó por 6 semanas después de la cirugía en casi la mitad de los pacientes como consecuencia del período de convalecencia relacionado con morbilidad postoperatoria. Aunque es motivo de controversia, se describe un mayor índice de cirugías preservadoras de esfínteres en pacientes con QRT neoadyuvante (35, 36). Si esta alta rata de preservación de esfínteres se debe a la reducción del tumor por la QRT preoperatorio (37), o si se debe al incremento y popularización de este tipo de técnicas quirúrgicas preservadoras de esfínteres (38) son cuestionamientos que están por resolverse.
Aunque diferentes grupos promueven la irradiación preoperatorio (con o sin quimioterapia) con el presupuesto que la disminución del tamaño tumoral se traduce en un mejor control local, pocos estudios muestran un seguimiento suficiente de estos pacientes. El estudio sueco (39) aleatorizado y prospectivo, con un seguimiento no menor a 5 años mostró una reducción en la recaída local (13% versus 22%) en el grupo con RT preoperatoria comparado con la RT postoperatoria, no se administró quimioterapia a ningún grupo. Sin embargo, no se demostró mejoría en la sobrevida.
El presente estudio evalúa el comportamiento de tres grupos de pacientes con carcinoma de recto bajo y medio con estados II y III, que recibieron QRT pre o postoperatoria o no recibieron esta terapia. La QRT post y preoperatoria fue bien tolerada y no se demostró una toxicidad mayor en ninguno de los grupos. La morbilidad postoperatoria igualmente fue muy similar para los diferentes grupos.
Se evidencia en esta serie de pacientes una tendencia hacia una mejor evolución en los pacientes con QRT preoperatoria. Sin embargo, se encontró una mayor sobrevida y período libre de enfermedad para el grupo que no recibió QRT comparado con el que la recibió en el postoperatorio, lo que se explica porque los pacientes que se sometieron a la QRT postoperatoria tenían un estado tumoral más avanzado que los que no la recibieron (Tabla 1).
Dadas las características retrospectivas del presente estudio y la consiguiente heterogeneidad del grupo de cirujanos tratantes de los pacientes (cirujanos generales, gastrointestinal y coloproctólogos) no se consideró en ellos el papel de la disección total del mesorrecto, técnica operatoria que incide, de acuerdo a diferentes publicaciones, en una mayor sobrevida y un mayor período libre de enfermedad.
Como conclusión, el presente estudio sugiere una mejor sobrevida y período libre de enfermedad para el grupo sometido a QRT preoperatorio, sin afectar la morbilidad postoperatoria y permitiendo un mayor número de procedimientos preservadores del esfínter anal lo que se traduce en una mejor calidad de vida para el paciente. Existe un sesgo de selección adverso para los pacientes sometidos a QRT postoperatoria cundo se le compara con los que no la recibieron porque los primeros tenían tumores en estadios más avanzados. Con base en estos resultados preliminares se ha iniciado un protocolo de seguimiento prospectivo en pacientes sometidos a la quimioterapia descrita con radioterapia conformacional.
Referencias
1. Castaño R, Ferro R. Factores Pronósticos de recurrencia local en el carcinoma de recto. Experiencia en el Instituto Nacional de Cancerología. Presentado en el Congreso Colombiano de Enfermedades Digestivas el 5 de mayo de 1997. [ Links ]
2. Rich T, Gunderson LL, Lew R, Galdibini JJ, Cohen AM, Donaldson G. Patterns of recurrence of rectal cancer after potentially curative surgery. Cancer 1983; 52: 1317-29. [ Links ]
3. Quirke P, Durdey P, Dixon MF, Williams NS. Local recurrence of rectal adenocarcinoma due to inadequate surgical resection: histopathological study of lateral tumour spread and surgical excision. Lancet 1986; 2: 996-9. [ Links ]
4. Castaño R. Epidemiología y factores de riesgo en el cáncer colorrectal. Temas escogidos en gastroenterología. Tomo XXXI. Bogotá DC. 2001; 52-56. [ Links ]
5. Gunderson LL, Nelson H, Martenson JA, et al. Intraoperative electron and external beam irradiation with or without 5-Fluorouracil and maximum surgical resection for previously unirradiated, locally recurrent colorectal cancer. Dis Colon Rectum 1996; 39: 1379-95. [ Links ]
6. Fisher B, Wolmark N, Rockette H, et al. Postoperative adjuvant chemotherapy or radiation therapy for rectal cancer: results from NSABP protocol R-01. J Natl Cancer Inst 1988; 80: 21-9. [ Links ]
7. Treurniet-Donker AD, van Putten WL, Wereldsma JC, et al. Postoperative radiation therapy for rectal cancer: an interim analysis of a prospective, randomized multicenter trial in The Netherlands. Cancer 1991; 67: 2042-8. [ Links ]
8. Medical Research Council Rectal Cancer Working Party. Randomized trial of surgery alone versus surgery followed by radiotherapy for mobile cancer of the rectum. Lancet 1996; 348: 1610-4. [ Links ]
9. Gastrointestinal Tumor Study Group. Prolongation of the disease-free interval in surgically treated rectal carcinoma. N Engl J Med 1985; 312: 1465-1472. [ Links ]
10. Douglass HO Jr, Moertel CG, Mayer R, et al. Survival after postoperative combination treatment of rectal cancer. N Engl J Med 1986; 315: 1294-5. [ Links ]
11. Krook JE, Moertel CG, Gunderson LL, et al. Effective surgical adjuvant therapy for high-risk rectal carcinoma. N Engl J Med 1991; 324: 709-15. [ Links ]
12. Tveit KM, Guldvog I, Hagen S, et al. Randomized controlled trial of postoperative radiotherapy and short-term time-scheduled 5-fluorouracil against surgery alone in the treatment of Dukes B and C rectal cancer: Norwegian Adjuvant Rectal Cancer Project Group. Br J Surg 1997; 84: 1130-5. [ Links ]
13. Gallagher MJ, Brereton HD, Rostock RA, et al. A prospective study of treatment techniques to minimize the volume of pelvic small bowel with reduction of acute and late effects associated with pelvic irradiation. Int J Radiat Oncol Biol Phys 1986; 12: 1565-1573. [ Links ]
14. Stockholm Rectal Cancer Study Group. Preoperative short-term radiation therapy in operable rectal carcinoma: a prospective randomized trial. Cancer 1990; 66: 49-55. [ Links ]
15. Improved survival with preoperative radiotherapy in resectable rectal cancer: Swedish Rectal Cancer Trial. N Engl J Med 1997; 336: 980-7. [ Links ]
16. Gerard A, Buyse M, Nordlinger B, et al. Preoperative radiotherapy as adjuvant treatment in rectal cancer: final results of a randomized study of the EORTC. Ann Surg 1988; 208: 606-614. [ Links ]
17. Minsky B, Cohen A, Enker W, et al. Preoperative 5-fluorouracil, low-dose leucovorin, and concurrent radiation therapy for rectal cancer. Cancer 1994; 73: 273-278. [ Links ]
18. Steele GD Jr, Herndon JE, Bleday R, et al. Sphincter-sparing treatment for distal rectal adenocarcinoma. Ann Surg Oncol 1999; 6: 433- 41. [ Links ]
19. Russell AH, Harris J, Rosenberg PJ, et al. Anal sphincter conservation for patients with adenocarcinoma of the distal rectum: long-term results of radiation therapy oncology group protocol 89–02. Int J Radiat Oncol Biol Phys. 2000; 46: 313-22. [ Links ]
20. Gastrointestinal Tumor Study Group. Radiation therapy and fluorouracil with or without semustine for the treatment of patients with surgical adjuvant adenocarcinoma of the rectum. J Clin Oncol 1992; 10: 549-57. [ Links ]
21. OConnell MJ, Martenson JA, Wieand HS, et al. Improving adjuvant therapy for rectal cancer by combining protracted-infusional fluorouracil with radiation therapy after curative surgery. N Engl J Med 1994; 331: 502-7. [ Links ]
22. Santiago RJ, Metz JM, Hanh S. Chemoradiotherapy in the treatment of rectal cancer. Hematol Oncol Clin N Am 2002; 16: 995-1014. [ Links ]
23. Heald RJ, Moran BJ, Ryall RD, Sexton R, MacFarlane JK. Rectal cancer: the Basingstoke experience of total mesorectal excision, 1978-1997. Arch Surg 1998; 133(8): 894-9. [ Links ]
24. Enker WE, Thaler HT, Cranor ML, Polyak T. Total mesorectal excision in the operative treatment of carcinoma of the rectum. J Am Coll Surg 1995; 181(4): 335-46. [ Links ]
25. Arenas RB, Fichera A, Mhoon D, Michelassi F. Total mesenteric excision in the surgical treatment of rectal cancer: a prospective study. Arch Surg 1998; 133(6): 608-11; discussion 611-2. [ Links ]
26. MacFarlane JK, Ryall RD, Heald RJ. Mesorectal excision for rectal cancer. Lancet 1993; 341(8843): 457-60. [ Links ]
27. Havenga K, Enker WE, Norstein J, Moriya Y, Heald RJ, van Houwelingen HC, et al. Improved survival and local control after total mesorectal excision or D3 lymphadenectomy in the treatment of primary rectal cancer: an international analysis of 1411 patients. Eur J Surg Oncol 1999; 25(4): 368-74. [ Links ]
28. Martling AL, Holm T, Rutqvist LE, Moran BJ, Heald RJ, Cedemark B. Effect of a surgical training programme on outcome of rectal cancer in the County of Stockholm. Stockholm Colorectal Cancer Study Group, Basingstoke Bowel Cancer Research Project. Lancet 2000; 356(9224): 93-6. [ Links ]
29. Wiig JN, Carlsen E, Soreide O. Mesorectal excision for rectal cancer: a view from Europe. Semin Surg Oncol 1998; 15(2): 78-86. [ Links ]
30. Goldberg S, Klas JV. Total mesorectal excision in the treatment of rectal cancer: a view from the USA. Semin Surg Oncol 1998; 15(2): 87-90. [ Links ]
31. Nelson H, Petrelli N, Carlin A, Couture J, Fleshman J, Guillem J, et al. Guidelines 2000 for colon and rectal cancer surgery. J Natl Cancer Inst 2001; 93(8): 583-96. [ Links ]
32. Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, et al. Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med 2001; 345(9): 638-46. [ Links ]
33. Minsky BD, Cohen AM, Kemeny N, et al. Combined modality therapy for rectal cancer: decreased acute toxicity with preoperative approach. J Clin Oncol. 1992; 10: 1218-1224. [ Links ]
34. Pahlman L, Glimelius B. Pre- or postoperative radiotherapy in rectal and rectosigmoid carcinoma: report from a randomized multicenter trial. Ann Surg 1990; 211: 187-195. [ Links ]
35. Minsky BD, Cohen AM, Enker WE, et al. Phase I/II trial of preoperative radiation therapy and coloanal anastomosis in distal invasive resectable rectal cancer. Int J Radiat Oncol Biol Phys 1992; 23: 387-392. [ Links ]
36. Bannon JP, Marks GJ, Mohiuddin M, Rakinic J, Nong-Zhou J, Nagle D. Radical and local excisional methods of sphincter-sparing surgery after high-dose radiation for cancer of the distal 3 cm of the rectum. Ann Surg Oncol 1995; 2: 221-227. [ Links ]
37. Horn A, Morild I, Dahl D. Tumour shrinkage and down staging after preoperative radiation of rectal adenocarcinomas. Radiother Oncol 1990; 18: 19-28. [ Links ]
38. Cavalier F, Pemberton JH, Cosimell M, Fazio VW, Beart RW Jr. Coloanal anastomosis for rectal cancer: long-term results at the Mayo and Cleveland Clinics. Dis Colon Rectum 1995; 38: 807-812. [ Links ]
39. Frykholm GJ, Glimelius B, Pahlman L. Preoperative or postoperative irradiation in adenocarcinoma of the rectum: final treatment results of a randomized trial and an evaluation of late secondary effects. Dis Colon Rectum 1993; 36: 546-572. [ Links ]