Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO  Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.20 no.4 Bogotá Dec. 2005
Síndrome de intestino irritable
William Otero MD,1 Martín Gómez MD.2
1 Internista, Gastroenterólogo, Epidemiólogo. Docente, coordinador de Gastroenterología Universidad Nacional de Colombia. Gastroenterólogo Clínica Fundadores, Bogotá, Colombia. wotero@cable.net.co
2 Internista, Gastroenterólogo. Docente de Gastroenterología Universidad Nacional de Colombia. Gastroenterólogo, Hospital El Tunal, Bogotá, Colombia
Fecha recibido 22/09/05 - Fecha recibido 23/11/05
RESUMEN:
El síndrome de intestino irritable (SII), es uno de las más frecuentes enfermedades gastrointestinales funcionales, afectando del 10 al 20% de la población. El diagnóstico está basado en la identificación de síntomas de acuerdo a los criterios de ROMA I y ROMA II y exclusión de síntomas o signos de alarma. El tratamiento está basado en una excelente relación médico-paciente así como la prescripción de medicamentos dirigidos al órgano blanco, especialmente durante las exacerbaciones. Para el dolor abdominal, los aniespasmòdicos, tienen a lo sumo una modesta eficacia. Los antidepresivos triciclícos en dosis bajas son útiles. Para la diarrea, son útiles los antagonistas opioides, especialmente loperamida, pero no estos no alivian el dolor. La fibra y los aumentadores de volumen pueden ayudar en la constipación según algunos ensayos, pero la evidencia es equívoca. Tegaserod, un agonista 5HT4, está disponible en muchos países para su uso en mujeres con SII cuyo síntoma predominante es el estreñimiento. Sin embargo, el manejo del SII sigue siendo insatisfactorio tanto para los pacientes como para los médicos. Se necesitan nuevas drogas para el SII ya que las existen actualmente, generalmente proporcionan resultados subóptimos.
PALABRAS CLAVE
Síndrome de intestino irritable, moduladores de receptor de serotonina, tratamiento, diagnóstico, desorden gastrointestinal funcional, estreñimiemnto, diarrea, síntomas alternantes.
ABSTRACT
Irritable bowel síndrome (IBS) is one of the most common gut functional diseases, affecting 10 a 20% of people. Diagnosis is based on the identificactiòn of symptoms according to manning, Rome I and Rome II criteria and exclusion of alarma symptoms or signs. The treatment is based on an excellent doctor-patient relatioship along with drugs targeting the predominant symptom, especially during exacerbations. For abdominal pain, antispasmodics are, at best, of only modest efficacy. Tryciclic antidepressants in low doses are useful. For diarrhea, are useful opioid antagonists, especially loperamide, but not for pain. Fyber and bulking agents may help constipation in some trials but the evidence is equivocal. Tegaserod, a 5HT4 agonist is available en many countries for use in women with IBS whose primary bowel symptom is constipation. Moreover the management of the IBS remains unsatisfactory either patients or practitioners. New drugs for IBS are needed, as currently available agents provide generally suboptimals results.
KEYWORDS
Irritable bowel syndrome, serotonin-receptor modulators, treatment, diagnosis, functional gastrointestinal disorder, constipation, diarrhea, alternants symptoms.
El síndrome de intestino irritable (SII) constituye una alteración gastrointestinal sintomática crónica y recurrente, que se caracteriza por dolor o malestar abdominal y alteración del hábito intestinal con diarrea o estreñimiento (1, 2). En general, los síntomas del SII son fluctuantes en su intensidad. El SII se describió por primera vez en 1812 por William Powell (3). En los países industrializados, el SII tiene una prevalencia del 10 a 15%, siendo más frecuente en mujeres con una relación de 3:1 con respecto a los hombres (2, 4, 5). Depresión o ansiedad se detectan en aproximadamente el 40 a 60% de los pacientes que consultan por los síntomas de SII (6).
El SII tiene un impacto impresionante en varios niveles, como lo ilustran las siguientes cifras. En gastroenterología, representa el 38% de las consultas y en medicina general el 12% de las mismas (2), por encima de la hipertensión arterial (10%), el asma (4%) y la enfermedad coronaria (2%), (78). Se estima que es la segunda causa de ausentismo laboral después de la gripa (9). Al año en Estados Unidos el SII genera 2,4 a 3,5 millones de consultas médicas y más de dos millones de prescripciones (9) y produce un costo superior a 33 mil millones de dólares (10). Además, estos pacientes son operados tres veces más de colecistectomías, dos veces más de histerectomías y apendicectomías y 50% más cirugías de columna que los pacientes sin SII (11). El exceso de cirugías, usualmente se debe a un diagnóstico equivocado y estas intervenciones innecesarias, en una población tan grande con SII, ocasiona importante morbimortalidad (12). Los individuos con SII que consultan tienen una notable disminución en su calidad de vida, la cual es peor que la de los pacientes con enfermedad por reflujo gastroesofágico y de los que tienen asma (13, 14-16).
Los síntomas predominantes en el SII son el dolor o malestar abdominal, que se alivian con la defecación, acompañados por cambios en la frecuencia o consistencia de las heces, con un patrón de diarrea o estreñimiento (1, 2). Una importante proporción de los pacientes con SII presentan alternancia del hábito intestinal, es decir, unas veces diarrea y otras, estreñimiento. Las crisis o períodos sintomáticos se asocian o se exacerban con el estrés, alcohol o algunos alimentos (17). El dolor abdominal, que es probablemente el síntoma más alarmante y que más incide en la frecuencia de la consulta y que determina las cirugías innecesarias, no tiene un patrón que ayude a distinguirlo del dolor de otras etiologías; puede ser generalizado o localizado y usualmente se produce en el abdomen inferior (17).
Durante la defecación, se pueden producir molestias como urgencia, esfuerzo o sensación de evacuación incompleta. Otros síntomas que pueden padecer estos pacientes son la sensación de distensión abdominal y la expulsión de moco en la heces (1, 17). Son frecuentes varios síntomas extracolónicos e incluso extradigestivos. Entre los primeros se destacan dispepsia (dolor o malestar en el abdomen superior), pirosis (ardor retroesternal), regurgitación (agrieras) y entre los últimos urgencia urinaria, disfunción sexual, fibromialgia, dispareunia, alteraciones del sueño, dificultades menstruales, dolor lumbar, cefalea y fatiga crónica (17, 18).
No obstante la alta prevalencia de las alteraciones sicológicas (depresión, ansiedad, somatización), estas manifestaciones no hacen parte de los criterios actuales para el diagnóstico y tampoco ayudan a distinguir a los pacientes con SII de los pacientes con enfermedades orgánicas intestinales (3, 17).
En la mayoría de los casos, el examen físico es normal, aunque en algunos se puede encontrar dolor abdominal inferior, generalmente del lado izquierdo (17).
El diagnóstico se basa en los criterios diagnósticos en ausencia de signos y síntomas de alarma o banderas rojas: edad de inicio mayor de 50 años, síntomas nocturnos que despierten al paciente, diarrea refractaria, sangrado rectal, anemia, pérdida de peso, fiebre, masa abdominal palpable, síntomas severos no fluctuantes, historia familiar de cáncer de colon o de enfermedad inflamatoria intestinal (8, 17).
Ante la ausencia de marcadores biológicos específicos (anticuerpos, biopsias, etc.), en el pasado y lamentablemente todavía en el presente, muchos médicos lo consideraban un diagnóstico de exclusión, en el cual se debía pensar, después de múltiples pruebas de laboratorio y estudios imagenológicos y endoscópicos que descartaban una enfermedad orgánica convencional. En la actualidad, ya no se procede de esa manera sino que la entidad es identificada, teniendo en cuenta los denominados criterios para el diagnóstico, el cual se basa solamente en los síntomas teniendo por supuesto una excelente historia clínica y un examen físico que descarte patologías concomitantes (1-8), siendo innecesario realizar pruebas diagnósticas. Estas pruebas se solicitan para descartar una enfermedad orgánica, en los pacientes que presentan indicios o sospechas de las mismas. Este acercamiento o abordaje para el diagnóstico, es lo que se ha denominado un acercamiento positivo. Cuando se identifica cualquier manifestación de alarma o bandera roja, (8), serán necesarios exámenes. Con este acercamiento positivo, el diagnóstico de SII es relativamente estable y solamente del 2 al 5% de pacientes se les encontrará una enfermedad orgánica durante el seguimiento (19). En los pacientes que cumplan los criterios diagnósticos de Roma II para SII (1), (tabla 1), (los criterios de ROMA III están en progreso), la probabilidad pretest para identificar enfermedad inflamatoria intestinal o cáncer de colon es menor del 1% (20), pero la probabilidad para enfermedad celíaca (EC), es 7 a 10 veces la de la población general sin SII y en un reciente estudio, esta entidad se diagnosticó en 4,8% de los pacientes con base en anticuerpos e histología confirmatoria (21) y en este sentido, la Asociación Americana de Gastroenterología (AGA), recomienda pruebas serológicas para EC con anticuerpos Ig A antitransglutaminasa tisular o antiendomisio en los pacientes con SII, no solamente en los que presentan diarrea severa (22). La decisión de descartar enfermedad celíaca, debe tener en cuenta la prevalencia de esta enfermedad en el medio donde viva el paciente. En un reciente estudio de costo-eficacia, se encontró que cuando la prevalencia de EC es del 1%, las pruebas serológicas tienen un costo aceptable y cuando es mayor del 8% es la mejor estrategia (23). Es muy lamentable que todavía se lean en los informes radiológicos diagnósticos como: colon espástico o colon irritable, desconociendo lo más elemental para el diagnóstico, que son los síntomas. En los criterios diagnósticos no existe ni ha existido ninguna alusión a características radiológicas y por lo tanto seguir utilizando esas expresiones contribuye a confundir muchísimo al paciente y al médico no especialista, trayendo consigo una desinformación que en muchos casos es perturbadora para el adecuado manejo e incluso información y educación del paciente, acerca de sus enfermedad.
Tabla 1. Criterios de Roma II
Cuando en la evaluación inicial no se encuentran alteraciones sugestivas de enfermedad orgánica, se debe iniciar el tratamiento sintomático y el paciente reevaluarse en cuatro a seis semanas (24). Si los síntomas progresan o aparecen manifestaciones de alarma, está indicado realizar exámenes o pruebas diagnósticas según las manifestaciones clínicas predominantes (24, 25). Las principales entidades que deben tenerse en cuenta como diagnóstico diferencial en pacientes con SII son la enfermedad inflamatoria intestinal (EII) en personas jóvenes y el cáncer colorrectal en pacientes de mayor edad. En países con pobres condiciones sanitarias, económicas y sociales, que eufemísticamente y de manera optimista se denominan en vías de desarrollo es necesario también tener en cuenta las infecciones bacterianas o parasitarias (8, 26).
Con base en los síntomas predominantes, los pacientes se clasifican en 4 subgrupos:
1. Constipación predominante.
2. Diarrea predominante.
3. Dolor/gas/distensión predominante.
4. Diarrea alternante con constipación.
FISIOPATOLOGÍA
En la actualidad, la concepción de la fisiopatología del SII puede dividirse en mecanismos clásicos (viejos) y conceptos recientes que involucran mecanismos inflamatorios (27, 28). El SII es considerado un síndrome funcional que, como en todas las entidades funcionales gastrointestinales, existe un amplio rango de síntomas cuyos mecanismos fisiopatológicos son pobremente entendidos. En estas patologías, la mayoría de los médicos consideran que la anormalidad principal está en el cerebro, es decir, en la interpretación de síntomas que provienen del intestino; sin embargo, estos pacientes son heterogéneos y existe una proporción de los mismos, en los cuales la principal anormalidad está realmente en el intestino, como ocurre en los pacientes con SII postinfeccioso, pero los métodos actualmente disponibles en la práctica clínica no permiten identificarlos (29).
En esta fisiopatología compleja, se considera que múltiples factores participan en el origen y en las manifestaciones clínicas de la entidad. Los mecanismos clásicamente implicados y los niveles de evidencia se muestran en la tabla 2 (28).
Tabla 2. Niveles de evidencia de los mecanismos fisiopatológicos del SII.
+++: Fuerte evidencia, numerosos estudios clínicos con apreciable concordancia.
++: Evidencia moderada, estudios clínicos en concordancia con datos preliminares.
+: Evidencia débil, informes aislados, datos para ser confirmados.
Modificado de ref. 28.
Hipersensibilidad visceral. Aproximadamente el 70% de los pacientes pueden tener disminución del umbral de sensibilidad visceral, pero no somática (28).
Alteración de la motilidad. Las diferentes alteraciones encontradas tienen pobre correlación con los síntomas del paciente (28).
Factores sicosociales. Contribuyen pero no causan los síntomas (28).
Agentes infecciosos. Las infecciones explican del 6-17% de todos los casos de SII, sin embargo, del 7 al 33% de los pacientes con gastroenteritis infecciosas desarrollan SII en el futuro (29, 30). Cuando se produce infección bacteriana gastrointestinal, existe un riesgo de 11 veces de desencadenar SII, comparado con los que la han padecido (30). En los pacientes con la infección, se ha demostrado inflamación colónica persistente, así como activación del sistema inmune (14, 31, 32) y también mayor número de células enterocromafin que contienen serotonina, la cual puede contribuir a la diarrea y dolor abdominal (33). El 50% de los pacientes con SII postinfección se recuperan a los seis años comparados con el 31% del SII inespecífico (34).
Factores genéticos. La evidencia para la participación de factores genéticos en el SII incluye la frecuencia dos veces mayor en gemelos homocigotos, comparados con heterocigotos (35), pero la concordancia en los gemelos monocigotos no es 1:1, indicando que se necesitan otros factores, como los ambientales. Otros hallazgos a favor de la genética son la aparición de esta enfermedad en familias (36), polimorfismo de genes de citoquinas que controlan la inflamación como la IL-10 (37) y polimorfismo funcional en el gene transportador de serotonina en mujeres con SII y diarrea predominante (38).
Serotonina. El 95% de la serotonina o 5 hidroxitriptamina (5HT) del cuerpo humano está en el tracto gastrointestinal (39), principalmente en las células enterocromafines (90%) y en menor proporción (10%) en las neuronas entéricas (40). Hay por lo menos 14 clases de receptores de 5HT con diversas funciones tanto en el sistema nervioso central y el periférico (41). En el SII los principales receptores son el 5HT3 y el 5HT4 (42, 43).
La acción de la 5HT termina cuando es removida del espacio intersticial mediante recaptación por acción del transportador de serotonina (42-44). La 5HT tiene un papel fundamental en la regulación de la motilidad, secreción y sensibilidad del tracto gastrointestinal a través de la activación de numerosos receptores distribuidos ampliamente en los nervios entéricos y aferentes sensoriales (44, 45). Sus acciones son muy complejas y puede producir contracción del músculo liso al estimular nervios colinérgicos o relajación por estimulación de neuronas inhibidoras que liberan óxido nítrico (46). La 5HT se libera en la mucosa tanto en las neuronas sensoriales intrínsecas como en las extrínsecas. En las primeras, inicia reflejos peristálticos y secretorios a través de receptores 5HT4 y las últimas modulan la sensibilidad vía receptores 5 HT3. Los receptores 5HT4 están localizados sobre las células enterocromafines, musculares lisas, y sobre las neuronas (43). La liberación de 5HT de las células enterocromafines es uno de los iniciadores de la peristalsis a través de los 5HT4 sobre los eferentes primarios (43, 45). Los receptores 5HT3 están distribuidos sobre las neuronas motoras entéricas, terminales periféricas de aferentes viscerales y en el sistema nervioso central (centro del vómito) (43, 45). El antagonismo de esos receptores reduce el dolor visceral, el tránsito colónico y las secreciones del intestino delgado (47).
La 5HT también modula la sensibilidad por los aferentes vagales sensoriales (44). A nivel central participa en la regulación del estado de ánimo, de la función sexual y del apetito (44).
En pacientes con SII diarrea predominante, se han encontrado niveles elevados de 5HT postprandial (44, 45).
Con base en lo anterior, puede resumirse que probablemente las diferentes alteraciones mencionadas, interactúan de manera variable con el medio ambiente y desencadenan el SII.
TRATAMIENTO
Hasta el momento, ningún medicamento de los actualmente disponibles alivia todas las manifestaciones del SII, como tampoco cura o modifica el curso de la enfermedad. Solamente en algunos pacientes se alivia transitoriamente la sintomatología ya que la respuesta de estos pacientes al placebo, varía desde 16 a 71% (46) y además, es improbable que cualquier medicamento que interactúe con un receptor específico bien sea como agonista o antagonista, pueda suprimir todas las diferentes manifestaciones intestinales y extraintestinales que se presentan en el SII. En cualquier caso, independientemente, del abordaje terapéutico utilizado, un manejo eficaz requiere una excelente relación médico-paciente.
Clásicamente el tratamiento farmacológico está dirigido al síntoma predominante, pero la clasificación en diferentes tipos o patrones de la enfermedad, sigue siendo controvertida, ya que hay fluctuaciones impredecibles de los diferentes patrones clínicos y los criterios actualmente utilizados para definir los patrones de hábito intestinal son arbitrarios.
Los diferentes subgrupos de los criterios de ROMA II fueron determinados por opinión de expertos y no basados en la evidencia y hasta el momento no han sido validados (47, 48).
El subgrupo de síntomas alternantes al parecer representa entre el 19 y 63% de todos los pacientes con SII (49, 50) y los criterios de ROMA II no dan recomendaciones para su identificación y no hay acuerdo universal sobre los síntomas en los cuales se basa esta clasificación, como tampoco se ha definido con exactitud en que consiste la alternancia.
Pimentel y col (50) han propuesto un cuestionario con un puntaje para evaluar la severidad de la diarrea y del estreñimiento que permite identificarlos y excluir los que tienen diarrea o estreñimientos puros o dominantes.
Como se mencionó previamente, la piedra angular del tratamiento en los pacientes con SII es una fuerte relación médico paciente; cuando existe empatía se disminuye de manera notable, el número de consultas de estos pacientes (51) y por lo tanto la consulta por sí misma debe ser un evento terapéutico.
Las opciones de tratamiento farmacológico en los pacientes con SII se pueden dividir en dos categorías:
1. Tratamientos del órgano blanco, esto es, medica-mentos dirigidos al intestino y seleccionados de acuerdo al síntoma predominante.
2. Medicamentos que actúen a nivel del sistema nervioso central (SNC).
El 70% de los pacientes tienen manifestaciones leves, el 20% moderadas y el 5% severas (52). Estos últimos pacientes a menudo requieren un tratamiento interdisciplinario con gastroenterólogos y psicólogos expertos en la entidad.
Los pacientes con síntomas leves, usualmente no requieren tratamientos farmacológicos, siendo de gran ayuda las recomendaciones dietéticas fibra, etc. Cuando se decide utilizar medicamentos, se debe informar al paciente que debe ser usado durante la recurrencia de los síntomas y no de manera permanente (8). El tratamiento de los pacientes con SII según el síntoma predominante se muestra en la tabla 3 (17).
Tabla 3. Tratamiento de SII
Dolor predominante
Para este síntoma se utilizan antiespasmódicos y antidepresivos tricíclicos (6-8, 17, 18, 22, 24). Los antiespasmódicos se clasifican en tres categorías (8):
1. Anticolinérgicos (ej. Cimetropium, hiosciamina, diciclomine).
2. Relajantes del músculo liso, que son medicamentos papaverina-like (Meveberine), que inhiben directa-mente la contracción de la fibra muscular lisa aumentando los niveles de AMPc o interfiriendo con el pool de calcio intracelular.
3. Bloqueadores del canal de calcio, como la nifedipina y el pinaverio.
En dos metaanálisis recientes, se concluyó que diversos miorrelajantes son superiores a un placebo (53, 54). Los diferentes medicamentos incluidos en este estudio, con eficacia y sin efectos colaterales fueron el bromuro de otilonium, y el cimetropium. La trimebutina, mebeverina, hiosciamina y pinaverio no fueron mejor que un placebo (53). En un metaanálisis publicado este año, Quartero et al (55) concluyeron que el pinaverio y la escopolamina fueron eficaces en términos de mejoría del dolor abdominal y síntomas globales del SII. Estos medicamentos no están disponibles en Estados Unidos y en ese país la piedra angular del tratamiento son los anticolinérgicos como diciclomine, belladona y hiosciamina (17, 18).
Los antiespasmódicos tomados 30 minutos antes de las comidas pueden ser efectivos en controlar el dolor abdominal posprandial. Las preparaciones sublinguales parecen ser útiles a demanda, pero no hay estudios formales que los hayan evaluado (8).
Los antidepresivos tricíclicos en bajas dosis han demostrado eficacia superior a placebo para aliviar el dolor abdominal con un NNT de 3 (56). Efectos colaterales de estas drogas incluyen sedación, sequedad de ojos y boca, aumento de peso. La disipramina también tuvo superioridad a placebo (60% vs. 47%) en quienes no tenían depresión y en los que tenían diarrea (57).
Los inhibidores selectivos de la recaptación de serotonina tienen menos efectos colaterales que los antidepresivos tricíclicos y teóricamente tendrían más beneficio en pacientes con estreñimiento ya que aceleran el tiempo de tránsito orocecal (6, 27, 28).
Diarrea predominante
En estos pacientes se utilizan los medicamentos antidiarreicos clásicos como la loperamida y el difenoxilato. La loperamida, un derivado butiramida, es superior a placebo en los casos de diarrea (58, 59) y es preferible al difenoxilato porque carece de actividad opioide a dosis convencionales y no cruza la barrera hematoencefálica (59). Los estudios clínicos han demostrado que la loperamida disminuye significativamente la diarrea, la urgencia y el escurrimiento rectal (58, 59) y puede aumentar el tono rectal. Ambos son más útiles de manera profiláctica para prevenir episodios predecibles de diarrea desencadenados por el estrés, etc. (58). Su eficacia se debe a la inhibición de la secreción intestinal y al aumento de la absorción de líquidos y electrolitos al aumentar el tiempo del tránsito intestinal.
Colestiramina y colestipol: medicamentos secuestradores de sales biliares que teóricamente podrían ser de utilidad en el grupo de pacientes con SII con diarrea y con alteración del metabolismo de las sales biliares, (mayor cantidad de los mismos transportados del ileum al colon). Si bien no han sido estudiados en SII en ensayos clínicos controlados (17, 60, 61), podrían adicionarse de manera empírica en pacientes con diarrea refractaria.
El alosetron, un antagonista 5HT3, fue más eficaz que placebo en pacientes con SII diarrea predominante (62-65). En noviembre de 2000, el medicamento fue retirado voluntariamente del mercado por el fabricante, después que la FDA recibió 49 informes de colitis isquémica, 21 casos de estreñimiento severo, 44 hospitalizaciones, diez intervenciones quirúrgicas y tres muertes, todos relacionados con el medicamento (66). Se estimó que la colitis isquémica podía ocurrir en uno por cada 350 pacientes y el estreñimiento severo en uno por cada 1000 pacientes tratados por seis meses (64). En junio de 2002, la FDA permitió su reintroducción por la fuerte presión cientos de consumidores y fue recomendado con indicaciones muy precisas, con la mitad de la dosis previa (1 mg una vez al día durante 4 semanas), intentarlo solamente después de que otros medicamentos han fracasado y totalmente contraindicado en casos de estreñimiento (62, 66).
El cilansetrón otro antagonista 5HT3 se encuentra en avanzados estudios de fase III y se esperan sus resultados (6).
Estreñimiento predominante
En los pacientes con este síntoma predominante, los suplementos de fibra son la primera elección y aunque hay controversia, un reciente metaanálisis mostró beneficio para el estreñimiento pero no para los síntomas globales (67). La fibra insoluble puede exacerbar los síntomas en SII y la fibra soluble alivia el estreñimiento, pero no el dolor (67, 68). La fibra soluble incluye el psyllium, isphagula, policarbofilo de calcio y la insoluble, salvado de trigo y fibra de maíz. La fibra soluble es disuelta en el agua, formando un gel que es fermentado por las bacterias colónicas produciendo gas y ácidos grasos de cadena corta, los cuales aceleran el tránsito de las heces y facilitan la defecación (69). La insoluble sufre mínimos cambios en el tracto digestivo, produce aumento en la masa fecal y también acorta el tránsito del colon (69).
El abordaje para estos pacientes es aumentar la fibra de la dieta de manera gradual, aproximadamente 20-25 gr/día durante algunas semanas y si esta dieta fracasa, entonces adicionar psyllium iniciando con dosis de 4 a 6 gr/día y aumentado a 10-12 gr/día en dos a tres semanas (17). Es necesario advertir al paciente que puede presentar distensión abdominal, especialmente al inicio del tratamiento pero esta molestia usualmente desaparece después (17). Cuando no se logra mejoría con la fibra, el próximo paso es utilizar laxantes preferiblemente iniciando con los osmóticos (leche de magnesia, lactulosa, sorbitol) (17,62) o con polietilenglicol que frecuentemente es mejor tolerado en pacientes con SII (62), aunque no hay estudios clínicos controlados en estos pacientes. Los laxantes estimulantes (bisacodilo, sen, fenolftaleina, ácido ricinoleico, cáscara sagrada y otros derivados del dantrum), aunque son comúnmente utilizados motu proprio por los pacientes con SII, no existen estudios controlados y utilizados crónicamente pueden producir colon catártico con distensión, atonía del colon y empeoramiento del estreñimiento (69).
El tegaserod, un agonista parcial de 5HT4 es un proquinético que también puede modular las vías sensoriales, estimular el peristaltismo y aumentar la motilidad del intestino delgado y del colon (70). Aunque es considerado agonista selectivo para 5HT4, Beatti el al (71) encontraron que tegaserod es antagonista del receptor 5HT2B. La estimulación del 5HT2B, teóricamente puede aumentar la contractilidad del músculo liso intestinal y su inhibición, se disminuiría la actividad proquinética del tegaserod. Se ignora si esto realmente puede ocurrir ya que dicho receptor se expresa fundamentalmente en la vida temprana (71).
En tres ensayos controlados se demostró mayor eficacia de tegaserod que un placebo en mujeres con SII y estreñimiento predominante (72-74). En estos trabajos hubo insuficiente número de hombres y por lo tanto no se pudo determinar la eficacia en los mismos. Este medicamento fue aprobado por la FDA para mujeres durante 12 semanas, con SII y estreñimiento predominante, pero la Unión Europea aún no lo aprobado. El medicamento está contraindicado en alteración hepática moderada a severa, en insuficiencia renal severa y según la FDA también en pacientes con adherencias intestinales, enfermedad del tracto biliar y antecedentes de obstrucción intestinal (75).
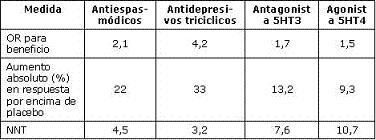
La ganancia sobre placebo en términos de alivio global fue 13% en el primer mes y 5% al final del trabajo (80) con un NNT de 10, que aunque significativo, es relativamente modesto (75). En un reciente metaanálisis (76) de siete estudios en mujeres con SII y estreñimiento predominante, tegaserod fue superior a placebo con dosis de 12 mg (RR de responder 1,19, IC 95% 1,09-1,29) con un NNT de 14. A pesar de que se ha demostrado un benéfico estadísticamente significativo sobre el placebo, algunos autores se preguntan si este pequeño efecto es clínicamente importante y si ganancias terapéuticas similares pueden ser obtenidas con fibra o laxantes (6). En la consulta diaria, donde se atienden pacientes de la vida real, la experiencia que tenemos en pacientes con SII y estreñimiento severo, es excelente y muchos de ellos manifiestan su satisfacción con el medicamento, al igual que los pacientes con estreñimiento funcional sin SII. Con respecto a la seguridad de tegaserod, un metaanálisis demostró que durante el tratamiento con este medicamento no hay mayor número de cirugías abdominopélvicas como tampoco de colecistectomías (77). El impacto de algunos de los principales medicamentos utilizados en el SII, se muestra en la tabla 4 (68).
Tabla 4. Impacto de medicamentos utilizados en SII.
Modificado de ref. 68.
La colchicina aumenta los movimientos intestinales, acelera el tránsito colónico y ha sido utilizada con éxito en pacientes con estreñimiento crónico funcional refractario con dosis de 0,6 mg tres veces al día (78, 79), pero hasta el momento no se ha estudiado en pacientes con SII. Por su bajo precio y su buen perfil de seguridad, en nuestro grupo actualmente la utilizamos frecuentemente en pacientes con SII (Observaciones no publicadas).
TERAPIAS ALTERNATIVAS
Los tratamientos actualmente disponibles tienen eficacia limitada y por ello muchos pacientes buscan tratamientos con medicinas alternativas incluyendo acupuntura y hierbas chinas pero desafortunadamente con éstas no hay suficientes ensayos clínicos y por lo tanto se desconoce la eficacia de los mismos (80).
Probióticos
Teniendo en cuenta la evidencia sobre una anormal composición de la flora bacteriana en pacientes con SII, los probióticos se han considerado que pueden ser una alternativa útil (81). Un reciente estudio con una mezcla de probióticos encontró que hubo eficacia en aliviar los síntomas (82).
Referencias
1. Otero W. Gómez M. Síndrome de intestino irritable: Revisión concisa. Revista Peruana de Gastroenterologia 2005; 25: 189-197. [ Links ]
2. Drossman DA, Camilleri M, Mayer EA, et al AGA technical review on irritable bowel syndrome. Gastroenterology 2002; 123: 2108-2131. [ Links ]
3. Olden KW, Drossman DA. Psychological and psychiatric aspects of gastrointestinal disease. Med Clin North Am 2000; 84: 1313-1327. [ Links ]
4. Everhart JE, Renault PF. Irritable bowel syndrome in office-based practice in the United States. Gastroenterology 1991; 100: 998-1005. [ Links ]
5. Drossman DA, Li Z, Andruzzi E, et al. U.S. householder survey of functional gastrointestinal disorders. Prevalence, sociodemography, and health impact. Dig Dis Sci 1993; 38: 1569-1580. [ Links ]
6. Farthing MJG. Treatment options in irritable bowel syndrome. Best Pract Res Clin Gastroenterol 2004; 18: 773-786. [ Links ]
7. Lacy BL. Irritable bowel síndrome: a primer on management. Rev Gastroenterol Dis 2003; 3 (Suppl 3): S32-42. [ Links ]
8. De Giorgio R, Brbara G, Stanghellini V, et al. Diagnosis and Therapy of irritable bowel syndrome. Aliment Pharmacol Ther 2004; 20 (Suppl 2): 10-22). [ Links ]
9. Saito YA, Schoenfeld P, Locke GR. The epidemiology of irritable bowel syndrome in North America: A systematic review. Am J Gastroenterol 2002; 97: 1910-1915. [ Links ]
10. Hahn BA, Yan S, Strassels S. Impact of irritable bowel syndrome on quality of life and resource use in the United States and United Kingdom. Digestion 1999; 60: 77-81. [ Links ]
11. Longstreth GF, Yao JF. Irritable bowel syndrome and surgery: a multivariate analysis. Gastroenterology 2004; 126: 1665-1673. [ Links ]
12. Talley NJ. Unnecesary abdominal and back surgery in irritable bowel syndrome: time to stem the flood now? Gastroenterology 2004; 126: 1899-1902 (Ed). [ Links ]
13. Frank K, Kleinman L, Rentz A, et al. Health-related quality of life associated with irritable bowel syndrome: comparison with other chronic diseases. Clin Ther 2002; 24: 675-689. [ Links ]
14. Talley NJ, Spiller R. Irritable bowel syndrome: a little understood organic bowel disease? Lancet 2002; 360: 555-564. [ Links ]
15. Gralnek IM, Hays RD, Kilbourne A. et al. The impact of irritable bowel syndrome on health-related quality of life. Gastroenterology 2000; 119: 654-660. [ Links ]
16. El-Serag H, Olden K, Bjorkman D. Health-related quality of life among persons with irritable bowel syndrome: a systematic review. Aliment Pharmacol Ther 2002; 16: 1171-1185. [ Links ]
17. Sommers SC, Lembo A, Irritable bowel syndrome: evaluation and treatment. Gastroenterol Clin North Am 2003; 32: 507-529. [ Links ]
18. Camilleri M. Management of the Irritable Bowel Syndrome. Gastroenterology 2001; 120: 652-68. [ Links ]
19. El-Serag HB, Pilgrim P, Schoenfield P. Systematic review: natural history of irritable bowel syndrome. Aliment Pharmacol Ther 2004; 19: 861-870. [ Links ]
20. Cash BD, Schoenfeld P, Chey WD. The utility of diagnostic test in irritable bowel syndrome patients: a systematic review. Am J Gastroenterol 2002; 97: 2812-2819. [ Links ]
21. Sanders DS, Carter MJ, Hurlstone DP, et al. Association of adult coeliac disease with irritable bowel syndrome: a acese-control study in patients fullfilling ROME II criteria referred to secondary care. Lancet 2001; 358: 1504-1508. [ Links ]
22. Drossman DA, Camilleri M, Mayer EA, et al. AGA technical review on irritable bowel syndrome. Gastroenterology 2002; 123: 2108-2131. [ Links ]
23. Spiegel BMR, de Rosa VP, Gralnek IM, et al. Testing for celiac sprue in irritable bowel syndrome with predominant diarrhea: a cost effectiveness analysis. Gastroenterology 2004; 126: 1721-1732. [ Links ]
24. Somers S, Lembo A. Irritable bowel syndrome: evaluation and treatment. Gastroenterol Clin N Am 2003; 32: 507-529. [ Links ]
25. Olden KW. Irritable bowel syndrome: an overview of diagnosis and pharmacologic treatment. Clev Clin J Med 2003; 70 (Suppl 2): S3-S7. [ Links ]
26. Camilleri M, Heading RC, Thompson WG. Clinical perspectives, mechanisms, diagnosis and management of irritable bowel syndrome. Aliment Pharmacol Ther 2002; 16: 1407-1430. [ Links ]
27. Camilleri M. Mechanisms in IBS: something old, something new, something borrowed Neurogastroenterol Motil 2005; 17: 311-16. [ Links ]
28. Barbara G, De Giorgio R, Stanghellini V, et al. New pathophysiogical mechanisms in irritable bowel syndrome. Aliment Pharmacol Ther 2004; 20 (Suppl 2): 1-9. [ Links ]
29. Spiller RC. Infection, immune function and functional gut disorders. Clin Gastroenterol Hepatol 2004; 2: 445-455. [ Links ]
30. Spiller RC. Postinfectious irritable bowel syndrome. Gastroenterologyn 2003; 124: 1662-1671. [ Links ]
31. Gwee KA, Collins SM, Read NW, et al. Increased rectal mucosal expression of interleukin 1beta in recently acquired postinfectious IBS Gut 2003; 52: 523.526. [ Links ]
32. O´Sullivan MA. Gastroenterology 2000; 118: A702. [ Links ]
33. Yeo A, Boyd P, Lumsden S, et al. Association between a functional polymorphism in the serotonin transporter gene and diarrhea predominant irritable bowel syndrome in women. Gut 2004; 53: 1452-1458. [ Links ]
34. Neal KR, Barker L, Spiller RC. Prognosis in post-infective irritable bowel syndrome: a six year follows up study. Gut 2002; 51: 410-413. [ Links ]
35. Levy RL, Jones KR, Whitehead WE, et al. Irritable bowel syndrome in twins: hereditary and social learning both contribute to etiology. Gastroenterology 2001; 121: 799-804. [ Links ]
36. Locke GR, Zinsmeister AR, Talley NJ, et al. Familial association in adults with functional gastrointestinal disorders. Mayo Clin Proc 2000; 75: 907-912. [ Links ]
37. Gonsalkorale WM, Perrey C, Pravica V, et al. Interleukin 10 genotypes in irritable bowel syndrome: evidence for an inflammatory component? Gut 2003; 52: 91-93. [ Links ]
38. Camilleri M. Review article: Tegaserod. Aliment Pharmacol Ther 2001; 15: 277-289. [ Links ]
39. Talley NJ. Serotoninergic neuroenteric modulators. Lancet 2001; 358: 2061-2068. [ Links ]
40. De Ponti F, Tonini M. Irritable bowel syndrome: new agents targeting serotonin receptor subtypes. Drugs 2001; 61: 317-332. [ Links ]
41. Kim DY, Camilleri M. Serotonin: a mediator of the brain-gut connection. Am J Gastroenterol 2000; 95: 2698-2709. [ Links ]
42. Koslowski CM, Green A, Grundy D, et al. The 5-HT3 receptor antagonist alosetron inhibits the colorectal distention induced depressor response and spinal c-fos expression in the anaesthetized rat. Gut 2000; 46: 474-480. [ Links ]
43. Bearcroft CP, Perrett D, Farthing MJG. Postprandial plasma 5 hydroxytriptamine in diarrhea predominant irritable bowel syndrome: a pilot study. Gut 1998; 42: 42-46. [ Links ]
44. Houghton LA, Atkinson W, Whitaker RP, et al. Increased platelet depleted plasma 5 hydroxytriptamine concentration following meal ingestion in symptomatic female subjects with diarrhea-predominant irritable bowel syndrome. Gut 2003; 52: 663-670. [ Links ]
45. Talley NJ. Pharmacologic therapy for the irritable bowel syndrome. Am J Gastroenterol 2003; 98: 750-758. [ Links ]
46. Patel SM, Stason WB, Legedza A, et al. The placebo effect in irritable bowel syndrome trials: a meta-analysis. Neurogastroenterol Motil 2005; 17: 332-40. [ Links ]
47. Walter SA, Skagerström E, Bodemar G. Subgroups of irritable bowel syndrome: a new approach. Eur J Gastroenterol Hepatol 2004; 16: 991-994. [ Links ]
48. Mearin F, Balboa A, Badia X, et al. Irritable bowel syndrome subtypes according to bowel habit: Revisiting the alternative subtype. Eur J Gastroenterol Hepatol 2003; 15: 165-172. [ Links ]
49. Hungin AP, Whorwell PJ, Tack J, et al. The prevalence, patterns and impact of irritable bowel syndrome: an international survey of 40.000 subjects. Aliment Pharmacol Ther 2003; 15: 643-50. [ Links ]
50. Pimentel M, Park S, Kong Y. Testing a definition of predominantly alternating bowel habits in IBS using the previously validated Rome Composite Score (RCS) Questionnaire. Gastroenterology 2004; 126 (Suppl.2): A373-A374. [ Links ]
51. Ilnychyj A, Graff LA, Blanchard JF, et al. Therapeutic value of a gastroenterology consultation in irritable bowel syndrome. Aliment Pharmacol Ther 2003; 17: 871-880. [ Links ]
52. Drossman DA. Irritable Bowel Syndrome. Syllabus ACG, 2000; 261-73. [ Links ]
53. Poynard T, Regimbeau C, Benhamou Y. Meta-analysis of muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2001; 15: 355-61. [ Links ]
54. Lesbros-Pantoflickova D, Micchetti P, Fried M, et al. Meta-analysis: the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2004; 20: 1253-1269. [ Links ]
55. Quartero AO, de Wit NJ, Meiniche-Schmidt V, et al. Spasmolytic agents for the treatment of irritable bowel syndrome; a meta-analysis. Gastroenterology 2004; 126(suppl2): A644. [ Links ]
56. Jackson JL, O,Malley PG, Tomplans G, et al. Treatment of functional gastrointestinal disorders with anti-depressant medications: A meta-analysis. Am J Med 2000; 108: 65-72. [ Links ]
57. Drossman DA, Toner BB, Whitehead WE, et al. Cognitive-behavioral therapy versus education and disipramine versus placebo for moderate to severe functional bowel disorders. Gastroenterology 2003; 125: 19-31. [ Links ]
58. Efskind PS, Bernklev T, Vatn MH. A double-blind placebo-controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol 1996; 31: 463-468. [ Links ]
59. Cann PA, Read NW, Holdsworth CD, et al. Role of loperamide and placebo in management of irritable bowel syndrome. Dig Dis Sci 1984; 29: 239-247. [ Links ]
60. Efskind PS, Bernklev T, Vatn MH. A double-blind placebo-controlled trial with loperamide in irritable bowel syndrome. Scand J Gastroenterol 1996; 31: 463-468. [ Links ]
61. Jailwala JM, Imperiale TF, Kroenke K. Pharmacologic treatment of the irritable bowel syndrome: a systematic review of randomized, controlled trials. Ann Intern Med 2000; 133: 136-47. [ Links ]
62. Talley NJ. Evaluation of drugs treatment in irritable bowel syndrome. Br J Clin Pharmacol 2003; 56: 362-369. [ Links ]
63. Camilleri M, Borntcutt AR, Kong S, et al. Efficacy and safety of alosetron in women with irritable bowel syndrome: a randomized, placebo-controlled trial. Lancet 2000; 355: 1035-1040. [ Links ]
64. Lembo T Wrigth RA, Bagby B, et al. Lotronex Investigator Team. Alosetron controls bowel urgency and provides global symptom improvement in women with diarrhea-predominant irritable bowel syndrome. Am J Gastroenterol 2001; 96: 2662-2670. [ Links ]
65. Camilleri M, Chey WY, Mayer EA, et al. A randomized controlled clinical trial of the serotonin type 3 receptor antagonist alosetron in women with diarrhea-predominant irritable bowel syndrome. Arch Intern Med 2001; 161: 1733-1740. [ Links ]
66. Lievre M. Alosetron for irritable bowel syndrome. Br Med J 2002; 325: 555-556. [ Links ]
67. Bijkerk CJ, Muris JWM, Knottnerus JA, et al. Systematic review:the role of different types of fiber in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther 2004; 19: 245-251. [ Links ]
68. Mertz HR. Irritable bowel syndrome. N Engl J Med 2003; 349: 2136-2146. [ Links ]
69. Aponte L, Lizarazo J, Otero W, et al. Tratamiento médico del estreñimiento crónico. En Otero W, Padron J, Pineda L, Arbeláez V (eds). Estreñimiento crónico: Fisiopatología, diagnóstico y tratamiento. 1era ed. Bogotá, Colombia, ServiOffset Ltda, 2000: 63-84. [ Links ]
70. Camilleri M. Review article: Tegaserod. Aliment Pharmacol Ther 2001; 15: 277-289. [ Links ]
71. Beattie DT, Armstrong SR, Humphrey PPA, et al. Tegaserod is a potent 5HT2B antagonist in vitro and in vivo. Gastroenterology 2004; 126 (Suppl 2): A276. [ Links ]
72. Müller-Lisner SA, Fumagalli I, Bardham KD, et al. Tegaserod 5Ht4 receptor partial agonist relieves symptoms in irritable bowel syndrome patients with abdominal pain, bloating and constipation. Aliment Pharmacol Ther 2001; 15: 1655-1666. [ Links ]
73. Novick J, Miner P, Krause R, et al. A randomized, double blind, placebo controlled trial of tegaserod in female patients suffering from irritable bowel syndrome with constipation. Aliment Pharmacol Ther 2002; 16: 1877-1888. [ Links ]
74. Kellow J, Lee OY, Chang FY, et al. An Asia-pacific, double blind, placebo controlled randomized study to evaluate the efficacy, safety, and tolerability of tegaserod in patients with irritable bowel syndrome. Gut 2003; 52: 671-676. [ Links ]
75. Talley NJ. Pharmacologic therapy for the irritable bowel syndrome. Am J Gastroenterol 2003; 98: 750-758. [ Links ]
76. Evans B, Clark W, Moore D, et al. Tegaserod for the treatment of irritable bowel syndrome. Cochrane database Syst Rev 2004; 1: CD003960. [ Links ]
77. Schoenfield P. Systematic review: incidence of abdominopelvic surgery amongst patients using tegaserod in randomized controlled trials. Aliment Pharmacol Ther 2004: 19: 263-269. [ Links ]
78. Verne GN Eaker EY, Davis RH, et al. Colchicine is an affective treatment for patients with chronic constipation: an open –label trial Dig Dis Sci 1997; 42: 1059-1073. [ Links ]
79. Verne GN, Davis RH, Robinson ME, et al. Treatment of chronic constipation with colchicine: randomized, double blind, placebo-controlled, crossover. Am J Gastroenterol 2003; 98: 1112-1116. [ Links ]
80. Tillisch K, Chang L. Diagnosis and treatment of irritable bowel syndrome: state of the art. Curr Gastroenterol Rep 2005; 7: 249-56. [ Links ]
81. Verdu EF, Collins SM, Irritable bowel syndrome. Best Pract Res Clin Gastroenterol 2004; 18: 315-21. [ Links ]
82. Kajander K, Hatakka K, Poussa T, et al. A probiotic mixture alleviates symptoms in irritable bowel syndrome patients: a controlled 6 month intervention. Aliment Pharmacol Ther 2005; 22: 387-94. [ Links ]