Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.24 n.3 Bogotá jul./sep. 2009
Etiología de las úlceras duodenales en una población colombiana
Etiology of duodenal ulcers in a Colombian population
William Otero Regino, MD (1), Martín Gómez Zuleta MD (2), Xiomara Ruiz Lobo, MD (3)
(1) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia, Gastroenterólogo, Clínica Fundadores, Clínica Carlos Lleras Restrepo, Fundación Hospital San Carlos, Bogotá, Colombia.
(2) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia, Gastroenterólogo, Hospital El Tunal, Clínica Carlos Lleras Restrepo, Fundación Hospital San Carlos, Bogotá, Colombia.
(3) Gastroenteróloga, Hospital El Tunal, SaludCoop, Clìnica carlos Lleras, Fundación Hospital San Carlos, Bogotá, Colombia.
Fecha recibido: 22-04-09 Fecha aceptado: 18-08-09
Resumen
Introducción. En la última década en USA, se ha documentado disminución de las UDs secundarias a H. pylori y recíprocamente aumento de las asociadas a AINES, y las idiopáticas (H. pylori y AINES negativos). Teniendo en cuenta el desconocimiento de estas etiologías en nuestro medio, se decidió realizar el presente trabajo.
Materiales y métodos. Se incluyeron pacientes adultos, reclutados prospectivamente en las unidades de Gastroenterología del Hospital El Tunal y de la Clínica Fundadores, de Bogotá, Colombia, a quienes se les diagnosticó úlcera duodenal mediante endoscopia digestiva alta.
Resultados. Se reclutaron 104 pacientes con UD, edad promedio 56 +/- 13 años, 61% hombres. La infección por H. pylori se identificó en 76 pacientes (73%), en 31 pacientes (29,8%) se documentó utilización de AINES e infección simultánea por H. pylori. En 12 pacientes (11.5%) había consumo de AINES sin infección por H. pylori. En 15 pacientes (14,3%) no se encontró H. pylori ni habían consumido AINES/ASA, representando las úlceras idiopáticas.
Conclusiones. Las UDs H. pylori (-) y AINES/ASA (-) representaron el 15%, justificando iniciar estudios para determinar las causas responsables. Las secundarias a AINES solo fueron del 12%. H. pylori fue la primera causa de UD (74%). Con base en este último resultado, se podría considerar erradicar H. pylori si no se pudieran realizar pruebas diagnósticas para el mismo.
Palabras clave
Helicobacter, AINES, úlceras duodenales Hp (-), úlceras duodenales AINES/ASA (-)
Summary
Introduction. In the last decade in the United States it had documented lowering of duodenal ulcers secondary to Helicobacter pylori y reciprocally increase of that associated to NSAID as also of the idiopathic ulcers H. pylori (-), NSAID/Aspirin (-). We aimed to assess the prevalence rates of H. pylori also as NSAID/Aspirin.
Materials and Methods. We include adult patients who underwent esophagogastroduodenoscopies (EGD) in the Hospital el Tunal and Clínica Fundadores.
Results. Between January 2007 to november 2008, we recollect 104 patients with duodenal ulcer with a mean (+/-SD) age of 56 (+/-13) years, 61% men. The infection by H. pylori has be identificated in 76 patients (73%), in 12 patients (11.5%) NSAID/Aspirin, both risks factors in 31 patients (29.8%) and any risk factors in 12 patients (11.5%).
Conclusions. The duodenal ulcers H. pylori (-), NSAID/Aspirin (-) represent 14.4% so is necessary to begin additional studies for to determine responsible causes. The NSAID/Aspirin secondary was only of 12%. H. pylori was the first cause of duodenal ulcers. With that last result we can consider to eradication of this infection if we cant realize diagnostic proofs for H. pylori infection.
Key words
Helicobacter, duodenal ulcers, Hp (-), NSAID/Aspirin (-) duodenal ulcer.
Introducción
Desde el descubrimiento de Helicobacter pylori (H. pylori), en 1982 (1), diversos estudios han demostrado de manera consistente que es el principal agente etiológico de la gastritis crónica (GC) y de las úlceras pépticas (UPs) tanto gástricas como duodenales (2, 3). Asimismo se ha encontrado que la erradicación de esta infección es necesaria, para curar la GC y evitar la recurrencia de las Ups (úlceras pépticas) (4-8) y está bien documentado, que la erradicación de H. pylori es más eficaz que los antisecretores de ácido para la curación de las úlceras duodenales (UDs) (8). Las principales causas de UDs son H. pylori y los antiinflamatorios no esteroideos (AINES), incluyendo aspirina (ASA) a dosis antitrombóticas (9-11). Existen causas menos usuales como hipersecreción de ácido diferentes a síndrome de Zollinger Ellison (ZE) y muy infrecuentemente enfermedad de Crohn, enfermedad de Becet, úlceras malignas, isquemia e infección por citomegalovirus (9-13). Los AINES y la infección por H. pylori, se consideran factores de riesgo independientes y sinérgicos para UPs complicadas y no complicadas (14). En diversos estudios, previamente se ha encontrado que H. pylori se encuentra en más del 90% de los pacientes con UDs y en el 70% de los pacientes con úlceras gástricas (15, 16). En otras publicaciones la prevalencia de la infección es del 100% en pacientes con UDs (17). Sin embargo, en la última década, se ha documentado que en algunas latitudes, epidemiología de los agentes etiológicos de las UPs ha cambiado conforme ha declinado la prevalencia de la infección por H. pylori y se ha incrementado la utilización de AINES y ASA (18). En Estados Unidos (USA), se ha encontrado que 20 a 40% de las UPs son idiopáticas, es decir, no están asociadas a H. pylori ni a AINES (18,19) y después de excluir la utilización de AINES, H. pylori se encontró en 61% de pacientes con UPs (19) y en un análisis de seis ensayos clínicos, que incluyó 2.900 pacientes, Ciociola encontró la infección en el 73% de los pacientes con UDs (20), en contraste con Japón en donde las UPs idiopáticas representan solamente el 1,3% y las secundarias a H. pylori siguen siendo altamente frecuentes (21). Diferentes guías de manejo como la del Colegio Americano de Gastroenterología (22) y el reciente consenso de Masstriccht III (23), recomiendan que todos los pacientes con úlcera duodenal infectados con H. pylori reciban tratamiento de erradicación con antibióticos junto con terapia antisecretora. Teniendo en cuenta el impacto de erradicar H. pylori en la úlcera duodenal y que en nuestro medio se desconoce la prevalencia de las diferentes causas, no obstante que desde hace casi dos décadas, utilizando coloración de Gram y/o cultivo, se encontró una prevalencia de H. pylori en el 80%, de las personas adultas (24), y en el 77% de los pacientes con UDs; se decidió llevar a cabo el presente trabajo para determinar la prevalencia de H. pylori, AINES/ASA y la ausencia de estos factores de riesgo en los pacientes a quienes se les diagnosticó esta entidad mediante endoscopia digestiva alta EVDA.
Materiales y métodos
Se incluyeron en el estudio los pacientes adultos, inmunocompetentes, mayores de 18 años, que acudieron a las unidades de gastroenterología del Hospital El Tunal y de la Clínica Fundadores y se les diagnosticó UD durante el período comprendido entre enero 2007 y noviembre del 2008. El protocolo de investigación y el consentimiento informado fueron aprobados por los respectivos comités de ética de las instituciones participantes. No obstante, la resolución 08430 de 1993 del Ministerio de Salud de Colombia, que cataloga el presente estudio como una investigación sin riesgo, que no requeriría consentimiento informado escrito, este se hizo por la eventualidad de que al paciente se le pudiera requerir para una entrevista adicional. Las características de cada paciente fueron consignadas en un formulario específicamente diseñado para los propósitos de la investigación.
Criterios de exclusión
Se excluyeron pacientes con tumores gástricos (adenocarcinoma linfoma, sarcoma, carcinoides, etc.), antecedente de cirugía gástrica previa, pacientes con VIH/SIDA, tratamiento con quimioterapia, enfermedad de Crohn, pacientes con enfermedad de Becet, pacientes con pérdida de peso mayor al 10% del peso usual, cirrosis, insuficiencia renal crónica avanzada (diálisis), trasplantes de órganos, diabetes descompensada, enfermedad maligna o coagulopatía, terapia previa de erradicación para H. pylori, o que estuvieran recibiendo terapia antisecretora o antibiótica en las últimas cuatro semanas, alcohólicos o quienes tuvieran contraindicación para realizar endoscopia digestiva alta (Infarto agudo del miocardio reciente, enfermedad cerebro vascular, falla cardíaca congestiva grado IV, falla respiratoria severa, sospecha perforación de víscera hueca, etc.), como tampoco las mujeres embarazadas y los pacientes que no aceptaron participar en el estudio y los que no firmaron el consentimiento informado.
La EVDA se realizó en la forma usual, en decúbito lateral izquierdo, después de seis horas o más de ayuno, sin sedación, utilizando endoscopios Olympus Exera CFQ145L o Fujynon 2200. Una úlcera fue definida como una lesión con pérdida de la integridad de la mucosa de 5 mm o más, con una profundidad aparente de 1 mm o más. El diámetro de la lesión se midió utilizando como guía una pinza estándar de biopsia gástrica, la cual, al estar abierta da un diámetro de 6 mm. Las úlceras de mayor tamaño no requirieron utilizar esta medida y la profundidad mayor o igual a 1 mm, se basó en la experiencia de los gastroenterólogos que realizaron las endoscopias (MG y WO). A todos los pacientes se les tomaron cuatro biopsias del estómago para histología con hematoxilina y eosina, dos del antro (curva mayor y curva menor) tomadas a dos a tres cm del píloro y dos del cuerpo (curva mayor y curva menor), tomadas a ocho cm del cardias (24). Si en hematoxilina y eosina no se identificaba H. pylori, se hacía coloración de Giemsa. Se tomó además una biopsia del antro para test de ureasa rápida utilizando una solución de urea y rojo fenol hecha por nosotros ("Homemade") de acuerdo a las recomendaciones publicadas sobre la misma (25). Se consideró que existía infección por H. pylori cuando este se detectó por ureasa rápida y/o histología.
La información se digitó en Excel 2003 y se depuró en el paquete estadístico Stata 9.0. En la descripción de las variables de estudio se utilizó estadística descriptiva. En variables categóricas nominales u ordinales se analizaron distribución de frecuencia y porcentajes. Las variables numéricas se expresaron con medidas de tendencia central y de dispersión. Las pruebas estadísticas se evaluaron a un grado de significancia del 5% (p<0,05). Las variables continuas se reportaron como frecuencias y promedios. Las diferencias entre los promedios se determinaron utilizando la t de student.
Resultados
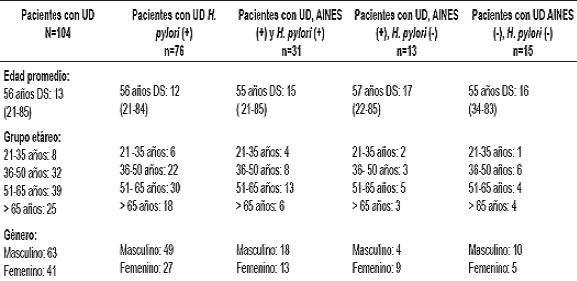
Durante el periodo comprendido entre enero del 2007 y octubre de 2008, se incluyeron 104 pacientes prospectivamente. La edad promedio fue de 56 +/- 13 años, el 61% fueron hombres. La infección por H. pylori se identificó en 76 pacientes (73%), en 31 pacientes (29,8%) se documentó el consumo de AINES y/o ASA y H. pylori, en 12 pacientes (11,5%) la causa de la UD era exclusivamente AINES (H. pylori negativos). En 15 pacientes (14,4%) no se encontró infección por H. pylori ni consumo de AINES. Entre los diferentes grupos no hubo diferencias estadísticamente significativas con respecto a promedio de edades ni escolaridad. Las características de los pacientes se muestran en la tabla 1.
Tabla 1. Características de los pacientes con úlcera duodenal.
Discusión
La prevalencia de H. pylori en las UDs de este estudio (73%), es inferior a la informada en otros países en la década de los 90 (>/=90%) (14, 15). Sin embargo, ignoramos si para nuestro medio significa alguna modificación o no de prevalencias previas, ya que no encontramos estudios al respecto y en el trabajo publicado por el grupo de la Universidad Nacional (24), la prevalencia global de la misma fue de 80% en personas mayores de 30 años, y en los pacientes con UD en el 77%, la cual es similar a la encontrada en esta investigación, aunque existe la posibilidad de que en aquel trabajo, la frecuencia de la infección fuera más alta, ya que se determinó utilizando la coloración de Gram que tiene un rendimiento inferior de cultivo, y menor sensibilidad, si se les compara con otros métodos invasivos de detección como el test de ureasa rápida o histología con coloraciones complementarias como Giemsa o coloraciones de plata cuando el microorganismo no se encuentra con hematoxilina y eosina (HE) (22). Teniendo en cuenta la menor sensibilidad de las técnicas empleadas en el trabajo de la Universidad Nacional, nuestros hallazgos podrían sugerir, que en la actualidad, las UDs son menos frecuentemente secundarias a H. pylori. En un estudio realizado por Bravo y cols sobre la prevalencia de H. pylori en biopsias gástricas (27), se encontró que la prevalencia de la infección fue del 69,1%; sin embargo, esta cifra probablemente no refleja la prevalencia real de la infección en la población general, ya que son muestras de pacientes cuya historia se desconoce con respecto a terapias previas de erradicación, utilización o no de antisecretores o antimicrobianos, etc., que se sabe pueden influir en la detección de la infección (28), incluso cuando la infección se determina con pruebas tan sensibles como el test respiratorio de urea (28, 29); además, no se utilizaron coloraciones complementarias como Giemsa o coloraciones especiales, en los casos en que la hematoxilina y eosina fueron negativas, por lo cual se pudo haber subestimado adicionalmente el hallazgo de la infección (26). Encontrar H. pylori en el 73% de las UDs en el presente estudio refleja que en nuestro medio sigue siendo alta la prevalencia de la infección, aunque para tener datos más exactos y confiables, sobre la prevalencia en la población general, serían necesarios estudios bien diseñados, con un adecuado cálculo del tamaño de la muestra y controlando las variables ya mencionadas que influyen en la detección de la infección. El hallazgo de H. pylori en este estudio es similar al encontrado en un análisis de seis ensayos clínicos de USA (73%) hace una década (20). Sin embargo, en ese estudio fueron incluidos pacientes en quienes existía la sospecha de haber tomado antimicrobianos que pudieran haber suprimido temporalmente el crecimiento de H. pylori y de esa manera el resultado pudo haber sido erróneamente más alto, contrastando con el 61% encontrado en otro estudio de ese mismo país, publicado durante el mismo período (18). En este último estudio, cuando se estratificó la población, la infección se encontró en el 52% de la población blanca y en el 78% de los no blancos, cifra que es similar a la encontrada por nosotros, posiblemente reflejando similitudes socioeconómicas con esa población, pero de diez años antes. Consideramos que la relativamente alta frecuencia de la infección, aunque discutible, podría en algunos casos justificar el tratamiento empírico de erradicación si no se dispone de pruebas para su detección.
El hallazgo de 14% de UDs H. pylori (-) y AINES/ASA (-), es inferior al encontrado en USA que oscila entre el 40 y 27% (18,20), pero diez veces el encontrado en Japón (21) y más de quince veces del encontrado en España en una población con prevalencia de infección por H. pylori de más del 95% (17). En Italia, Meucci y cols (30) encontraron una prevalencia del 4,6% entre 409 úlceras pépticas. Aunque la definición de infección positiva utilizada por nosotros, combinando pruebas con alta sensibilidad y especificidad, test de ureasa rápida sensibilidad (S) 88-95% y especificidad (E) de 95-100% (28) y con histología S 99% cuando se toman tres biopsias (31), tendrían teóricamente mayor eficacia de encontrar la infección que utilizándolas por separado, y por lo tanto baja probabilidad de dar resultados falsos negativos. No descartamos que exista la posibilidad de error de las mismas, si en el interrogatorio el paciente hubiera omitido mencionar el antecedente de utilización de antisecretores, antibióticos o AINES/ASA. El consumo de AINES se ha considerado la causa más frecuente de úlceras pépticas en pacientes negativos para H. pylori, siendo su prevalencia de alrededor del 50% (32, 33), en contraste con el 12% encontrado por nosotros. Una posibilidad para esta notable diferencia podría ser que, en nuestro medio, el uso de AINES sea mayor al informado por los pacientes, probablemente debido al vago reconocimiento por parte de ellos de este tipo de medicamentos, de manera similar como se ha encontrado en otros países y, la utilización de ASA por ejemplo, se demostró mediante análisis de orina y de suero (34). No obstante que fuera improbable que esas circunstancias hayan influido de manera importante en los resultados, los de este estudio sugieren que en nuestro medio pueden existir otras causas de UDs, que tradicionalmente pueden haber sido enmascaradas por las principales causas de las mismas (H. pylori, AINES/ASA), y es necesario iniciar investigaciones al respecto y desde el punto de vista práctico, en pacientes con UDs se debe interrogar sobre otros medicamentos diferentes a AINES/ASA que puedan lesionar la mucosa gastroduodenal, tales como bifosfonatos, colchicina, clopidogrel, etc. (29) y si es negativo y el paciente no mejora con el tratamiento antisecretor, creemos que se justifica investigar las entidades que tradicionalmente se han considerado causas raras de UDs, tales como el ZE (con gastrina sérica), biopsias de los ángulos de la úlcera y de la mucosa adyacente, para descartar malignidad, linfoma, Crohn o Helicobacter heilmanii (29). Se ha informado que este último microorganismo puede producir UDs cuyo tratamiento sería con terapia cuádruple (35). En nuestro medio, la prevalencia del ZE en pacientes con úlceras pépticas es desconocido, aunque "coloquialmente" se le considera una entidad muy rara, al igual que en USA en donde se considera que UDs puede ser menor del 1% (36).
En conclusión, la infección por H. pylori es la principal causa de UDs en nuestra población y las UDs H. pylori (-) AINES/ASA (-) representan un grupo relativamente grande de las UDs, mayor que los AINES solos y por lo tanto, consideramos que son necesarios estudios adicionales para determinar las etiologías subyacentes.
Referencias
1. Warren JR, Marshall BJ. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983; 1: 1273-5. [ Links ]
2. Kuipers EJ, Thies JC, Festen HPM. The prevalence of Helicobacter pylori infection in peptic ulcer disease. Aliment Pharmacol Ther 1995; 9: 59-70. [ Links ]
3. Liu Yi Ponsioen CIJ, Xiao S, Tytgat GNJ, Ten FJW. Geographic pathology of Helicobacter pylori gastritis. Helicobacter 2005; 10: 107-113. [ Links ]
4. Tatsuta M, Lishi H, Yokata Y. Effects of helicobacter pylori infection on healing and recurrence of gastric ulcers. Am J Gastroenterol 1995; 90: 406-10. [ Links ]
5. Graham DY, Lew GM, Klein PD, Evans DG, Evans DJ, Jr, Saeed ZA, et al. Effect of treatment of Helicobacter infection on the long term recurrence of gastric or duodenal ulcer: A randomized, controlled study. Ann Intern Med 1992; 116: 705-8. [ Links ]
6. Tytgat GNJ. Treatments that impact favorably upon the eradication of Helicobacter pylori and ulcer recurrence. Aliment Pharmacol Ther 1994; 8: 359-68. [ Links ]
7. Logan RPH, Bardham, Celestin LR. Eradication of Helicobacter pylori and prevention of recurrence of duodenal ulcer: A randomized double blind, multicentric trial of omeprazole with or without clarithromycin. Alimen Pharmacol Ther 1995; 9: 417- 24. [ Links ]
8. Gisbert JP, Pajares JM. Systematic review and metanalysis: is 1 week proton pump inhibitor-based triple therapy sufficient to heal peptic ulcer? Aliment Pharmacol Ther 2005; 21: 795-804. [ Links ]
9. Dore MP, Graham DY. Pathogenesis of duodenal ulcer disease: the rest of story. Baillieres Best Pract Res Clin Gastroenterol 2000; 14: 97-107. [ Links ]
10. Chan FK. NSAID-induced peptic ulcers and Helicobacter pylori infection: implications for patient management. Drug Saf 2005; 28: 287-300. [ Links ]
11. Weisman SM, Graham DY. Evaluation of the benefits and risks of low-dose aspirin in the secondary prevention of cardiovascular and cerebrovascular events. Arch Intern Med 2002; 162: 2197-2202. [ Links ]
12. Yeomans ND, Lanas AI, Talley NJ, Thomson AB, Daneshjoo R, Ercksson B, et al. Prevalence and incidence of gastroduodenal ulcers during treatment with vascular protective doses of aspirin. Aliment Pharmacol Ther 2005; 22: 795-801. [ Links ]
13. Papatheodoridis GP, Sougioultzis S, Archimandritis AJ. Effects of Helicobacter pylori and Nonsteroidal anti-inflammatory drugs on peptic ulcer disease: A sytematic review. Clin Gastroenterol Hepatol 2006; 4: 130-42. [ Links ]
14. Marshall BJ, McGechie DB, Rogers PA, Glancy RJ. Pyloric Campylobacter infection and gastroduodenal disease . Ms J Aust 1985; 142: 439-44. [ Links ]
15. Graham DY, Klein P, Opekun AR, Malaty HM, Boutton TW. Effect of age on the frequency of active Campylobacter pylori infection diagnosed by the C13 urea breath test in normal subjects and patients with peptic ulcer disease. J Infect Dis 1988; 157: 777-80. [ Links ]
16. Cow DKL, Sung JY. Is the prevalence of idiopathic ulcers really on the increase? Nature Clin Pract Gastroenterol Hepatol 2007; 4: 176-77. [ Links ]
17. Gisbert JP, Blanco M, Mateos JM, Fernández-Salazar L, Fernández-Bermejo M, Cantero J, et al. H. pylori-negative duodenal ulcer prevalence and causes in 774 patients. Dig Dis Sci 1999; 44: 2295-302. [ Links ]
18. Jyotheeswaran, S, Shah, AN, Jin, HO, Potter GD, Ona FV, Chey Wy, et al. Prevalence of Helicobacter pylori in peptic ulcer patients in greater Rochester, NY: is empirical triple therapy justified? Am J Gastroenterol 1998; 93: 574-8. [ Links ]
19. Quan C, Tallley NJ. Management of peptic ulcer disease not related to Helicobacter pylori or NSAIDs. Am J Gastroenterol 2002; 97: 2950-61. [ Links ]
20. Ciociola AA, McSorley DJ, Turner K, Sykers D, Palmer J. Helicobacter pylori infection rates in duodenal ulcer patients in the United States may be lower than previously estimated. Am J Gastroenterol 1999; 94: 1834-40. [ Links ]
21. Nishikawa K, Sugiyama T, Kato M, Ishizuka J, Komatzu Y, Kagaya H, et al. Non- Helicobacter pylori and non-NSAID peptic ulcer disease in the Japanese population. Eur J Gastroenterol Hepatol 2000; 12: 635-40. [ Links ]
22. Chey WD, Wong BCY. American College of Gastroenterology guideline on the management of Helicobacter pylori infection. Am J Gastroenterol 2007; 102: 1808-1825. [ Links ]
23. Malfertheiner P, Megarud F, O`Morain C, Bazzoli F, El-Omar E, Graham DY, et al. Current concepts in the management of Helicobacter pylori infection: The Masstricht III consensus report. Gut 2007; 56: 772-81. [ Links ]
24. Sierra F, Gutiérrez O, Gómez MC, Camargo H, Serrano B, Otero W. Campylobacter pylori en úlcera duodenal, gastritis crónica y dispepsia no ulcerosa. Acta Med Col 1990; 15: 74-83. [ Links ]
25. El-Zimaity HM, Graham DY. Evaluation of gastric mucosal biopsy site and number for identification of Helicobacter pylori or intestinal metaplasia: role of the Sydney system. Human pathol 1999; 30: 72-7. [ Links ]
26. Genta RM, Graham DY. Diagnosis and treatment of Helicobacter pylori infection. En: Gastritis, Graham DY, Genta RM, Dixon MF, (eds) Lippincott Wiliams & Wilkins Phil 1999. p. 189-201. [ Links ]
27. Bravo LE, Cortés A, Carrascal E, Jaramillo R, García LS, Bravo PA, et al. Helicobacter pylori: Patología y prevalencia en biopsias gástricas en Colombia. Clomb Med 2003; 34: 124-31. [ Links ]
28. Megraud F, Lerhours P. Helicobacter pylori detection and antimicrobial susceptibility testing. Clinical Microbiol Rev 2007; 20: 280-322. [ Links ]
29. McKoll KEL. How I manage H. pylori-negative, ASAID/Aspirin negative peptic ulcers. Am J Gastroenterol 2009; 104: 190-93. [ Links ]
30. Meucci G, Di Battista R, Abbiati C, Benassi R, Bierti L, Batoli A, et al. Prevalence and risk factors of Helicobacter pylori-negative peptic ulcer. J Clin Gastroenterol 2000; 31: 42-7. [ Links ]
31. Guarner J, Herrera-Goepfert R, Mohar A, Smith C, Scofield A, Halperin D, et al. Diagnostic of gastric biopsy specimens when screening for preneoplasic lesions. Human Pathol 2003; 34: 28-31. [ Links ]
32. Di Battista R, Bierti L, Benassi R, Bortoli A, Ferrara A, Redaelli D, et al. Prevalence and risk factors in Helicobacter pylori-negative peptic ulcer in an area of northern Italy. Gastroenterology 1997; 112: A 102. [ Links ]
33. McColl KEL, El-Nujumi AM, Chittajallu RS, Dahill SW, Dorrian CA, El-Omar. A study of the pathogenesis of Helicobacter pylori negative chronic duodenal ulceration. GUT 1993; 34: 762-8. [ Links ]
34. Hirschowitz BI. Intractable peptic ulceration due to aspirin abuse in patients who have not had gastric surgery. Gastroenterology 1997; 112: A962. [ Links ]
35. Goddard AF, Logan RPH, Atherton JC. Healing of duodenal ulcer after eradication of Helicobacter heilmanii. Lancet 1997; 249: 1815. [ Links ]
36. Isenberg JI, Walsh JH, Grossman MI. Zollinger-Ellison syndrome. Gastroenterology 1973; 65: 140-65. [ Links ]











 texto en
texto en