Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.24 no.3 Bogotá July/Sept. 2009
Papel protector de la bilirrubina en el ser humano
The protective role of bilirubin in human beings
William Otero Regino MD (1), Héctor Velasco MD (2), Héctor Sandoval MD (2)
(1) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia, Gastroenterólogo, Clínica Fundadores, Clínica Carlos Lleras Restrepo y Fundación Hospital San Carlos. Bogotá, Colombia.
(2) Residente de Medicina interna, Universidad Nacional de Colombia. Bogotá, Colombia.
Fecha recibido: 21-07-09 Fecha aceptado: 18-08-09
Resumen
La bilirrubina no es simplemente el producto final del metabolismo del hem. En la actualidad, se considera que es una sustancia fundamental como antioxidante y antiinflamatoria del suero. Por su capacidad de neutralizar radicales libres evita la peroxidación de los lípidos y hay evidencia de que posee efectos protectores cardiovasculares, neuronales, hepatobiliares, pulmonares e inmunológicos. Recientemente se ha considerado que la utilización de agentes farmacológicos que aumenten la expresión de la hem oxidasa 1 (HO-1) y por ende de sus metabolitos como el monóxido de carbono (CO), la biliverdina (BV) y de la bilirrubina (BR) puede ser una estrategia terapéutica para diferentes enfermedades inflamatorias.
Palabras clave
Biliverdina, bilirrubina, antioxidante, antiinflamatorio, citoprotección.
Summary
Bilirubin is more than just the final product of heme catabolism. Today it is considered to be a fundamental substance which acts as an antioxidant and anti-inflammatory agent in the serum. It can neutralize free radicals and prevent peroxidation of lipids. In addition there is evidence that it protects the cardiovascular system, neuronal systems, the hepatobiliary system, the pulmonary system and the immune system. Recently the use of pharmacological agents which augment expression of Heme oxygenase 1 (HO-1) has been considered. Consequently its metabolites such as carbon monoxide (CO), biliverdin (BV) and Bilirubin (BR) could become parts of a therapeutic strategy for treatment of various inflammatory illnesses.
Key words
Biliverdin, bilirubin, antioxidant, antiinflammatory, cytoprotection.
Clásicamente se ha considerado que la bilirrubina (BR) es simplemente un "producto final" del catabolismo del hem y adicionalmente, que los recién nacidos normales tienen elevadas concentraciones como resultado del rompimiento de los eritrocitos fetales y de la incapacidad transitoria del mismo para conjugarla con el ácido glucurónico y además, que muy altos niveles en ellos puede producir su acumulación en el cerebro causando daño irreversible en diversas áreas como los ganglios basales, ocasionando el kernicterus o más ampliamente hablando, encefalopatía por bilirrubina (1, 2). Sin embargo, desde hace más de veinte años, también se ha considerado que la bilirrubina tiene funciones fisiológicas, a concentraciones normales específicamente como un potente antioxidante y antiinflamatorio y como tal puede evitar la oxidación de lípidos y de otras sustancias de manera más eficiente que la vitamina E (3, 4), postulándose que es uno de los principales mecanismos de defensa presentes en el suero contra el estrés oxidativo (5, 6) y puede tener efectos protectores pulmonares (7), cerebrales (8), hepatobiliares (9), inmunológicos y cardiovasculares (1, 3), como veremos más adelante.
El concepto de la bilirrubina no conjugada como un poderoso antioxidante puede ser la respuesta a la reflexión desde el punto de vista teleológico, sobre cuál sería la necesidad de los mamíferos para involucrar la producción de bilirrubina y no detener la cadena catabólica del hem hasta biliverdina (BV) como lo hacen los anfibios, reptiles y aves (10), teniendo en cuenta que la biliverdina es una sustancia hidrosoluble y fácilmente excretada en la bilis, y no utilizar de manera adicional una gran cantidad de energía y otros sistemas enzimáticos como la biliverdina reductasa para producir finalmente bilirrubina, una sustancia insoluble en agua, que para su transporte necesita albúmina y para poder excretarse conjugarla con el ácido glucurónico por la enzima UDP glucuronil transferasa 1, la cual la hace hidrosoluble y de esa manera puede ser excretada en la bilis e intestino delgado (11). En este artículo se revisará la evidencia que apoya el concepto de la bilirrubina como una sustancia protectora para el ser humano.
Diariamente se producen aproximadamente 4 mg de bilirrubina por kilogramo de peso, a partir de moléculas que contienen hem, el cual está presente en la hemoglobina de los glóbulos rojos y otras hemoproteínas como citocromos, catalasas, peroxidasa y triptofano pirrolasa (11, 12). El 80% del grupo hem proviene de la hemoglobina liberada de los eritrocitos senescentes y de la eritropoyesis ineficaz y el 20% restante corresponde a las fuentes enzimáticas no eritroides mencionadas (11, 12).
Después de la administración intravenosa de radiomarcadores de precursores de porfirina, como son el ácido γ-aminolevulνnico o la glicina, se han demostrado dos picos en la producción de bilirrubina: a las 72 horas por eritropoyesis ineficaz y a los 110 días por destrucción de eritrocitos senescentes (11-13).
El hem es un grupo tetrapirrólico, unido por cuatro puentes de metano, los cuales no son iguales debido al tamaño de las cadenas y su distribución asimétrica (14).
El hem libre es peligroso en cantidades excesivas (15), por lo cual es rápidamente removido de los tejidos mediante su hidrolización por la hem-oxigenasa microsomal, específicamente en el puente α-metano resultando en la producciσn de biliverdina y una molécula de monóxido de carbono (CO), liberando hierro, consumiendo oxígeno y requiriendo un agente reductor, NADPH (16). El CO es un neurotransmisor y un potente antiinflamatorio (17-19). Hay tres isoformas de hem-oxigenasa, la isoforma HO-1 que es inducible por estrés o por el mismo hem; la HO-2 que es una proteína constitutiva principalmente en el testículo y el cerebro y la HO-3 que tiene muy poca actividad catalítica y su principal función es la de ser una proteína de unión al hem (17-19). La HO-1 tiene elevadas concentraciones en el bazo y es la responsable de la rápida eliminación del hem de la circulación y la HO-2, al parecer, protege las neuronas del daño oxidativo (20). La hem-oxigenasa hace parte de un sistema regulador de la integridad de la célula endotelial y el estrés oxidativo. Es un grupo de enzimas de suma importancia para la célula endotelial porque regula la actividad de la guanilato ciclasa soluble (GCs), óxido nítrico sintetasa (NOS), citocromo P450 (CYP450), monooxigenasas, ciclooxigenasas (COX) y catalasas (21, 22). Como se discutirá más adelante, su inducción o sobreexpresión juega también un rol protector sobre la lesión celular mediada por estrés oxidativo. La HO-1 puede ser expresada no solamente por el estímulo de sus sustratos, el hem libre, sino también por diversos estímulos proinflamatorios, de manera tal, que sus funciones no son solamente la degradación del grupo hem, sino la eliminación de la inflamación (23) y sus efectos antioxiodantes y antiinflamatorios, se deben en gran parte a la formación de biliverdina y bilirrubina (24).
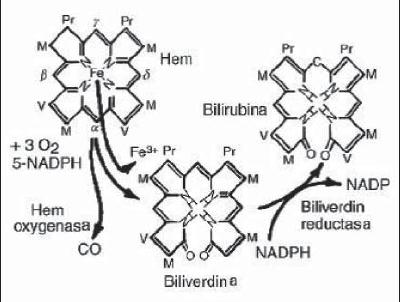
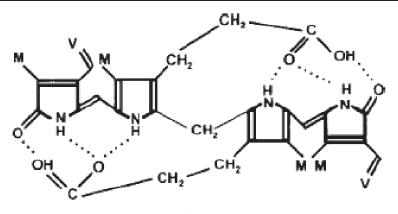
La biliverdina posteriormente es reducida a bilirrubina por la acción de la biliverdina reductasa (BVR) (13, 21) (figura 1). A pesar de la presencia de varios grupos polares como el ácido propiónico y los grupos aminos, la bilirrubina es insoluble en agua y esta paradoja se debe a la internalización de los hidrogeniones (21) (figura 2).
Figura 1. Paso de hem a bilirrubina.
Figura 2. Internalización de los hidrogeniones de la bilirrubina.
Una vez formada la bilirrubina puede interactuar con radicales libres de oxígeno, produciéndose la oxidación de la misma y convirtiéndose nuevamente en biliverdina (1, 13). Esta reconversión es catalizada por la BVR y en virtud de la misma, la bilirrubina detoxifica hasta 10.000 veces el exceso de oxidantes (1) (figura 3). Cuando la bilirrubina actúa como antioxidante es convertida a biliverdina. Teniendo en cuenta que la bilirrubina es soluble en lípidos, puede proteger las células contra la peroxidación lipídica y los oxidantes solubles serán neutralizados o detoxificados por el glutatión mediante un ciclo que requiere dos enzimas: la glutatión peroxidasa y la glutatión reductasa (1, 25). Así, las proteínas hidrosolubles son protegidas de la oxidación principalmente por el glutatión y los lípidos principalmente por la bilirrubina, por lo cual, se considera que estas dos sustancias ejercen funciones antioxidantes y citoprotectoras fisiológicas complementarias (1), aunque pueden tener actividades superpuestas ya que el glutatión también protege contra la oxidación de lípidos (1, 2, 13). Otros mecanismos de defensa antioxidante conocidos son las enzimas superóxido dismutasa y la catalasa, que convierten el anión superóxido en agua (1, 2).
En la naturaleza, el puente de hidrógeno es hidrolizado por la glucuronización del carboxilo del ácido propiónico, y como resultado la bilirrubina se vuelve hidrosoluble (bilirrubina conjugada) y es excretada en la bilis. En tanto que la bilirrubina no conjugada reacciona muy lentamente a los reactivos de Diazo por tener el hidrógeno internalizado y el puente de metano poco accesible al reactivo, la bilirrubina conjugada reacciona rápidamente por tener el grupo metano central asequible, por medio de la reacción de Van den Bergh (VdB) (13, 21). La bilirrubina total puede ser medida por aceleradores que rompen puentes de hidrogeno (VdB) y la diferencia entre estas dos reacciones se considera la bilirrubina no-conjugada. Menos del 4% de la bilirrubina total normal es conjugada, pero los métodos basados en la "diazo-reacción" como VdB, dan resultados de la bilirrubina directa falsamente elevados, del orden del 10 al 15% de la total, por lo cual clásicamente se ha considerado que este tipo de reacción sobreestima la bilirrubina conjugada (13). La exposición al sol rompe los puentes de hidrógeno, cambiando la configuración de la bilirrubina no-conjugada pudiendo de esta manera ser excretada en la bilis (26).
Sistema cardiovascular
En la actualidad hay evidencia sobre el efecto protector de los niveles leve a moderadamente elevados de bilirrubina, los cuales se asocian con un mejor pronóstico de enfermedades relacionadas con el estrés oxidativo, como sucede, entre otras, con la enfermedad isquémica cardiovascular, la enfermedad de Alzheimer y la lesión por isquemia-reperfusión, sugiriendo que la producción incrementada de bilirrubina es una respuesta adaptativa contra la oxidación (27). Diversos estudios han encontrado que los niveles elevados de bilirrubinas están relacionados con disminución del riesgo de enfermedad coronaria (28, 29). La asociación inversa entre la bilirrubina y el riesgo de enfermedad coronaria fue analizada en el estudio europeo "Prospective Epidemiological Study of Myocardial Infarction (PRIME)" (30). En este estudio, la bilirrubina fue medida en 216 sujetos quienes habían desarrollado enfermedad coronaria a los 5 años de seguimiento y en 434 controles. Los niveles de bilirrubina fueron significativamente menores en los casos (media de 0,46 mg/dL rango de 0,31-0,72 mg/dL) comparados con el grupo control (0,53 mg/dL rango de 0,36-0,75 mg/dL). Con base en estos hallazgos, se ha sugerido que la bilirrubina es un nuevo marcador de riesgo coronario en hombres de mediana edad (30). En las personas con síndrome de Gilbert, la frecuencia de enfermedad isquémica coronaria es inferior a la población general (2% vs. 12%) (31) y al parecer, el efecto protector de la bilirrubina es superior al nivel de la HDL, clásicamente considerada la fracción protectora del colesterol (31). También se ha encontrado que los altos niveles de bilirrubina preservan el flujo coronario y las funciones coronarias microvasculares. Hakan y cols (32) encontraron que el flujo diastólico pico estuvo directamente relacionado con los niveles de bilirrubina total y en cambio, cuando se comparó con los niveles de proteína C reactiva (PCR) ultrasensible se comportó de manera inversamente proporcional, confirmando que niveles elevados de bilirrubina pueden prevenir la aterosclerosis. El 12% de la población tiene niveles elevados de bilirrubina (33), los cuales al parecer están genéticamente determinados.
En un reciente estudio con 55 familias (33), se aleatorizaron pacientes con varios factores de riesgo cardiovascular, para determinar si bajos niveles de bilirrubina están relacionados con eventos cardiovasculares tempranos (hombres hasta 55 años y mujeres hasta 65 años). En 188 hombres y 140 mujeres, altos niveles de albúmina y bajos niveles de lipoproteínas de alta densidad (HDL) fueron relacionados con niveles altos de bilirrubina en mujeres pero no en hombres; bajos niveles de bilirrubina fueron relacionados con leve incremento de evento cardiovascular en hombres pero no en mujeres. Genes "secretadores" de bilirrubina fueron encontrados en el 23% de la población. Se concluyó que los altos niveles de bilirrubina tienen un efecto leve en disminución del riesgo cardiovascular en hombres y no hubo diferencias en mujeres debido posiblemente a niveles bajos de HDL-C (33). En el estudio Framingham Heart Study, el homocigoto alelo UGT1A1*28 se relacionó con altos niveles de bilirrubina y fuerte asociación con bajo riesgo cardiovascular (34). También los niveles bajos de bilirrubina están independiente e inversamente relacionados con deterioro de flujo carotídeo mediado por vasodilatación e incremento del grosor de la zona íntima-media de la carótida en hombres y mujeres, los cuales son predictores de aterosclerosis (35). En enfermedad arterial periférica, se ha encontrado correlación entre los niveles más altos de bilirrubina y menor riesgo de esta entidad. En el National Health and Nutrition Examination Survey (NHANES) 1999 a 2004 (36), en 7.075 sujetos, se analizaron los niveles de bilirrubina total y factores de riesgo para enfermedad arterial periférica (EAP) y se encontró que un incremento de 0,1 mg/dl de bilirrubina fue asociado con una disminución del 6% de EAP (OR 0,94, 95% IC 0,9-0,98). Los resultados de hiperbilirrubinemia no fueron debidos a enfermedad hepática crónica o ingesta de alcohol. Una relación inversa se encontró entre EAP y niveles de bilirrubina en hombres (OR 0,90; 95% IC 0,85 a 0,96) comparado con mujeres (OR 0,97; 95% IC 0,91 a 1,04); hubo asociación fuerte entre fumadores (OR 0,81; 95% IC 0,73 a 0,90) y no fumadores (OR 0,97; 95% CI 0,93 a 1,02). Los resultados del estudio permitieron concluir que niveles altos de bilirrubina están asociados con menor prevalencia de EAP. En un metanálisis, también se encontró una asociación negativa entre los altos niveles de bilirrubina y la severidad de la arterioesclerosis (37).
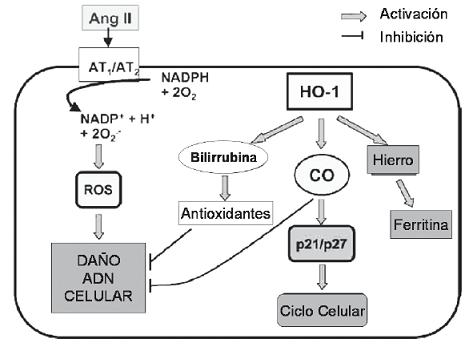
La bilirrubina no conjugada, además de neutralizadora de radicales de oxígeno, también actúa como agente reductor de ciertas peroxidasas, incluyendo la prostaglandina H sintetasa (PGH) en presencia de peróxido de hidrogeno o hidroxiperóxidos orgánicos (38). Recientemente, Mazza y col han demostrado los efectos antioxidantes y citoprotectores de la bilirrubina al daño de la célula endotelial mediada por angiotensina II (38). Así mismo, otros autores han encontrado que la angiotensina II estimula significativamente la formación de peróxido en monocitos y que al aplicarle la bilirrubina exógenamente no solo se suprimió la formación de peróxido, sino también la actividad quimiotáctica de la angiotensina II en estas células (39), por lo cual, se considera que su acción biológica puede ser particularmente relevante para prevenir las acciones vasoconstrictoras mediadas por mecanismos de oxidación. Dentro de los mecanismos de acción en esta vía, se ha demostrado que al inhibir la NADPH oxidasa y la actividad de la PKC, ambas han mostrado mediar el daño vascular sobrevenido por la angiotensina II (40, 41). Desde hace mucho tiempo se sabe que la angiotensina II está frecuentemente elevada en personas hipertensas y se asocia a niveles elevados de radicales libres de oxígeno, los cuales aumentan el daño renal (42) y por lo tanto, los antioxidantes naturales como la bilirrubina tendrían efectos protectores (figura 3).
Figura 3. Hipótesis sobre los mecanismos de protección de la OH-1 ante la lesión inducida por angiotensina II. Ang II: Angiotensina II. AT1/2: Receptor 1 y 2 de la angiotensina II. HO-1: Hem-oxigenasa 1; CO: Monóxido de carbono. ROS: Moléculas reactivas de oxígeno.
Recientemente, se ha encontrado que tanto la biliverdina como la bilirrubina pueden preservar la integridad de la célula endotelial y prevenir su muerte, aumentando la reactividad vascular en ratones diabéticos (43, 44), así como también la re-estenosis vascular (45, 46). En diabetes experimental, la bilirrubina está implicada en reducción del estrés oxidativo al aumentar la biodisponibilidad del óxido nítrico (NO) necesario para la integridad de la célula endotelial (46). Al mediar en la inhibición de PKC y NADPH oxidasa, la HO-1 atenúa la generación de oxidantes por diabetes y desacoplamiento de óxido nítrico sintetasa (NOS) en la célula endotelial (43, 46). La glucosa aumenta la producción de productos de reacción NO/O2-, los peroxinitritos. Los peroxinitritos inactivan al precursor de óxido nítrico sintetasa (NOS) aumentando desacople de la enzima: mayor cantidad O2- (peróxido), que de NO (47-49). La NOS funcional puede aumentarse con HO-1, los peroxinitritos estimulan la expresión de HO-1 en personas no diabéticas, pero en diabéticos la glucosa suprime los efectos en la expresión genética de HO-1. La HO-1 aumenta la expresión de la superóxido dismutasa que puede proteger contra el desacoplamiento de la NOS (47-49).
En los vasos renales de roedores tratados con biliverdina, la expresión de selectinas E y P, por el lipolisacárido (LPS) fue reducida significativamente, confirmando que la biliverdina y bilirrubina tiene propiedades antiinflamatorias (50). En modelos experimentales de endotoxemia en roedores, Want y colaboradores (51) demostraron que la bilirrubina es un mediador clave en la citoprotección al mejorar las lesiones celulares en respuesta a infusión de LPS, ya que disminuyeron los niveles de ON y TNF-α y la sintetasa inducible de ON hepαtica fue significativamente menor.
La arterioesclerosis es una enfermedad inflamatoria de las paredes de las arteriolas de grande y mediano calibre, precipitada por niveles elevados de lipoproteínas de baja densidad en la sangre (52). La modificación oxidativa en plasma de las lipoproteínas de baja densidad (LDL), principalmente a nivel de las paredes arteriales, aumenta de manera marcada la aterogenicidad de estas (53) y, junto con el depósito de LDL oxidadas, forman parte de la lesión crucial de la aterosclerosis (54). Las LDL mínimamente modificadas inducen a la proteína-1 quimiotáctica de monocitos y al factor estimulante de colonias, con lo cual, se produce reclutamiento y diferenciación de macrófagos en la pared arterial (54). La disfunción de las células endoteliales inducida por LDL oxidadas es uno de los primeros pasos en el desarrollo de aterosclerosis, por lo que las respuestas vasculares adaptativas y/o protectoras al estrés oxidativo son importantes en la prevención de la aterogénesis (55). Dentro de las propiedades antiaterogénicas de la bilirrubina, se incluye la inhibición de la oxidación de las LDL, como neutralizante de los radicales libres de oxígeno generados a partir de fosfolípidos, triglicéridos y ésteres de colesterol (56, 57) e incluso en bajas concentraciones su capacidad para inactivar radicales de oxígeno in vitro reduciendo el daño celular oxidativo y atenuación del estrés oxidativo in vivo (58-60). Los mecanismos por los cuales la bilirrubina reacciona con los radicales de oxígeno no están completamente dilucidados, sin embargo, su estructura tetrapirrólica hidrofóbica ha sido reportada como inhibidor de la NADPH oxidasa, protein cinasa C (PKC), entre otros mediadores de factores proaterogénicos (58-60).
Sistema inmunológico
Experimentalmente la bilirrubina tiene efectos inmunosupresores al actuar sobre linfocitos y granulocitos (61). In Vitro, la bilirrubina en concentraciones de 100 a 200 micromoles inhibe la actividad de linfocitos T citotóxicos (62). Así mismo, altera la proliferación de células T inducida por fitohemaglutinina (63). La HO-1 tiene importantes efectos inmunosupresores y su inducción disminuye los episodios de rechazo agudo y crónico en los trasplantes de órganos sólidos (64, 65) y esos efectos, como se mencionó, parecen ser mediados por la biliverdina y la bilirrubina (BV/BR) (62, 65). La expresión de los efectos antiinflamatorios de la BV en los trasplantes de órganos es la menor proliferación de células T, menor infiltración de leucocitos y mayor sobrevida de los transplantes cardíacos (66). La BR inhibe la activación de células endoteliales, al suprimir las moléculas de adhesión E-selectina (67). Un importante efecto del sistema BV/BR es la inhibición del factor nuclear kB, el cual es necesario para la transcripción de genes proinflamatorios (66, 67). Ambas sustancias son antiapópticas y pueden suprimir las respuestas involucradas en la disfunción crónica de los trasplantes (24).
Efectos hepatobiliares
Experimentalmente se ha encontrado que el sistema BV/BR evita la toxicidad por acetaminofén (68) al neutralizar los radicales libres tóxicos producidos por el metabolismo de este medicamento (69). En ratas se han demostrado los efectos citoprotectores de la biliverdina contra las lesiones producidas por la reperfusión hepática posisquemia (70). Se ha probado que el CO modula la formación y el flujo de bilis (71).
Conclusiones
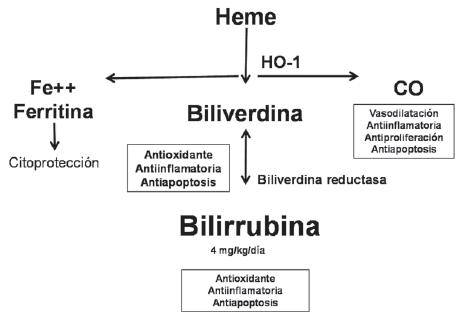
No obstante existir evidencias sobre el efecto antioxidante de la bilirrubina, es importante destacar que este ocurre fundamentalmente en el suero, y los mecanismos protectores celulares más importantes, se producen dentro de los tejidos, por lo cual, aún falta por dilucidar la interrelación de las actividades de la bilirrubina en el suero, con la que está en el interior de las células, ya que en el primero, la concentración de bilirrubina es 100 a 1.000 veces superior (1). El desafío del conocimiento de estos eventos fisiológicos sería la aplicación terapéutica del mismo. Recientemente, se han revisado los resultados de la aplicación terapéutica de biliverdina y bilirrubina en trasplantes de órganos sólidos (1, 72). La utilización de agentes farmacológicos que aumenten la expresión de HO-1 y por ende de sus metabolitos (monóxido de carbono, biliverdina y bilirrubina) puede constituirse en una estrategia terapéutica para el manejo de diferentes enfermedades inflamatorias (24), así como para evitar los episodios de rechazo agudo de los trasplantes (24). Esta última posibilidad adquiere mayor relevancia si se tiene en cuenta que la única estrategia actualmente disponible es la utilización de medicamentos inmunosupresores, los cuales aumentan la incidencia de tumores en pacientes trasplantados (73), así como un mayor riesgo de enfermedades infecciosas bacterianas, micóticas y virales. Una hipótesis médica sobre la utilización de la bilirrubina no conjugada como agente terapéutico sería inducir un "síndrome Gilbert iatrogénico" administrando inductores de HO-1 (74). De igual manera, la HO-1 se está considerando como un potencial blanco terapéutico para hepatoprotección (9). En la figura 4, se muestran los efectos benéficos de los metabolitos involucrados en la cadena metabólica del metabolismo de hem (CO, BV/BR).
Figura 4. Beneficios del metabolismo del hem.
Referencias
1. Sedlack TW, Zinder SH. Bilirrubin benefits: cellular protection by a biliverdin reductase antioxisant cycle. Pediatrics 2004; 113: 1776-82. [ Links ]
2. Kapitulnik J. Bilirrubin: an endogenous product of heme degradation with both cytotoxic and cytoprotective properties. Mol, Pharmacol 2004; 66: 773-9. [ Links ]
3. Stocker R, Glazer AN, Ames BN. Antioxidant activity of albumin-bound bilirrubin. Proc Natl Acad Sci USA 1987; 84: 5918-22. [ Links ]
4. Stocker R, Yamamoto Y, McDonagh AF, Glazer AN, Ames BN. Bilirrubin is an antioxidant of possible physiological importance. Science 1987; 235: 1043-6. [ Links ]
5. Belanger S, Lavoie JC, Chessex P. Influence of bilirrubin on the antioxidant capacity of plasma in newborn infants. Biol Neonat 1997; 71: 233-8. [ Links ]
6. Copinhatan V, Miller NJ, Milner AD, Rice-Evans CA. Bilirrubin and ascorbate antioxidant activity in neonatal plasma. FEBS Lett 1994; 349: 197-200. [ Links ]
7. Sarady-Andrews JK, Liu F, Gallo D, Nakao A, Overhaus M, Ollinger AM, et al. Biliverdin administration protects against endotoxin-induced acute lung injury in rats. Am J Physiol Lung Mol Physiol 2005; 289: L1131-L1137. [ Links ]
8. Syapin PJ. Regulation of heme oxygenase-1 for treatment of neuroinflammation and brain disorders. Br J Pharmacol 2008; 11: 623-40. [ Links ]
9. Farombi EO, Surh YJ. Heme Oxygenase-1 as a potential therapeutic target for hepatoprotection. J Bioch Mol Biol 2006; 39: 479-91. [ Links ]
10. McDonagh AF. Bile pigments: bilatrienes and 5, 15 biladiens. En: Dolphin D (Editor). The porphyrins. New Cork, NY: Academic Press 1979. p. 293-491. [ Links ]
11. Roy Chowdhury J, Wolkoff AW, Roy Chowdhury N, Arias I. Hereditary jaundice and disorders of bilirubin metabolism. The metabolic and molecular bases of inherited disease. 8th ed. McGraw-Hill 2001. p. 3063-101. [ Links ]
12. Roy-Chowdhury, N., Wang, X., and Roy-Chowdhury, J. Bile pigment metabolism and its disorders. En Rimoin DL, Connor JM, Pyeritz RE, Korf BR, (edits). Principles and practice of medical genetics, Fifth Edition 2006. p. 28-35. [ Links ]
13. Choudhry N, Arias IM, Wolkoff AW, Chowdhry JR, Disroders of bilirubin metabolism. En: Arias IM, Boyer JL, Chisari FV (edit). The liver: Biology and Pathobiology 4th,. Philadelphia. 2001. p. 291-309. [ Links ]
14. Roy Chowdhury N, Arias IM, Wolkoff AW. Disorders of bilirubin metabolism. In Zakim D, Boyer TD: Hepatolog. A textbook of liver disease. 3 ed. 1996, p 791-200. [ Links ]
15. Kumar S, Bandyopadhyay U. free heme toxicity and its detoxofication systems in human. Toxicol Lett 2005; 157: 175-88. [ Links ]
16. Maines MD. Heme oxigenase: function, multiplicity, regulatory mechanisms and clinical applications. FASEB J 1988; 2: 2557-68. [ Links ]
17. Zakhary R, Poss KD, Jaffrey SR, Ferris CD, Tonegawa S, Snyder SH. Targeted gene deletion of heme oxigenase 2 reveals neural role for carbon monoxide. Proc Natl Acad Sci USA 1997; 94: 1848-53. [ Links ]
18. Baranano DE, Ferris CD, Snyder SH. Atypical neural messengers. Trend Neurosci 2001; 24: 99-106. [ Links ]
19. Ryter SW, Alam J, Choi AM. Heme oxigenase-1/carbon monoxide: from basic science to therapeutic applications. Physiol Rev 2006; 86: 583-650.
20. Dore S, Goto S, Sampei K, et al. Heme-oxigenase 2 acts to prevent neuronal death in brain cultures and following transient cerebral ischemia. Neoroscience 2000; 99587-92. [ Links ]
21. Roy Chowdhry J, Roy Chowdhury N, Jansen PLM. Bilirubin metabolism and its disorders. In: Zakim D, Boyer T, editors. Hepatology: a textbook of liver disease. 4th ed. 2003. p. 233-69. [ Links ]
22. Xia Wang, Jayanta Roy Chowdhury, Namita Roy. Bilirubin metabolism: Applied physiology. Current Paediatrics 2006; 16: 70-74. [ Links ]
23. Willoughby DA, Moore AR, Colville-Nash PR, Gilroy D. Resolution of inflammation. Int J Immunopharmacol 2000; 22: 1131-5. [ Links ]
24. Ollinger R, Wang H, Yamashita K, Wegiel B, Thomas M, Margreiter R, et al. Therapeutics applications of bilirrubin and biliverdin in transplantation. Antioxid Redox signal 2007; 9: 2175-85. [ Links ]
25. Sedlak TW, Sqaleh M, Higgison DS, Paul BD, Juluri KR, Snyder SH. Bilirubin and gluthatione have complementary antioxidant and cytoprotective roles. PNAS 2009; 106: 5171-6. [ Links ]
26. Bonnett R, Davis E, Hursthouse MB. Structure of bilirubin. Nature 1976; 262: 327-8. [ Links ]
27. Morita, T. Heme Oxygenase and Atherosclerosis. Arterioscler Thromb Vasc Biol 2005; 25: 1786-795. [ Links ]
28. Clark JE, Foresti R, Sarathchandra P, Kaur H, Green CJ, Motterlini R. Postischemic myocardial dysfunction. Am J Physiol Heart Circ Physiol 2000; 278: H643-H651. [ Links ]
29. Hill-Kapturczak N, Chang SH, Agarwal A. Heme oxygenase and the kidney. DNA Cell Biol 2002; 21: 307-321. [ Links ]
30. Troughton J, Woodside J, Young S, Arveiler D, Amouyel P, Ferrieres J, et al. Bilirubin and coronary heart disease risk in the Prospective Epidemiological Study of Myocardial Infarction (PRIME). European Journal of Cardiovascular Prevention and Rehabilitation 2007; 14: 79-84. [ Links ]
31. Vítek L, Jirsa M, Brodanová M, Kalab M, Marecek Z, Danzig V, Novotný L, Kotal P. Gilbert syndrome and ischemic heart disease: a protective effect of elevated bilirubin levels. Atherosclerosis 2002; 160: 449-56. [ Links ]
32. Hakan G, Erdogan D. High serum bilirubin concentrations preserve coronary flow reserve and coronary microvascular functions. Arterioscler Thromb Vasc Biol 2005; 25: 2289-2294. [ Links ]
33. Lingenhela A, Kolleritsa B, Schwaigera J, Huntb S, Gressb R, Hopkins P, et al. Serum bilirubin levels, UGT1A1 polymorphisms and risk for coronary artery disease. Atherosclerosis 2006; 184: 431-437. [ Links ]
34. Jing-Ping L, ODonnell C, Schwaiger J, Cupples A, Lingenhel A, Hunt S, et al. Association between the UGT1A1*28 allele, bilirubin levels and coronary heart Disease in the Framingham heart study. Circulation 2006; 114: 1476-1481. [ Links ]
35. Jing-Ping L, Cupples A, Wilson P, Heard-Costa N, ODonnell C. Early carotid atherosclerosis and family history of vascular disease. Atherosclerosis 2001; 154: 747-754. [ Links ]
36. Perlstein T, Pande R, Beckman J, Creager M. Serum total bilirubin level and prevalent lower-extremity peripheral arterial disease: National Health and Nutrition Examination Survey (NHANES) 1999 to 2004. Arterioscler Thromb Vasc Biol 2008; 28: 166-172. [ Links ]
37. Novotni L, Vitek L. Inverse relationship between serum bilirubin and atherosclerosis in men: A meta-analysis of published studies. Experimental Biology and Medicine 2003; 228: 568-571. [ Links ]
38. Mazza F, Goodman AI, Lombardo G, Vanella A, Abraham NG. Heme oxygenase I gene expression attenuates angiotensin II mediated DNA damage in endothelial cells. Exp Biol Med 2003; 228: 576-583. [ Links ]
39. Morita T, Imai T, Yamaguchi T, Sugiyama T, Katayama S, Yoshino G. Induction of heme oxygenase-1 in monocytes suppresses angiotensin II-elicited chemotactic activity through inhibition of CCR2: role of bilirubin and carbon monoxide generated by the enzyme. Antioxid Redox Signal 2003; 5: 439-447. [ Links ]
40. Kwak JY, Takeshige K, Cheung BS, Minakami S. Bilirubin inhibits the activation of superoxide-producing NADPH oxidase in a neutrophil cell-free system. Biochim Biophys 1991; 1076: 369-373. [ Links ]
41. Sano K, Nakamura H, Matsuo T. Mode of inhibitory action of bilirubin on protein kinase C. Pediatric Research 1985; 19: 587-590. [ Links ]
42. Kiemer AK, Bildner N, Weber NC, Vollmar AM. Characterization of heme oxygenase 1 (heat shock protein 32) induction by atrial natriuretic peptide in human endothelial cells. Endocrinology 2003; 144: 802-812. [ Links ]
43. Rajagopalan S, Kurz S, Munzel T, Tarpey M, Freeman BA, Griendling KK, Harrison DG. Angiotensin II-mediated hypertension in the rat increases vascular superoxide production via membrane NADH/NADPH oxidase activation. Contribution to alterations of vasomotor tone. J Clin Invest 1996; 97: 1916-1923. [ Links ]
44. Ishizaka N, Aizawa T, Mori I, Taguchi J, Yazaki Y, Nagai R, Ohno M. Heme oxygenase-1 is upregulated in the rat heart in response to chronic administration of angiotensin II. Am J Physiol Heart Circ Physiol 2000; 279: H672-H678. [ Links ]
45. McClung JA, Morita T, Rodella L, Rezzani R, Weiss MB, Abraham NG. Heme oxygenase-1 prevents superoxide anion associated vascular smooth muscle growth and decreases circulating endothelial cells in a rat model of balloon injury and restenosis in diabetes mellitus. Circulation 2004; 110: III-282. [ Links ]
46. Milstien S, Katusic Z. Oxidation of tetrahydrobiopterin by peroxynitrite: implications for vascular endothelial function. Biochem. Biophys Res Commun 1999; 263: 681-4. [ Links ]
47. Foresti R, Sarathchandra P, Clark JE, Green CJ, Motterlini R. Peroxynitrite induces haem oxygenase-1 in vascular endothelia to apoptosis. Biochem J 1999; 339: 729-36. [ Links ]
48. Rezzani R, Quan S, Rodella L, Bianchi R, Goodman A, Abraham NG. Heme oxygenase-1 upregulation attenuates glucose-mediated oxidative stress renal injury in HO-2 knockout mice. Hypertension 2003; 42: 421 (abstract). [ Links ]
49. Chang SH, Barbosa-Tessmann I, Chen C, Kilberg MS, Agarwal A. Glucose deprivation induces heme oxygenase-1 gene expression by a pathway independent of the unfolded protein response. J Biol Chem 2002; 277: 1933-40. [ Links ]
50. Vachharajani TJ, Work J, Issekutz AC, Granger DN. Heme oxygenase modulates selectin expression in different regional vascular beds. Am J Physiol Heart Circ Physiol 2000; 278: H1613-H1617. [ Links ]
51. Wang WW, Smith DL, Zucker SD. Bilirubin inhibits iNOS expression and NO production in response to endotoxin in rats. Hepatology 2004; 40: 424-33. [ Links ]
52. Galkina E, Ley K. Immune and inflammatory mechanisms of aterosclerosis. Ann Rev Immunol 2009; 27: 165-97. [ Links ]
53. Wiztum JL, Steinberg D. Role of oxidized low density lipoprotein in atherogenesis. J Clin Invest 1991; 88: 1785-92. [ Links ]
54. Berliner JA, Heinecke JW. The role of oxidized lipoproteins in atherosclerosis. Free Radic Biol Med 1996; 20: 707-27. [ Links ]
55. Morita, T. Heme Oxygenase and Atherosclerosis. Arterioscler Thromb Vasc Biol 2005; 25: 1786-795. [ Links ]
56. Xia Wang, Jayanta Roy Chowdhury, Namita Roy. Bilirubin metabolism: Applied physiology. Current Paediatrics 2006; 16: 70-74. [ Links ]
57. Hill-Kapturczak N, Chang SH, Agarwal A. Heme oxygenase and the kidney. DNA Cell Biol 2002; 21: 307-21. [ Links ]
58. Stocker R, Yamamoto Y, McDonagh AF, Glazer AN, Ames BN. Bilirubin is an antioxidant of possible physiological importance. Science 1987; 235: 1043-1046. [ Links ]
59. Stocker R, Glazer AN, Ames BN. Antioxidant activity of albumin-bound bilirubin. Proc Natl Acad 1987; 84: 5918-5922. [ Links ]
60. Clark JE, Foresti R, Sarathchandra P, Kaur H, Green CJ, Motterlini R. Heme oxygenase-1-derived bilirubin ameliorates. Free Radical Biology & Medicine 2005; 19: 1-25. [ Links ]
61. Sima P, Mala J, Miller I, Hodr R, Truxova E. The suppresisve effect of continuous infusion of bilirubin on the immune response in mice. Folia Microbiol 1980; 25: 483-90.
62. Haga Y, Tempero MA, Zetterman RK. Unconjugated bilirubin inhibits in vitro cytotoxic T lynphocyte activity of human lymphocytes. Biochim Biophys Acta 1996; 1317: 65-70. [ Links ]
63. Haga Y, Tempero MA, kay D, Zetterman RK. Intracellular accumulation of unconjugated bilirubin inhibits phytohemagglutin induced proliferation and interleukin-2 production of human lymphocytes. Dig Dis Sci 1996; 41: 1468-74. [ Links ]
64. Camara NO, Soares MP. Heme oxigenase-1 (HO-1), a protective gene that prevents chronic graft dysfunction. Free Radic Biol Med 2005; 38: 426-35. [ Links ]
65. Tsui TY, Wu X, Lau CK, Ho DW, Xu T, Siu YT, et al. Prevention of chronic deterioration of heart allograft by recombinant adeno-associated virus-mediated heme oxygenase-1 gene transfer. Circulation 2003; 103: 2623-9. [ Links ]
66. Yamashita K, McDaid J, Ollinger R, Tsui TY, Berberat PO, Usheva A, et al. Biliverdin, a natural product of heme catabolism induces tolerance to cardiac allografts. FASEB J 2004; 18: 765-7. [ Links ]
67. Soares MP, Seldon MP, Gregoire IP, Vassilevskaia T, Berberat PO, et al. Heme-oxygenase 1 modultes the expression of adhesion molecules associated with endotelial cell activation. J Immunol 2004; 172: 553-63.
68. Chiu H, Brittingham JA, Lakim DL. Differential induction of heme oxigenase-1 in macrophages and hepatocytes during acetaminophen-induced hepatotoxicity in the rat: effects oh hemin and biliverdin. Toxicol Appl Pharmacol 2002; 181: 106-15. [ Links ]
69. Nelson SD. Molecular mechanisms of the hepatotocixity caused by acetaminophen. Sem liver Dis 1990; 10: 267-78. [ Links ]
70. Fondevila C, Shen XD, Tsuchiyashi S, Yamshita K, Csizmadia E, Lassman C, et al. Bilivedin therapy protects rat livers from ischemia and reperfusion injury. Hepatology 2004; 40: 1333-41. [ Links ]
71. Wunder C, Potter RF. The heme oxygenase system: its role in liver inflammation. Curr Drug Targets Cardiovasc Haematol Disord 2003; 3: 199-208. [ Links ]
72. Pae HO, Chung HT. Heme Oxygenase-1: its therapeutic roles in inflammatory disease. Immune Network 2009; 9: 12-19. [ Links ]
73. Buell JF, Gross TG, Woodle ES. Malignancy after transplantation. Transplantation 2005; 80: S254-S264. [ Links ]
74. McCarty MF. "Iatrogenic Gilbert syndrome"--a strategy for reducing vascular and cancer risk by increasing plasma unconjugated bilirubin. Med Hypotheses 2007; 69: 974-94. [ Links ]











 text in
text in