Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.25 no.2 Bogotá Apr./June 2010
Tumores neuroendocrinos gastroenteropancreáticos
Cristian Camilo Vargas Martínez, MD (1), Rodrigo Castaño Llano, MD (2)
(1) Estudiante de Medicina, Universidad de Antioquia, Medellín, Colombia. Grupo de Gastrohepatología, Universidad de Antioquia, Medellín, Colombia. e-mail: crivargas@gmail.com
(2) Cirujano Gastrointestinal y Endoscopista, Hospital Pablo Tobón Uribe, Medellín, Colombia. Profesor de Cirugía, Universidad Pontificia Bolivariana, Medellín, Colombia. Grupo de Gastrohepatología, Universidad de Antioquia, Medellín, Colombia.
Fecha recibido: 27-10-09 Fecha aceptado: 26-05-10
Resumen
Los tumores neuroendocrinos gastroenteropancreáticos son neoplasias raras distribuidas a lo largo del tubo digestivo y poseen características peculiares, como la captación de sales de plata, la expresión de marcadores de célula neuroendocrina y los gránulos secretorios de contenido hormonal. Según su tamaño, localización anatómica y la presencia de metástasis, estos tumores debutan con distintas características clínicas y pronóstico. El diagnóstico temprano, que requiere de un alto grado de sospecha y una confirmación con estudios especializados, resulta invaluable para tratar estas lesiones a tiempo y aumentar la sobrevida de los pacientes. El tratamiento quirúrgico es la herramienta de primera mano, y otras terapias médicas ayudan a mejorar los síntomas y la calidad de vida de aquellos pacientes con lesiones irresecables. En esta revisión, se tratan los aspectos más relevantes en cuanto a la clasificación, morfología, localización, diagnóstico y tratamiento de estas neoplasias gastrointestinales, y al final, se expone la única experiencia colombiana sobre la epidemiología y el manejo de los tumores neuroendocrinos.
Palabras clave
Tumores neuroendocrinos, tumor carcinoide, síndrome carcinoide, gastrinoma, tumores neuroendocrinos pancreáticos.
Introducción
El sistema endocrino difuso del tracto gastroenteropancreático representa el más amplio de todo el organismo (9) con por lo menos 16 células endocrinas diferentes que producen más de 50 aminas o péptidos diferentes (10, 11). Los tumores neuroendocrinos (TNE) se consideran con potencial maligno y pueden cursar en una forma indolente hasta que se hacen clínicamente aparentes por sus metástasis o las manifestaciones del síndrome carcinoide (5, 8). En 1907 Oberndorfer (4) acuñó el término de tumor carcinoide (TC), para diferenciar estas neoplasias, con un comportamiento menos agresivo, de los carcinomas. El grupo de Thorson & Waldestrom (6) fue el primero en describir una serie de pacientes con TC ileales y metástasis hepáticas que presentaban el llamado síndrome carcinoide, encontrando diarrea, asma, enrojecimiento facial, cianosis y lesión valvular derecha. Estos tumores representan menos del 1% de todas las neoplasias, aunque la reciente evidencia sugiere que ha habido un incremento en su incidencia (8).
Nomenclatura y clasificación
El histórico término de TC se hace cada vez más inapropiado para agrupar estos tumores con características neuroendocrinas; actualmente, se reserva para aquellas lesiones benignas y productoras de serotonina (9, 11). Otro inconveniente con el uso del término carcinoide se asocia con la presentación del síndrome carcinoide (SC) en ciertos tipos de tumores, como aquellos con células enterocromafines (CE) que producen sustancias vasoactivas como serotonina y sustancia P, mientras que aquellos carcinoides sin CE se asocian a otros tipos de síndromes o, más frecuentemente, son silentes (13). Bajo el término de TNE se recoge el amplio espectro de estas neoplasias, desde la presentación clásica del tumor carcinoide en un extremo hasta la variedad anaplásica en el otro. En la nueva clasificación, se propone en primer término agrupar los tumores de acuerdo a su sitio de origen (intestino anterior, medio y posterior para las variedades gastrointestinales). El segundo principio es subdividirlos de acuerdo con su comportamiento biológico en:
1. Comportamiento benigno
2. Comportamiento incierto (tumores que pueden ser benignos o con bajo grado de malignidad)
3. Tumores con bajo grado de malignidad
4. Tumores con alto grado de malignidad.
Los principales criterios para esta última denominación son la diferenciación histológica, angioinvasión, invasión directa a órganos vecinos y la presencia de metástasis. Otro criterio es el tamaño, el cual se ha constituido en un importante parámetro pronóstico. Un tercer principio en la clasificación es el incorporar la función hormonal y designarlos como funcionantes o no funcionantes (12). Esta clasificación no considera los tumores con características mixtas, endocrinas-exocrinas, llamados también anficrinos. Estos tumores que exhiben diferentes líneas de diferenciación celular fueron descritos inicialmente en el apéndice y se llamaron carcinomas de células caliciformes. Las neoplasias mixtas, adenocarcinomas con focos de células neuroendocrinas, deben considerarse como un grupo aparte pues su comportamiento biológico está determinado principalmente por el contenido y diferenciación del componente exocrino (14). La clasificación más aceptada de estos tumores en el momento, se recoge en la tabla 1.
Tabla 1. Clasificación de los TNE según la OMS (15).
Histogénesis
Las células del sistema neuroendocrino exhiben unas características peculiares histoquímicas y a la microscopia de luz, como su reacción argentafín o argirófila. Las células enterocromafines (CE) son las más frecuentes células endocrinas del intestino y se encuentran en toda su extensión excepto el esófago. En el intestino se ubican preferentemente en duodeno, íleon terminal y apéndice. Tienen en común, de acuerdo con Pearse (7) la capacidad de captar precursores aminados y decarboxilarlos. La extracción de numerosos péptidos neuroendocrinos y la disponibilidad de diferentes métodos inmunohistoquímicos hacen posible identificar su sitio de síntesis y almacenamiento (15).
Williams y Sandler (17) clasificaron estos tumores de acuerdo a su sitio de origen como del intestino anterior (irrigados por el tronco celiaco), medio (irrigados por la arteria mesentérica superior) o posterior (irrigados por la arteria mesentérica inferior). Los tumores endocrinos del páncreas y pulmón se comportan como los del intestino anterior. Esto ha permitido entender el comportamiento hormonal de estas neoplasias.
Morfología
Las neoplasias que directamente captan y depositan las sales de plata son llamadas argentafines y se relacionan con un comportamiento más agresivo. Las que requieren de un agente externo para la captación y depósito se denominan argirófilas y presentan un comportamiento más benigno. Los tumores del intestino anterior son más frecuentemente argirófilos mientras los del intestino medio, los más agresivos, son casi exclusivamente argentafines. Los TNE del intestino posterior presentan células con ambas características. Sin embargo, se desconoce la causa del comportamiento biológico tan diferente entre el apéndice y el íleon siendo ambas del intestino medio y argentafines. La detección por inmunohistoquímica de los diferentes marcadores de las células neuroendocrinas (enolasa específica neuronal (1), cromograninas (2), sinaptofisinas (3)) permite la diferenciación de tumores endocrinos y no endocrinos. Esto se hace en combinación con las tinciones de plata. La inmunohistoquímica ha mostrado que los tumores del intestino anterior presentan una mayor carga hormonal. El síndrome carcinoide se da más frecuentemente en tumores del árbol bronquial, páncreas, duodeno o yeyuno proximal (intestino anterior). Los TNE gástricos son frecuentemente asintomáticos, argirófilos y raramente presentan células con gránulos con serotonina. TNE dependientes de gastrina que se originan en un ambiente de gastritis atrófica son de comportamiento benigno, mientras que los independientes de gastrina son potencialmente malignos (15, 16).
La ultraestructura de las células neuroendocrinas del tracto gastrointestinal ha sido definida desde antes del advenimiento de la inmunohistoquímica. Gránulos secretorios son característicos de los TNE. El cuadro histológico típico consiste en focos de células pequeñas y regulares con disposición en empalizada. Una forma atípica presenta marcado pleomorfismo con núcleos irregulares e hipercromáticos, número de mitosis alto y áreas de necrosis, lo que la relaciona con un peor pronóstico.
A diferencia del gran número de hormonas de las células del intestino anterior los tumores del intestino medio presentan una menor variedad de células neuroendocrinas. Ellas producen principalmente serotonina y taquiquininas, las cuales pueden servir de marcadores tumorales (15). Los TNE del intestino posterior presentan una gran cantidad de células productoras de péptidos como somatostatina, encefalinas, sustancia P y serotonina, e incluso insulina. Considerando la menor producción de hormonas por los tumores del intestino medio (serotonina y taquiquininas) con respecto a las del intestino anterior y posterior, la producción de estas hormonas no es un parámetro pronóstico (18).
Distribución y pronóstico
El 85% de los TNE se originan del tracto gastrointestinal, en el 10% de los pulmones, principalmente como carcinoide bronquial y el resto en laringe, timo, riñón, ovario, próstata y piel. La ubicación más frecuente en el tracto gastrointestinal es en el apéndice seguida por el recto y el íleon (tabla 2). En los TC, la presentación clínica varía según la localización anatómica. La sobrevida depende principalmente del tamaño tumoral (influido por la rata de crecimiento y el grado de diferenciación) y la presencia de metástasis. Los principales sitios de metástasis son los linfáticos del mesenterio, hígado, pulmón y peritoneo. La sobrevida depende en menor forma de la ubicación del tumor, siendo del 99% para las lesiones del apéndice independiente de su estado, solo del 75% para los del intestino delgado localizado, pero disminuye a 54% al considerar todos los estados.
Tabla 2. Distribución de los TNE según el sitio (n=2837) (19).
Esto habla en términos generales de un buen pronóstico para esta lesión y está en concordancia con la apreciación de Oberdonfer (4) al referirse a ella como carcinoide. Dadas las limitaciones para evaluar los TNE del intestino delgado, por endoscopia o rayos X, el reciente uso de las imágenes por medicina nuclear se han constituido en una buena alternativa. La mayoría de TNE presenta receptores de membrana para la somatostatina. El octreótido, un análogo de la somatostatina con una vida media más prolongada se usa frecuentemente como terapia hormonal en estos pacientes con SC o diarrea. En diferentes estudios usando octreótido marcado con Indio 111 o Tecnecio 127 se han localizado tumores con receptores positivos para somatostatina. Esta técnica permite una detección precoz de estas neoplasias y una estatificación más precisa, y provee una importante información terapéutica al detectar tumores que responderán al tratamiento hormonal (20).
TNE esofágicos
Son raros. Exhiben la morfología de la neoplasia de células pequeñas del pulmón. Se ha descrito también como variantes la diferenciación escamosa o glandular. Se encuentran en el tercio distal como grandes masas vegetantes, ulceradas y con rápido crecimiento, de allí su pobre pronóstico (18).
TNE gástricos
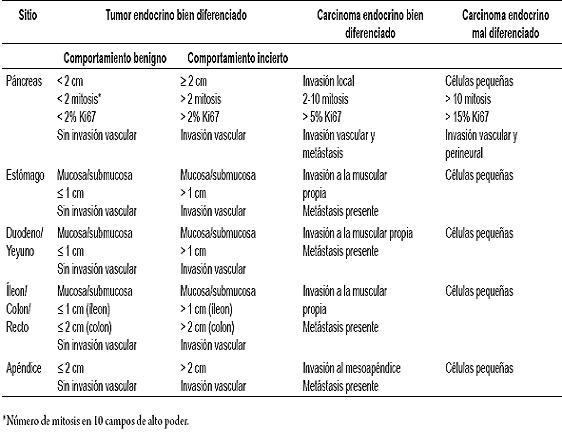
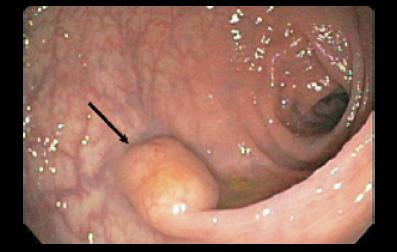
De acuerdo con la revisión de Godwin (18) representan el 4% de estas neoplasias en el tracto gastrointestinal. Se han estratificado según estén relacionados con estados de hipergastrinemia o con un fondo de gastritis crónica atrófica (GCA) con o sin anemia perniciosa (tipo I), asociados al síndrome de Zollinger Ellison (ZE), o en combinación con las neoplasias endocrinas múltiples (NEM) tipo 1 (tipo II), o las formas esporádicas (tipo III) (figura 1).
Figura 1. TNE gástrico asociado a gastritis antral crónica.
Esta distinción tiene implicaciones pronósticas pues los tumores asociados a la GCA, NEM 1 ó el ZE, tienen un mejor pronóstico que las formas esporádicas. La mayoría de estos tumores son pequeños, bien diferenciados y confinados a la mucosa y submucosa de la región fundocorporal o la zona de transición corporoantral. Aparecen como una lesión polipoide, con un comportamiento benigno. Están compuestos principalmente por células argirófilas, con producción de histamina. Frecuentemente pueden ser multicéntricos en asociación con una GCA del fundus, por destrucción autoinmune de las células parietales, llevando a una hipoclorhidria profunda con hipergastrinemia y anemia perniciosa. Esta forma de aparición representa los 2/3 de los TNE gástricos, y cursa con una hiperplasia de CE. En una serie de 27 pacientes con TNE asociados a GCA con diámetros hasta de 2 cm, ninguno tenía metástasis y una revisión de la literatura mostró compromiso ganglionar en solo el 8,6% (21). También se han asociado al consumo prolongado de bloqueadores de bomba (22). La combinación de ZE con NEM 1 cursa con hipergastrinemia que lleva a hiperplasia de CE lo que induce al desarrollo del tumor. Estos tumores son característicamente de menor tamaño (< 1 cm en promedio), pero pueden mostrar metástasis ganglionares. Las formas esporádicas son de mayor tamaño (mayor a 2 cm) con angioinvasión o penetran la pared en su totalidad con desarrollo de metástasis en más del 60% y metástasis hepáticas hasta en el 50%. La sobrevida oscila entre 2 y 4 años. Pueden producir histamina y dar un SC. Estos tumores representan el 20% de los TNE del estómago y se presentan como una masa solitaria, donde predominan las CE. Los tumores de células G son raros y se ubican en el antropíloro. Las formas pobremente diferenciadas están constituidas por células intermedias en vez de células pequeñas, con sobrevida a un año del 25%. Lo anterior sugiere que los tumores menores a un cm tienen un curso benigno, los de 1 a 2 cm únicos o múltiples con GCA o AEM-1/ZE e hipergastrinemia son difíciles de predecir pero en general se encuentran bien localizados, mientras que los mayores de 2 cm son malignos y frecuentemente desarrollan metástasis. Las formas indiferenciadas tienen pobre pronóstico independiente de su tamaño (23).
TNE pancreáticos
Pueden ocurrir con los síntomas típicos por la hipersecreción hormonal como el insulinoma, gastrinoma, VIPoma, glucagonoma o somatostatinoma, pero hasta en el 50% son no funcionantes o secretan péptidos de bajo poder biológico como el polipéptido pancreático (PP) o la neurotensina. Sin embargo, hasta en el 50% puede haber metástasis al momento del diagnóstico (24). Los insulinomas y gastrinomas son los más frecuentes. Los insulinomas son en el 90% benignos, menores de dos cm y únicos. Solo del 6-13% son múltiples y del 4-6% se asocian a la MEN-1. Se caracterizan por la hipoglucemia con síntomas neuroglicopénicos. Por la liberación de catecolaminas por la hipoglucemia cursa con sudor, temblor y palpitaciones. La secreción crónica de la gastrina en los gastrinomas lleva a una producción ácida gástrica elevada con aparición de úlceras pépticas, diarreas severas y refractarias y manifestaciones de reflujo gastroesofágico. Al momento del diagnóstico, el 50-60% de los gastrinomas son malignos. Los tumores se ubican más frecuentemente en páncreas (24-53%) y duodeno (13-49%). Los VIPomas secretan el péptido intestinal vasoactivo y producen el síndrome de Verner Morrison caracterizado por una diarrea acuosa de grandes volúmenes, hipocalemia y deshidratación. Son raros, usualmente de gran tamaño (72% de más de 5 cm) y malignos (64-92%) al momento del diagnóstico. VIPomas extrapancreáticos ocurren más frecuentemente en niños y son de origen neurogénico (ganglioneuromas, ganglioneuroblastomas, neuroblastomas y feocromocitomas) (24).
Los glucagonomas son raros, con un tamaño de 5-10 cm y 50-82% metastásicos al momento del diagnóstico. Su presentación más frecuente es con el eritema necrolítico migratorio, asociado a diabetes, anemia, pérdida de peso, depresión, diarrea o tromboembolismo (25). Los somatostatinomas son los más raros y se originan también de duodeno o la ampolla de Vater. Puede hacer parte de la neurofibromatosis tipo I. Los tumores pancreáticos son grandes y metastásicos (70-92%) En la clínica se encuentra diabetes, colelitiasis, diarrea con esteatorrea, hipoclorhidria, dolor abdominal, pérdida de peso y anemia (26). Estos tumores son no funcionantes en el 30-50% de los casos y deben diferenciarse del adenocarcinoma de páncreas porque las implicaciones pronósticas son muy diferentes. Generalmente, los asociados a las MEN-1 son grandes, multifocales y malignos del 62-92% (27).
TNE duodenal
Menos frecuentes, 1-2%. Se han reconocido 5 tipos:
1. Productores de gastrina
2. Productores de somatostatina
3. Paragangliomas
4. Productores de calcitonina, serotonina y polipéptido pancreático
5. Indiferenciados.
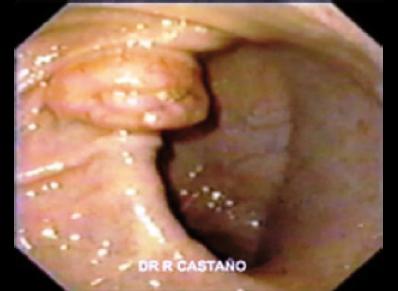
A diferencia del estómago, donde el pronóstico depende más del tamaño y de la asociación a otras entidades, en el duodeno su evolución depende del tamaño y sus características funcionales. El 60% de los tumores son de la variedad productora de gastrina, una tercera parte se asocia al SZE que hace parte de la MEN-1. El 40% del SZE tienen un gastrinoma duodenal, mientras en el otro 60% el tumor se ubica en páncreas. En el 90% de pacientes con MEN-1 y ZE, hay un gastrinoma duodenal, el cual es más frecuentemente multicéntrico y se ubica en la primera y segunda porción duodenal. Aparecen como nódulos submucosos que fácilmente pasan desapercibidos a la endoscopia. Aunque pequeños, dan metástasis a los linfáticos vecinos, principalmente los funcionantes, que son más grandes que el tumor primario. La invasión al hígado es rara y un evento tardío. Las formas no funcionantes se ubican en el bulbo duodenal (28). Los productores de somatostatina representan del 15-20%. Ocurre casi exclusivamente en la ampolla de Vater, y aparecen como masas prominentes, histológicamente con un patrón glandular y cuerpos de psamoma. Al momento del diagnóstico la mayoría muestra invasión a la muscular y metástasis ganglionares. Sin embargo, son no funcionantes, a diferencia de su contraparte en el páncreas. En un tercio se asocia a enfermedad de von Recklinghausen (Neurofibromatosis tipo 1). El tercero en frecuencia es el paraganglioma, que se aprecia en el área de la ampolla o periampular. Presenta principalmente somatostatina y polipéptido pancreático. Frecuentemente es mayor de 2 cm y compromete la muscular al momento del diagnóstico; sin embargo, su comportamiento no siempre es benigno (29). Tumores productores de serotonina, calcitonina o PP son raros. Usualmente alejados de la ampolla y sin signos de invasión. La aparición del carcinoide es excepcional. La mayoría son tumores bien diferenciados, con un comportamiento benigno y no funcionantes. Las formas indiferenciadas son raras y afectan más frecuentemente la ampolla de Vater (figura 2).
Figura 2. TNE duodenal manejado con bandas endoscópicas.
TNE yeyunoileales
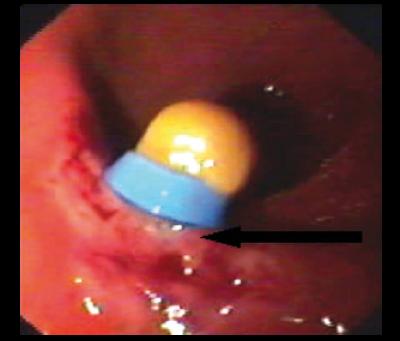
Representan del 20-30% de los TNE del TGI. La mayoría son argentafines. Compuestos de CE productoras de serotonina y sustancia P. Se producen principalmente en íleon distal. Aparecen como nódulos amarillo-grisosos, en la submucosa. Los casos sintomáticos son mayores a 1 cm, con invasión al mesenterio, fibrosis local y angulación del intestino, lo que puede llevar a obstrucción intestinal. Los mayores a 2 cm casi siempre son malignos y cursan con metástasis ganglionares. En el 40% estas neoplasias son múltiples. En el 20% de las formas malignas se asocian al SC, lo que implica el desarrollo de metástasis hepáticas. Los tumores mayores de 2 cm, que comprometen más allá de la submucosa, angioinvasivos y con el SC corresponden a la categoría de alta malignidad. Las formas indiferenciadas son raras (8) (figura 3).
Figura 3. TNE ileal encontrado por cápsula endoscópica.
TNE apendiculares
Pueden encontrarse como hallazgo incidental en 3-9/1.000 apendicetomías y generalmente son benignos. Corresponde al 50% de los TNE abdominales. Como en el íleon, más frecuentemente son argentafines, con CE que producen serotonina y sustancia P. La mayoría (70%) se ubica en la punta del apéndice y son menores a 2 cms. Recientemente se ha dicho que estos tumores se inician de complejos neuroendocrinos epiteliales en vez de células endocrinas intraepiteliales, lo que está sustentado por la tinción positiva con proteína S-100. La segunda forma más frecuente son los argirófilos que producen péptidos como el enteroglucagón, PP y PYY. En general presentan buen pronóstico con metástasis que oscilan entre 1,4 y 8%. Los que dan metástasis generalmente son mayores a 2 cm. La invasión del mesoapéndice independiente del tamaño es un marcador claro de metástasis. Tumores en la base del apéndice que comprometen el margen de resección deben ser llevados a hemicolectomía para evitar dejar tumor residual y la futura recaída. El SC es extremadamente raro en estas neoplasias y su hallazgo sugiere enfermedad metastásica al hígado y/o retroperitoneo (30).
TNE colorrectales
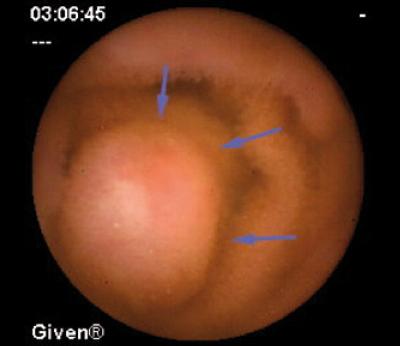
Se describen tres tipos: de células argirófilas, CE productoras de serotonina y sustancia P, y los pobremente diferenciados (célula pequeña) (31). Los bien diferenciados, argentafines, frecuentemente se hallan en recto y representan el 10% de todos los TNE (hallazgo incidental en 1/2500 rectoscopias). Frecuentemente son menores a 1 cm y la inmunohistoquímica los muestra positivos para glucagón 29, glucagón 37, fragmentos de proglucagón, PYY, PP. Menos frecuentemente se encuentra serotonina, sustancia P, somatostatina, insulina, encefalinas, B endorfinas, neurotensina, hormona gonadotrofina humana y motilina. El tamaño es el principal factor predictor del comportamiento. El riesgo de metástasis para tumores menores de 1 cm es de menos del 3%, entre 1 y 2 cm sube a 7% y si hay invasión a la muscular se eleva hasta el 46%. Los tumores mayores a 2 cm presentan metástasis en el 78%. Las formas argentafines con producción de serotonina predominan en el colon (los de peor pronóstico) y principalmente en el ciego, donde característicamente presentan un mayor tamaño. El SC se presentó en 4 de 118 casos y todos ellos tenían metástasis hepáticas. Las formas pobremente diferenciadas presentan una masa de rápido crecimiento. No se ha descrito ningún síndrome hormonal asociado y la sobrevida es de 5 meses (32) (figura 4).
Figura 4. TNE del recto alto con mucosa intacta.
Diagnóstico y síndromes clínicos
Diferentes marcadores tumorales en sangre u orina se han utilizado en el diagnostico y seguimiento de los TNE. Entre los marcadores genéricos, la cromogranina A (CgA) una glicoproteína contenida en los gránulos de secreción de las CE es el más importante marcador en sangre (33). Niveles altos se han observado en el 60-80% de los TNE funcionantes o no funcionantes, o en situaciones no tumorales como la insuficiencia renal, GCA, terapia con bloqueadores de bomba (34). Otros marcadores no específicos son la enolasa específica neuronal, PP y la hormona gonadotrópica coriónica, con menor sensibilidad y especificidad que la CgA (11). El ácido 5-OH-indolacético (5-HIA) es un marcador específico para los tumores secretantes de serotonina; es un metabolito de la serotonina que puede ser determinado en la orina de 24 horas. La sensibilidad del 5-HIA es del 65-75% con una especificidad del 90-100% (10, 11). Característicamente, los pacientes con el síndrome carcinoide presentan aumento de los depósitos de serotonina, con incremento de los niveles de la misma en las plaquetas y en los niveles del ácido 5-HIA en orina. El diagnóstico se confirma si la excreción aumentada del ácido 5-HIA en orina de 24 horas excede los 10 mg, teniendo la precaución de restringir por los 3-5 días previos al estudio alimentos ricos en serotonina (banano, uva, piña, tomates, ciruelas, berenjena, kiwi, nueces) y suspender los jarabes para la tos, levodopa, metisergida, paracetamol, AINEs y cafeína que dan cifras falsamente elevadas. Por el contrario la ACTH, esteroides, heparina, isoniazida y fenotiazinas dan resultados falsamente negativos (11). En los TNE funcionantes, la dosificación de las hormonas específicas que causa el síndrome característico representa el marcador específico. En particular, los pacientes con sospecha de insulinoma se deben determinar en sangre glicemia, insulina, péptido C y proinsulina. El ayuno prolongado (48-72 hs) es el estándar de oro para el diagnóstico, 98% desarrollará los síntomas. En el SZE la gastrina sérica (>1000 ng/L) y la secreción basal ácida con pH < 2,5 establece el diagnóstico. El test de provocación con secretina se realiza en pacientes con gastrinas menores a 1.000 ng/L. Las lesiones gástricas o del colon pueden ser evaluadas por endoscopia o colonoscopia o bien por ultrasonido endoscópico. Los tumores del intestino delgado son evaluados por el tránsito intestinal y más recientemente con el advenimiento de la enteroscopia y la cápsula endoscópica. Para los tumores pancreáticos la tomografía computarizada y la resonancia magnética son importantes para definir la extensión del tumor y la presencia de enfermedad metastásica, así como para valorar la respuesta al tratamiento. Ambos métodos tienen una sensibilidad del 30-94% (35).
El estudio con metaiodobenzilguanidina (MIBG) es otro método para evaluar TNE productores de catecolaminas, como los feocromocitomas y los paragangliomas. La MIBG es menos sensible que el OctreoScan en los otros TNE (36). Este estudio presenta la limitante de ser costoso y no estar disponible sino en centros de referencia para estos tumores. Imágenes funcionales como el OctreoScan tienen gran impacto en el manejo del paciente por proveer herramientas y estadificar mejor la enfermedad, visualizar lesiones ocultas o metastásicas y la evaluación para la elegibilidad del tratamiento con el análogo de la somatostatina. Más del 90% de los TC tienen receptores para la somatostatina, por eso pueden ser detectados con octreoscan que utiliza octreotide marcado con Indio 111 (111In octreotide). La sensibilidad de este método varía entre 80 y 100%. Es un excelente estudio para evaluar la enfermedad metastásica y puede servir como evaluación en la respuesta al tratamiento (47). Esta prueba es altamente específica para lesiones de 1 cm o más en el 80-90% (excepto los insulinomas que solo expresan estos receptores en el 50%). También detecta las metástasis a distancia con una sensibilidad del 96% (10, 11). Por el contrario, la tomografía por emisión de positrones (PET scan) en los TNE no ha probado ser útil, por su escasa actividad metabólica, excepto los tumores con una alta actividad proliferativa y baja diferenciación. No obstante el desarrollo de los métodos diagnósticos para esta entidad, el síndrome clínico relacionado con la sobreproducción hormonal es raramente reconocido. En una serie de 3.632 TNE, había una prevalencia de 60 casos con el síndrome carcinoide (1,6%). Se ha sugerido que la ausencia de síntomas se relaciona con la producción de hormonas inactivas (prohormonas) o a la rápida degradación de estos agentes en el mismo tumor o en la circulación general. En el caso de la producción de neuropéptidos, como serotonina, se asume que el número de células productoras es tan pequeño que la cantidad que llega a la circulación no alcanza a dar manifestaciones. Los síntomas principales son el rubor facial, diarrea, dolor abdominal, y las lesiones cardíacas seguidas por el asma y el edema. Lo más característico es el rubor facial episódico o permanente; el cual se acompaña de edema periorbital o facial, oliguria, hipotensión, y sibilancias. La segunda manifestación más frecuente es la diarrea que va de leve a explosiva, la cual no ocurre simultáneamente con los episodios de rubor facial. Esta diarrea es líquida y se explica por hipermotilidad intestinal. Ocasionalmente, episodios de broncoconstricción acompañan el rubor facial. Las manifestaciones cardíacas ocurren tardíamente y se dan por la fibrosis del tejido valvular derecho y/o izquierdo. Un estudio con ecocardiografía mostró que había compromiso valvular en el 66% de los pacientes que desarrollaba síndrome carcinoide. Los pacientes con compromiso valvular presentan niveles en sangre más altos de taquiquininas y mayor excreción de ácido 5-HIA en orina (8).
Actualmente, se acepta que solo parte del SC se explica por la sobreproducción de serotonina. La diarrea parece ser producida por la serotonina al inducir hipermotilidad y aumento de secreciones en el yeyuno. Además, la diarrea puede ser controlada con bloqueadores de la serotonina como metisergida, ciproheptadina y el ondansetron. Estos antagonistas de la serotonina no tienen mayor efecto en las manifestaciones del rubor facial. Recientemente se ha encontrado niveles altos en sangre de taquiquininas y sustancia P en los pacientes con SC, lo que soporta la teoría de una patogénesis multihormonal en estos síndromes. Incluso se ha logrado reproducir las manifestaciones del rubor facial en los minutos siguientes a la inyección de la sustancia P. Ocasionalmente el SC puede ocurrir sin la presencia de metástasis hepáticas, si el drenaje venoso del tumor se hace a la circulación sistémica como en algunos TNE del ovario o el retroperitoneo.
La presencia o no de hipergastrinemia tiene características pronósticas y terapéuticas. Gough (37) encontró que los pacientes sin hipergastrinemia, en el 66% desarrollaba metástasis, 60% tiene aumento del ácido 5-HIA, y el 50% fallecía por la entidad, mientras los pacientes con hipergastrinemia ni desarrollaban metástasis, ni aumentaban el ácido 5-HIA, ni morían por la enfermedad; además presentaban variedades histológicas "típicas".
Los TNE se han relacionado a la presencia de otras neoplasias NO neuroendocrinas con tasas tan altas como del 46-55%, más frecuentemente por compromiso del pulmón, mama, próstata y colon (38).
Manejo médico de las formas diseminadas
El manejo médico varía si son lesiones bien o mal diferenciadas. Los bien diferenciados producen el SC y el primer objetivo es el control de los síntomas. Como estas lesiones son de lento crecimiento y una sobrevida prolongada se debe tener en cuenta la calidad de vida con el tratamiento. La ciproheptadina (0,4 mg/kg/d en tres dosis, oral) que bloquea los receptores serotoninérgicos 1 y 2 y receptores H1 para la histamina ha disminuido la diarrea pero no el rubor facial en pacientes con TNE diseminados. Produce sedación suave y boca seca, y en menor proporción hay náuseas incontrolables y vómitos que inducen el cese del tratamiento. Otros han encontrado regresión del tumor con esta droga, sin embargo, esto no se ha reproducido en otras series. El tratamiento de los gastrinomas se inicia con dosis máxima de omeprazol o lansoprazol (40-120 mg/d) Los insulinomas son tratados con diazóxido asociado a la hidroclorotiazida, si no mejoran se recomienda bloqueadores de los canales del calcio, betabloqueadores y esteroides. Para las formas bien diferenciadas, la terapia se puede basar en el interferón, terapia con análogos de somatostatina y la terapia dirigida. La somatostatina es una hormona que inhibe la secreción de varias hormonas y péptidos, los receptores para la somatostatina se presentan en los TNE bien diferenciados (70-95%) con excepción de los insulinomas. Los análogos de la somatostatina permiten el control de los síntomas asociados a la producción hormonal y puede ser útil en el preoperatorio o en tumores inoperables (27). Pueden ser usados como agentes antiproliferativos, con cerca del 10% con disminución del tamaño tumoral (altas dosis) y en un 50% estabilización del crecimiento neoplásico. Se han usado dos tipos de análogos el octreótido y el lanreótide los cuales se unen principalmente a los receptores del subtipo 2 y 5. Recientemente, un análogo llamado pasireótide con afinidad por todos los subtipos de receptores a la somatostatina ha mostrado ser útil cuando los otros agentes han fallado (39). Los análogos de somatostatina como el octreótido son seguros, de fácil uso, bien tolerados, con infrecuentes efectos colaterales como el dolor abdominal, esteatorrea y colelitiasis. El octreótido se ha constituido en la medicación más frecuentemente usada en el TNE diseminado, con menos efectos colaterales, ha mostrado disminuir notablemente los niveles urinarios del ácido 5-HIA, el rubor facial y la diarrea. Kvols (40) ha demostrado también la regresión de las metástasis hepáticas con el octreótido, aunque se desconoce el mecanismo de acción exacto se sugiere un efecto antineoplásico directo o indirectamente a través de la inhibición de la hormona del crecimiento, insulina y otros factores del crecimiento. El interferón alfa en monoterapia o combinado al octreótido se ha usado para inhibir la secreción hormonal y estabilizar la enfermedad con variable respuesta. Hay respuesta bioquímica en el 40-60% y mejoría sintomática en 40-70% con disminución del volumen tumoral en el 10-15% (41). Los efectos colaterales son escasos, como un síndrome gripal, fatiga, pérdida de peso, anemia, leucopenia y hepatotoxicidad. Los tumores mal diferenciados requieren quimioterapia, con agentes (estreptozotocina, doxorrubicina, dacarbazina, 5-fluoruracilo) y respuestas variables (40-70%) con el uso de etopósido y cisplatino en los anaplasicos (11). Como los TNE expresan moléculas como el factor de crecimiento epidérmico, factor de crecimiento endotelial, nuevas terapias como el sorafenib, everolimus y los inhibidores mTOR (Rapamicina) se han usado (9). La terapia con radionúclidos de receptores peptídicos con el uso de análogos de somatostatina para llevar radioactividad al interior del tumor, usando 90 Itrio, 177 Lutecio o 111 Indio, que son captados por los receptores de somatostatina. Se utilizan en pacientes no operables y con receptores para somatostatina positivos. Los estudios sugieren estabilización de la enfermedad del 50-70% y control de los síntomas en el 70%. Las dosis aún no han sido bien determinadas y varían por la tolerancia variable de los diferentes órganos como la médula ósea o el riñón (42).
Manejo quirúrgico
La cirugía es la piedra angular en el manejo de los TNE. Se ha demostrado que la exploración quirúrgica temprana de los pacientes aumenta significativamente la supervivencia. Un estudio de pronóstico con 195 pacientes con gastrinomas seguidos durante 20 años mostró un aumento de las metástasis hepáticas 5 veces mayor en los pacientes no operados comparados con los sometidos a resección del tumor. Igualmente, los pacientes no intervenidos presentaron nuevas lesiones evidenciadas por imágenes dos veces más frecuente que el grupo operado. Finalmente, la rata de muertes relacionadas con la enfermedad fue 23 veces mayor en el grupo no quirúrgico comparándolo con el quirúrgico (46).
En el compromiso locorregional o las metástasis hepáticas una cirugía de citorreducción puede llevarse a cabo para el 90% del tumor. La cirugía paliativa debe hacer en las siguientes situaciones:
1. Remover el tumor primario en pacientes con metástasis hepáticas no operables, principalmente en tumores hormonalmente funcionantes
2. Si el tumor primario se ubica en el intestino delgado por el alto riesgo de obstrucción
3. En el caso que la cirugía permita un manejo multimodal subsiguiente.
Las indicaciones quirúrgicas para los pacientes con TNE diseminado incluyen los síntomas incapacitantes por:
1. SC refractario al tratamiento
2. Dolor abdominal episódico por obstrucción intestinal, masa tumoral, o compromiso vascular
3. Pérdida de peso.
Los pacientes son llevados a cirugía antes si la resección es potencialmente curativa o para reducir la necesidad de la terapia médica. La tomografía no detecta pequeños tumores pero ayuda a determinar el grado de extensión local y a distancia. Igualmente el ultrasonido, la placa simple de abdomen, la angiografía y el tránsito intestinal proveen muy poca información adicional. El 60% de los TNE se ubica en el apéndice y para tumores menores a 2 cm la simple apendicectomía es curativa. Esto también se admite para pacientes ancianos o con alto riesgo quirúrgico, con lesiones ligeramente mayores a 2 cm. La hemicolectomía derecha se reserva para pacientes jóvenes con bajo riesgo operatorio y con lesiones mayores a 2 cm. En los casos en que hay compromiso del mesoapéndice o invasión vascular se prefiere ser más agresivo aun con tumores entre 1 y 2 cm, practicar mínimo la resección del ciego. Estas recomendaciones globales deben ser tomadas con reserva, pues aun tumores menores a 1 cm muestran evidencia de invasión muscular, permeación linfática y compromiso de la grasa periapendicular con una larga sobrevida y sin secuelas a pesar de haber sido manejados con solo la apendicectomía (8, 48).
El manejo endoscópico ha sido reportado con éxito para TNE del estómago. Los criterios para intentar la remoción endoscópica incluyen: tumores menores a 2 cm, ausencia de malignidad en la histología, y la presencia de hipergastrinemia, mientras que las que no se puedan remover totalmente o muestren invasión deben resecarse radicalmente (43, 44).
El hallazgo incidental de TNE es desafortunadamente escaso. Si se encontrara, la remoción quirúrgica agresiva en monobloque debe intentarse y buscar multicentricidad y otras neoplasias primarias. Para tumores entre 1 y 2 cm, el 18% tiene metástasis hepáticas. A pesar de la gran masa tumoral, intentos quirúrgicos agresivos deben procurarse. El tumor más frecuente en el divertículo de Meckel es el TNE y presenta el mismo pronóstico ominoso que los de ubicación ileal.
Manejo del TNE con metástasis hepáticas
La presencia de metástasis hepáticas implica una pobre sobrevida y casi invariablemente cursará con el SC. Sin embargo, el crecimiento tumoral es lento y la sobrevida promedio es de 8,1 años luego de iniciados los síntomas. Con el uso del octreótido algunos de los síntomas del SC se han logrado controlar, sin embargo, los grandes volúmenes tumorales poco responden a la terapia médica, de allí que se promulgue la remoción completa o al menos tratar de lograr la mayor citorreducción. Solo el 9% de los TNE sintomáticos son considerados candidatos para cirugía. La resección paliativa del hígado también ha sido recomendada si por lo menos el 90% de la masa puede ser removida, aunque el número de pacientes que adquiere una adecuada paliación de sus síntomas y la corta respuesta del tratamiento refleja la necesidad de refinar las indicaciones para la cirugía paliativa. Sin embargo, la sobrevida promedio de los pacientes con intervención sobre las metástasis hepáticas fue de 218 meses, comparado con los 48 meses de los pacientes sin esta intervención. La experiencia con el trasplante hepático para estas lesiones es aún incipiente, pero en pacientes jóvenes con el tumor primario controlado y sin compromiso tumoral extrahepático, el trasplante puede ser una buena opción (10, 45). La embolización es precedida por la angiografía para determinar la permeabilidad y anatomía de la vena porta. Clínicamente los pacientes siguen un curso bastante predecible luego de la ligadura o embolización, consistente en dolor en el cuadrante superior derecho, fiebre, leucocitosis con las pruebas de función hepática alteradas (aumento de AST, ALT) con disminución de su función. No está demostrada una ventaja de la embolización con quimioterápicos sobre la sola embolización, sin embargo, lesiones tumorales de más de tres cm responden mejor con la ablación por radiofrecuencia asociado a la quimioembolizacion (10). A pesar del compromiso multilobar no se debe detener la laparotomía, pues la sola reducción de la masa hepática tumoral y la resección de segmentos intestinales isquémicos y obstruidos permiten obtener una buena paliación, además, se debe practicar la colecistectomía profiláctica para evitar la colecistitis gangrenosa luego de la ligadura de la arteria hepática, la embolización o la administración prolongada del octreótido. Las manifestaciones cardinales del SC intraoperatorio son el enrojecimiento facial y la hipotensión luego de la inducción de la anestesia. Las medidas de soporte deben acompañarse con la administración del octreótido 50 mcg, seguido por otros 50 en 15 seg lo que resulta en una mejoría dramática. Este SC puede ocurrir en cualquier momento del transoperatorio. Se debe evitar el tiopentano, agonistas adrenérgicos, noradrenalina, dopamina, succinilcolina y liberadores de histamina (atracurium, d-Tubocurarina) por parte del anestesiólogo. Se sugiere dar fentanyl, diazepam con vencuronio para facilitar la intubación (8).
Experiencia nacional
A continuación se presenta la única experiencia publicada que evalúa el manejo y desenlace de estas neoplasias en el país (8).
Pacientes y métodos
El presente estudio se llevó a cabo en el Instituto Nacional de Cancerología, centro de tercer nivel y sitio de referencia para diferentes neoplasias. Se revisaron 45.869 informes de patología, entre el 1° de enero de 1988 y el 31 de diciembre de 1992, y se encontraron 26 pacientes con TNE. Se tomaron 24 de ellos por contar con un seguimiento estricto, 10 hombres y 14 mujeres (58%), con TNE de diferente ubicación en el abdomen. En todos los casos el tumor fue diagnosticado por biopsia, ya fuera endoscópica o quirúrgica. El diagnóstico histológico se basó en el examen del tejido tenido con hematoxilina-eosina y en algunos casos con fenotipificación por inmunohistoquímica. Se buscó que todos los pacientes tuvieran un estrecho seguimiento para lograr un buen análisis de la sobrevida.
Resultados
La edad promedio de presentación fue de 60 años para los hombres y 50 para las mujeres. La ubicación no representa la encontrada en las diferentes series de la literatura, donde predominan los TNE del apéndice, diagnosticados como hallazgo incidental. Predominaron en la presente serie los TNE de ubicación gástrica con 9 casos (40%), siendo más frecuentes los de ubicación proximal (66%). En segundo lugar se ubicaron los rectales con el 20%, mientras que los de ubicación en colon derecho, esófago, páncreas, duodeno y 2 casos de TNE metastásico a hígado con primario desconocido, representaron el 8% cada uno.
De acuerdo con la distribución de estas neoplasias, según la clasificación de Williams y Sandler (17), el 62% son de intestino anterior, 8% intestino medio, 22% intestino posterior y 2 casos (8%) de tumores metastásicos a hígado con primario desconocido. El tiempo promedio de síntomas antes de consultar a la institución fue de 11,5 meses, sin embargo no se encontró una mayor recurrencia o mayor mortalidad en los pacientes con evoluciones más prolongadas. Solo se encontró una paciente con SC (4,2%), que presentaba múltiples metástasis hepáticas de un TNE de origen desconocido y curso con enrojecimiento facial, diarrea, broncoconstricción y valvulopatía. Se manejó con ciproheptadina con pobre respuesta. Para esta época no se contaba con el octreótido para las crisis del SC. Presentaba cifras de ácido 5-HIA de 8,9 mg/24 horas y falleció 8 meses después de una laparotomía exploratoria donde se le encontró una carcinomatosis peritoneal con mayor compromiso tumoral en la unión ileocecal. Se llevaron a cirugía 19 pacientes para resección con intención curativa a 13 de ellos (sobrevida de 55 meses), a 1 solo se le hizo citorreducción, a 2 paliación, y 3 fueron declarados como irresecables. La sobrevida global para el grupo de pacientes intervenidos fue de 40 meses. A 5 pacientes no se les pudo practicar cirugía encontrándose una sobrevida de 7 meses (p 0,02).
De acuerdo a la ubicación de estos tumores y la sobrevida, no se encontró una diferencia significativa, y en la presente revisión ningún caso asociado a neoplasia endocrina múltiple. En 7 pacientes hubo recaída a distancia, en promedio a los 12 meses, sin encontrarse predilección por una ubicación del tumor en especial. A 5 pacientes se les administró quimioterapia adyuvante, con 5-fluoruracilo más levamisol, 2 de ellos se combinaron con radioterapia. Esto se hizo para tumores gástricos (3) y de colon (2). Se le aplicó radioterapia solo a 5 pacientes, 2 de estómago, 1 de colon y 2 de recto. La evolución de los pacientes mostró que 13 de ellos murieron, 1 por una sepsis en el postoperatorio, 1 vive con una recaída en hígado, y 12 a causa de la enfermedad.
Discusión
En la presente serie se recoge la experiencia del manejo de los TNE en un centro de referencia como lo es el Instituto Nacional de Cancerología, Bogotá-Colombia, destacando que en el lapso de 5 años (1988-1992) se recogieron 26 casos de los cuales se encontró seguimiento en 24 pacientes. Contrastan estas cifras con las recientemente informadas para el país en un consenso latinoamericano para el manejo de estas neoplasias, 36 donde se informa sobre 150 casos de TNE (83 gastrointestinales) recogidos en 4 años (2003-2006) lo que sugiere un incremento en su incidencia y con una distribución similar a la informada en la serie nuestra. Este incremento en la incidencia en buena medida pude ser explicado por el advenimiento de pruebas más sensibles y específicas para la detección de estos tumores, como son la enteroscopia, la endoscopia por cápsula, el OctreoScan y un mejor conocimiento y refinamiento de las técnicas de patología (inmunohistoquímica). La sobrevida de estos tumores son mejores a la contraparte, los carcinomas, y su curso indolente e insidioso permite terapias que apenas se implementan en el medio como la administración del octreótido radiomarcado para ser captado por la célula con receptores para esta molécula y servir no solo de diagnóstico sino además de tratamiento. Se ha mejorado la sobrevida con las grandes resecciones hepáticas que muchas veces ameritan los TNE metastásicos y se han realizado incluso dos trasplantes por el grupo de Gastrohepatología de la Universidad de Antioquia, uno de ellos con una recaída precoz y masiva y el otro con una buena sobrevida. Faltan varios tópicos por mejorar en el manejo local de estas lesiones como son el contar en forma más expedita con el recurso de los marcadores tanto en sangre (cromogranina A) así como en orina (OH-indolacético) y del recurso del OctreoScan que es costoso y de difícil aprobación por las entidades prestadoras de salud. La mejor forma de impactar favorablemente el pronóstico de estas lesiones se basa en el desarrollo de grupos interdisciplinarios de especialistas (oncólogos, patólogos, endocrinólogos, cirujanos) con un especial interés por estos tumores, como existen en Argentina y Brasil, que desarrollen las estrategias para lograr obtener un registro local que alimente uno nacional para la tabulación y seguimiento de estas neoplasias. Esto además serviría para consolidar un registro latinoamericano para los TNE.
Referencias
1. Lubarsh O. Uber den primären Krebs des Ileum nebst Bemerkungen über das glichzeitige Vorkommen von Krebs und tuberculose Virchow Arch 1888; 3: 280. [ Links ]
2. Ranson WB. A case of primary carcinorna of the ileum. Lancet 1890; 2: 1020. [ Links ]
3. Ciaccio C. Sur une nouvelle espèce cellulaire dans les glandes de lieberkühn. C R Soc Biol 1906; 1: 76. [ Links ]
4. Oberndorfer S. Karzinoide Tumoren des Dünndarms. Frankfrt Z Pathol 1907; 1: 407. [ Links ]
5. Lembeck F. 5-Hydoxytryptamine in a carcinoid tumor. Nature 1953; 172: 1910. [ Links ]
6. Thorson A, Bjork G, Bjorkman G. Malignant carcinoid of the srnall intestine with metastases to the liver, valvular disease of the right heart (pulmonary stenosis and tricuspid regurgitation without septal defect) peripheral vasomotor symptoms bronchoconstriction and an unusul type of cyanosis. Am Heart J 1954; 4: 795. [ Links ]
7. Pearse AGE. The cytochemistry and ultrastructure of polypeptide hormone producing cells of the APUD serics and the embryologic, physiologic and pathologic implications of the concept. J Histochem Cytochem 1969; 17: 303. [ Links ]
8. Castaño R, Aristizábal H, Hoyos S. Tumores neuroendocrinos abdominales. In: Botero M, ed. Cirugía. 2 ed. Medellín: Editorial Universidad de Antioquia 2002. p. 220-36. [ Links ]
9. Massironi S, Sciola V, Peracchi M, Ciafardini C, Spampatti MP, Conte D. Neuroendocrine tumors of the gastro-entero-pancreatic system. World J Gastroenterol 2008; 14: 5377-84. [ Links ]
10. Modlin IM, Oberg K, Chung DC, et al. Gastroentero-pancreatic neuroendocrine tumours. Lancet Oncol 2008; 9: 61-72. [ Links ]
11. Ramage JK, Davies AH, Ardill J, et al. Guidelines for the management of gastroenteropancreatic neuroendocrine (including carcinoid) tumours. Gut 2005; 54 Suppl 4: iv1-16. [ Links ]
12. Kloppel G, Heitz PU, Capella C, Solcia E. Pathology and nomenclature of human gastrointestinal neuroendocrine (carcinoid) tumors and related lesions. World J Surg 1996; 20: 132-41. [ Links ]
13. Insabato L, Del Basso De Caro M, Caramanna E, De Rosa G. Pathology of neuroendocrine tumours. Front Biosci 2009; 14: 4712-8. [ Links ]
14. Faggiano A, Mansueto G, Ferolla P, et al. Diagnostic and prognostic implications of the World Health Organization classification of neuroendocrine tumors. J Endocrinol Invest 2008; 31: 216-23. [ Links ]
15. Solcia E, Klöppel G, Sobin LH. Histological Typing of Endocrine Tumors. WHO International Histological Classification of Tumors. 2 nd ed. Berlin: Springer; 2000: 56-70. [ Links ]
16. Rindi G, Kloppel G, Alhman H, et al. TNM staging of foregut (neuro)endocrine tumors: a consensus proposal including a grading system. Virchows Arch 2006; 449: 395-401. [ Links ]
17. Williams ED, Sandler M. The classification of carcinoid tum ours. Lancet 1963; 1: 238- 9. [ Links ]
18. Chejfec G, Falkmer S, Askensten U, Grimelius L, Gould VE. Neuroendocrine tumors of the gastrointestinal tract. Pathol Res Pract 1988; 183: 143-54. [ Links ]
19. Godwin JD, 2nd. Carcinoid tumors. An analysis of 2,837 cases. Cancer 1975; 36: 560-9. [ Links ]
20. Hubalewska-Dydejczyk A, Fross-Baron K, Mikolajczak R, et al. 99mTc-EDDA/HYNICoctreotate scintigraphy, an efficient method for the detection and staging of carcinoid tumours: results of 3 years' experience. Eur J Nucl Med Mol Imaging 2006; 33: 1123-33. [ Links ]
21. Rindi G, Luinetti O, Cornaggia M, Capella C, Solcia E. Three subtypes of gastric argyrophil carcinoid and the gastric neuroendocrine carcinoma: a clinicopathologic study. Gastroenterology 1993; 104: 994-1006. [ Links ]
22. Castaño R, Ruiz MH, Jaramillo P, et al. Pólipos gástricos: aspectos epidemiológicos y su relación con el consumo de bloqueadores de bomba. Rev Col Gastroenterol 2005; 20: 25-34. [ Links ]
23. Hou W, Schubert ML. Treatment of gastric carcinoids. Curr Treat Options Gastroenterol 2007; 10: 123-33. [ Links ]
24. Alexakis N, Neoptolemos JP. Pancreatic neuroendocrine tumours. Best Pract Res Clin Gastroenterol 2008; 22: 183-205. [ Links ]
25. Marogy G, De Man M, Verslype C. Necrolytic migratory erythaema and glucagonoma syndrome. Acta Clin Belg 2009; 64: 70-1. [ Links ]
26. South CD, Baird MA, Marsh WL, Jr. Clinical challenges and images in GI. Ampullary somatostatinoma associated with neurofibromatosis type 1, presenting with iron-deficiency anemia. Gastroenterology 2009; 136: 51, 368. [ Links ]
27. Oberg K, Eriksson B. Endocrine tumours of the pancreas. Best Pract Res Clin Gastroenterol 2005; 19: 753-81. [ Links ]
28. Burke AP, Federspiel BH, Sobin LH, Shekitka KM, Helwig EB. Carcinoids of the duodenum. A histologic and immunohistochemical study of 65 tumors. Am J Surg Pathol 1989; 13: 828-37. [ Links ]
29. Selvakumar E, Rajendran S, Balachandar TG, et al. Neuroendocrine carcinoma of the ampulla of Vater: a clinicopathologic evaluation. Hepatobiliary Pancreat Dis Int 2008; 7: 422-5. [ Links ]
30. Moertel CG, Weiland LH, Nagorney DM, Dockerty MB. Carcinoid tumor of the appendix: treatment and prognosis. N Engl J Med 1987; 317: 1699-701. [ Links ]
31. Tsukamoto S, Fujita S, Yamaguchi T, et al. Clinicopathological characteristics and prognosis of rectal well-differentiated neuroendocrine tumors. Int J Colorectal Dis 2008; 23: 1109-13. [ Links ]
32. Vilallonga R, Espin Basany E, Lopez Cano M, Landolfi S, Armengol Carrasco M. [Neuroendocrine carcinomas of the colon and rectum. A unit's experience over six years]. Rev Esp Enferm Dig 2008; 100: 11-6. [ Links ]
33. Jansson AM, Rosjo H, Omland T, et al. Prognostic value of circulating chromogranin A levels in acute coronary syndromes. Eur Heart J 2009; 30: 25-32. [ Links ]
34. Campana D, Nori F, Piscitelli L, et al. Chromogranin A: is it a useful marker of neuroendocrine tumors? J Clin Oncol 2007; 25: 1967-73. [ Links ]
35. Rockall AG, Reznek RH. Imaging of neuroendocrine tumours (CT/MR/US). Best Pract Res Clin Endocrinol Metab 2007; 21: 43-68. [ Links ]
36. Costa F, Domenichini E, Garavito G, et al. Management of neuroendocrine tumors: a meeting of experts from Latin America. Neuroendocrinology 2008; 88: 235-42. [ Links ]
37. Gough DB, Thompson GB, Crotty TB, et al. Diverse clinical and pathologic features of gastric carcinoid and the relevance of hypergastrinemia. World J Surg 1994; 18: 473-9; discussion 9-80. [ Links ]
38. Tichansky DS, Cagir B, Borrazzo E, et al. Risk of second cancers in patients with colorectal carcinoids. Dis Colon Rectum 2002; 45: 91-7. [ Links ]
39. Ben-Shlomo A, Melmed S. Pasireotide--a somatostatin analog for the potential treatment of acromegaly, neuroendocrine tumors and Cushing's disease. I Drugs 2007; 10: 885-95. [ Links ]
40. Kvols LK, Martin JK, Marsh HM, Moertel CG. Rapid reversal of carcinoid crisis with a somatostatin analogue. N Engl J Med 1985; 313: 1229-30. [ Links ]
41. Frank M, Klose KJ, Wied M, Ishaque N, Schade-Brittinger C, Arnold R. Combination therapy with octreotide and alpha-interferon: effect on tumor growth in metastatic endocrine gastroenteropancreatic tumors. Am J Gastroenterol 1999; 94: 1381-7. [ Links ]
42. Kwekkeboom DJ, de Herder WW, Kam BL, et al. Treatment with the radiolabeled somatostatin analog [177 Lu-DOTA 0, Tyr3]octreotate: toxicity, efficacy, and survival. J Clin Oncol 2008; 26: 2124-30. [ Links ]
43. Mashimo Y, Matsuda T, Uraoka T, et al. Endoscopic submucosal resection with a ligation device is an effective and safe treatment for carcinoid tumors in the lower rectum. J Gastroenterol Hepatol 2008; 23: 218-21. [ Links ]
44. Martínez-Ares D, Souto-Ruzo J, Varas Lorenzo MJ, et al. Endoscopic ultrasoundassisted endoscopic resection of carcinoid tumors of the gastrointestinal tract. Rev Esp Enferm Dig 2004; 96: 847-55. [ Links ]
45. Frilling A, Li J, Malamutmann E, Schmid KW, Bockisch A, Broelsch CE. Treatment of liver metastases from neuroendocrine tumours in relation to the extent of hepatic disease. Br J Surg 2009; 96: 175-84. [ Links ]
46. Norton J, Fraker D, Alexander H, Gibril F, Liewehr D, Venzon D, Jensen R. Surgery Increases Survival in Patients with Gastrinoma. Ann Surg 2006; 244: 410-419. [ Links ]
47. Khan M, Coleman E. Diagnosis and therapy of carcinoid tumorscurrent state of the art and future directions. Nuclear Medicine and Biology 2008; 35: S177-S191. [ Links ]
48. Modlin I, Kidd M, Latich I, Zikusoka M, Shapiro M. Current Status of Gastrointestinal Carcinoids. Gastroenterology 2005; 128: 1717-1751. [ Links ]











 text in
text in