Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957versión On-line ISSN 2500-7440
Rev Col Gastroenterol v.27 n.1 Bogotá ene./mar. 2012
Trasplante hepático en adultos: Estado del arte
State of the art liver transplantation in adults
Óscar Santos, MD, (1,2) Juan Marín, MD, (1,2) Octavio Muñoz, MD, (1,2) Álvaro Mena, MD, (1) Carlos Guzmán, MD, (1) Sergio Hoyos, MD, MSc, (1,2) Juan C. Restrepo, MD, MSc, PhD, (1,2) Gonzalo Correa, MD. (1,2)
(1) Unidad de Hepatología y Trasplante hepático de la Universidad de Antioquia y el Hospital Pablo Tobón Uribe, Medellín, Colombia
(2) Grupo de Gastrohepatología de la Universidad de Antioquia, Medellín, Colombia
Correspondencia y responsable de la solicitud de reimpresos Óscar Mauricio Santos Sánchez Dirección: Calle 78B No. 69-240. Hospital Pablo Tobón Uribe. Medellín. Piso 9°, Unidad de Hepatología. Teléfono: 4459752. Fax: (4) 4459752 osmausa@yahoo.com
Fecha recibido: 22-12-11 Fecha aceptado: 21-02-12
Resumen
El trasplante hepático se ha convertido en la mejor opción de tratamiento para la cirrosis, la falla hepática aguda y algunos tumores, con grandes avances en los últimos años que han permitido obtener resultados muy buenos en la sobrevida a largo plazo de estos pacientes. Las principales complicaciones que se presentan son alteraciones vasculares y de la vía biliar en el injerto hepático, la recaída de la enfermedad de base, la insuficiencia renal, las infecciones oportunistas y, a largo plazo, el desarrollo de síndrome metabólico con enfermedad cardiocerebrovascular y las neoplasias de novo. En la actualidad, en varios centros de alta complejidad del país se realizan trasplantes hepáticos, de ahí que sea importante para la comunidad científica conocer los aspectos más importantes en el cuidado de estos pacientes.
Palabras clave
Trasplante hepático, cirrosis, MELD, rechazo, injerto hepático.
Abstract
Liver transplantation has become the best treatment option for cirrhosis, acute liver failure and some tumors. The great advances of recent years have yielded very good results in the long-term survival of these patients. The main complications that occur are vascular and bile duct alterations in the liver graft, relapses of the underlying disease, renal failure, opportunistic infections, and in the long term development of metabolic syndrome, cardiovascular disease, and new malignancies. Currently, several highly complex medical centers in this country perform liver transplants. For this reason it is important for scientists to know the most important aspects in the care of these patients.
Key words
Liver transplantation, cirrhosis, MELD, rejection, liver graft.
INTRODUCCIÓN
El trasplante de hígado (TH) es un tratamiento mundialmente aceptado desde la década de los ochenta para el manejo de la enfermedad hepática avanzada (1) y actualmente es la terapia de elección en la falla hepática aguda con indicadores de mal pronóstico, en insuficiencia hepática crónica, en el manejo de tumores hepáticos primarios y en algunas enfermedades por errores en el metabolismo.
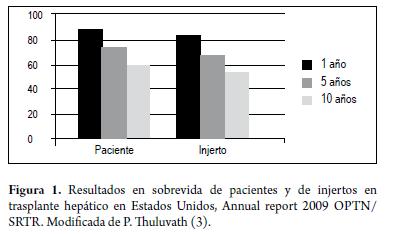
Han existido grandes avances desde 1963 cuando el doctor Thomas Starzl realizó el primer TH exitoso (2), actualmente con muy buenas tasas de sobrevida a largo plazo de pacientes y de injertos hepáticos (figura 1), logrando una buena calidad de vida con reincorporación a las actividades de la vida diaria (3). Estos resultados favorables son el fruto del perfeccionamiento de las técnicas quirúrgicas, mejores cuidados perioperatorios, la utilización de nuevos y más efectivos medicamentos inmunosupresores y la adecuada selección de los pacientes. Desde el punto de vista quirúrgico ha existido una depuración progresiva de las técnicas durante los últimos 40 años, lo que ha llevado a que sea un procedimiento cada vez más seguro para el receptor. Con la introducción de la técnica de "piggyback" o de preservación de la cava se ha logrado un menor tiempo quirúrgico, menor tiempo de isquemia caliente, con fase anhepática más corta, disminución de las pérdidas sanguíneas, sin necesidad del uso de bypass veno-venoso, lo que ha representado disminución en algunas complicaciones y costos, por lo tanto en la actualidad se considera la técnica quirúrgica de elección (4). Con respecto a la anastomosis biliar se prefiere la colédoco-coledocostomía porque permite un flujo biliar fisiológico hasta el duodeno con preservación de la función del esfínter de Oddi, evita la contaminación intestinal de los conductos biliares y permite realizar intervenciones diagnósticas y terapéuticas (5). En los casos donde los conductos biliares del receptor sean anormales como en la colangitis esclerosante primaria (CEP), sean ausentes como en la atresia biliar, hayan sido manipulados previamente por cirugías o en los casos de inadecuada concordancia en los tamaños del donante y el receptor, se puede optar por la técnica de hepaticoyeyunostomía en Y de Roux. En cuanto a los cuidados perioperatorios, se han demostrado mejores resultados con protocolos racionales de transfusiones, apropiada corrección de coagulopatía y acidosis, prevención de la hipotermia y el mantenimiento de una presión venosa central baja (6). Todos estos cambios han permitido la posibilidad de extubación temprana en un buen grupo de pacientes, lo que se asocia con disminución de complicaciones como infecciones, injuria renal, menores tiempos de estancia hospitalaria y menor utilización de recursos (7).
INDICACIONES Y CONTRAINDICACIONES
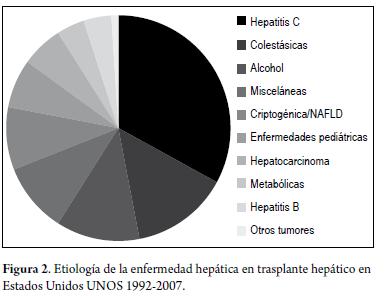
La principal indicación para el TH es la cirrosis hepática (CH), siendo en el mundo occidental la causa más frecuente la infección crónica por el virus de la hepatitis C (VHC), seguida de la CH por alcohol y la enfermedad hepática grasa no alcohólica (de las siglas en ingles NAFLD), mientras en Asia y África la principal causa de cirrosis es la infección crónica por el virus de la hepatitis B (VHB) (8). Otras etiologías de enfermedades hepáticas con su frecuencia en trasplante hepático aparecen en la figura 2. En nuestro medio, la principal indicación de trasplante es la enfermedad hepática por alcohol. En el caso de los pacientes con cirrosis, son tributarios de trasplante aquellos clasificados con puntaje Child-Turcotte-Pugg (CTP) C, o CTP B con complicaciones como peritonitis bacteriana espontánea, ascitis refractaria, encefalopatía hepática persistente o recurrente, y sangrado variceal recurrente. En las enfermedades colestásicas se indica en los casos de hiperbilirrubinemia moderada a severa, prurito intratable, colangitis recurrente y específicamente en colangitis esclerosante primaria cuando exista una estenosis dominante que no se resuelva con manejo intervencionista, siempre y cuando se descarte colangiocarcinoma. Con respecto al carcinoma hepatocelular (CHC) está mundialmente aceptado el trasplante cuando se cumplen los criterios de Milán (9), es decir una lesión menor de 5 cms ó 3 nódulos menores de 3 cms, con muy buenos resultados a largo plazo y con un bajo porcentaje de recidiva. Existen en el mundo múltiples intentos por expandir los criterios de Milán e incluir pacientes con enfermedad más avanzada para trasplante, siendo hasta el momento los criterios de San Francisco los que han mostrado buenos resultados, refiriéndose a pacientes con una lesión única menor de 6,5 cms ó 3 lesiones menores de 4,5 cms y que la suma de estas sea menor de 8 cms (10); sin embargo, no son aceptados por toda la comunidad médica especializada. En el escenario de la falla hepática aguda, el trasplante hepático es la única terapia definitiva para aquellos pacientes con pobre expectativa de vida libre de trasplante, existiendo varios factores pronósticos adversos que se reúnen en los criterios del King’s College (tabla 1) y que se utilizan como referentes para la selección de los pacientes (11). Todo individuo cirrótico con evidencia de progresión de su enfermedad debe remitirse tempranamente para evaluación y seguimiento en un centro de trasplante hepático, generalmente con un CTP mayor de 7 puntos o un puntaje MELD mayor de 11, con el fin de que pueda llegar a trasplantarse en las mejores condiciones posibles y no esperar a que se presenten complicaciones que impida llevarlo a este procedimiento.
Se consideran contraindicaciones para el TH la presencia de enfermedad cardiopulmonar avanzada que tenga un riesgo prohibitivo para el procedimiento quirúrgico, donde se incluye la enfermedad coronaria sintomática, la disfunción ventricular severa, la cardiomiopatía avanzada y la hipertensión pulmonar severa (HTP), es decir, con presión media en la arteria pulmonar mayor de 50 mmHg.
En los casos de HTP moderada debe realizarse cateterismo derecho con medición de la resistencia vascular pulmonar, siendo indispensable que sea menor de 240 dinas/cms/seg para poder considerar el trasplante. También es una contraindicación la presencia de una malignidad extrahepática no controlada o curada según criterios oncológicos (excepto cáncer superficial de piel), los procesos infecciosos sistémicos no controlados, la falta de un adecuado soporte psicosocial y el abuso activo de alcohol o psicotóxicos. Para considerar un paciente con cirrosis alcohólica como candidato para TH la mayoría de centros exige un tiempo mínimo de abstinencia (6 meses); sin embargo, en la actualidad muchos expertos opinan que más que un tiempo de abstinencia determinado, se requiere la adherencia a un programa de rehabilitación con un buen soporte social y familiar. En cuanto a la obesidad, solo los pacientes con un estado mórbido (Índice de masa corporal > 40) tienen contraindicación para TH. En los últimos años se ha considerado que los pacientes mayores de 65 años (12) y con infección por el virus del VIH (13) pueden ser llevados a trasplante hepático, aunque requieren de una exhaustiva evaluación multidisciplinaria de cada caso en particular. La falla renal no se considera una contraindicación del TH, pero los pacientes con enfermedad renal crónica con depuración de creatinina menor 30 ml/min, una biopsia renal con glomeruloesclerosis mayor del 30% o con síndrome hepatorrenal en diálisis por más de 12 semanas, deben someterse a trasplante combinado de hígado y riñón.
SELECCIÓN PARA EL TRASPLANTE y ASIGNACIÓN DE ÓRGANOS
Los buenos resultados mostrados en la actualidad ha llevado a un aumento importante de los centros de TH en el mundo y por supuesto de los pacientes referidos a los programas; como consecuencia de esto se presenta una progresiva escasez de órganos con respecto a la demanda de los mismos y por lo tanto que las listas de espera sean cada vez más largas. El proceso de distribución de los órganos de donantes fallecidos ha sido uno de los más controvertidos en el trasplante hepático, siendo inicialmente tenido en cuenta el puntaje CTP y el tiempo de permanencia en la lista de espera, con la desventaja de la evaluación subjetiva de los síntomas en el CTP, la no incorporación de la función renal en el CTP y dando gran importancia al tiempo de permanencia en lista, lo que se asoció a un riesgo de morir del 12% anual en lista de espera (14). La asignación de órganos debe cumplir las siguientes características: transparencia, objetividad, justicia y beneficio con el trasplante, por lo cual desde el 2002 se implementó en los Estados Unidos el puntaje MELD (Modelo para la enfermedad hepática terminal) con este propósito. Este se desarrolló originalmente para evaluar la sobrevida de pacientes que serían sometidos a TIPS (Derivación portosistémica intrahepática transyugular) (15), basado en un cálculo logarítmico de 3 variables: el nivel de bilirrubina, la creatinina plasmática y el INR, para objetivamente predecir el riesgo de muerte en los próximos 3 meses. Existen varios estudios dentro y fuera de los Estados Unidos validando la utilidad del MELD en el escenario de asignación de órganos en TH, donde a un mayor puntaje (rango de 6 a 40) se tiene mayor riesgo de muerte y por lo tanto la inminente necesidad de un trasplante. Se ha demostrado que con el uso del MELD se ha disminuido en forma significativa el número de muertes anuales de pacientes que fallecían en lista de espera, y a pesar de que se trasplantan pacientes muy enfermos, no se ha demostrado una disminución en la sobrevida post TH (16). Su implementación también ha permitido evaluar los resultados postrasplante en una forma más objetiva y se ha encontrado que los pacientes con un puntaje MELD bajo que se llevan a un TH se asocian con un mayor riesgo de muerte comparado con su permanencia en la lista de espera (17). Por supuesto también existen críticas a este sistema de distribución, en especial el hecho de que se asignen puntos extras a pacientes con CHC, lo cual permite una ventaja en lograr el TH comparado con otras etiologías, y en ocasiones con serios interrogantes sobre el diagnóstico exacto de la neoplasia y la estadificación (18). El hecho de incluir creatinina sérica en el MELD ha llevado a un incremento de trasplantes en pacientes con falla renal y el número de procedimientos combinados hígado-riñón, lo cual es crítico por la escasez de órganos disponibles (19). Se ha determinado que niveles de sodio sérico menores de 126 meq/L al ingresar el paciente a una lista se asocia con un incremento de 6,3 a 7,8 veces en el riesgo de morir (20), con lo cual se considera que la adición del sodio sérico en el puntaje MELD aumenta el poder pronóstico especialmente en pacientes con complicaciones de hipertensión portal. Como es de esperarse, el puntaje MELD puede no ser apropiado para todos los pacientes y por lo tanto existen algunas excepciones, en algunas de ellas asignando puntos extras al MELD para lograr un adecuado grado de prioridad para el trasplante, como por ejemplo en el CHC, el síndrome hepatopulmonar, la hipertensión portopulmonar, la polineuropatía amiloidótica familiar y la hiperoxaluria primaria. Otras excepciones son el prurito intratable y las colangitis recurrentes.
Cuando hay un órgano disponible se escoge el receptor de los pacientes que se encuentran en lista de espera, buscando la compatibilidad en el grupo y Rh sanguíneo, el peso, la talla y el paciente con el puntaje MELD más alto, es decir, el individuo más enfermo.
Han surgido varias estrategias para optimizar el número escaso de donantes frente al número de receptores en lista. Una de ellas es utilizar órganos con criterios extendidos (21), como son mayores de 50 años y postparo cardíaco, lo cual se ha asociado a mayor riesgo de disfunción del injerto y necesidad de retrasplante (22). Otras estrategias incluyen el uso de hígados de donantes vivos relacionados, de mayor aceptación en Asia, con las ventajas de un apropiado tamizaje del donante, el mínimo tiempo de isquemia fría y la posibilidad de elegir el tiempo óptimo para el trasplante. También se están efectuando intervenciones de órganos divididos, donde el segmento lateral izquierdo se utiliza en TH de un niño y el remanente se utiliza en un adulto, o donde se reparte en lóbulo hepático izquierdo y derecho para 2 adultos, pero con resultados que no son fácilmente reproducibles (23). Finalmente, se plantea el TH dominó que se refiere a la posibilidad de volver donante el hígado explantado de pacientes con enfermedades metabólicas (24).
CONSULTA PRETRASPLANTE Y POSTRASPLANTE
La consulta pretrasplante tiene como objetivo verificar la condición del paciente para soportar la cirugía, los inmunosupresores y los cuidados postrasplante. Se confirma la ausencia de contraindicaciones, se descartan infecciones virales ocultas, se verifica el estado inmunológico contra citomegalovirus (CMV) y es de vital importancia descartar con TAC o RNM la presencia de lesiones sugestivas de CHC y trombosis del eje porto-mesentérico. Los pacientes deben ser evaluados por odontología, nutrición, trabajo social, psicología y finalmente por anestesiología para dar vía libre al procedimiento y poder incluirlos en lista de espera. Durante el tiempo que el paciente se encuentre en lista de espera debe asistir a citas rutinarias con el grupo de trasplante para evaluar su estado, descartar la aparición de nuevas complicaciones de la cirrosis y realizar el tratamiento oportuno de estas, en ocasiones siendo necesario inactivar temporalmente para el trasplante o incluso retirar definitivamente de la lista. En cada control se realiza un nuevo cálculo del MELD, y por lo tanto puede cambiar la prioridad del trasplante con respecto a los otros pacientes en lista.
La consulta postrasplante habitualmente se realiza cada ocho a quince días durante los primeros 2 meses, posteriormente cada mes durante el primer año y se continúa cada 3 meses. Durante estas evaluaciones se verifica el adecuado funcionamiento del injerto hepático y se descartan las complicaciones a corto y largo plazo que se discutirán más adelante en el artículo. Es muy importante esta consulta para confirmar la adherencia al tratamiento, insistir en tener un buen estilo de vida con dieta y ejercicio para evitar las complicaciones metabólicas y finalmente estimular a los pacientes en la reincorporación de las actividades familiares, sociales y laborales.
INMUNOSUPRESIÓN
Desde la introducción de la ciclosporina al mundo del trasplante en 1979 (25) y a partir de allí, con la llegada de nuevos medicamentos inmunosupresores, ha sido posible aumentar la sobrevida del injerto y los pacientes por disminución de los episodios de rechazo agudo y crónico. Los esquemas actuales se basan en el uso de esteroides, un inhibidor de la calcineurina (ICN): Ciclosporina (CsA) o tacrolimus (TAC) y un inhibidor de la síntesis de purinas: Azatioprina (AZA) o micofenolato (MF). Con el uso de estos agentes debe mantenerse un estricto balance entre la toxicidad de la droga y su eficacia. Los ICN son la columna vertebral de la inmunosupresión, su mecanismo de acción es la inhibición de la transcripción de genes de la interleucina 2 (IL 2), siendo el TAC 100 veces más potente que la CsA, y aunque existe superioridad en sobrevida, pérdida del injerto y número de rechazos agudos, esta no ha sido tan significativa en los diferentes estudios clínicos (26) y se relaciona con aumento en la frecuencia de diabetes mellitus (DM) y neurotoxicidad. Otras complicaciones importantes con estos medicamentos inmunosupresores son la insuficiencia renal, la hipertensión arterial (HTA), la dislipidemia y una significativa asociación como promotores tumorales.
La AZA y el MF inhiben la síntesis de las purinas y bloquean la proliferación de los linfocitos. La principal ventaja del MF es la ausencia de efectos tóxicos renales; sin embargo, cuando se evaluó para el uso como monoterapia se encontraron mayores tasas de rechazo agudo. Sus principales efectos adversos son gastrointestinales y hematológicos. La AZA es poco usada actualmente en Estados Unidos, pero tiene como ventajas el bajo costo y la confirmada utilidad en hepatopatías autoinmunes. Otros agentes son los inhibidores de la mTOR, sirolimus y everolimus, que bloquean la activación de células T. Actualmente hay serios interrogantes hacia el perfil de seguridad de estas moléculas, al ser relacionado sirolimus con trombosis de la arteria hepática (27), y aumento de la mortalidad en pacientes estables que venían recibiendo ICN. Otros efectos adversos importantes son el retraso en el cierre de las heridas, dislipidemia, edema de miembros inferiores, proteinuria, neumonitis y úlceras orales. Se planteaba inicialmente un mejor perfil en cuanto a falla renal, pero este supuesto beneficio no se ha logrado demostrar en estudios clínicos. También se habla de sus propiedades antitumorales y antifibróticas, pero están pendientes nuevos ensayos clínicos donde se confirmen si existen esas ventajas. Los esteroides se usan durante los primeros meses, buscando suspenderlos entre el tercer y sexto mes para evitar sus efectos adversos a largo plazo, excepto en la patología autoinmune de base donde en la mayoría de los casos se continúan en dosis bajas. Otras opciones en inmunosupresión son las terapias basadas en anticuerpos y moléculas pequeñas como son las globulinas antilinfocito-antitimocito, los anticuerpos contra el receptor de la IL 2 (Basiliximab) y el agente depletador de linfocitos (Alemtuzumab), las cuales no son usadas en forma rutinaria en TH, pero que son útiles en ciertos escenarios específicos como agentes ahorradores de ICN en el periodo postrasplante inmediato especialmente en pacientes con falla renal (28).
COMPLICACIONES VASCULARES
Las complicaciones vasculares se presentan cada vez con menos frecuencia, pero su aparición siempre genera preocupación sobre el estado del paciente e injerto hepático, porque pueden llevar a pérdida del injerto, retrasplante y muerte. La principal herramienta diagnóstica en este tipo de complicaciones es la ultrasonografía con doppler que se realiza por protocolo en el primer día postoperatorio. En los casos de dudas se pueden confirmar con tomografía computarizada, resonancia nuclear magnética o estudios de radiología intervencionista, especialmente si se plantean intervenciones en los pacientes. Las complicaciones arteriales son la trombosis, la estenosis, los pseudoaneurismas de la arteria hepática y los síndromes de robos de la arteria esplénica y gastroduodenal. Todas estas pueden llevar a disfunción del injerto y complicaciones del árbol biliar porque este depende exclusivamente del flujo arterial para su irrigación. Los factores de riesgo de las complicaciones vasculares se encuentran en la tabla 2. La trombosis de la arteria hepática se presenta en menos del 5% de los pacientes adultos post-TH, pero es un evento catastrófico que se relaciona con pérdida del injerto en 53% y una mortalidad del 30% (29). Se manifiesta por elevación súbita de las transaminasas, prolongación del tiempo de protrombina, cambios en el estado mental, estenosis biliares y sepsis de origen biliar, encontrando hasta un 30% de los pacientes que pueden estar asintomáticos. Las opciones de tratamiento son la reintervención quirúrgica, la trombólisis/angioplastia/stent por radiología intervencionista y el retrasplante hepático, siendo este último necesario en más del 50% de los pacientes. Las estenosis de la arteria hepática se presentan en el 3 a 5% de los TH (30), ocurren principalmente en el sitio de la anastomosis y el tratamiento de elección es la angioplastia y endoprótesis. Las complicaciones de las estructuras venosas son raras en la actualidad, presentándose la trombosis y la estenosis de la porta en menos del 2% de los pacientes post-TH en adultos (31). Se manifiesta por dolor abdominal, congestión intestinal venosa, ascitis, hemorragia variceal y alteraciones bioquímicas hepáticas. El tratamiento de la trombosis es la trombectomía quirúrgica o percutánea con anticoagulación y el manejo primario de la estenosis es la angioplastia con endoprótesis, reconociendo que en algunos pacientes las estenosis no son hemodinámicamente significativas y por lo tanto no requieren tratamiento. Las complicaciones en las venas hepáticas y la vena cava inferior aparecen en menos del 1% de los pacientes, se presentan con ascitis y edema de miembros inferiores, pero en ocasiones llevan a disfunción severa del injerto hepático como consecuencia de la obstrucción al tracto de salida venoso (32). El tratamiento de elección es por radiología intervencionista pero en ocasiones es necesaria la reconstrucción quirúrgica.
COMPLICACIONES BILIARES
Las complicaciones biliares se consideran el "talón de Aquiles" del TH. Aquí se incluyen las fugas biliares, las estenosis, la obstrucción por cálculos o barro biliar y la disfunción del esfínter de Oddi (33). Se presentan hasta en el 25% de los pacientes. Las estenosis se clasifican en tempranas o tardías si se presentan antes o después del primer mes y en estenosis anastomóticas (EA) o no anastomóticas (ENA) de acuerdo con su localización (34). Las EA son un poco más tardías y se relacionan con factores técnicos, mientras las ENA tienden a ocurrir más temprano y en su fisiopatología se destaca el daño isquémico y la lesión inmunológica del epitelio biliar. Desde los primeros reportes las complicaciones biliares se relacionaron con importante morbilidad y mortalidad, que han disminuido en el tiempo pero que todavía pueden llevar a la muerte hasta al 10% de los pacientes (35). Los principales factores de riesgo que se han establecido para este tipo de lesiones son la presencia de tubo en T, la anastomosis en Y de Roux, la lesión por isquemia-reperfusión, las lesiones en la arteria hepática, la infección por CMV, la incompatibilidad de grupo sanguíneo, el uso de órganos donados postparo cardíaco y el antecedente de CEP (36). Las complicaciones biliares pueden manifestarse con elevación asintomática en las pruebas bioquímicas del hígado, o con dolor abdominal, fiebre y sepsis recurrente. Para su diagnóstico se requiere evaluar la vía biliar primero con métodos no invasivos y se confirma con el estudio colangiográfico. Si la sospecha clínica es alta se prefiere la colangiopancreatografía retrógrada endoscópica (CPRE) o la colangiografía transhepática percutánea (CTP) dependiendo del tipo de anastomosis realizada y la experiencia del centro, para permitir la realización de procedimientos terapéuticos como dilataciones y el uso de stent biliar. Cuando la sospecha sea baja se puede realizar colangiografía por resonancia nuclear magnética, con un valor predictivo positivo y precisión mayor del 95% para el diagnóstico de lesiones en la vía biliar (37). En algunos pocos casos será necesaria la reintervención quirúrgica y en otros, especialmente en las ENA el daño puede ser irreparable y será inevitable el retrasplante hepático.
INFECCIONES
Las infecciones permanecen aún como la principal causa de muerte en el periodo temprano y más del 60% de los pacientes presenta alguna infección durante el primer año (38). El uso extendido de algunas profilaxis ha cambiado la epidemiología de las infecciones postrasplante, resaltando el papel del trimetoprim sulfametoxazol para controlar procesos por Pneumocistis jirovecii, además con la capacidad de prevenir otros patógenos como Nocardia, Legionella, Listeria, Toxoplasma, Isospora, Ciclospora y bacterias sensibles (39), y el uso de nistatina para evitar candidiasis del tracto gastrointestinal superior. De acuerdo con el tiempo post-TH cambian los riesgos de infección por ciertos microorganismos, explicado especialmente por la intensidad de la inmunosupresión y la ubicación de los pacientes (tabla 3) (40). Las infecciones no son fáciles de reconocer en los pacientes con TH por la inmunosupresión y por la presencia de causas no infecciosas de fiebre. Por lo tanto debe tenerse una gran agudeza diagnóstica para tomar tempranamente estudios de radiología, cultivos y procedimientos diagnósticos invasivos de acuerdo a cada caso en particular. Hay que tener precaución con los antimicrobianos por los efectos tóxicos y por las interacciones con los inmunosupresores. El CMV es muy relevante en TH no solo por sus efectos citopáticos en los órganos que enferma, sino por su capacidad inmunomoduladora que puede facilitar infecciones por bacterias, hongos y la relación con mayores episodios de rechazo, con un curso acelerado en la reactivación del VHC, con disfunción crónica del injerto y la muerte (41, 42). Se cuenta en la actualidad con 2 estrategias para la evitar la enfermedad por CMV, la profilaxis universal que incluye el uso de antivirales por lo menos 3 meses desde el momento del trasplante (43), y la terapia anticipada o preventiva en donde se hacen seguimientos rutinarios con carga viral o antígeno pp65 y en el momento de la detección de partículas virales se da un curso de tratamiento así el paciente esté asintomático (44). Ambas estrategias han probado disminuir la enfermedad por CMV, sin embargo, solo la profilaxis universal previene los efectos indirectos por la infección y se asocia a aumento de la sobrevida del paciente y el injerto, por lo cual es de elección en individuos de alto riesgo como aquellos con seroestado para CMV IgG donante positivo / receptor negativo.
RECHAZO AGUDO Y CRÓNICO
A pesar de los avances en la inmunosupresión, el rechazo del injerto hepático continúa siendo una causa importante de morbilidad y de pérdida del injerto en algunos pacientes (45). Se divide en rechazo hiperagudo, agudo y crónico. El primero es muy raro, está mediado por anticuerpos y se relaciona con incompatibilidad del grupo sanguíneo con depósito de complejos inmunes y complemento en el sinusoide hepático. El rechazo celular agudo es el más común, se presenta predominantemente en el primer mes, se divide a su vez en leve, moderado y severo de acuerdo a los hallazgos en la biopsia hepática, donde la característica es el infiltrado inflamatorio portal, el compromiso del epitelio biliar y del endotelio vascular. Se presenta en el 40 a 60%, con un 20% de los pacientes experimentando un segundo episodio. A pesar de que se presentan en la misma frecuencia que en trasplante de otros órganos sólidos, el rechazo agudo temprano se ha considerado por la mayoría de los autores que no tiene impacto en la función tardía del injerto hepático ni en la sobrevida de los pacientes. Los principales factores de riesgo asociados a rechazo son la incompatibilidad HLA, los receptores jóvenes, la raza negra, el tiempo prolongado de isquemia fría, una creatinina menor de 2,0 mg/ dL, la edad del donante mayor de 30 años y cuando se indica el trasplante por enfermedad hepática autoinmune, falla hepática aguda o infección por hepatitis C (46). Se manifiesta por alteración bioquímica hepática, fiebre, dolor abdominal y ascitis. El diagnóstico se confirma con biopsia hepática y siempre se deben descartar complicaciones infecciosas, vasculares y biliares. El tratamiento de elección son los bolos intravenosos de esteroides que son efectivos en el 90% de los pacientes, siendo necesario en los casos refractarios el uso de terapia erradicadora de linfocitos. Después del rescate con esteroides es necesario aumentar la inmunosupresión de base o cambiar a TAC y/o MF en los pacientes que no los venían recibiendo (47). En cuanto a los rechazos crónicos, actualmente ocurren en menos del 5% de los pacientes, pueden suceder tempranamente pero en el 85% pasa después de los 6 meses post-TH (48). Los factores de riesgo incluyen trasplante por CEP o CBP, incompatibilidad HLA, infección por CMV y rechazos agudos recurrentes o refractarios a esteroides. Los pacientes se presentan con cambios bioquímicos colestásicos, ictericia, prurito y en algunos casos, ya con estigmas de cirrosis. Las características histológicas son ductopenia y vasculopatía obliterativa de las arterias de mediano calibre. El tratamiento es el uso de TAC o aumento de la dosis con la adición de MF, y en muchos casos el retrasplante hepático.
RECIDIVA DE LA ENFERMEDAD
La recidiva de la enfermedad de base es un problema importante en el seguimiento a largo plazo post-TH. En el caso de CH por VHC la recurrencia es temprana y universal en aquellos pacientes con carga viral detectable al momento del trasplante; sin embargo, pueden presentarse varios patrones de recidiva. El más común es con hepatitis crónica indiferenciable a la de los pacientes no trasplantados, pero con mayor viremia y una rápida progresión a cirrosis en 5 a 10 años (49). Otros pacientes (< 10%) se presentan con hepatitis colestásica fibrosante, una presentación severa, relacionada con altas cargas virales en pacientes con una fuerte inmunosupresión, donde el virus ejerce un efecto citopático directo con ausencia de respuesta inmune, se presenta durante los primeros meses y lleva generalmente a falla del injerto en el primer año. Independiente del patrón de recurrencia, la cirrosis se presenta en el 30% de los pacientes, con descompensación de la misma en el primer año, siendo entonces la recurrencia la principal causa de falla del injerto y muerte en pacientes trasplantados por VHC. El tratamiento incluye el uso de interferón pegilado más ribavirina durante un año con tasas de respuesta viral sostenida del 30% (50), en donde son frecuentes los efectos adversos, los ajustes de las dosis, la suspensión de los medicamentos y rechazo agudo en algo menos del 10% de los pacientes. El retrasplante es muy controvertido en este grupo de pacientes por alta frecuencia de pérdida del nuevo injerto. La recurrencia del VHB fue muy alta y asociada a mayor mortalidad por lo cual el trasplante en estos pacientes inicialmente fue considerado incluso una contraindicación. Esta historia cambió desde el uso a largo plazo de la combinación de inmunoglobulina para hepatitis B con un antiviral, lo cual ha llevado a tasas de recurrencia menores del 10% en esta población (51). En la actualidad se trabaja para definir un temprano retiro de la inmunoglobulina y el tiempo de permanencia de los antivirales. La recurrencia de la enfermedad hepática por alcohol es del 7 al 50%, pero de estos solamente 10 a 15% tienen un consumo severo de alcohol que puede llevar a pérdida del injerto (52). La recurrencia de otras enfermedades con sus respectivos factores de riesgo aparece en la tabla 4.
COMPLICACIONES A LARGO PLAZO
En la medida que ha aumentado la sobrevida de los pacientes post-TH ha sido necesario familiarizarse con las complicaciones que aparecen en el largo plazo y que pueden poner en riesgo la funcionalidad del injerto, la calidad de vida de los pacientes y que disminuyen la sobrevida de los mismos. La mayoría de estas complicaciones deriva de los efectos adversos de los inmunosupresores, el sedentarismo y la no adherencia a una dieta apropiada. La hipertensión arterial (HTA) se desarrolla en el 65 a 70% en el primer año post-TH (53), habitualmente ocurre temprano y se mantiene en el tiempo. En el tratamiento se prefieren los calcioantagonistas y los betabloqueadores, con precaución con los iECA o ARA II durante los primeros meses por el uso de ICN en dosis altas. En el seguimiento a largo plazo la HTA ha demostrado ser un factor de riesgo para muerte (54). La dislipidemia se presenta en 45 a 60% después del TH. Se relaciona al uso de ICN y mTor. Habitualmente es refractaria a los cambios dietéticos así que debe considerarse el inicio rápido de normolipemiantes (estatinas y fibratos), los cuales pueden tener leve interacción medicamentosa con los inmunosupresores. La pravastatina es la estatina con menos interacción. La DM post-TH ocurre en el 30 a 40% de los pacientes (55), el 80% se presenta desde el primer mes, puede ser transitoria en sus inicios para luego establecerse. Es más frecuente en individuos obesos, con TH por alcohol o VHC y aquellos en tratamiento con TAC. Debe intentarse el desmonte rápido de esteroides y el manejo primario es con insulina. La presencia de DM pre y post-TH se ha relacionado a mayor morbilidad y mortalidad después del primer año (56). La obesidad se presenta hasta en el 40% de los pacientes post-TH (57). La mayor ganancia de peso se genera durante los primeros 6 meses y es más frecuente en pacientes trasplantados por cirrosis por NAFLD. Las anteriores complicaciones se pueden resumir en el síndrome metabólico postrasplante que se presenta hasta en el 50% de los pacientes y que requiere como tratamiento cambios saludables del estilo de vida con una dieta de frutas, verduras y ácidos grasos poliinsaturados, además de ejercicio semanal, medidas que deben implementarse precozmente en el postrasplante (58). La enfermedad renal crónica avanzada se presenta en el 18% de los receptores de TH a largo plazo (59). Su presencia se asocia con aumento de la morbilidad y mortalidad (60). Todo paciente con factores de riesgo para falla renal debe seguirse con tasa de filtración glomerular y microalbuminuria cada 6 meses, evitar el uso de sustancias nefrotóxicas y tratar apropiadamente la HTA y la DM.
Los receptores de TH tienen un incremento en el riesgo de padecer de neoplasias 2 a 4 veces mayor que pacientes no trasplantados de la misma edad y sexo (61). Se plantea que la medicación inmunosupresora disminuye la capacidad de vigilancia del sistema inmune contra células malignas y contra virus con propiedades oncogénicas, y precisamente algunas neoplasias relacionadas con virus son las que predominan en estos pacientes: Linfoma no Hodking, sarcoma de Kaposi y carcinoma de cuello uterino (62). El cáncer de piel es el más frecuente y en algunas ocasiones presenta un curso más rápido y con metástasis tempranas. Algunos grupos de pacientes tienen factores de riesgo específicos para ciertas neoplasias, por ejemplo, en los pacientes con CEP hay que vigilar la aparición de colangiocarcinoma y de cáncer de colon en aquellos que cursan concomitantemente con colitis ulcerativa. En los pacientes con enfermedad hepática alcohólica se ha visto mayor riesgo de neoplasias del tracto aerodigestivo especialmente por el tabaquismo concomitante. La mortalidad por neoplasias es significativamente mayor en el escenario post-TH que en la población general y esta es una de las principales causas de muerte a largo plazo (63).
CONCLUSIONES
El trasplante hepático es el tratamiento de elección de la enfermedad hepática avanzada y de algunas otras entidades, con resultados muy buenos a largo plazo que dependen de factores propios del paciente, el donante, la cirugía y la terapia inmunosupresora. Se debe remitir tempranamente a los pacientes con cirrosis a los programas de trasplante hepático para lograr optimizar su condición y realizar la cirugía en el momento ideal. Los cuidados postrasplante hepático son complejos por las complicaciones particulares que se presentan en estos pacientes pero es posible la recuperación total de los mismos con la reincorporación a la vida social, familiar y laboral.
REFERENCIAS
1. National Institutes of Health Consensus Development Conference Statement: liver transplantation--June 20-23, 1983. Hepatology 1984; 4 (1 suppl): S107-10. [ Links ]
2. Starzl TE, Groth CG, Brettschneider L, et al. Orthotopic homotransplantation of the human liver. Ann Surg 1968; 168(3): 392-415. [ Links ]
3. P Thuluvath, M Guidinger, et al. Liver Transplantation in the United States, 1999-2008. American Journal of Transplantation 2010; 10(Part 2): 1003-1019. [ Links ]
4. Hosein Shokouh-Amiri M, Osama Gaber A, Bagous WA, et al. Choice of surgical technique influences perioperative outcomes in liver transplantation. Ann Surg 2002; 231: 814. [ Links ]
5. Greif F, Bronsther OL, Van Thiel DH, et al. The incidence, timing, and management of biliary tract complications after orthotopic liver transplantation. Ann Surg 1994; 219: 40. [ Links ]
6. Hendriks HG, Van der Meer J, De Wolf JT, et al. Intraoperative blood transfusion requirement is the main determinant of early surgical re-intervention after orthotopic liver transplantation. Transpl Int 2005; 17: 673-9. [ Links ]
7. Mandell MS, Lezotte D, Kam I, Zamudio S. Reduced use of intensive care after liver transplantation: influence of early extubation. Liver Transpl 2002; 8: 676-681. [ Links ]
8. Fan ST, Cheung ST, Lo CM. Indications for liver transplantation in patients with chronic hepatitis B and C virus infection and hepatocellular carcinoma. J Gastroenterol Hepatol 2000; 15(Suppl): E181-E186. [ Links ]
9. Mazzaferro V, Regalia E, Doci R, Andreola S, Pulvirenti A, Bozzetti F, Montalto F. Liver transplantation for the treatment of small hepatocellular carcinomas in patients with cirrhosis. N Engl J Med 1996; 334: 693-699. [ Links ]
10. Yao FY, Ferrell L, Bass NM, et al. Liver transplantation for hepatocellular carcinoma: expansion of the tumor size limits does not adversely impact survival. Hepatology 2001; 33: 1394-403. [ Links ]
11. Julie Polson and William M Lee. AASLD Position Paper: The Management of Acute Liver Failure. Hepatology 2005. [ Links ]
12. Cross TJ, Antoniades CG, Muiesan P, Al-Chalabi T, et al. Liver transplantation in patients over 60 and 65 years: an evaluation of long-term outcomes and survival. Liver Transpl 2007; 13(10): 1382-8. [ Links ]
13. Eisenbach C, Merle U, Stremmel W, Encke J. Liver transplantation in HIV-positive patients. Clin Transplant 2009; 23(Suppl 21): 68-74. [ Links ]
14. Trotter JF. Impact of the model for endstage liver disease score on liver transplantation. Curr Opinion Organ Transplant 2007; 12: 294-297. [ Links ]
15. Malinchoc M, Kamath PS, Gordon FD, Peine CJ, Rank J, Borg PC. A model to predict poor survival in patients undergoing transjugular intrahepatic portosystemic shunts. Hepatology 2000; 31(4): 864-871. [ Links ]
16. Habib S, Berk B, Chang CC, et al. MELD and prediction of postliver transplantation survival. Liver Transpl 2006; 12: 440-447. [ Links ]
17. Merion RM, Schaubel DE, Dykstra DM, et al. The survival benefit of liver transplantation. Am J Transplant 2005; 5: 307-313. [ Links ]
18. Freeman RB, Mithoefer A, Ruthazer R, et al. Optimizing staging for hepatocellular carcinoma before liver transplantation: A retrospective analysis of the UNOS/OPTN data-base. Liver Transpl 2006; 12: 1504-1511. [ Links ]
19. Machicao VI, Srinivas TR, Hemming AW, et al. Impact of implementation of the MELD scoring system on the prevalence and incidence of chronic renal disease following liver transplantation. Liver Transpl 2006; 12: 754-761. [ Links ]
20. Biggins SW, Rodriguez HJ, Bacchetti P, et al. Serum Sodium predicts mortality in patients listed for liver transplantation. Hepatology 2005; 41: 32-39. [ Links ]
21. Renz J, Kin C, Kinkhabwala M, et al. Utilization of extended donor criteria liver allografts maximizes donor use and patient access to liver transplantation. Ann Surg 2005; 242: 556-63. [ Links ]
22. Malag M, Rogiers X, Broelsch CE. Liver splitting and living donor techniques. Br Med Bull 1997;53: 860-7. [ Links ]
23. Giacomoni A, Lauterio A, Donadon M, et al. Should we still offer split-liver transplantation for two adult recipients? A retrospective study of our experience Liver Transpl 2008; 14: 999-1006. [ Links ]
24. Yamamoto S, Wilczek HE, Nowak G, et al. Liver transplantation for familial amyloidotic polyneuropathy (FAP): a single-center experience over 16 years. Am J Transplant 2007; 7: 2597. [ Links ]
25. Calne RY, Rolles K, White DJ, et al. Cyclosporin A initially as the only immunosuppressant in 34 recipients of cadaveric organs: 32 kidneys, 2 pancreases, and 2 livers. Lancet 1979; 2(8151): 1033-1036. [ Links ]
26. Haddad E, Mcalister V, Renouf E, Malthaner R, Kjaer MS, Gluud LL. Cyclosporin versus tacrolimus for liver transplanted patients. The Cochrane Collaboration 2009. [ Links ]
27. Montalbano M, Neff GW, Yamashiki N, Meyer D, .Tzakis AG et al. A retrospective review of liver transplant patients treated with sirolimus from a single center: an analysis of sirolimus-related complications. Transplantation 2004; 78(2): 264-8. [ Links ]
28. Goralczyk AD, Hauke N. Interleukin 2 receptor antagonists for liver transplant recipients: a systematic review and metaanalysis of controlled studies. Hepatology 2011; 54(2): 541-54. [ Links ]
29. Stange BJ, Glanemann M, Nuessler NC, et al. Hepatic artery thrombosis after adult liver transplantation. Liver Transpl 2003; 9: 612-20. [ Links ]
30. Orons PD, Sheng R, Zajko AB. Hepatic artery stenosis: prevalence and cholangiographic appearance of associated biliary complications. Am J Roentgenol 1995; 165: 1145-1149. [ Links ]
31. Settmacher U, Nussler NC, Glanemann M, et al. Venous complications after orthotopic liver transplantation. Clin Transplant 2000; 14: 235-241. [ Links ]
32. Michael D. Darcy. Management of Venous Outflow Complications After Liver Transplantation. Tech Vasc Interventional Rad 2007; 10: 240-245. [ Links ]
33. Hampe T, Dogan A, Encke J, et al. Biliary complications after liver transplantation. Clin Transplant 2006; 20: 93-96. [ Links ]
34. Koneru B, Sterling MJ, Bahramipour PF. Bile duct strictures after liver transplantation: a changing landscape of the Achilles heel. Liver Transpl 2006; 12: 702-704. [ Links ]
35. Welling TH, Heidt DG, Englesbe MJ, Magee JC, Sung RS, Campbell DA, Punch JD, Pelletier SJ. Biliary complications following liver transplantation in the model for end-stage liver disease era: effect of donor, recipient, and technical factors. Liver Transpl 2008; 14: 73-80. [ Links ]
36. Londoño MC, Balderramo D, Cárdenas A. Management of biliary complications after orthotopic liver transplantation: the role of endoscopy. World J Gastroenterol 2008; 14: 493-497. [ Links ]
37. Valls C, Alba E, Cruz M, Figueras J, Andia E, Sanchez A, Llado L, Serrano T. Biliary complications after liver transplantation: diagnosis with MR cholangiopancreatography. AJR Am J Roentgenol 2005; 184: 812-820. [ Links ]
38. Salizzoni M, Cerutti E, Romagnoli R, et al. The first one thousand liver transplants in Turin: a single-center experience in Italy. Transplant International 2005; 18: 1328-35. [ Links ]
39. Fishman JA. Pneumocystis carinii and parasitic infections in transplantation. Infect Dis Clin North Am 1995; 9(4): 1005-44. [ Links ]
40. Jay A. Fishman. Infection in Solid-Organ Transplant Recipients. N Engl J Med 2007; 357: 2601-14. [ Links ]
41. Rubin RH. The indirect effects of cytomegalovirus infection on the outcome of organ transplantation. JAMA 1989; 261: 3607-9. [ Links ]
42. Falagas ME, Snydman DR, Griffith J, Ruthazer R, Werner BG. Effect of cytomegalovirus infection status on first-year mortality rates among orthotopic liver transplant recipients. Ann Intern Med 1997; 126(4): 275-9. [ Links ]
43. Kalil AC, Levitsky J, Lyden E, et al. Meta-analysis: the efficacy of strategies to prevent organ disease by cytomegalovirus in solid organ transplant recipients. Ann Intern Med 2005; 143(12): 870-80. [ Links ]
44. Camille N Kotton, Deepali Kumar, Angela M Caliendo, et al. International Consensus Guidelines on the Management of Cytomegalovirus in Solid Organ Transplantation. Transplantation 2010; 89: 779-795. [ Links ]
45. Klintmalm GB, Nery JR, Husberg BS, Gonwa TA, Tillery GW. Rejection in liver transplantation. Hepatology 1989; 10(6): 978-85. [ Links ]
46. Wiesner RH, Demetris AJ, Belle SH, et al. Acute hepatic allograft rejection: incidence, risk factors and impact on outcome. Hepatology 1998; 28: 638-45. [ Links ]
47. Anand A, Hubscher S, Gunson B, et al. Timing, significance and prognosis of late acute liver allograft rejection. Transplantation 1995; 60: 1098-103. [ Links ]
48. Neuberger J. Incidence, timing, and risk factors for acute and chronic rejection. Liver Transpl 1999; 5: S30. [ Links ]
49. Gane E. The natural history and outcome of liver transplantation in hepatitis C virus infected recipients. Liver Transpl 2003; 9: S28-34. [ Links ]
50. Berenguer M. Systematic review of the treatment of established recurrent hepatitis C with pegylated interferon in combination with ribavirin. J Hepatol 2008; 49(2): 274-87. [ Links ]
51. Yoshida EM, Erb SR, Partovi N, et al. Liver transplantation for chronic hepatitis B infection with the use of combined lamivudine and low-dose hepatitis B immune globulin. Liver Transpl 1999; 5: 520-5. [ Links ]
52. Cuadrado A, Fabrega E, Casafont F, Pons-Romero F. Alcohol recidivism impairs long-term patient survival after orthotopic liver transplantation for alcoholic liver disease. Liver Transpl 2005; 11: 420-6. [ Links ]
53. Sheiner PA, Magliocca JF, Bodian CA, Kim-Schluger L et al. Long-term medical complications in patients surviving > or = 5 years after liver transplant. Transplantation 2000; 69(5): 781-9. [ Links ]
54. Watt K, Pedersen R, Kremers W, Heimbach J, Charlton M. Evolution of causes and risk factors for mortality post liver transplant: results of the NIDDK long-term follow-up study. Am J Transplant 2010; 10: 1-8. [ Links ]
55. Kuo HT, Sampaio MS, Ye X, Reddy P, Martin P, Bunnapradist S. Risk factors for new-onset diabetes mellitus in adult liver transplant recipients, an analysis of the Organ Procurement and Transplant Network/United Network for Organ Sharing Database. Transplantation 2010; 89: 1134-1140. [ Links ]
56. John P, Thuluvath P. Outcome of patients with new onset diabetes mellitus after liver transplantation compared with those without diabetes mellitus. Liver Transpl 2002; 8: 708-713. [ Links ]
57. Wawrzynowicz-Syczewska M, Karpin Ska E, Jurczyk K, Laurans L, Boron-Kaczmarska A. Risk factors and dynamics of weight gain in patients after liver transplantation. Ann Transplant 2009; 14: 45-50. [ Links ]
58. Kymberly D.S. Watt, Michael R. Charlton. Metabolic syndrome and liver transplantation: A review and guide to management. Journal of Hepatology 2010; 53: 199-206. [ Links ]
59. Ojo AO, Held PJ, Port FK, et al. Chronic renal failure after transplantation of a nonrenal organ. N Engl J Med 2003; 349(10): 931-40. [ Links ]
60. Brown RS Jr, Lombardero M, Lake JR. Outcome of patients with renal insufficiency undergoing liver or liver-kidney transplantation. Transplantation 1996; 62(12): 1788-93. [ Links ]
61. Haagsma EB, Hagens VE, Schaapveld M, van den Berg AP, de Vries EG, Klompmaker IJ, et al. Increased cancer risk after liver transplantation: a population-based study. J Hepatol 2001; 34: 84-91. [ Links ]
62. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a metaanalysis. Lancet 2007; 370: 59-67. [ Links ]
63. Herrero JI, Lorenzo M, Quiroga J, Sangro B, Pardo F, Rotellar F, et al. De novo neoplasia after liver transplantation: an analysis of risk factors and influence on survival. Liver Transpl 2005; 11: 89-97. [ Links ]











 texto en
texto en