Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.27 no.2 Bogotá Apr./June 2012
Evaluación para comparar dos esquemas de terapia estándar (7 frente a 10 días) contra el Helicobacter pylori, con seguimiento clínico a 1 año
Randomized study of seven days of standard treatment for Helicobacter Pylori vs. ten days of standard treatment for Helicobacter Pylori with one year follow-ups of patients
Rodrigo Castaño Llano, MD (1), Mario H. Ruíz Vélez, MD (2) Cristina Martínez Hincapié, MD (3), Fred A. Naranjo Aristizábal, MD (4), Germán Campuzano Maya, MD (5), Eugenio Sanín Fonnegra, MD (6), Juan D. Puerta Díaz, MD (7), Víctor Calvo Betancur (8), Luis Miguel Ruiz Velásquez, Est. (9)
(1) Grupo de Gastrohepatología, Universidad de Antioquia, Hospital Pablo Tobón Uribe, Medellín, Colombia.
(2) Cirugía general y Endoscopia, Hospital Pablo Tobón Uribe, Medellín, Colombia.
(3) Cirujano general, Medellín, Colombia.
(4) Cirujano general, Medellín, Colombia.
(5) Hematología y Patología clínica, Director Médico, Laboratorio Clínico Hematológico, Profesor Universidad de Antioquia, Medellín, Colombia.
(6) Gastroenterólogo, Medellín, Colombia.
(7) Cirujano general, Coloproctólogo, Profesor de Cirugía general, Universidad Pontificia Bolivariana, Clínica las Américas, Medellín, Colombia.
(8) Instituto de Alta Tecnología Médica de Antioquia (IATM), Medellín, Colombia.
(9) Universidad Pontificia Bolivariana, Medellín, Colombia.
Fecha recibido: 18-01-12 Fecha aceptado: 15-05-12
Resumen
Antecedentes: la creciente resistencia del Helicobacter pylori a los antibióticos induce el fracaso de la terapia de erradicación, por lo que se pretende modificar no solo la duración de la misma sino el régimen de antibióticos.
Materiales y métodos: luego de una asignación aleatorizada se compararon dos esquemas de tratamiento estándar (7 [grupo 1] frente a 10 días [grupo 2]) con omeprazol 20 mg más amoxicilina 1 g y claritromicina 500 mg, todos vía oral (VO) cada 12 horas en pacientes con dispepsia no ulcerosa (DNU) y dispepsia ulcerosa (DU), para evaluar la efectividad de la erradicación con la prueba o test del aliento. Al año se comparó de nuevo la respuesta clínica de cada una de las terapias en los pacientes con DNU y DU. Se evaluó, además, la tolerancia a la terapia en cada grupo.
Resultados: se asignaron aleatoriamente 149 pacientes al grupo 1 y 144 pacientes al grupo 2. La tasa de erradicación en el análisis por intención a tratar fue del 67,8% en el grupo 1 y del 74,3% en el grupo 2 (p=0,24), y en el análisis por protocolo fue del 72,1% y 81,1% (p=0,08), respectivamente. La tasa de erradicación fue similar para ambos grupos independiente del grado de infección por H. pylori (p=0,22) y no se encontraron diferencias en el grado de infección y la presencia de DNU o DU (p=0,19). Los efectos adversos fueron más frecuentes en el grupo 2 (27,5% frente a 36,1%), aunque sin relevancia estadística (p=0,4). La tasa de erradicación para ambos grupos fue similar para los pacientes con DNU (73,8% frente a 81,1%) y DU (64,3% frente a 73%). El seguimiento al año mostró que las manifestaciones clínicas no se relacionaron con el hecho de haber erradicado o no la bacteria (p=0,7), pese a que la respuesta clínica de los pacientes con DU fue mejor que la observada para los pacientes con DNU.
Conclusiones: la terapia estándar durante 7 o 10 días es insuficiente para la erradicación del H. pylori, independiente del grado de infección por este microorganismo o del tipo de hallazgo endoscópico (DNU o DU). Ambas terapias mostraron unas tasas de erradicación subóptimas y una pobre respuesta clínica al año de seguimiento en el grupo con DNU.
Palabras clave
Helicobacter pylori, terapia de erradicación, enfermedad ulcerosa péptica, dispepsia funcional, dispepsia no ulcerosa.
INTRODUCCION
Al iniciarse el siglo XXI, el Helicobacter pylori coloniza más del 50% de los estómagos de la población mundial y se constituye en la infección más frecuente de la humanidad, con una mayor prevalencia en los países pobres y en vía de desarrollo (1). La prevalencia de la infección por H. pylori en nuestro medio es de las más altas del mundo, con tasas que pueden estar alrededor del 60% en niños y del 80% en la población adulta (2-6). Además, el espectro clínico de la presencia de este microorganismo en el estómago va desde la infección asintomática, pasando por manifestaciones como la gastritis, la úlcera péptica (gástrica o duodenal) hasta neoplasias como el linfoma del tejido linfoide asociado a mucosas (MALT) o el adenocarcinoma gástrico, e incluso con diferentes manifestaciones extra gástricas (7, 8).
Después de casi 30 años de su descripción los investigadores no han definido el protocolo ideal de tratamiento, aunque está bien establecido y unánimemente aceptado que el umbral de respuesta a la terapia de erradicación no debe ser inferior al 80% (9-11).
En la úlcera péptica, la erradicación del H. pylori es considerada como la estrategia de tratamiento más importante para prevenir la recaída de las úlceras, así como para facilitar su rápida cicatrización (12). El tratamiento ideal para la infección del H. pylori debe ser simple, efectivo en todos los casos, de bajo costo y libre de efectos secundarios.
La primera línea de tratamiento estándar para la erradicación del H. pylori es la triple terapia por 7 a 14 días, en la que se combina un inhibidor de la bomba de protones (IBP) con dos antibióticos, principalmente claritromicina (500 mg dos veces al día) y amoxicilina (1 g dos veces al día) o metronidazol (500 mg dos veces al día), esto según diferentes guías de manejo de amplia difusión mundial que incluyen, entre otras, el Consenso de Maastricht III (10, 11, 13). La tasa de éxito descrita en diferentes publicaciones oscila entre el 80% y el 96% (14).
Un estudio local que evaluó la efectividad de la triple terapia mostró tasas de éxito satisfactorias (90%) hace casi 10 años (15). Sin embargo, de acuerdo con estudios nacionales recientes, los antibióticos como el metronidazol y la claritromicina han alcanzado cifras de resistencia bacteriana prohibitivas de su uso rutinario (15-17). Los datos actuales reflejan una disminución en las tasas de éxito para la erradicación de H. pylori que alcanza el límite inferior (18). La falla en la erradicación está dada por la no tolerancia del paciente a la terapia o la resistencia bacteriana a los antibióticos. El amplio uso de los antibióticos macrólidos en las infecciones respiratorias y el consiguiente aumento de la resistencia bacteriana a la claritromicina desempeñan un papel importante (19).
También hay dudas con respecto a la óptima duración de la triple terapia. El grupo europeo para el estudio del H. pylori recomienda un mínimo de 7 días al igual que el segundo consenso Asia-Pacífico, así como los datos obtenidos en Japón (10, 20, 21). Las guías americanas sugieren un tratamiento más prolongado, por 10 a 14 días (22). En Latinoamérica existen reportes de estudios mexicanos que comprobaron la superioridad de la erradicación con un esquema de 14 días (92,3%) sobre uno de 7 días (62,2%) (23). En Brasil, el consenso 2005 recomendó la terapia triple por 7 días (24); en Ecuador, un estudio demostró una mejor tasa de erradicación para la terapia durante 10 días (83,8%) sobre el tratamiento a 7 días (68%), aunque en el Perú no hubo diferencia entre los dos esquemas, con erradicación del 86% para ambos (25, 26). Existen reportes de tratamientos más cortos de 3 y 5 días con cuádruples terapias que mostraron buenos resultados (27, 28). A esta falta de unanimidad y de consenso en la terapia contra el H. pylori se suman los hallazgos contradictorios de dos metaanálisis realizados sobre la duración del tratamiento: el primero, desarrollado por Calvet, justifica el uso de las terapias más prolongadas (10 días) pero el más reciente, elaborado por Fuccio, no encuentra diferencias con los tratamientos de más de 7 días en la erradicación del H. pylori (29, 30).
Ante esta incertidumbre generalizada respecto a la duración óptima del tratamiento para erradicar el H. pylori, el propósito del presente estudio es comparar la eficacia de la triple terapia estándar con un IBP más claritromicina y amoxicilina administradas en dos esquemas de 7 y 10 días, respectivamente, para la erradicación del H. pylori.
MATERIALES Y METODOS
Este es un ensayo clínico aleatorizado y abierto, realizado en población urbana de la consulta externa correspondiente a los diferentes autores, entre enero de 2007 y mayo de 2010.
Población del estudio
El estudio incluyó pacientes >18 años y ≤70 años de edad, con diagnóstico histológico de infección por H. pylori en muestras obtenidas por endoscopia y coloración con hematoxilina-eosina. Fueron excluidos los pacientes con antecedente de gastrectomía, complicaciones por úlcera péptica como estenosis o sangrado, mujeres embarazadas o que estuvieran lactando, hallazgos endoscópicos de linfoma MALT, cáncer gástrico, o que hubieran recibido cualquier tratamiento contra el H. pylori.
Para prevenir interferencias con el tratamiento de H pylori, fueron excluidos los pacientes con antecedente en el último mes de consumo de antibióticos o compuestos con bismuto, bloqueadores de los receptores H2 de la histamina, probióticos o IBP. Tampoco se incluyeron los pacientes con trastorno psiquiátrico mayor, alergia a la penicilina o historia de enfermedad maligna concurrente, insuficiencia hepática o renal.
Diseño del estudio
El estudio se realizó en pacientes con biopsias positivas para H. pylori, provenientes de diferentes instituciones hospitalarias de la ciudad de Medellín y de la práctica privada de varios de los autores. Se evaluaron dos terapias estándar para la erradicación del H. pylori, una de 10 días y la otra de 7 días. Para la selección de la muestra se utilizó una diferencia de proporciones poblacionales, en la que se asumió un error tipo 1 de 0,05, una proporción de efectividad en la erradicación en el grupo de los 10 días de 0,9, una proporción de efectividad en la erradicación del grupo de 7 días de 0,78, para una diferencia absoluta entre proporciones de 0,12 y una tasa de asignación entre los grupos de 1. Con los parámetros descritos, el tamaño de la muestra, calculado por el programa "Tamaño de Muestra" versión 1.1, fue de 140 pacientes por cada grupo de estudio.
Se evaluaron las características demográficas de los pacientes y los resultados endoscópicos, en los cuales se consideraron los siguientes hallazgos: gastritis sin componente erosivo, gastritis asociada con componente erosivo, úlcera gástrica o duodenal. Una densidad de infección por H. pylori en el examen histológico de no menos de 2 biopsias del antro fue categorizada en dos grupos: escasa (1 o 2 cruces) o abundante (3 o 4 cruces) Solo se utilizó la coloración de hematoxilina-eosina.
Se llevó a cabo un control por consulta de 1 a 3 semanas después de la terminación del tratamiento, en el que se evaluó si hubo efectos adversos relacionados con el tratamiento y la tolerancia a la terapia; también se registró si hubo cumplimiento del tratamiento, es decir, un consumo de más del 70% de la prescripción (5 de los 7 días o 7 de los 10 días ordenados).
Grupos de estudio
Inicialmente, los pacientes recibieron triple terapia con omeprazol 20 mg por 30 días, amoxicilina 1 g y claritromicina 500 mg, todos por vía oral (VO) cada 12 horas. Luego fueron asignados de manera aleatoria a dos grupos según la duración del tratamiento antibiótico: 7 días (grupo 1) y 10 días (grupo 2). Se generó una secuencia de aleatorización mediante el paquete estadístico EPIDAT® 3.01. Después de obtener la secuencia se asignó el tratamiento a los pacientes, a quienes se les conminó para que no fumaran durante la administración de la terapia.
Evaluación de la erradicación
En el Laboratorio Clínico Hematológico S.A. de la ciudad de Medellín, Colombia, los pacientes fueron sometidos a una prueba del aliento optimizada, después de 4-6 semanas de haber terminado la terapia. Esta prueba tiene una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del 100% (31).
El desenlace primario fue la erradicación de la infección por H. pylori medida con la prueba del aliento según carbono 13, e informada por el laboratorio como negativa. Como desenlace secundario se evaluó la adherencia al tratamiento, cuyo cumplimiento se estableció como el consumo mayor o igual al 70% del esquema de tratamiento y se confirmó en cita de revisión por consulta posterior a la terminación de la terapia antibiótica; esta también se tuvo en cuenta en el análisis por protocolo y por intención a tratar.
Las pruebas del aliento fueron realizadas por un investigador que desconocía (ciego) la terapia implementada en los pacientes.
Evaluación del tratamiento al año
La condición clínica de los pacientes fue valorada al momento de la prescripción de la terapia y al año después del tratamiento de la erradicación del H. pylori con base en la versión validada en español de los criterios de Roma III para los trastornos gastrointestinales funcionales del adulto (32, 33), para determinar si esta era mejor, igual o peor. En el análisis al año se hizo especial énfasis en el diagnóstico inicial endoscópico del paciente y en la relación de la erradicación del H. pylori con la condición actual para el momento.
Análisis estadístico
Las características demográficas de ambos grupos fueron comparadas mediante la prueba de chi-cuadrado. La tasa de erradicación del H. pylori fue analizada por intención a tratar (AIT) o por protocolo (APP). La totalidad de los pacientes del estudio fue evaluada por el AIT. En el APP solo se tuvieron en cuenta a los pacientes con tratamiento completo. Para el AIT y el APP se calcularon las diferencias en las tasas de erradicación del H. pylori y los intervalos de confianza del 95%. Se esperaba que la erradicación del H. pylori en la terapia de 7 días (grupo 1) fuera inferior a la terapia de 10 días (grupo 2). Se consideró un margen de no inferioridad del 12% con base en estudios controlados previos (34, 35). También se comparó la incidencia de efectos adversos entre los dos grupos usando la prueba de chi-cuadrado. La respuesta clínica al año de seguimiento fue analizada mediante la comparación de los dos grupos de tratamiento empleando esta prueba. Los valores de p<0,05 se consideraron estadísticamente significativos.
Aspectos éticos
Esta investigación se clasificó, de acuerdo con la declaración internacional de Helsinki, el informe de Belmont y la resolución colombiana 8430 de 1993, como una investigación sin riesgos biológicos, fisiológicos, psicológicos y sociales. Además se tuvo en cuenta la resolución 1995 de 1999 por la cual se establecen normas para el manejo de la historia clínica.
RESULTADOS
Pacientes
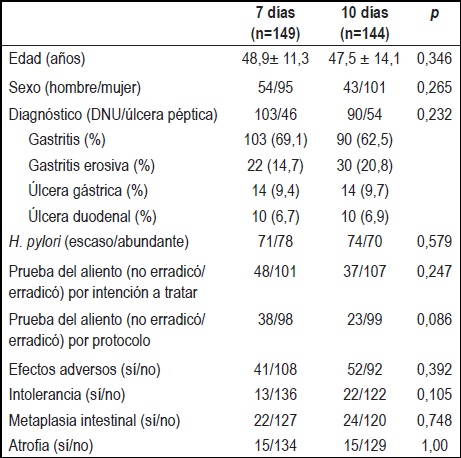
Entre enero de 2007 y mayo de 2010 un total de 293 pacientes fueron tratados para erradicación del H. pylori. Estos tenían diagnóstico de infección por este microorganismo confirmada por biopsia endoscópica tomada en el último mes antes del inicio de la terapia. De los 293, un total de 149 pacientes fue aleatorizado al grupo de 7 días de tratamiento (grupo 1) y los 144 pacientes restantes recibieron 10 días de tratamiento (grupo 2). Los hallazgos endoscópicos de gastritis, gastritis erosiva y úlcera duodenal o gástrica fueron similares para los dos grupos de tratamiento. No se encontraron diferencias sociodemográficas significativas entre los dos grupos (tabla 1).
Tabla 1. Características sociodemográficas y clínicas de los grupos de tratamiento.
Tasas de erradicación
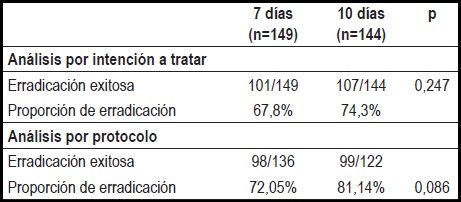
La tasa de erradicación de los pacientes tratados durante 7 días fue menor a la correspondiente para los tratados por 10 días en ambos análisis, AIT y APP. Sin embargo, ninguna de estas terapias logró unas cifras óptimas de erradicación de la bacteria (tabla 2).
Tabla 2. Tasas de erradicación en ambos grupos.
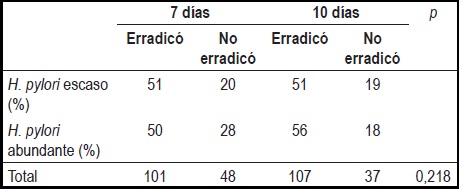
Al discriminar si las tasas de erradicación se relacionaban con el grado de infección por H. pylori de acuerdo con lo reportado en la biopsia, se encontró estas eran similares para ambas terapias independiente de la carga bacteriana (tabla 3).
Tabla 3. Tasas de erradicación del H. pylori y su relación con el grado de infección.
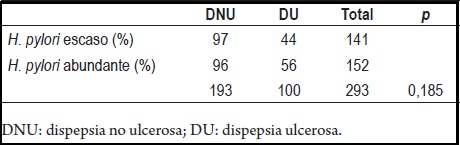
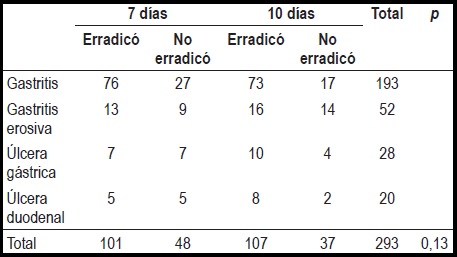
Tampoco se demostró una diferencia significativa en el grado de infección por H. pylori y el tipo de hallazgo endoscópico, sea DNU o DU (tabla 4).
Tabla 4. Relación de los hallazgos endoscópicos y el grado de infección por H. pylori.
Reacciones adversas
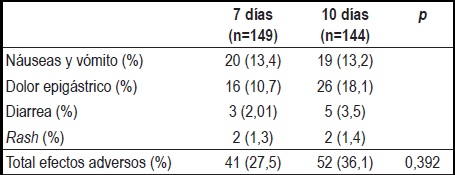
De los 149 pacientes en el grupo 1, 11 suspendieron la terapia por intolerancia, mientras que 17 del grupo 2 no completaron el tratamiento por la misma razón. Para el APP se incluyeron 120 pacientes del grupo 1 y 107 del grupo 2. El 27,44% de los pacientes tratados durante 7 días y el 36,09% de los tratados por 10 días reportaron efectos adversos, sin observarse una diferencia estadísticamente significativa (p=0,392).
Los síntomas más frecuentes para ambos grupos fueron: dolor epigástrico, náuseas y vómitos (con sabor metálico en boca), diarrea y presencia de brote cutáneo, sin diferencias entre los dos grupos.
Característicamente, los síntomas eran más intensos durante los primeros dos a tres días y luego disminuyeron (tabla 5).
Tabla 5. Efectos adversos en cada uno de los grupos de tratamiento.
Respuesta a la terapia de erradicación según el diagnóstico inicial
Se presentó una tasa similar de erradicación para las diferentes terapias y los diferentes hallazgos endoscópicos (tabla 6).
Tabla 6. Respuesta a la terapia de erradicación según los hallazgos endoscópicos.
Seguimiento al año
Un año después de haber recibido la terapia, los pacientes fueron contactados personalmente o por vía telefónica para evaluar sus manifestaciones gastrointestinales, cuando las había, de acuerdo con los criterios de Roma III. Se registró si un año después del tratamiento los síntomas habían mejorado, o bien empeorado o se mantenían iguales, con particular énfasis en el diagnóstico inicial si se trataba de una dispepsia funcional o había una enfermedad ácido-péptica con componente estructural (erosiones o úlcera) a la endoscopia. No se observó una diferencia significativa entre los tratamientos y las manifestaciones clínicas al año de seguimiento.
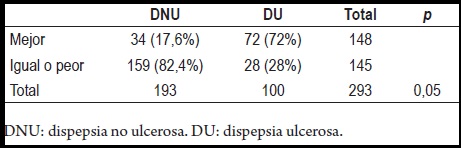
Sin embargo, al evaluar la respuesta clínica según el diagnóstico inicial, se encontró que de 100 pacientes con dispepsia ulcerosa (úlcera duodenal, gástrica o gastritis erosiva) 72 mejoraron (72 %), mientras que en los 193 pacientes con dispepsia no ulcerosa solo 34 (38%) lo hicieron (tabla 7).
Tabla 7. Evaluación del comportamiento clínico según el diagnóstico inicial, al año de haber erradicado el H. pylori.
DISCUSION
La triple terapia con un IBP y dos antibióticos es reconocida como la primera línea de tratamiento contra la infección por H. pylori. En la actualidad no se encuentra bien establecida ni sustentada cuál es la duración óptima de la terapia, pues esta varía en la geografía mundial con estándares entre 7 y 14 días de tratamiento, habitualmente. De acuerdo con los diferentes reportes de la literatura referentes al tratamiento del H. pylori local (Colombia) y regional (Latinoamérica), la duración de la mayoría de las terapias de erradicación oscilan entre los 7 y 10 días (36-38).
Además de las discrepancias en el tiempo en que se debe administrar el tratamiento, existe un amplio desconocimiento médico referente a cuál es la terapia más indicada para erradicar el H. pylori, que ya fue evaluado en nuestro medio (37). Varias son las diferencias respecto a la duración del tratamiento, o bien al número y tipo de medicamentos, triple o cuádruple terapia, estas últimas frecuentemente asociadas con el uso de bismuto con resultados locales inaceptables en cuanto a las tasas de erradicación, así como con un alto porcentaje de efectos secundarios (39, 40). En el medio también se han descrito otras alternativas con el uso de furazolidona, con buenas tasas de erradicación (41, 42).
En gran parte estas variaciones amplias en los diferentes esquemas de tratamiento contra el H. pylori se deben a las crecientes tasas de resistencia de este microorganismo a los diferentes fármacos utilizados en su erradicación. En Colombia se ha descrito un incremento de esta resistencia de la bacteria al metronidazol y a la claritromicina (16, 17, 43). Es válido pensar, entonces, que una terapia más prolongada inducirá una tasa más alta de erradicación, pero si esta terapia falla por la resistencia al antibiótico, independiente de la duración del tratamiento, dicha tasa no será mayor.
En el AIT correspondiente al estudio, la terapia estándar de 10 días comparada con la terapia de 7 días para la erradicación del H. pylori no mostró una mayor tasa de erradicación 74,3% frente a 67,8%), ni hubo diferencias respecto a los efectos adversos (36,1% frente a 27,5%) o la necesidad de suspender el tratamiento (15,7% frente a 8,72%). Sin embargo, estas cifras muestran que ambas terapias se encuentran por debajo de una óptima tasa de erradicación que debería estar por encima del 80%, y que la terapia más prolongada cursa con una mayor proporción de efectos indeseables.
Contrario a nuestro estudio, en el metaanálisis realizado por Calvet se observó una mayor tasa de erradicación para las terapias de 14 días en comparación con las de 7 días (29). No obstante, en los 7 estudios incluidos se utilizaron esquemas terapéuticos diferentes: en 4 de estos se combinó un IBP más amoxicilina y claritromicina; en 2, claritromicina y metronidazol; y en el estudio restante, claritromicina más metronidazol o amoxicilina. Por ende, es difícil comparar nuestros hallazgos con los de este metaanálisis.
Estos resultados sugieren que la resistencia a los antibióticos es la principal causa de falla en la erradicación, más que lo prolongado o no del tratamiento, en un área geográfica con una alta tasa de resistencia antibiótica. Incluso en el APP, el éxito en la erradicación estuvo escasamente por encima del límite inferior esperado.
Como se ha descrito en otras series, las tasas de erradicación son más altas en los pacientes con DU así como el control de los síntomas a largo plazo (44, 45). El presente estudio mostró que una vez erradicado el H. pylori y realizado el seguimiento, la mejoría clínica de los pacientes con úlcera duodenal (72%) fue mayor a la de los pacientes con dispepsia no ulcerosa (17,6%). Se argumenta que las diferencias en los tipos de cepas de H. pylori que originan la infección son la explicación más probable (46). Algunos metaanálisis han afirmado que cepas más virulentas (vacA s1, cagA-negativo) son más fáciles de erradicar que las cepas menos virulentas (vacA s2, cagA-negativo) (47). Es posible que estas últimas alcancen mayores densidades poblacionales en la mucosa y sea más difícil curar a los pacientes por las altas cargas bacterianas. En cuanto a las cepas más virulentas, estas causan más inflamación (48). El incremento en la inflamación puede facilitar la llegada de los antibióticos al sitio de la colonización bacteriana. Diferentes estudios, en contraste con la presente serie, han mostrado que los pacientes con más inflamación tuvieron mayor probabilidad de curarse de la infección por H. pylori (49, 50). Es más frecuente que los pacientes con dispepsia ulcerosa estén infectados con cepas más virulentas que los pacientes con dispepsia no ulcerosa; esto puede explicar las diferencias en las tasas de curación entre la úlcera y la dispepsia no ulcerosa y, por consiguiente, las menores manifestaciones de bienestar en el grupo con DNU en el control a 1 año. No se ha descrito una correlación entre los factores de virulencia y la resistencia antimicrobiana.
Surgen varios interrogantes por resolver con los datos descritos: ¿se debe aumentar la terapia a 14 días incrementando los costos de la misma al doble y, potencialmente, los efectos adversos de la medicación? ¿Cuál debe ser el fármaco de elección, si se tiene en cuenta que los diferentes esquemas que se describen como alternativas, terapia secuencial o concomitante utilizan metronidazol, que presenta unas cifras prohibitivas para su uso en nuestro medio por la alta resistencia descrita? ¿Es la levofloxacina la alternativa de elección, sin olvidar que dos metaanálisis sustentan que esta debe ser la terapia de rescate cuando el tratamiento estándar inicial ha fallado? (51, 52). El presente estudio suscita más preguntas que las respuestas que ofrece y convoca a un decidido compromiso de la comunidad médica para realizar una investigación en el área y así poder ofrecer a nuestros pacientes mejores alternativas de manejo, con base en nuestras propias cifras, para una infección tan frecuente y con las implicaciones tan serias que ella conlleva.
CONCLUSIONES
La terapia de erradicación del H. pylori durante 10 días no es superior a la terapia por 7 días y cursa con una mayor incidencia de efectos adversos y de retiros del tratamiento. Sin embargo, los resultados de ambos tratamientos para erradicar la bacteria no son satisfactorios, lo que sugiere una disminución en las tasas de erradicación debido a un incremento en las tasas de resistencia del H. pylori.
Conflictos de intereses
Los autores declaran que no existe ningún conflicto de interés.
REFERENCIAS
1. Pounder RE, Ng D. The prevalence of Helicobacter pylori infection in different countries. Aliment Pharmacol Ther 1995; 9(Suppl 2): 33-9. [ Links ]
2. Goodman KJ, Correa P, Tenganá Aux HJ, Ramírez H, DeLany JP, Guerrero Pepinosa O, et al. Helicobacter pylori infection in the Colombian Andes: a population-based study of transmission pathways. American journal of epidemiology 1996; 144(3): 290-9. [ Links ]
3. Duque JJ. Helicobacter pylori en la mucosa gástrica de cadáveres de niños. IATREIA 1999; 12(3): 135-8. [ Links ]
4. Gutiérrez O, Aponte D, Páramo D, Sabbag LC, Angel L, Cardona H, et al. Seroprevalencia y factores de riesgo asociados con la infección por Helicobacter pylori en niños. Rev Col Gastroenterol 2001; 16(1): 19-22. [ Links ]
5. Bravo LE, Cortés A, Carrascal E, Correa P, Ordoñez N. Seroprevalencia de anticuerpos anti-Helicobacter pylori en donantes de sangre de regiones colombianas con diferencias en la mortalidad por cáncer gástrico. Colomb Med 2000; 31(3): 122-30. [ Links ]
6. Campuzano-Maya G, Hoyos-Castano D, Calvo-Betancur VD, Suárez-Ramírez OA, Lizcano-Cardona D, Rojas-Arbelaez CA. [Prevalence of Helicobacter pylori infection in physicians in Medellin, Colombia]. Acta Gastroenterol Latinoam 2007; 37(2): 99-103. [ Links ]
7. Suerbaum S, Michetti P. Helicobacter pylori infection. N Engl J Med 2002; 347(15): 1175-86. [ Links ]
8. Solnick JV, Franceschi F, Roccarina D, Gasbarrini A. Extragastric manifestations of Helicobacter pylori infection--other Helicobacter species. Helicobacter 2006; 11(Suppl 1): 46-51. [ Links ]
9. Warren JR, Marshall B. Unidentified curved bacilli on gastric epithelium in active chronic gastritis. Lancet 1983; 1(8336): 1273-5. [ Links ]
10. Malfertheiner P, Megraud F, O'Morain C, Bazzoli F, El-Omar E, Graham D, et al. Current concepts in the management of Helicobacter pylori infection: the Maastricht III Consensus Report. Gut 2007; 56(6): 772-81. [ Links ]
11. Lam SK, Talley NJ. Report of the 1997 Asia Pacific Consensus Conference on the management of Helicobacter pylori infection. J Gastroenterol Hepatol 1998; 13(1): 1-12. [ Links ]
12. Costa F, D'Elios MM. Management of Helicobacter pylori infection. Expert Rev Anti Infect Ther 2010; 8(8): 887-92. [ Links ]
13. Bourke B, Ceponis P, Chiba N, et al. Canadian Helicobacter Study Group Consensus Conference: Update on the approach to Helicobacter pylori infection in children and adolescents--an evidence-based evaluation. Can J Gastroenterol 2005; 19: 399-408. [ Links ]
14. Otero W, Gómez M, Trespalacios AA. Helicobacter pylori: después de todo. In: Feris J, Sierra F, Pérez M, eds. Temas Escogidos de Gastroenterología. Bogotá: Nomos Impresores; 2007:43-56. [ Links ]
15. Gutiérrez O, Otero W, Páez O, Roldan L, De Lima E, Reyes R,et al. Terapia triple con lansoprazol, amoxicilina y claritromicina durante 10 días (LAC-10) erradica Helicobacter pylori. Rev Col Gastroenterol 2001; 16(3): 132-5. [ Links ]
16. Reddy R, Osato M, Gutierrez O. Metronidazole resistance is high in Korea and Colombia and appears to be rapidly increasing in US. Gastroenterology 1996; 110: A238. [ Links ]
17. Yepes CA, Rodríguez A, Ruiz Á, Ariza B. Resistencia antibiótica del Helicobacter pylori en el Hospital Universitario San Ignacio de Bogotá. Acta Med Col 2008; 33(1): 11-4-. [ Links ]
18. Greenberg ER, Anderson GL, Morgan DR, Torres J, Chey WD, Bravo LE, et al. 14-day triple, 5-day concomitant, and 10-day sequential therapies for Helicobacter pylori infection in seven Latin American sites: a randomised trial. Lancet 2011; 378(9790): 507-14. [ Links ]
19. Francesco VD, Zullo A, Hassan C, Giorgio F, Rosania R, Ierardi E. Mechanisms of Helicobacter pylori antibiotic resistance: An updated appraisal. World J Gastrointest Pathophysiol 2011; 2(3): 35-41. [ Links ]
20. Fock KM, Katelaris P, Sugano K, Ang TL, Hunt R, Talley NJ, et al. Second Asia-Pacific Consensus Guidelines for Helicobacter pylori infection. J Gastroenterol Hepatol 2009; 24(10): 1587-600. [ Links ]
21. Asaka M. [Guidelines in the management of H. pylori infection in Japan--2009 version]. Nihon Rinsho 2009; 67(12): 2227-32. [ Links ]
22. Chey WD, Wong BC. American College of Gastroenterology guideline on the management of Helicobacter pylori infection. Am J Gastroenterol 2007; 102(8): 1808-25. [ Links ]
23. Bosques-Padilla FJ, Garza-González E, Calderón-Lozano IE, Reed-SanRoman G, de Ariño Suárez M, Valdovinos-Díaz MA, et al. Open, randomized multicenter comparative trial of rabeprazole, ofloxacin and amoxicillin therapy for Helicobacter pylori eradication: 7 vs. 14 day treatment. Helicobacter 2004; 9(5): 417-21. [ Links ]
24. Coelho LG, Zaterka S. [Second Brazilian Consensus Conference on Helicobacter pylori infection]. Arq Gastroenterol 2005; 42(2): 128-32. [ Links ]
25. Robles-Jara C, Robles-Medranda C, Moncayo M, Landivar B, Parrales J. Is a 7-day Helicobater pylori treatment enough for eradication and inactivation of gastric inflammatory activity? World J Gastroenterol 2008; 14(18): 2838-43. [ Links ]
26. Rodríguez W, Pareja Cruz A, Yushimito L, Ramírez Ramos A, Gilman RH, Watanabe Yamamoto J, et al. [Omeprazole, amoxicillin and clarithromycin in the treatment of helicobacterpylori, in 7 and 10-day regimens]. Rev Gastroenterol Peru 2003; 23(3): 177-83. [ Links ]
27. Wang HH, Chou JW, Liao KF, Lin ZY, Lai HC, Hsu CH, et al. One-year follow-up study of Helicobacter pylori eradication rate with 13C-urea breath test after 3-d and 7-d rabeprazole-based triple therapy. World J Gastroenterol 2005; 11(11): 1680-4. [ Links ]
28. Nagahara A, Miwa H, Yamada T, Kurosawa A, Ohkura R, Sato N. Five-day proton pump inhibitor-based quadruple therapy regimen is more effective than 7-day triple therapy regimen for Helicobacter pylori infection. Aliment Pharmacol Ther 2001; 15(3): 417-21. [ Links ]
29. Calvet X, García N, López T, Gisbert JP, Gené E, Roque M. A meta-analysis of short versus long therapy with a proton pump inhibitor, clarithromycin and either metronidazole or amoxycillin for treating Helicobacter pylori infection. Aliment Pharmacol Ther 2000; 14(5): 603-9. [ Links ]
30. Fuccio L, Minardi ME, Zagari RM, Grilli D, Magrini N, Bazzoli F. Meta-analysis: duration of first-line proton-pump inhibitor based triple therapy for Helicobacter pylori eradication. Ann Intern Med 2007; 147(8): 553-62. [ Links ]
31. Campuzano-Maya G. An optimized 13C-urea breath test for the diagnosis of H pylori infection. World J Gastroenterol 2007; 13(41): 5454-64. [ Links ]
32. Tack J, Talley NJ, Camilleri M, Holtmann G, Hu P, Malagelada JR, et al. Functional gastroduodenal disorders. Gastroenterology 2006; 130(5): 1466-79. [ Links ]
33. Morgan DR, Squella FE, Pena E, Mearin F, Rey E, Enriquez HE, et al. Multinational validation of the Spanish Rome III questionnaire: comparable sensitivity and specificity to the English instrument. Gastroenterology 2010; 138(5: Suppl 1): S-386. [ Links ]
34. Vakil N, Lanza F, Schwartz H, Barth J. Seven-day therapy for Helicobacter pylori in the United States. Aliment Pharmacol Ther 2004; 20(1): 99-107. [ Links ]
35. Kim BG, Lee DH, Ye BD, Lee KH, Kim BW, Kim SK, et al. Comparison of 7-day and 14-day proton pump inhibitor-containing triple therapy for Helicobacter pylori eradication: neither treatment duration provides acceptable eradication rate in Korea. Helicobacter 2007; 12(1): 31-5. [ Links ]
36. Otero W, Gutiérrez O, Quintero F, et al. Eficacia de pantoprazol con claritromicina y amoxicilina para la erradicación de Helicobacter pylori en pacientes con úlcera duodenal o dispepsia no ulcerosa. Rev Col Gastroenterol 2000; 15: 247-51. [ Links ]
37. Gómez M, Otero W, Gutiérrez O. Tratamiento de la infección por Helicobacter pylori. Encuenta a un grupo de médicos generales y especialistas en Colombia. Rev Col Gastroenterol 2007; 22(1): 7-16. [ Links ]
38. Coelho LG, León-Barúa R, Quigley EM. Latin-American Consensus Conference on Helicobacter pylori infection. Latin-American National Gastroenterological Societies affiliated with the Inter-American Association of Gastroenterology (AIGE). Am J Gastroenterol 2000; 95(10): 2688-91. [ Links ]
39. Gutiérrez O, Otero W, Melo M, et al. Eficacia de la terapia tetraconjugada para la erradicación de Helicobacter pylori en pacientes con úlcera duodenal y dispepsia no ulcerosa. Rev Col Gastroenterol 1998; 12: 63-8. [ Links ]
40. Gutiérrez O, Otero W, Ricaurte O, et al. Eradication of H. pylori with a new quadruple therapy: Bismuth, lansoprazole, clarithromycin, amoxycillin (BLAC) twice a day for 5 or 10 days. Gastroenterology 2000; 118(Suppl 2): A 1242. [ Links ]
41. Segura AM, Gutiérrez O, Otero W, Angel A, Genta RM, Graham DY. Furazolidone, amoxycillin, bismuth triple therapy for Helicobacter pylori infection. Aliment Pharmacol Ther 1997; 11(3): 529-32. [ Links ]
42. Gutiérrez O, Otero W, Cardona H. Terapia cuádruple con furazolidona como tratamiento de rescate para la infección por Helicobacter pylori. Rev Col Gastroenterol 2003; 18: 222-8. [ Links ]
43. Gutiérrez O, Otero W. Resistencia de Helicobacter pylori al Metronidazol en Colombia. Rev Col Gastroenterol 1998; 12: 31-5. [ Links ]
44. Chung SJ, Lee DH, Kim N, Jung SH, Kim JW, Hwang JH, et al. Eradication rates of helicobacter pylori infection with second-line treatment: non-ulcer dyspepsia compared to peptic ulcer disease. Hepatogastroenterology 2007; 54(76): 1293-6. [ Links ]
45. Huang JQ, Zheng GF, Hunt RH, Wong WM, Lam SK, Karlberg J, et al. Do patients with non-ulcer dyspepsia respond differently to Helicobacter pylori eradication treatments from those with peptic ulcer disease? A systematic review. World J Gastroenterol 2005;11(18): 2726-32. [ Links ]
46. Karaman M, Abacioglu H, Topalak OS, Simsek I. [Molecular detection of Helicobacter pylori vacA and cagA genes in gastric tissue specimens of patients with peptic ulcer disease and non-ulcer dyspepsia]. Mikrobiyol Bul 2011; 45(1): 11-20. [ Links ]
47. Suzuki T, Matsuo K, Sawaki A, Ito H, Hirose K, Wakai K, et al. Systematic review and meta-analysis: importance of CagA status for successful eradication of Helicobacter pylori infection. Aliment Pharmacol Ther 2006; 24(2): 273-80. [ Links ]
48. Saxena A, Shukla S, Prasad KN, Ghoshal UC. Virulence attributes of Helicobacter pylori isolates & their association with gastroduodenal disease. Indian J Med Res 2011; 133: 514-20. [ Links ]
49. Ruggiero P. Helicobacter pylori and inflammation. Curr Pharm Des 2010; 16(38): 4225-36. [ Links ]
50. Tsai HF, Hsu PN. Interplay between Helicobacter pylori and immune cells in immune pathogenesis of gastric inflammation and mucosal pathology. Cell Mol Immunol 2010; 7(4): 255-9. [ Links ]
51. Li Y, Huang X, Yao L, Shi R, Zhang G. Advantages of Moxifloxacin and Levofloxacin-based triple therapy for second-line treatments of persistent Helicobacter pylori infection: a meta analysis. Wien Klin Wochensch 2010; 122(13-14): 413-22. [ Links ]
52. Saad RJ, Schoenfeld P, Kim HM, Chey WD. Levofloxacin-based triple therapy versus bismuth-based quadruple therapy for persistent Helicobacter pylori infection: a meta-analysis. Am J Gastroenterol 2006; 101(3): 488-96. [ Links ]











 text in
text in