Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957On-line version ISSN 2500-7440
Rev Col Gastroenterol vol.27 no.2 Bogotá Apr./June 2012
Friedrich Krukenberg, el del tumor de Krukenberg: a propósito de una serie de casos
Friedrich Krukenberg of Krukenberg's Tumor: Report of a series of cases
Martin Gómez Zuleta, MD (1), Luis Fernando Benito, MD (2), Cristina Almonacid, MD.(3)
(1)Profesor Asistente, Unidad de Gastroenterología, Departamento de Medicina Interna, Universidad Nacional de Colombia, Hospital El Tunal, Bogotá, Colombia
(2) Residente de tercer año de Cirugía, Universidad de San Martín, Bogotá, Colombia
(3) Patóloga, Hospital El Tunal, Clínica de la Policía, Bogotá, Colombia
Fecha recibido: 17-01-12 Fecha aceptado: 15-05-12
Resumen
El tumor de Krukenberg (descrito por un médico alemán que tenía el mismo nombre) es un tumor de ovario que representa la metástasis de una tumoración primaria usualmente ubicada en el estómago. En este trabajo se realiza una breve reseña histórica y se presentan cinco casos manejados en nuestro servicio, con el fin de mostrar la complejidad de su diagnóstico, el abordaje terapéutico y el pésimo pronóstico que esta enfermedad tiene.
Palabras clave
Tumor de Krukenberg, cáncer gástrico.
Friedrich Ernst Krukenberg (1871-1946) fue un médico alemán que durante su formación de pregrado trabajó en la ciudad de Marburg bajo la tutela de Felix Jacob Marchand (1846-1928),médico jefe del Departamento de Patología de la Universidad de Marburg. El doctor Marchand tenía en su casuística seis casos de tumores ováricos atípicos, los que entregó a Krukenberg como material para su tesis de doctorado. En 1896 y a los 25 años de edad publicó su tesis, en la que planteaba que estos tumores correspondían a un nuevo tipo de neoplasia primaria del ovario de tipo sarcomatosa por el aspecto de las células malignas, al cual denominó como "fibrosarcoma ovarii mucocellulare (carcinomatodes)" (1-3).
En 1902, Schlagenhauffer propuso que este tumor no correspondía a una entidad primaria del ovario sino a una metástasis de una neoplasia epitelial. Décadas más tarde se confirmó que se trataba de una metástasis de adenocarcinoma con células en anillo de sello de origen típicamente gástrico, lo que se asoció con una reacción desmoplásica desproporcionada. Esto explica el gran tamaño que alcanzan estas lesiones y el prominente componente estromal que confundió a Marchand y a Krukenberg. En 1928, Gauthier-Villars en su serie de tumor de Krukenberg describió microscópicamente la presencia de tubos y glándulas. En 1981, Bullon explicó, con mayor detalle, lo que denominó tumor de Krukenberg tubular (3-5).
El concepto de tumor de Krukenberg se encuentra fundamentado en los libros de texto publicados por Scully, Young y Kurman y se define como el carcinoma que se presenta en el ovario, y que tiene un componente significativo de mucina (MUC) filante y células típicas en "anillo de sello'' dentro de un estroma celular proliferativo derivado del estroma normal del ovario. Pueden encontrarse glándulas pequeñas con epitelio plano, o grandes con epitelio de tipo intestinal y mucinoso. En el 2006, Kiyokawa, Young y Scully reportaron su experiencia con 120 casos de tumor de Krukenberg; de igual manera, el mismo año Lerwill y Young reportaron 4 casos de metástasis al ovario de un carcinoma gástrico tipo intestinal (4-7).
Actualmente casi todos los tumores de Krukenberg se consideran metástasis; sin embargo, hay casos raros y aislados que se han interpretado como primarios. El tumor de Krukenberg constituye del 1% al 1,5% de todos los tumores del ovario; se puede presentar en cualquier edad (predominantemente entre los 30 y 40 años; raro durante la menopausia) y su evolución y crecimiento son rápidos, con un proceso degenerativo importante (8, 9).
Clínicamente la paciente presenta síntomas ginecológicos asociados con la presencia de ascitis. Por lo general, la aparición del tumor es bilateral hasta en un 80% de los casos y por su estructura externa y consistencia no muestra adherencias dentro de la cavidad peritoneal. Dada su composición histológica se clasifica como tumor epitelial con tejido conjuntivo. Las vías de propagación son, al parecer, por continuidad, por vía sanguínea, linfática y transperitoneal; no obstante, hasta el momento no se ha definido en realidad cuál es la vía exacta de propagación, lo que constituye en sí un motivo de estudio continuo (10-12).
CASOS CLINICOS
Caso 1
Paciente de 48 años de edad que consultó al servicio de urgencias por dolor y distención abdominal asociados con pérdida de peso (10 kg) y anorexia. Al momento del examen físico se encontró que sus signos vitales estaban dentro de los límites normales; sus condiciones generales eran regulares, con distensión abdominal importante y presencia de una masa abdominopélvica móvil con ascitis a la palpación, sin signos de irritación peritoneal. Se hospitalizó para estudio y se realizó prueba de marcador tumoral que arrojó los siguientes resultados: CA 125 de 549 (positivo) y antígeno CA 19,9 de 7,46, valores que están dentro de los límites normales. La ecografía abdominal total evidenci>ó como hallazgo positivo la presencia de masas en ambos ovarios, de 16 x 3 cm en el ovario derecho y de 13 x 10 cm en el ovario izquierdo. Se llevó a endoscopia de vías digestivas altas que permitió evidenciar en el tercio proximal y medio del cuerpo una lesión ulcerosa e infiltrante compatible con cáncer gástrico avanzado tipo III de Borrmann.
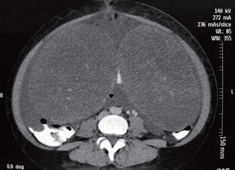
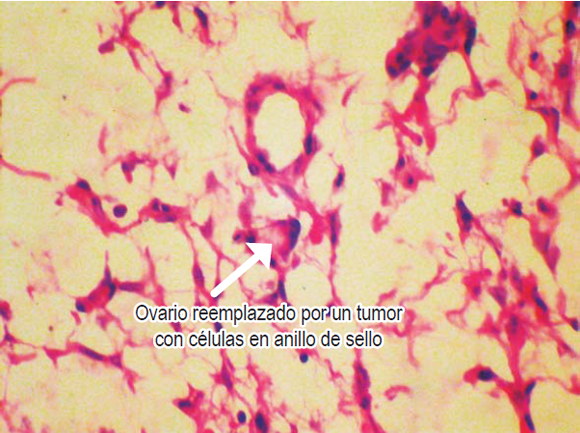
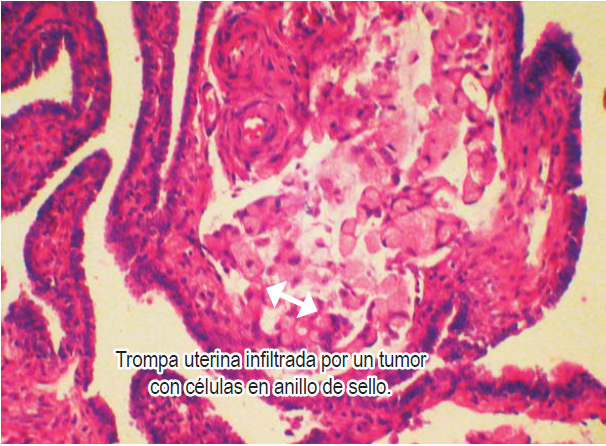
Se realizó tomografía que mostró una masa de 20 cm en el ovario derecho y de 23 cm en el ovario izquierdo (figura 1). El resultado de la patología evidenció adenocarcinoma con células en anillo de sello ulcerado (difuso). Después de una semana de estudios y estancia hospitalaria y debido al pronóstico de la paciente, se decide iniciar manejo paliativo; es llevada a cirugía por parte del servicio de ginecología para la resección de ambas masas ováricas y disminuir así la sintomatología (figura 2). La patología evidenció las células en anillo de sello no solo dentro del estroma ovárico (figura 3) sino dentro de las trompas de Falopio (figura 4). La evolución posoperatoria es adecuada. Se decidió manejo complementario con quimioterapia y la paciente falleció a los 4 meses del diagnóstico.
Figura 1. Evidencia de masas dependientes de los ovarios que alcanzan un tamaño de 20 cm en el ovario derecho y de 23 cm en el ovario izquierdo.
Figura 2. Intraoperatorio de salpingooforectomía bilateral. Se aprecian masas bilaterales dependientes del ovario izquierdo y derecho.
Figura 3. Células en anillo de selloque infiltran el ovario.
Figura 4. Células en anillo de selloque infiltran la trompa uterina.
Caso 2
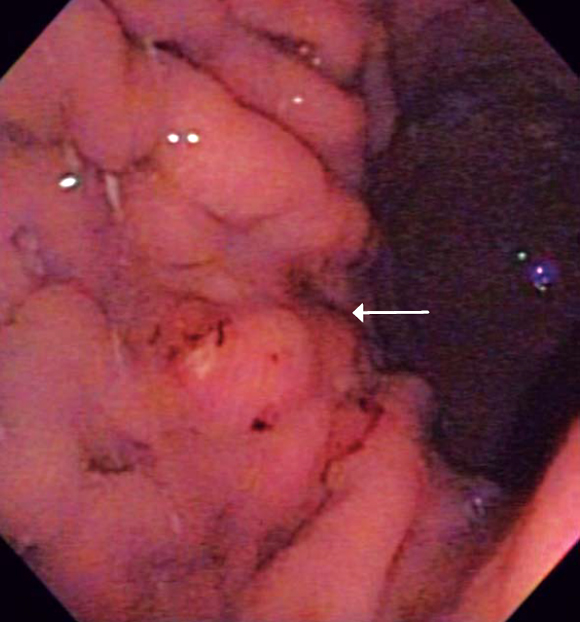
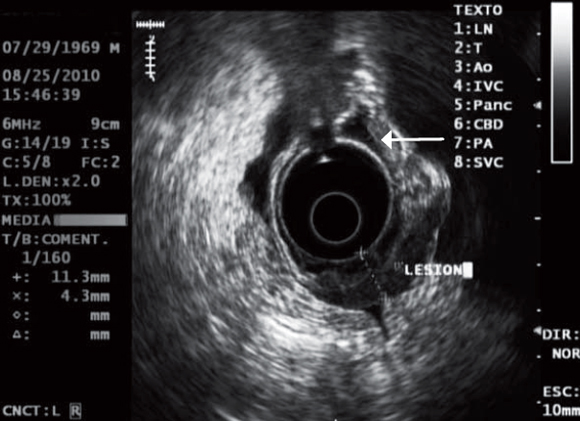
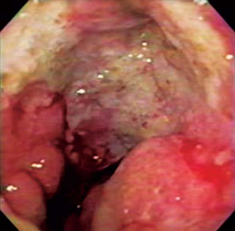
Paciente de 41 años de edad que consultó por dolor pélvico progresivo asociado con alteraciones en el ciclo menstrual y pérdida de peso durante 3 meses. Al momento del examen físico la paciente presentaba unas condiciones generales aceptables, estaba hidratada, con mucosas pálidas y un abdomen globoso con ascitis. Durante el examen pélvico se detectaron masas ováricas bilaterales, cuya confirmación se realizó por ecografía y tomografía axial computarizada (TAC). Se tomó endoscopia digestiva alta (EDA) que mostró en la curva mayor del tercio superior gástrico un ligero engrosamiento y convergencia de pliegues en un área no mayor a 1 cm (figura 5), de donde se recogieron biopsias que una vez hecho el análisis reportaron un carcinoma difuso. Luego se llevó a ecoendoscopia, examen que permitió evidenciar ascitis y una lesión hipoecoica –limitada solo a esta área– que destruyó todas las capas gástricas; el resto del estómago estaba normal (figura 6). Posteriormente se realizó salpingooforectomía bilateral y se inició quimioterapia, pero la paciente falleció a los 5 meses de seguimiento.
Figura 5. La flecha indica una lesión de aproximadamente 1 cm de tamaño, que solo se evidencia por pérdida de pliegues en ese nivel.
Figura 6. Lesión focal de 11,3 mm de tamaño, que destruye todas las capas y engrosa la pared gástrica. La pared normal es de 4,3 mm (flecha).
Caso 3
Paciente de 48 años de edad que consultó por dolor pélvico progresivo y alteración del ciclo menstrual. Al momento del examen físico se encontró que su estado general era malo con anemia, abdomen distendido y onda ascítica positiva. En la valoración ginecológica se evidenciaron masas ováricas bilaterales, motivo por el que se decidió su hospitalización para estudio. La TAC abdominal mostró masas ováricas bilaterales. Durante la endoscopia se observó una lesión infiltrante y ulcerada que afectaba a todo el cuerpo gástrico, la cual fue diagnosticada como cáncer tipo IV de Borrmann (figura 7). La patología reportó carcinoma difuso. Dadas las malas condiciones generales, la paciente y la familia decidieron no someterse a ningún tratamiento, solo analgesia. La paciente falleció a los 2 meses del diagnóstico.
Figura 7. Lesión ulcerada e infiltrante que compromete todo el cuerpo y parcialmente el antro.
Caso 4
Paciente de 50 años de edad que consultó por aumento progresivo del perímetro abdominal, sin otro síntoma asociado. No refería dispepsia o sangrado digestivo. En el examen físico se evidenciaron mucosas rosadas, signos vitales normales y como hallazgo positivo, ascitis y masas ováricas bilaterales. Se realizó una TAC abdominopélvica que mostró masas ováricas bilaterales, CA 125 de 712 (valor normal 33 UI/mL) y una endoscopia que permitió apreciar una lesión ulcerada reportada como tipo III de Borrmann, que se extendía desde el cardias hasta la incisura angular sin comprometer la curva mayor. La patología reportó carcinoma difuso.
La paciente es sometida a cirugía para extracción de las masas ováricas y posteriormente se remite a quimioterapia. Como en los tres casos anteriores, no se realizó cirugía gástrica. Aunque la evolución fue aceptable, la paciente falleció a los 4 meses del diagnóstico.
Caso 5
Paciente de 32 años de edad que consultó por cuadro de dolor pélvico y perineal progresivo asociado con distensión abdominal, vómito y anorexia de 2 meses de evolución; no refirió pérdida de peso. Al momento del examen físico se encontró que sus condiciones generales eran regulares con abdomen distendido y presencia de onda ascítica. El servicio de ginecología ordenó su hospitalización para estudio; se realizó una TAC abdominal que evidenció masas ováricas bilaterales con presencia de siembras tumorales en peritoneo. La endoscopia, por su parte, reportó lesión ulcerada e infiltrante diagnosticada como tipo II de Borrmann, aproximadamente de 4 cm en tercio superior sobre la pared posterior. La patología reportó carcinoma pobremente diferenciado y ulcerado con células en anillo de sello. La paciente es sometida a cirugía ginecológica para resección de las masas ováricas, procedimiento durante el que se encontró un tumor en el ovario derecho de 20 x 20 cm y de 15 x 10 cm en el ovario izquierdo. Posteriormente se inició quimioterapia, con evolución parcialmente adecuada; no obstante, falleció a los 4 meses después del diagnóstico.
En la siguiente tabla pueden observarse las principales características de las cinco (5) pacientes evaluadas con tumor de Krukenberg (tabla 1).
Tabla 1. Características principales de las 5 pacientes evaluadas con tumor de Krukenberg.
DISCUSIÓN
El tumor de Krukenberg representa del 1% al 2% del total de las neoplasias ováricas. En la mayoría de los casos, esta lesión se diagnostica simultáneamente con la neoplasia primaria, mientras que de un 20% a un 30% se presenta como una recidiva posquirúrgica (13-15). El pronóstico de una paciente con tumor de Krukenberg es extremadamente pobre, con una sobrevida de 3 a 10 meses; en nuestra serie de casos fue de 3,7 meses, en promedio. Solo el 10% de las pacientes sobrevive más de dos años después del diagnóstico (16, 17).
El tumor de Krukenberg presenta dos características importantes: la primera de ellas es metástasis ovárica, caracterizada por la presencia de células en anillo de sello; y la segunda, la existencia de proliferación pseudosarcomatosa del estroma ovárico. Muestra una reacción desmoplásica desproporcionada por las células neoplásicas epiteliales a través de los productos tumorales que inducen una reacción proliferativa del estroma ovárico con células fusionadas y abundante depósito de colágeno (18). Es importante resaltar que el origen de estos tumores no es solo gástrico: el 76% son del estómago; el 11%, intestinales (usualmente de colon y recto); el 4%, de seno; el 3%, del sistema biliar; el otro 3%, del apéndice cecal; y el 3 % restante, delpáncreas, cuello uterino, vejiga o pelvis renal (19). Alrededor del 80% son bilaterales, y si el examen de los ovarios se realiza en patología se puede apreciar que son de consistencia suave, esponjosa o gelatinosa, o es posible que estén firmes, lo que dependerá del grado de edema, de los agregados de MUC dentro del estroma, de la hipercelularidad o de la transformación fibrosa (20). Por lo general, el ovario conserva su forma a pesar del gran tamaño que pueden alcanzar estas lesiones, el cual varía de los 5 a los 20 cm como en el primer caso presentado, un tumor en el ovario izquierdo que llegaba a los 23 cm de diámetro (21).
Desde el punto de vista inmunohistoquímico encontramos los siguientes inmunomarcadores: MUC 1, citoqueratina 7 (CK 7) y receptor estrogénico positivo, lo cual es de gran importancia ya que, por ejemplo, en el segundo caso presentado el tumor gástrico era muy pequeño (<2 cm), las masas ováricas eran muy grandes y había ascitis. Solo la inmunohistoquímica nos permitió confirmar que el tumor era primario de estómago y no de ovario, aspecto que cambia completamente el tratamiento y el pronóstico del paciente (22-24).
Las pacientes con tumor de Krukenberg usualmente consultan por dolor abdominopélvico, cambios en el ciclo menstrual o dispareunia, y en estadios más avanzados se presentan con ascitis. Llama la atención que todos los 5 casos expuestos tuvieron ascitis, con lo que se demuestra que eran pacientes en estadios avanzados. El segundo caso es muy llamativo debido a que con una lesión gástrica pequeña la paciente ya tenía ascitis y masas ováricas de 12 y 15 cm, situación que permite darnos una idea de la agresividad de estos carcinomas de tipo difuso. Es aquí donde surge la pregunta de cómo se diseminan estos tumores: las vías y mecanismos por los que las células cancerígenas del estómago alcanzan los ovarios han sido un misterio durante mucho tiempo y todavía no son completamente conocidos (10-12).
Son tres las posibles rutas metastásicas que se han considerado: linfática, hemática y peritoneal. El hecho de que en estos tumores no se observe afectación peritoneal en la superficie ovárica y de que en la mayoría de ellos no exista enfermedad peritoneal, ha descartado la teoría de la diseminación peritoneal como mecanismo de extensión. La vía linfática es la que más se ha postulado ya que la permeación linfática a modo de émbolos carcinomatosos en las estructuras anexiales (hilio ovárico, mesovario y mesosálpinx) es un hallazgo frecuente en el estudio histológico de estos tumores; además, se han descrito en muchas series pacientes con cáncer gástrico temprano y tumor de Krukenberg en los que se considera que debido a los ricos plexos linfáticos que drenan la mucosa y submucosa gástricas estos pudieran ser la ruta de diseminación del tumor al ovario. Incluso se ha encontrado que el riesgo de compromiso ovárico aumenta cuando hay un número mayor de ganglios afectados por el cáncer gástrico (8, 9). Algunos autores proponen el acceso directo a la circulación sistémica a través del conducto linfático-torácico como alternativa a la diseminación retrógrada pura por vía linfática (22-24).
En cuanto al tratamiento y el pronóstico del tumor de Krukenberg, debido a que es una tumoración metastásica, primero se debe encontrar y tratar el cáncer primario. La mayoría de los casos tiene generalmente un pronóstico pobre y la cirugía radical, tal como la oforectomía, puede mejorar la supervivencia solamente en casos de metástasis ováricas solitarias o de enfermedad con extensión local; es decir, que la enfermedad solo esté situada en la pelvis. La quimioterapia y radioterapia están indicadas como tratamiento neoadyuvante para citorreducción y como terapia adyuvante para controlar el cáncer gástrico, que en la mayoría de los casos ya no es susceptible de manejo quirúrgico. En cuatro de los casos presentados en esta serie se llevó a cabo la salpingooforectomía bilateral, aparentemente porque la lesión no estaba diseminada en otros sitios y principalmente con el objetivo de disminuir la carga tumoral y complementar con una quimioterapia, aunque ya se sabía del pésimo pronóstico de la enfermedad. Si quisiéramos controlar el tumor de Krukenberg y su pésimo pron>óstico posiblemente deberíamos prevenir el carcinoma gástrico difuso que, como todos sabemos, tiene un componente genético importante con un síndrome identificado: cáncer heredofamiliar asociado con el gen CDH1. Si logramos identificar una familia que cumpla los criterios de Ámsterdam para este tumor, sería necesario hacerle la prueba genética para identificar las mutaciones en el gen CDH1 en sus familiares asintomáticos; si es positivo, el paciente deberá ser sometido a gastrectomía para prevenir la aparición del tumor (23-25).
CONCLUSION
Para concluir, no debe confundirse con tumor de Krukenberg a toda paciente que tenga una masa ovárica, puesto que con frecuencia se presentan muchas neoplasias primarias de este órgano. El tumor de Krukenberg del ovario es una metástasis que tiene los patrones histológicos característicos señalados y comentados. Es importante la comunicación con el equipo médico para identificar antes del acto quirúrgico el tumor primario, el cual, por lo general, se encuentra en el estómago, aunque puede estar en otros órganos como el colon, recto, vesícula biliar, páncreas, etc. El pronóstico de las pacientes con este tipo de tumor metastásico es malo, y la gran mayoría fallecen dentro del primer año de evolución. Hay casos raros que pueden sobrevivir varios años (26).
REFERENCIAS
1. Kim SH, Kim WH, Park KJ, Lee JK, Kim JS. CT and MR findings of Krukenberg tumors: comparison with primary ovarian tumors. J Comput Assist Tomogr 1996; 20(3): 393-8. [ Links ]
2. Tavassoli FA, Devilee P (editors). WHO Classification Tumors of the Breast and Female Genital Organs. Lyon: IARC Press; 2003. [ Links ]
3. Irving JA, Lerwill MF, Young RH. Gastrointestinal stromal tumors metastatic to the ovary: a report of five cases. Am J Surg Pathol 2005; 29(7): 920-6. [ Links ]
4. Lash RH, Hart WR. Intestinal adenocarcinomas metastatic to the ovaries: a clinicopathologic evaluation of 22 cases. Am J Surg Pathol 1987; 11(2): 114-21. [ Links ]
5. Mccluggage W, Wilkinson N. Metastatic neoplasms involving the ovary: a review with an emphasis on morphological and immunohistochemical features. Histopathology 2005; 47(3): 231-47. [ Links ]
6. Al-Agha OM, Nicastri AD. An in-depth look at Krukenberg tumor: an overview. Arch Pathol Lab Med 2006; 130(11): 1725-30. [ Links ]
7. Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002. CA Cancer J Clin 2005; 55(2): 74-108. [ Links ]
8. Krukenberg F. Ueber das fibrosarcoma ovarii mucocellulare (carcinomatodes). Arch Gynaecol Obstet 1896; 50(2): 287-321. [ Links ]
9. Woodruff JD, Novak ER. The Krukenberg tumor: study of 48 cases from the ovarian tumor registry. Obstet Gynecol 1960; 15: 351-60. [ Links ]
10. Yakushiji M, Tazaki T, Nishimura H, Kato T. Krukenberg tumors of the ovary: a clinicopathologic analysis of 112 cases. Acta Obstet Gynaecol Jpn 1987; 39(3): 479-85. [ Links ]
11. Hale RW. Krukenberg tumor of the ovaries. A review of 81 records. Obstet Gynecol 1968; 32(2): 221-5. [ Links ]
12. Israel SL, Helsel EV Jr, Hausman DH. The challenge of metastatic ovarian carcinoma. Am J Obstet Gynecol 1965; 93(8): 1094-101. [ Links ]
13. Kakushima N, Kamoshida T, Hirai S, Hotta S, Hirayama T, Yamada J, et al. Early gastric cancer with Krukenberg tumor and review of cases of intramucosal gastric cancers with Krukenberg tumor. J Gastroenterol 2003; 38(12): 1176-80. [ Links ]
14. Kim NK, Kim HK, Park BJ, Kim MS, Kim YI, Heo DS, et al. Risk factors for ovarian metastasis following curative resection of gastric adenocarcinoma. Cancer 1999; 85(7): 1490-9. [ Links ]
15. de Palma P, Wronski M, Bifernino V, Bovani I. Krukenberg tumor in pregnancy with virilization. A case report. Eur J Gynaecol Oncol 1995; 16(1): 59-64. [ Links ]
16. Cetin B, Aslan S, Akinci M, Atalay C, Cetin A. A long surviving case of Pseudomeigs' syndrome caused by Krukenberg tumor of the stomach. Jpn J Clin Oncol 2005; 35(4): 221-3. [ Links ]
17. Sugimoto Y, Endo K, Sakahara H, Nakajima K, Abe M, Torizuka K, et al. Sequential measurement of serum CA 125 levels in Krukenberg's tumor. Gan No Rinsho 1985; 31(15): 1893-7. [ Links ]
18. Kikkawa F, Shibata K, Ino K, Nomura S, Kajiyama H, Suzuki T, et al. Preoperative findings in non-gynecologic carcinomas metastasizing to the ovaries. Gynecol Obstet Invest 2002; 54(4): 221-7. [ Links ]
19. Park SY, Kim HS, Hong EK, Kim WH. Expression of cytokeratins 7 and 20 in primary carcinomas of the stomach and colorectum and their value in the differential diagnosis of metastatic carcinomas to the ovary. Hum Pathol 2002; 33(11): 1078-85. [ Links ]
20. Yook JH, Oh ST, Kim BS. Clinical prognostic factors for ovarian metastasis in women with gastric cancer. Hepatogastroenterology 2007; 54(75): 955-9. [ Links ]
21. Cheong JH, Hyung WJ, Chen J, Kim J, Choi SH, Noh SH. Survival benefit of metastasectomy for Krukenberg tumors from gastric cancer. Gynecol Oncol 2004; 94(2): 477-82. [ Links ]
22. Taylor AE, Nicolson VM, Cunningham D. Ovarian metastases from primary gastrointestinal malignancies: the Royal Marsden Hospital experience and implications for adjuvant treatment. Br J Cancer 1995; 71(1): 92-6. [ Links ]
23. Mori T, Fujiwara Y, Yano M, Tamura S, Yasuda T, Takiguchi S, et al. Prevention of peritoneal metastasis of human gastric cancer cells in nude mice by S-1, a novel oral derivative of 5-Fluorouracil. Oncology 2003; 64(2): 176-82. [ Links ]
24. Gretschel S, Siegel R, Estévez-Schwarz L, Hünerbein M, Schneider U, Schlag PM. Surgical strategies for gastric cancer with synchronous peritoneal carcinomatosis. Br J Surg 2006; 93(12): 1530-5. [ Links ]
25. Yonemura Y, Bando E, Kawamura T, Ito H, Endo Y, Miura M, et al. Cytoreduction and intraperitoneal chemotherapy for carcinomatosis from gastric cancer. Cancer Treat Res 2007; 134: 357-73. [ Links ]
26. Xu DZ, Zhan YQ, Sun XW, Cao SM, Geng QR. Meta-analysis of intraperitoneal chemotherapy for gastric cancer. World J Gastroenterol 2004; 10(18): 2727-30. [ Links ]











 text in
text in