Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.27 no.3 Bogotá jul./set. 2012
Enfoque actual en el estudio y tratamiento de los tumores quísticos del páncreas. Corto análisis de las herramientas disponibles en la actualidad
Current approaches to the study and treatment of cystic tumors of the pancreas: A brief analysis of currently available tools
Diego Aponte Martín, MD. (1)
(1) Internista Universidad Javeriana, Gastroenterólogo Universidad Nacional. Coordinador Académico Postgrado Gastroenterología, Fundación Universitaria Sanitas. Bogotá, Colombia
Fecha recibido: 01-08-12 Fecha aceptado: 17-08-12
Es claro que los tumores quísticos del páncreas se han convertido en un tema de gran interés, debido al aumento en su frecuencia de aparición en los últimos años, relacionado con el uso común, además del desarrollo y perfeccionamiento de imágenes radiológicas, como la tomografía axial computarizada (TAC) y la resonancia magnética (RNM), que en la mayoría de ocasiones son realizadas en la investigación de diferentes síntomas digestivos. Como consecuencia, estos quistes surgen, la mayoría de veces, como hallazgos incidentales.
Aunque la prevalencia exacta de las lesiones quísticas pancreáticas no se conoce, esta oscila en diferentes estudios entre 2 y 16% en la investigación de estudios radiológicos, datos corroborados por autopsias con hallazgos del 25%; aproximadamente la mitad de esas lesiones corresponde a neoplasias quísticas del páncreas (NQPs) (1-3).
Dentro del grupo de las neoplasias quísticas pancreáticas (NQPs), la proporción varía en las diferentes regiones del mundo, pero es claro que se encuentran algunas más comunes que otras: neoplasias quísticas serosas (NQS) 32-39%, neoplasias quísticas mucinosas (NQM) 10-45%, neoplasias intraductales papilares mucinosas (IPMN) 21-33% y neoplasias sólidas pseudopapilares (NQSP) menos del 10% de todas las NQPs (4).
Las NQPs deben ser diferenciadas unas de otras, ya que claramente varía entre ellas el pronóstico y por consiguiente el seguimiento y el tratamiento; pero muchas veces, esta diferenciación no es fácil, y es por esta razón que se encuentran en la literatura diferentes puntos de vista, sobre cuál debe ser el mejor enfoque diagnóstico y de tratamiento de estas lesiones. Incluso un grupo ha propuesto resección quirúrgica de todas las NQPs en personas en adecuado estado de salud (5, 6) y aunque esta conducta "agresiva", medicamente hablando en mi concepto y el de otros autores, minimizaría el riesgo de pasar por alto lesiones con componente maligno, o evitaría la evolución de algunas lesiones a malignización, muchos sujetos sanos con lesiones benignas serían sometidos a innecesaria morbilidad quirúrgica, que en ocasiones puede ser muy alta, a pesar de los innegables avances en la especialidad de la cirugía. Además, en los últimos años, se ha avanzado de manera importante en varias herramientas, que generan gran certeza y precisión diagnóstica, y ayuda a establecer qué pacientes deben ir a cirugía (5, 7, 10-12).
Para responder cercanamente y en poco espacio a la pregunta sobre cuál debería ser el enfoque actual del estudio y manejo en los tumores quísticos, propongo en este espacio tan importante de la revista, evaluar las siguientes herramientas:
1. Elementos clínicos
2. Imágenes radiológicas
3. Estudios endoscópicos por ultrasonido endoscópico
4. Análisis del fluido del quiste. Para al final dar una recomendación y sugerencia sobre el tratamiento.
ELEMENTOS CLINICOS
En esta herramienta, tiene utilidad la epidemiología, ya que hay diferencias importantes en las edades y los sexos de presentación en los diferentes NQPs.
Una nemotecnia que puede ser útil en el estudio de los NQPs y que se está empleando en varios grupos del mundo es el uso de los parentescos familiares para recordar cada neoplasia a saber:
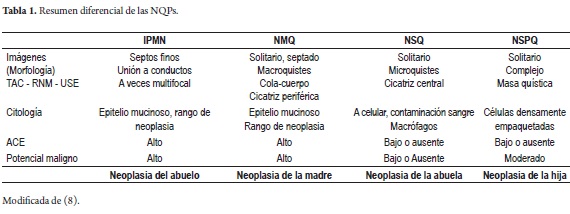
Tumor de la abuela: Corresponde a las NQSs, ya que se presentan principalmente en mujeres de aproximadamente 60 a 70 años, como lesiones benignas; solo se han descrito en el mundo aproximadamente 25 casos de progresión maligna, son solitarias y pueden ser grandes (2).
Tumor de la madre: Corresponde a las NQMs que se presenta principalmente en mujeres con un pico en los 50 años, como lesiones premalignas o malignas, encapsuladas, sin comunicación con el conducto pancreático, y principalmente localizadas en la cola o cuerpo (2).
Tumor de la hija: Corresponden a NQSPs, ya que se presenta principalmente en mujeres jóvenes entre los 20 y 30 años (2).
Tumor del abuelo: Corresponde a las IPMN, ya que su frecuencia es de predominio ligero en los hombres, con pico de presentación aproximado a los 70 años, claramente comunicados al conducto pancreático principal o secundario, pueden ser desde benignos hasta francamente malignos, y se ha visto más frecuentemente estos últimos asociados a un ducto principal mayor de 1 cm o secundario mayor de 3 cm (2).
El 40 a 75% de los tumores quísticos del páncreas son asintomáticos, y son hallazgos incidentales en búsqueda de alguna patología digestiva, y cuando son sintomáticos, la mayoría de veces corresponden a síntomas vagos e inespecíficos, como dolor abdominal, nauseas, o síntomas dispépticos (5), en pacientes con tumores grandes o con componente maligno asociado; puede aparecer pérdida de peso, ictericia, pancreatitis asociada o diabetes (6).
Las pruebas sanguíneas rutinarias sobre evaluación de función hepática, pancreática, renal o hematológica, generalmente son normales o muestran cambios inespecíficos, y antígenos como CA 19,9 y antígeno carcinoembrionario (ACE) en sangre no tienen valor diagnóstico, sin embargo, algunos reportes han mostrado elevación de estos dos antígenos en el 80% de IPMN invasivos, comparados con no invasivos solo en 18% (8).
IMAGENES RADIOLOGICAS
Gran avance han tenido los estudios que perfeccionan la morfología de las NQPs, estas son usadas para describir la localización anatómica, su relación con otros órganos y vasos sanguíneos, y la presencia o ausencia de metástasis, así como la comunicación de la lesión con los conductos pancreáticos. Cada lesión neoplásica tiene sus características específicas como se verá en la tabla 1 (8).
ESTUDIOS ENDOSCOPICOS Y UTILIDAD DEL ESTUDIO DE MATERIAL DEL QUISTE
El ultrasonido endoscópico (USE) tiene cada día más evidencia a favor, que demuestra su utilidad en el perfeccionamiento de la detallada morfología de las NQPs; pero su mayor utilidad y aporte al diagnóstico se encuentra en su utilización como guía de punción con agujas finas (FNA) y obtención de material fluido del quiste para estudios citológicos, en los cuales, con la presencia de citopatólogos expertos dentro de la sala del estudio, se puede dar una aproximación adecuada acerca de la presencia o no de células sugestivas de malignidad, con diferenciación celular que aproxime o descarte uno u otro tipo de quiste. Además, se puede extraer por el mismo método material del quiste, para realizar estudios antigénicos, principalmente (ACE) soportado por los estudios clásicos del doctor Brugge que muestran un punto de corte de 192 ng/ml para diferenciar neoplasias mucinosas de no mucinosas (10) y el análisis de ADN que en estudios muy recientes evidencia que la mutación de K RAS es altamente específica (96%) para quistes mucinosos y valores elevados, con gran amplitud de mutaciones y secuencias específicas son indicadores de malignidad (11, 14).
Actualmente, varios artículos han mostrado la utilidad de imágenes de alta resolución óptica no disponibles en nuestro país, como la tomografía de coherencia óptica, una herramienta que explora las características morfológicas del tejido pancreático, útil en diferenciar neoplasias mucinosas de no mucinosas con 95% de sensibilidad y 95% de especificidad, así como la endomicroscopia confocal con láser, que es una técnica que estudia histología in vivo, con microsondas que llegan al tejido pancreático ayudadas por el USE. Estas nuevas técnicas se convertirán pronto en herramientas clave para la diferenciación de las NQPs (12, 13).
SUGERENCIA DE APROXIMACION AL HALLAZGO DE UN QUISTE DE PANCREAS
Existen varios algoritmos sugeridos para el estudio y manejo de las lesiones quísticas del páncreas, con gran énfasis en el tamaño y morfología de la lesión.
Las siguientes recomendaciones están basadas y modificadas de los diferentes artículos publicados, y lo que considero como mi punto de vista sobre el manejo de los tumores quísticos del páncreas en nuestro país hoy en día.
La intención de la mayoría de los algoritmos es lograr la diferenciación de las lesiones benignas de las malignas o aquellas potencialmente malignas. Una vez descartado el pseudoquiste, estamos muy probablemente ante una NQP, y lo primero a diferenciar, es si estamos ante una benigna neoplasia serosa o ante un quiste con potencial maligno como son las NQMs o una variable IPMN donde debemos evaluar sus características, para definir el riesgo de malignización y definir manejo quirúrgico vs. vigilancia. Para esto debemos acudir a las herramientas analizadas previamente, que obviamente varían dependiendo de las disponibilidades, entrenamiento, experiencia y tecnología con que cuenta cada institución de nuestro país.
Además siempre analizando y evaluando en un ambiente multidisciplinario donde clínicos, endoscopistas y cirujanos evalúen y determinen conjuntamente el mayor beneficio y el menor riesgo para cada paciente (2, 9).
Lesiones pancreáticas sintomáticas
Mayores de 3 cm: Resección quirúrgica.
Lesiones pancreáticas asintomáticas (figura 1)
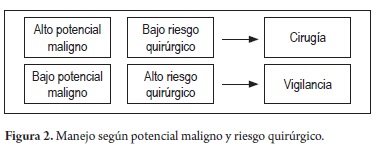
Además es importante definir en general el potencial maligno y el riesgo quirúrgico (figura 2).
Seguimiento de tumores quísticos indeterminados
Una recomendación actual formulada por el doctor Koenraad Mortele, Profesor Asociado de Radiología y Director de la División de Resonancia en Harvard Medical School es la vista en la tabla 2.
Algunas nuevas estrategias terapéuticas han evolucionado al ser posible la inyección de sustancias, como agentes citotóxicos dentro del quiste bajo guía por USE; el primer agente utilizado fue el etanol en diferentes concentraciones (5-80%) en 25 pacientes, sin reporte de complicaciones, 8 pacientes tuvieron resolución completa del quiste, otro ensayo clínico comparado con solución salina reportó disminución del quiste en un 33%. Otros agentes han sido aplicados recientemente, como paclitaxel, hasta ahora los estudios, aún tempranos, son prometedores, sin embargo, se necesitan aun más datos científicos para hacer una recomendación precisa (15, 16).
REFERENCIAS
1. Scheiman JM. Cystic Lesion of the pancreas. Gastroenterology 2005; 128: 263-9.
2. Dewhurst CE, Mortekele KJ. Cystic tumors of the pancreas: imaging and management. Radiol clin North Americ 2012; 50(3): 467-86. Epub 2012 Mar 28.
3. Basturk O, Coban I, Adsay NV. Pancreatics cysts: Pathological classification, differential diagnosis, and clinical implications. Arch Pathol Lab Med 2009; 133: 423-38.
4. Brugge WR, Lawers GY, Sahani D, et al. Cystic neoplasms of the pancreas. Nengl J Med 2004; 351: 1218-26.
5. Aponte Diego. Paciente con quiste pancreático incidental. Rev Col Gastroenterolog 2010; 25(3): 274-280.
6. Horvath KD, Chaboth JA, et al. An aggressive resectional approach to cystic neoplasms of the pancreas. Am J surg 1999; 178(4): 269-74.
7. Sohn TA, Yeo CJ, Cameron JL, et al. Intraductal Papillary mucinous neoplasms of the pancreas: an updated experience, Ann Surg 2004; 239: 788-97.
8. Fritz S, Hckert T, Hinz U, et al. Role of serum carbohydrate antigen 19,9 and carcinoembryonic antigen in distinguishing between benign and invasive intraductal papillary mucinous neoplasm of the pancreas. Br J Surg 2011; 98: 104-10.
9. Won Jae, Brugge William. Pancreatic Cystic neoplasms: Diagnosis and Management. Gastroenterol Clin N Ame 2012; 41: 103-118.
10. Brugge WR, Lewandroski K, Lee L, et al. Diagnosis of pancreatic cyst neoplasms: a report of the cooperative pancreatic cyst study. Gastroenterology 2004; 126: 1330-6.
11. Khalid A, Zahid M, Finkelstein SD, et al. Pancreatic cyst fluid DNA analysis in evaluating pancreatic cysts: a report of the PANDA Study. Gastrointest Endosc 2009; 69: 1095-102.
12. Iftimia N, Won J, Brugge W. Cystic Lesions of the Pancreas: more reliable differentiation with in situ high resolution optical imaging? Expert Rev Gastroenterol Hepatol 2012; 6(2): 125-127.
13. Konda VJ, Aslanian HR, Wallace MB, et al. First assessment of needle-based confocal laser endomicroscopy during EUS-FNA procedures of the pancreas (with videos). Gastrointest Endosc 2011; 74: 1049-60.
14. Kwon RS. Advances in the diagnosis of cystic neoplasms of the pancreas. Curr Opin Gastroenterol 2012; 28(5): 494-500.
15. De Witt J, Dimaio CJ, Brugge WR. Long Term follow-up of pancreatic cysts that resolve radiologically after EUS-guided ethanol ablation. Gastrointest Endosc 2010; 72: 862-6.
16. Oh HC, Seo DW, Song TJ, et al. Endoscopic ultrasonography-guided ethanol lavage with paclitaxel injection treats patients with pancreatic cysts. Gastroenterology 2011; 140: 172-9.











 texto en
texto en