Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 no.3 Bogotá July/Sept. 2012
Linfoma folicular primario duodenal. Informe de un caso y revisión de la literatura
Primary follicular lymphoma of the duodenum: Case report and literature review
Juan Carlos Hiromi López T., MD (1), María del Pilar Casasbuenas D. MD (2), Jinneth Acosta F., MD (3), Orlando Ricaurte G., MD (3)
(1) Residente cuarto año de Especialidad de Patología Anatómica y Clínica. Departamento de Patología, Facultad de Medicina, Universidad Nacional de Colombia. Bogotá, Colombia.
(2) Médica Gastroenteróloga - Endoscopista Clínica de Marly. Profesora Asistente Facultad de Medicina Universidad del Bosque. Bogotá, Colombia
(3) Médico Patólogo - Profesor Asociado, Departamento de Patología, Grupo de Patología Molecular, Facultad de Medicina - Universidad Nacional de Colombia. Bogotá, Colombia.
Correspondencia: oricaurteg@unal.edu.co
Fecha recibido: 07-03-11 Fecha aceptado: 17-08-12
Resumen
Mujer de 80 años con síntomas dispépticos a quien se le realizó endoscopia de vías digestivas altas que mostró lesiones polipoides confluentes en la segunda porción del duodeno, cuyo estudio histológico indicó un linfoma no Hodgkin B folicular primario, neoplasia duodenal infrecuente de bajo grado, la cual debe diferenciarse de hiperplasia linfoide folicular reactiva y de otros linfomas.
Palabras clave
Lesión polipoide duodenal, linfoma no Hodgkin B primario de tracto digestivo, linfoma duodenal primario, linfoma folicular.
Abstract
Patient was an 80 year old woman with dyspepsia. An upper endoscopy showed confluent polypoid lesions in the second portion of the duodenum. A histological study showed a follicular B-cell lymphoma. This is a rare low grade neoplasm of duodenum which must be differentiated from follicular reactive hyperplasia and other lymphomas.
Keywords
Duodenal polypoid lesion, primary B-cell lymphoma of the digestive tract, primary duodenal lymphoma, follicular lymphoma.
INTRODUCCIÓN
Los linfomas primarios del tracto digestivo son infrecuentes y constituyen un grupo heterogéneo de neoplasias; sus tipos histológicos más frecuentes son el linfoma de la zona marginal o linfoma derivado del tejido linfoide asociado a mucosas (MALT, por sus siglas en inglés) y el linfoma B difuso de célula grande, los cuales predominan en el estómago, constituyendo en conjunto los linfomas extraganglionares más comunes. Con frecuencia significativamente menor en el tubo digestivo se presentan otros linfomas como la poliposis linfomatosa (linfoma del manto), también no Hodgkin B y los linfomas T asociados a enteropatía (1-5). El linfoma folicular primario del tracto gastroinstestinal (LF- PGI), por su parte, es aún más inusual, representando solo 1 a 3,6% de los linfomas no Hodgkin primarios del tracto digestivo (6, 7), una de cuyas localizaciones características es el duodeno. Los diagnósticos diferenciales histológicos del LF- PGI son la hiperplasia linfoide folicular, el compromiso secundario digestivo por linfomas foliculares originados en ganglio linfático, los linfomas primarios del tubo digestivo de la zona marginal derivados de "MALT" y eventualmente la poliposis linfomatosa. A continuación presentamos el caso de una paciente con un linfoma folicular primario del duodeno.
PRESENTACION DEL CASO
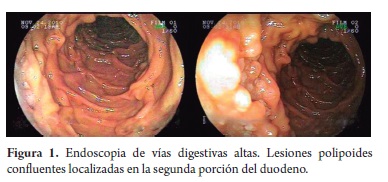
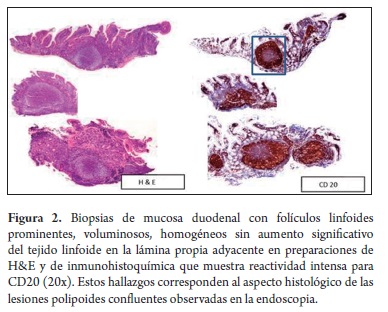
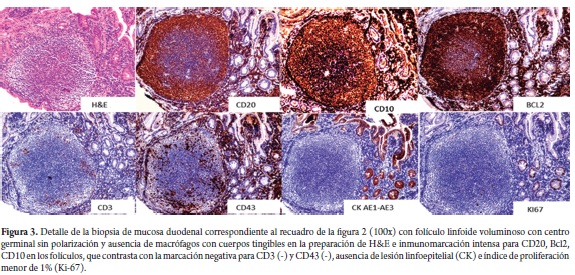
Mujer de 80 años, natural y procedente de Málaga (Santander), quien consultó por síntomas dispépticos y pérdida de peso no cuantificada, atendida inicialmente en el Hospital de Málaga, donde le practicaron endoscopia de vías digestivas altas, identificando un pólipo antral, cuyo estudio histopatológico demostró un adenoma tubular; una tomografía axial computada (TAC) abdominal no demostró masas, visceromegalias, ni adenopatías a ningún nivel; la radiografía de tórax, el cuadro hemático y la glicemia estuvieron también dentro de límites normales, no identificándose tampoco adenomegalias. Posteriormente, consultó en Bogotá, por la misma sintomatología y fiebre intermitente no cuantificada. El examen físico no mostró hallazgos sobresalientes, no se encontraron adenopatías superficiales, masas ni visceromegalias. Se practicó una nueva endoscopia que mostró lesiones polipoides confluentes localizadas en la segunda porción del duodeno, que desplazaban la ampolla de Váter (figura 1) y hallazgos sugestivos de gastritis crónica, mientras que en el esófago y el bulbo duodenal no se apreciaron alteraciones. Se tomaron biopsias de la lesión duodenal y gástricas, cuyo estudio histológico mostró en el duodeno un infiltrado linfoide atípico de aspecto nodular conformado exclusivamente por folículos linfoides voluminosos, uniformes (figura 2), con centros germinales sin polarización, constituidos predominantemente por linfocitos pequeños hendidos (centrocitos), ocasionales células grandes (centroblastos) en los centros germinales (menos de 5 por campo de 40x), los cuales carecían además de macrófagos con cuerpos tingibles y la lámina propia adyacente no tenía aumento significativo de la población linfoide; tampoco se identificó lesión linfoepitelial. Con base en estos hallazgos se plantearon los diagnósticos diferenciales iniciales de linfoma folicular e hiperplasia linfoide folicular reactiva, para los cuales se realizó estudio de inmunohistoquímica complementario (figuras 2 y 3) que mostró reactividad para CD20, Bcl 2 y CD10 en los elementos celulares de los folículos, mientras que la marcación para CD3 y CD43 estuvo restringida a linfocitos T reactivos dispersos de aspecto maduro, localizados predominantemente en la lámina propia de la vecindad de los folículos y no se demostraron lesiones linfoepiteliales con citoqueratina AE1/AE3; el índice de proliferación celular determinado con Ki-67 fue menor de 1%. La marcación de los linfocitos de los folículos y el bajo índice de proliferación celular son característicos de los linfomas no Hodgkin B foliculares y excluyen la hiperplasia folicular reactiva, mientras que la ausencia de adenopatías superficiales e intrabdominales y torácicas en el examen físico y en los estudios de extensión (TAC abdominal, radiografía de tórax) indican el carácter primario duodenal y excluyen el compromiso digestivo secundario a partir de una neoplasia linfoide ganglionar. El estudio de las biopsias gástricas mostró una gastritis crónica activa antral no atrófica moderada asociada a infección por Helicobacter pylori, para la cual recibió tratamiento triconjugado de erradicación con mejoría de sus síntomas dispépticos; los síntomas constitucionales remitieron espontáneamente.
DISCUSIÓN
El tejido linfoide del tracto gastrointestinal (TGI) es el componente más extenso del tejido linfoide asociado a mucosas (MALT), se localiza en la lámina propia y la submucosa, su densidad varía en los diferentes segmentos y en cualquiera de ellos pueden presentarse neoplasias linfoides primarias o compromiso secundario a partir de linfomas provenientes de grupos ganglionares vecinos (1, 2, 4, 5). Se han identificado diferentes factores de riesgo para el desarrollo de linfomas gastrointestinales, entre los cuales se destacan la infección por Helicobacter pylori, la inmunosupresión después de trasplantes de órganos sólidos, las enfermedades celíaca e inflamatoria intestinal y la infección por el virus de inmunodeficiencia humana (8).
Los linfomas primarios del TGI son neoplasias inusuales, aunque corresponden a la localización extraganglionar más frecuente de los linfomas no Hodgkin, representando aproximadamente el 30% de estos; comprometen con mayor frecuencia el estómago, aunque en menor medida pueden afectar cualquier segmento desde el esófago hasta el recto (1- 5, 8, 9).
El compromiso secundario del TGI por neoplasias hematolinfoides ganglionares es frecuente en estados avanzados y suele caracterizarse por compromiso multifocal afectando varios segmentos, por su diseminación a partir de ganglios linfáticos mesentéricos y retroperitoneales comprometidos; en contraste, los linfomas primarios por lo general comprometen un segmento único del TGI. Los criterios para el diagnóstico de los linfomas primarios gastrointestinales son: ausencia de adenopatías superficiales palpables, estudios radiográficos del tórax y tomográficos abdominales sin adenopatías, recuento total y diferencial de glóbulos blancos normal, compromiso predominante del segmento de TGI involucrado, en caso de existir compromiso ganglionar estar restringido al grupo de su drenaje linfático y no tener compromiso hepático, ni esplénico (8, 10).
Los tipos histológicos más frecuentes de los linfomas primarios del TGI son el linfoma de la zona marginal asociado a MALT, que representa hasta el 10% de los linfomas B y hasta el 50% de los linfomas gástricos y el linfoma B difuso de célula grande, que corresponde hasta el 60% de los linfomas gástricos, el cual puede ser secundario a la transformación de un linfoma de la zona marginal o presentarse de novo, el linfoma del manto o poliposis linfomatosa que representa hasta 30% de linfomas primarios del TGI y cuya presentación a diferencia de los anteriores suele ser multifocal; con menor frecuencia se presentan los linfomas B folicular y de Burkitt, los linfomas T asociados a enteropatía e intestinal monomórfico CD56+ y excepcionalmente el linfoma de Hodgkin (1-5).
El linfoma folicular (LF) ganglionar es uno de los tipos de linfoma no-Hodgkin (LNH) más frecuente; la mayoría de casos de LF se detectan inicialmente en los ganglios linfáticos y el compromiso visceral es secundario por diseminación a partir de los diferentes grupos ganglionares comprometidos, tiene un curso indolente y por ello, habitualmente se diagnostica en etapas avanzadas (estados III o IV) (3, 6), mientras que el LF primario duodenal, descrito por primera vez en 1997 (11) es una neoplasia muy infrecuente que representa únicamente entre 1 y 3,6% de todos los linfomas primarios del TGI (4, 6, 7); hasta 2010 se habían informado 249 casos en la literatura anglosajona, cerca de 50% en Japón, posiblemente por la mayor frecuencia de estudios endoscópicos realizados en ese país (6, 7). Sus diagnósticos diferenciales endoscópicos corresponden a pólipos epiteliales y eventualmente a la poliposis linfomatosa (linfoma no Hodgkin B del manto), mientras que los histológicos incluyen hiperplasia linfoide folicular reactiva, el compromiso secundario por linfoma folicular ganglionar y los linfomas gastrointestinales primarios de la zona marginal cuando se acompañan de folículos linfoides reactivos prominentes y el linfoma del manto (poliposis linfomatosa), aunque estos son también infrecuentes en el duodeno.
La edad promedio de los pacientes con LF-PGI es de 56 años con un rango entre 26 y 81 años con predominio en el género femenino; la mayoría de pacientes (43%) son asintomáticos, hasta 10% presenta síntomas gastrointestinales vagos y su diagnóstico es incidental en endoscopias efectuadas por otras razones; otros síntomas informados incluyen dolor abdominal (28%), nauseas y vómito (8%) y sangrado digestivo (6%). En el 66% de los casos la enfermedad se encuentra en estado I en el momento del diagnóstico y en el 27% en estado II, aspecto similar al observado en otros linfomas foliculares extraganglionares como los cutáneos primarios (4, 6-8, 12).
Los LF-PGI generalmente son unifocales, aunque con el creciente uso de la enteroscopia y la videocápsula se han informado algunos casos con compromiso multifocal de segmentos distales del intestino delgado; el sitio más frecuentemente comprometido es la segunda porción del duodeno en vecindad de la ampolla de Váter, como en este caso, seguido por el íleon terminal, el estómago y con menor frecuencia el colon y el recto; el aspecto endoscópico del LF-PGI se caracteriza por lesiones polipoides blanquecinas confluentes o nodulares dispersas de hasta 2 mm de diámetro, recubiertas casi siempre por mucosa de aspecto normal por su localización subepitelial o submucosa y por su lento crecimiento usualmente no se asocia a ulceración (4, 6-8).
Los hallazgos histopatológicos del LF-PGI son similares a los de LF originados en ganglios linfáticos, caracterizados por un patrón de crecimiento nodular o menos frecuentemente nodular y difuso, compuesto por folículos voluminosos homogéneos con centros germinales sin polarización, constituidos por dos clases de células, la mayoría pequeñas de contornos nucleares irregulares y citoplasma inconspicuo (centrocitos) y en menor proporción por células grandes de núcleos vesiculosos con cromatina laxa, nucléolos prominentes y citoplasma aparente (centroblastos), cuya proporción por campo de 40x determina el grado histológico del tumor (grado 1: 0-5, grado 2: 6-15, grado 3: más de 15); su índice de proliferación es bajo por tratarse de neoplasias de curso indolente y característicamente carecen de macrófagos con cuerpos tingibles, que confieren el patrón de cielo estrellado de los centros germinales de los folículos reactivos, propios de las hiperplasias foliculares, o que en algunos casos acompañan los linfomas de la zona marginal, con los cuales en ocasiones debe establecerse el diagnóstico diferencial; en la mayoría de casos de LF-PGI las células tumorales no infiltran las estructuras glandulares, no presentándose por ello las lesiones linfoepiteliales características del linfoma de la zona marginal (4, 6-8).
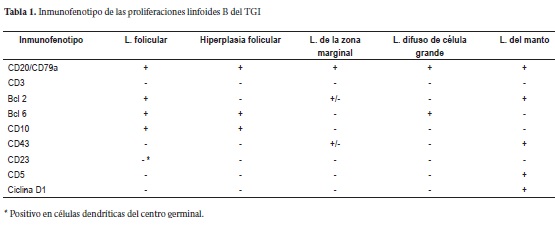
El inmunofenotipo de las células tumorales de los LF-PGI se caracteriza por la expresión de marcadores pan-B (CD19, CD20, CD22 y CD 79a, entre otros) y son negativas para CD43 que se expresa en una proporción significativa de linfomas de la zona marginal y CD5 y ciclina D1 que identifican los linfomas del manto; el 90% de los LF-PGI presentan marcación para CD10 y Bcl-2, en los centros germinales, marcadores útiles para su diferenciación de hiperplasia reactiva folicular, linfomas del manto y de la zona marginal derivados de MALT. En la tabla 1 se comparan los inmunofenotipos del LF- PGI con los de las hiperplasias foliculares reactivas y de otros linfomas B no Hodgkin del tracto digestivo (4, 6-8).
Entre 70 y 95% de los LF ganglionares presentan la translocación t(14;18) (q32;q21) que causa la fusión del gene Bcl-2 con el gene de la cadena pesada de las inmunoglobulinas (IgH), translocación que también ha sido descrita en los LF-PGI, pero que está ausente en los LF primarios de la piel, aspecto que sugiere más relación entre el LF-PGI y el LF ganglionar que con el cutáneo (4). Sin embargo los LF originados en el duodeno carecen de expresión de actividad de citidina deaminasa, enzima que participa en la inducción de recombinación e hipermutación somática, responsables de los patrones de redes de células dendríticas característicos de los linfomas foliculares ganglionares (13, 14); algunos casos de LF-PGI comparten rasgos genotípicos y moleculares con el linfoma de la zona marginal, entre los cuales se destaca la restricción del gene de la cadena pesada de inmunoglobulina a las regiones VH4 y VH5, aspecto relacionado con su posible desarrollo a partir de linfocitos B sujetos a un estímulo antigénico persistente, de forma similar al proceso que ocurre con el linfoma gástrico de la zona marginal y su asociación con el estímulo antigénico persistente debido a la infección por H. pylori (14); esta asociación patogénica se ha corroborado también con informes de regresión de algunos casos de LF-PGI después de terapia antibiótica para erradicación de H. pylori (15). Todas estas características indican que el LF- PGI es una entidad nosológica específica diferente de los otros linfomas mencionados.
Existen diferentes modalidades de tratamiento para los linfomas no Hodgkin, cuya selección depende del tipo, grado histológico y del estado clínico en que se diagnostiquen; para el LF-PGI, cuya sobrevida fluctúa entre 10 y 16 años, los esquemas de tratamiento deben personalizarse de acuerdo con las características particulares de cada paciente; a continuación se relacionan las opciones de manejo del LF-PGI (12), de acuerdo con las recomendaciones del British National Lymphoma Investigation - 2003 (16):
Manejo expectante: observación sin iniciar tratamiento, realizado en los pacientes con enfermedad local sin evidencia de diseminación y que no presenten prurito, pérdida de peso, fiebre mayor de 38,5 °C, sudoración nocturna, rápida progresión de la enfermedad, compromiso de órganos vitales, y de la médula ósea, lesiones óseas, infiltración renal y compromiso macroscópico del hígado.
Tratamiento específico para pacientes con evidencia de progresión de la enfermedad, quienes presenten los hallazgos mencionados y para quienes están disponibles las siguientes opciones:
Radioterapia para control local; el LF-PGI es altamente sensible a la radiación.
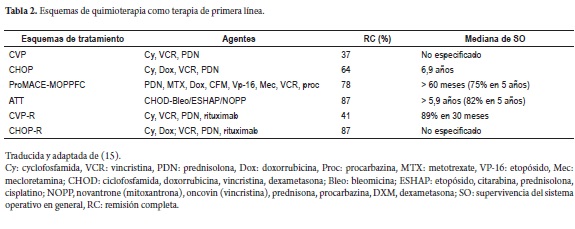
Quimioterapia: los esquemas CVP y CHOP entre otros, han demostrado ser altamente efectivos (tabla 2).
Terapia biológica con interferón y Rituximab –anticuerpo monoclonal humanizado anti-CD20–.
Radioinmunoterapia: administración sistémica de anticuerpos monoclonales (anti-CD20), conjugados con un radioisótopo, que permite dirigir la radioterapia específicamente contra las células tumorales.
CONCLUSIÓN
Se presentó el caso de una paciente adulta mayor con un linfoma folicular primario duodenal, neoplasia infrecuente, de bajo grado, habitualmente diagnosticada incidentalmente en estados tempranos, por ello de buen pronóstico y cuyo aspecto endoscópico polipoide plantea diagnóstico diferencial con lesiones epiteliales y poliposis linfomatosa, entidades más frecuentes; su diagnóstico específico se establece por estudios histológico e inmunohistoquímico, excluyendo hiperplasia linfoide folicular reactiva y linfomas B, dentro de los cuales se destacan el compromiso gastrointestinal secundario por linfoma folicular ganglionar, el cual se presenta en estados avanzados, caracterizados además por adenopatías superficiales y toracoabdominales y los linfomas de la zona marginal y del manto (poliposis linfomatosa) primarios del tubo digestivo, también inusuales en el duodeno y cuyo comportamiento biológico y tratamiento difieren.
REFERENCIAS
1. Isaacson PG, Wright DH. Malignant lymphoma of mucosa associated lymphoid tissue. A distinctive type of B-cell lymphoma. Cancer 1983; 52: 1410-1416. [ Links ]
2. Wotherspoon AC, Ortiz-Hidalgo C, Falzon M, et al. Helicobacter pylori–associated gastritis and primary B-cell gastric lymphoma. Lancet 1991; 338: 1175-1176. [ Links ]
3. Harris NL, Swerdlow SH, Jaffe ES, Olt G, Nathwani BN, de Jong D, Yoshino T, Spagnolo D. Follicular lymphoma in: Swerdlow SH, Campo E, Harris NL, Jaffe ES, Pireli S, Stein H, Thiele J, Vardiman J. WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. 4th Edition. International Agency for Research on Cancer: Lyon-France; 2008. p. 220-228. [ Links ]
4. Nakamura S, Müller- Hermelink HK, Delabie J, Ko YH, Jaffe ES. B cell lymphoma of the small intestine in: Bosman FT, Carneiro F, Hruban RH, Theise DT. WHO Classification of Tumours of the digestive system. 4th Edition. International Agency for Research on Cancer: Lyon-France; 2010. p. 69-73. [ Links ]
5. Nakamura S, Müller- Hermelink HK, Delabie J, Ko YH, van Krieken JH, Jaffe ES. Lymphoma of the stomach in: Bosman FT, Carneiro F, Hruban RH, Theise DT. WHO Classification of Tumours of the digestive system 4th Edition, 2010. International Agency for Research on Cancer: Lyon-France; 2010. p. 108-111. [ Links ]
6. Yamamoto S, Nakase H, Yamashita K, Matsuura M, Takada M, Kawanami C, Chiba T. Gastrointestinal follicular lymphoma: review of the literature. J Gastroenterol 2010; 45: 370-388. [ Links ]
7. Yoshino T, Miyake K, Ichimura K, Mannami T, Ohara N, Hamazaki S, et al. Increased incidence of follicular lymphoma in the duodenum. Am J Surg Pathol 2000; 24: 688-93. [ Links ]
8. Ghai S, Pattison J, Ghai S, O'Malley ME, Khalili K, Stephens M. Primary Gastrointestinal Lymphoma: Spectrum of Imaging Findings with Pathologic Correlation. RadioGraphics 2007; 27: 1371-1388. [ Links ]
9. López R, Andrade R. Tejido linfoide y linfomas gástricos. Rev Col Gastroenterol 2010; 4: 409-421. [ Links ]
10. Dawson IM, Cornes JS, Morson BC. Primary malignant tumors of the intestinal tract. Br J Surg 1961; 49: 80-89. [ Links ]
11. Misdraji J, Fernandez del Castillo C, Ferry JA. Follicle center lymphoma of the ampulla of Vater presenting with jaundice: report of a case. Am J Surg Pathol 1997; 21: 484-8. [ Links ]
12. Sentani K, Maeshima AM, Nomoto J, Maruyama D, Kim S-M, Watanabe T, Kobayashi Y, Tobinai K, Matsuno Y. Follicular Lymphoma of the Duodenum: A Clinicopathologic Analysis of 26 Cases. Jpn J Clin Oncol 2008; 38(8): 547-552. [ Links ]
13. Goodlad JR, MacPherson S, Jackson R, Batstone P, White J. Extranodal follicular lymphoma: a clinicopathological and genetic analysis of 15 cases arising at non-cutaneous extranodal sites. Histopathology 2004; 44: 268-76. [ Links ]
14. Takata K, Sato Y, Nakamura N, Kikuti YY, Ichimura K, Tanaka T, Morito T, Tamura M, Oka T, Kondo E, Okada H, Tari A, Yoshino T. Duodenal and nodal follicular lymphomas are distinct: the former lacks activation-induced cytidine deaminase and follicular dendritic cells despite ongoing somatic hypermutations. Modern Pathology 2009; 22: 940-949. [ Links ]
15. Toyoda H, Yamaguchi M, Nakamura S, Nakamura T, Kimura M, Suzuki H, et al. Regression of primary lymphoma of the ampulla of Vater after eradication of Helicobacter pylori. Gastrointest Endosc 2001; 54: 92-6. [ Links ]
16. Rohatiner AZ, Davies A, Montoto S, Lister TA. Follicular Lymphoma (Chapter 19) in: The lymphomas. Second edition. Elsevier Inc; 2006. p. 348-365. [ Links ]











 text in
text in