Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 supl.1 Bogotá Sept. 2012
Consenso Colombiano de Enfermedad Inflamatoria Intestinal
Editores del Consenso
Albis Cecilia Hani, MD,(1) María Teresa Galiano, MD,² Rosario Albis, MD,(3) Juan Ricardo Márquez, MD,(4) Fabián Juliao, MD.(5
Autores del Consenso
Diego Aguirre, MD,(6) Paulo Emilio Archila, MD,(7) Javier Carrera, MD,(8) Rodrigo Castaño, MD,(9) Carlos Mario Escobar, MD,(10) Rafael García Duperly, MD,(11) Sandro Gómez, MD,(12) Gerardo Guzmán, MD,(13), Javier Hernández, MD,(14) Margarita Hernández, MD,(15) Martha Herrán, MD,(16) Emiro Meissel, MD,(17) Marcela Mejía, MD,(18) Belén Mendoza de Molano, MD,(19) Andrés Muñoz, MD,(20) William Otero, MD,(21) Luis Fernando Pineda, MD,(22) Juan Darío Puerta, MD,(23) José Ignacio Restrepo, MD,(24) Gustavo Reyes, MD,(25) Alberto Rodríguez, MD,(26) Elmer Ruiz, MD,(27) José Fernando Vera, MD,(28) Julio Zuleta, MD.(29
(1) Gastroenteróloga. Jefe Servicio de Gastroenterología, Hospital San Ignacio. Jefe Programa Gastroenterología y Endoscopia Digestiva, Pontificia Universidad Javeriana. Bogotá, Colombia.
(2) Cirujana, Gastroenteróloga. Clínica de Marly. Presidente Asociación Colombiana de Gastroenterología. Bogotá, Colombia.
(3) Gastroenteróloga, Epidemióloga Clínica Reina Sofía. Bogotá, Colombia.
(4) Cirujano Coloproctólogo, Clínica de Las Américas. Medellín, Colombia.
(5) Médico Internista y Gastroenterólogo. Profesor Universidad de Antioquia y Pontificia Universidad Bolivariana Gastroenterología Clínica y Endoscopia Digestiva. Hospital Pablo Tobón Uribe.
Autores Consenso
(6) Radiólogo Institucional. Jefe del Departamento de Radiología e Imágenes Diagnósticas Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(7) Internista. Gastroenterólogo adscrito a la Clínica del Country. Bogotá, Colombia.
(8) Cirujano Colorectal. Fundación Santa Fe de Bogotá – Hospital Militar Central. Bogotá, Colombia.
(9) Grupo de Gastrohepatología, Universidad de Antioquia, Cirugía Gastrointestinal y Endoscopia, Hospital Pablo Tobón Uribe. Medellín, Colombia.
(10) Médico Gastroenterólogo, Clínica de Las Américas. Medellín, Colombia.
(11) Cirujano Coloproctólogo, Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(12) Médico Nutriólogo, Instituto Antioqueño de Diabetes, Metabolismo y Nutrición. Medellín, Colombia.
(13) Médico Gastroenterólogo, Clínica Farallones de Cali y Centro Médico Imbanaco. Cali, Valle.
(14) Médico Especialista en Medicina Interna, Gastroenterología y Endoscopia Digestiva. Maestría en Epidemiología Clínica. Santa Marta, Colombia.
(15) Médica, Gastroenteróloga. Hospital Universitario San Ignacio, Pontificia Universidad Javeriana. Bogotá, Colombia.
(16) Especialista en Gastroenterología y Endoscopia Digestiva, Universidad Pontificia Javeriana, Gastroenteróloga Hospital Federico Lleras Acosta y Clínica Medicadiz. Ibagué, Colombia.
(17) Médico Gastroenterólogo, Centro de Especialistas de Risaralda, Gastroclínicos SAS. Ips. Pereira, Colombia.
(18) Patóloga Oncológica Fundación Santa Fe de Bogotá, Bogotá, Colombia.
(19) Internista, Gastroenteróloga, Fundación Santa Fe de Bogotá. Profesora Clínica Universidad de Los Andes. Bogotá, Colombia.
(20) Especialista en Cirugía General y subespecialista en Cirugía Gastrointestinal y Endoscopia Digestiva Alta.Coordinador del Grupo de Gastroenterología y Endoscopia Digestiva de la Clínica del Country. Bogotá, Colombia.
(21) Profesor de Medicina, Unidad de Gastroenterología, Universidad Nacional de Colombia. Gastroenterólogo, Clínica Fundadores y Hospital Fundación San Carlos. Bogotá, Colombia.
(22) Especialista en Gastroenterología, Medicina Interna y Epidemiología. Centro Enfermedades Digestivas. Bogotá, Colombia.
(23) Cirujano General Coloproctólogo. Profesor Cirugía Universidad Pontificia Bolivariana. Clínica Las Américas. Medellín, Colombia.
(24) Médico Coloproctólogo, Hospital Pablo Tobón Uribe. Presidente Asociación Colombiana de Coloproctología. Medellín, Colombia.
(25) Médico Internista Gastroenterólogo, Fundación Santa Fe de Bogotá, Clínica Colombia Colsanitas. Bogotá, Colombia.
(26) Profesor Titular de Medicina Interna y Gastroenterología Pontificia Universidad Javeriana. Gastroenterólogo, Hospital San Ignacio. Bogotá, Colombia.
(27) Médico Internista Gastroenterólogo, Universidad Industrial de Santander. Departamento de Medicina Interna. Instituto de Gastroenterología y Hepatología del Oriente Colombiano. Bucaramanga, Colombia.
(28) Sección de Gastroenterología, Hepatología y Nutrición Pediátrica, Hospital Fundación Santa Fe de Bogotá. Miembro del Comité Editorial de la Revista Colombiana de Gastroenterología. Bogotá, Colombia.
(29) Médico Internista Gastroenterólogo. Hospital Pablo Tabón Uribe. Medellín, Colombia.
INTRODUCCION
La Enfermedad inflamatoria intestinal (EEI) es un término con el que se conocen varias entidades, las dos más importantes: la colitis ulcerativa idiopática (CUI) y la enfermedad de Crohn (EC), cuyo origen es multifactorial y se caracterizan por un fenómeno inflamatorio, crónico, recurrente, con diferentes grados de severidad del tubo digestivo; pero, además con afectación potencial de otros órganos.
En la última década ha habido un renovado interés en dichas entidades, debido a un auge en medicamentos novedosos; a pesar de lo cual estas siguen siendo incurables. Lo anterior asociado a una incidencia creciente de dicha patología en nuestro país nos obliga tanto científica como moralmente a convocar a un panel de expertos para elaborar unos lineamientos básicos en el enfoque y manejo de la EEI.
OBJETIVOS
1. Desarrollar un consenso adaptado a nuestro medio, basado en documentación científica de la mejor calidad disponible para el enfoque diagnóstico y el manejo médico y quirúrgico.
2. Publicar y difundir dichos lineamentos tanto a la comunidad científica como al público en general a través de foros especializados, y medios de comunicación de alta penetración.
3. Elaborar y divulgar el consenso en forma de suplemento de la Revista Colombiana de Gastroenterología, el 8 de diciembre de 2011, en medio del congreso de ACADI (Asociación Colombiana de Asociaciones del Aparato Digestivo); es el mejor homenaje que el panel multidisciplinario de expertos le puede rendir a dicho evento; pero más importante aún es el reconocimiento que se le hace a los pacientes que padecen de dicha patología en nuestro país, quienes en últimas son nuestra razón de ser.
METODOLOGIA
1. Se invitaron médicos especialistas (Clínicos y quirúrgicos), líderes de opinión e industria farmacéutica nacional, cuyo área de interés y de trabajo es la EEI.
2. Se separó y manejó independientemente desde el principio la CUI de la EC. A su vez, se dividió cada entidad por módulos, con base en el método de panel de Delphi, se nombró un coordinador por cada uno de ellos, el cual se encargó de analizar junto con su equipo la literatura, para extraer el nivel de evidencia clínica y así emitir unos conceptos preliminares. Posteriormente, todo el panel de expertos se reunió en varias jornadas y conjuntamente se revisó nuevamente la evidencia clínica y conclusiones de los diferentes módulos homogenizándolas y de una manera concertada se formularon las recomendaciones definitivas.
GLOSARIO DE ABREVIATURAS
ANAS: Anticuerpos antinucleares
ANCA: Anticuerpo anticitoplasma de neutrófilos
ASCA: Anticuerpo antisaccharomyces cerevisiae
AZA: Azatioprina
CCR: Carcinoma colorrectal
CEAM: Cromoendoscopia con azul de metileno
CEP: Colangitis esclerosante primaria
CU: Colitis ulcerativa
EAB: Enteroscopia asistida por balón
EBA: Examen bajo anestesia
EC: Enfermedad de Crohn
EII: Enfermedad inflamatoria intestinal
ENAS: Anticuerpos antinucleares extractables
DALM: Displasia asociada a lesión a masa
ICC: Insuficiencia cardíaca congénita
LNH: Linfoma no hodgkin
RM: Resonancia magnética
TAC: Tomografía axial computarizada
TBC: Tuberculosis
TNF: Factor de necrosis tumoral
US: Ultrasonido
VCE: Videocápsula endoscópica
VIH: Virus de inmunodeficiencia humana
5 ASA: 5-aminosalicilatos
6-MP: 6-mercaptopurina
1. EPIDEMIOLOGIA
1.1. Colitis ulcerativa (CU)
Afirmación 1
La CU es una enfermedad crónica caracterizada por una inflamación de la mucosa limitada al colon; con compromiso del recto en el 95% de los casos. El síntoma cardinal es diarrea sanguinolenta asociado con frecuencia a urgencia y tenesmo rectal; el curso clínico, la mayoría de las veces, es intermitente con exacerbaciones.
La CU es una enfermedad crónica caracterizada por una inflamación difusa de la mucosa colónica que afecta el recto y se extiende proximalmente de manera variable, simétrica y circunferencial a todo el colon (1). El síntoma cardinal es diarrea sanguinolenta asociado con urgencia y tenesmo rectal. El curso clínico es intermitente a exacerbaciones y remisiones (2).
En Estados Unidos se ha calculado una incidencia de 7-12/100.000 habitantes por año. En el Reino Unido la incidencia es de 10-20/100.000 habitantes por año, con una prevalencia de 100-200/100.000. No existen estudios en Colombia de incidencia o prevalencia. La CU se presenta en dos picos de edad, entre los 15 y 30 años y entre los 50 y 70 años. Es más frecuente en caucásicos y judíos ashkenazi con igual proporción entre sexo masculino y femenino, 6% en gemelos y 25% entre familiares, indicando alguna predisposición genética.
En Estados Unidos se ha calculado una incidencia de 7-12/100.000 habitantes/año (3). En el Reino Unido la incidencia es de 10-20/100.000 habitantes/año, con una prevalencia de 100-200/100.000 habitantes (2). En Asia y Suramérica se ha publicado una incidencia de 0,08/100.000 habitantes/año (2). En Colombia contamos con pocos estudios, una serie de casos publicada en 1991 (4) presentó 108 casos de enfermedad inflamatoria intestinal (EII) recolectados durante 22 años, de los cuales 98 correspondían a CU y 10 a EC. En una serie sobre colitis en adultos mayores de una institución de Bogotá (4) la CU fue reportada como la tercera más frecuente (18%) después de la colitis isquémica (30%) y la infecciosa (20%), en último lugar, la EC (2%). Más recientemente, dos estudios (5, 6) realizados en la ciudad de Medellín y Cartagena nos muestran series de 202 y 29 casos respectivamente, estableciendo que la CU es más frecuente que la enfermedad de Crohn en dichas poblaciones.
La CU tiene dos picos de presentación en la vida, entre los 15 y 30 años y entre los 50 y 70 años. Es más frecuente en caucásicos y judíos ashkenazi con igual proporción entre sexo masculino y femenino, 6% en gemelos y 25% entre familiares, indicando alguna predisposición genética (3).
1.2. Enfermedad de Crohn
Afirmación 3
La EC es una enfermedad crónica caracterizada por una inflamación transmural, focal, asimétrica y ocasionalmente granulomatosa que puede afectar cualquier parte del tracto gastrointestinal, y presentar manifestaciones extraintestinales, con inicio a cualquier edad, pero es más común en la segunda y tercera década de la vida.
La EC tiene características patológicas y clínicas especiales dadas por una inflamación transmural, focal, asimétrica y ocasionalmente granulomatosa del tracto gastrointestinal, lo cual permite el desarrollo de complicaciones frecuentes en esta patología como son la fibrosis, estenosis, fístulas y abscesos (7). Puede tener manifestaciones extraintestinales variables y presentarse a cualquier edad, siendo más común en la segunda y tercera década de la vida (7).
Afirmación 4
En Estados Unidos se ha calculado una incidencia de 5-11/100.000 habitantes contabilizándose 480.000 casos nuevos, con una prevalencia de 50/100.000. En el Reino Unido la incidencia es 5-10/100.000 con una prevalencia de 50-100/100.000 habitantes/año. En Asia y Suramérica se ha publicado una incidencia de 0,5/100.000 habitantes/año. No existen datos en Colombia sobre la incidencia y prevalencia.
En Estados Unidos se ha calculado una incidencia de 5-11/100.000 habitantes/año, contabilizándose 480.000 casos con una prevalencia de 50/100.000 (3). En el Reino Unido la incidencia es 5-10/100.000 con una prevalencia de 50-100/100.000 habitantes (3). En Asia y Suramérica se ha publicado una incidencia de 0,5/100.000 habitantes/año (3).
La EC es más frecuente en el sexo masculino con una relación de 1,8:1, con predominio en estratos urbanos altos (3). En nuestro medio la relación hombre: mujer es de 1.2:1 (5).
2. ETIOLOGIA Y FISIOPATOLOGIA
Afirmación 5
La etiología de la EII se desconoce, y su patogenia no es muy bien entendida. El mecanismo más aceptado hace referencia a que en individuos genéticamente susceptibles, un agente disparador genera un desequilibrio entre el sistema inmune intestinal y la flora residente, produciendo una respuesta inflamatoria tanto a nivel local como sistémico.
La etiología de la EII aún se desconoce y su patogenia no es muy bien comprendida. La evidencia disponible sugiere que la infección es el desencadenante ambiental que genera respuesta inflamatoria, la cual, en un huésped susceptible puede ser perpetuada por antígenos microbianos comensales (7). Además, una barrera intestinal defectuosa, determinada genéticamente, puede llevar a aumentar la exposición del sistema inmune intestinal a bacterias luminales y sus antígenos; cualquiera de los dos procesos lleva a una respuesta agresiva de las células T, culminando en daño tisular (9). En conclusión, la EII es el resultado de un desequilibrio entre el sistema inmune intestinal y los patógenos que lo habitan de manera permanente o transitoria, y en donde juega un papel muy importante la susceptibilidad genética de cada individuo (10).
3. MANIFESTACIONES CLINICAS
3.1. Colitis ulcerativa
Afirmación 6
La CU se caracteriza por sintomatología consistente en diarrea con sangre, dolor tipo cólico abdominal, urgencia fecal y tenesmo rectal.
La CU se caracteriza por diarrea sanguinolenta, dolor abdominal tipo cólico, urgencia fecal y tenesmo rectal (11), además de episodios de exacerbación y de remisión. Aproximadamente un 50% de los pacientes presentará exacerbación severa durante el curso de la enfermedad y una menor proporción recidivas frecuentes o enfermedad activa permanente (12); un 20-30% de las pancolitis requerirán en algún momento una colectomía.
3.2. Enfermedad de Crohn
Afirmación 7
La EC tiene manifestaciones clínicas heterogéneas, como dolor abdominal, diarrea, pérdida de peso, anemia, fiebre, anorexia, astenia, obstrucción intestinal, fístulas de predominio perianal y/o abscesos; y manifestaciones extraintestinales.
La EC tiene manifestaciones heterogéneas, que incluyen dolor abdominal, diarrea, pérdida de peso, fiebre y, en algunos casos, complicaciones serias como obstrucción intestinal, fístulas de predominio perianal y/o abscesos (7). Al igual que la CU también se caracteriza por periodos de exacerbación y remisión.
La presentación luminal es crónica recurrente, y solo la mitad de los pacientes entran en remisión (12).
El riesgo de presentar enfermedad fistulizante es del 20 al 40% (13). El curso clínico de las fístulas es variable y depende de su localización y complejidad. Las fístulas perianales complejas suelen no cicatrizar (12).
3.3. DIFERENCIAS CLINICAS ENTRE LA COLITIS ULCERATIVA Y LA ENFERMEDAD DE CROHN
Afirmación 8
Existen diferencias en la presentación clínica entre la CU y la EC.
La EC y la CU tienen patrones de presentación clínica similares, pero existen algunas diferencias que pueden ayudar a su clasificación.
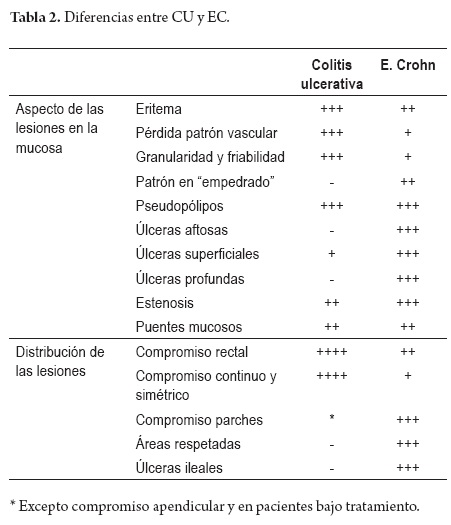
La EC se caracteriza por el compromiso transmural y fistulizante, que puede afectar todo el tracto digestivo y la región perineal (11), a diferencia de la CU donde el compromiso es mucoso, limitado al colon (11). El síntoma cardinal de la CU es la diarrea sanguinolenta, en la EC es más frecuente la diarrea con o sin sangre, asociada a dolor abdominal y disminución de peso (11). Las manifestaciones extraintestinales son más frecuentes en EC especialmente cuando afecta el colon (14).
4. CLASIFICACIONES
4.1. Colitis ulcerativa
Afirmación 9
Para el propósito de este consenso hemos considerado la clasificación de Montreal que define severidad y extensión, y brinda los lineamientos para el tratamiento y el pronóstico.
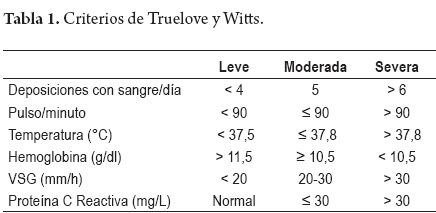
El enfoque diagnóstico, terapéutico y de pronóstico de la CU se debe basar en la severidad y en la extensión de la enfermedad de acuerdo a los criterios de Truelove y Witts (15) (tabla 1), y la clasificación de Montreal (9).
Clasificación de Montreal
Extensión (E)
E1: Proctitis. El compromiso está limitado al recto (distal a la unión rectosigmoidea). La vía de abordaje idealmente es transanal y con supositorios.
E2: Colitis izquierda. El compromiso inflamatorio está limitado a la porción del colon distal al ángulo esplénico. Su manejo inicial se debe hacer con enemas.
E3: Extensa. El compromiso se extiende proximalmente al ángulo esplénico, incluyendo una pancolitis. El manejo de esta presentación se debe hacer por vía oral y/o combinada.
Severidad (S)
S0: Colitis en remisión (Colitis silente): No hay síntomas de la enfermedad.
S1: Colitis leve: Cuatro o menos deposiciones al día con sangre, sin fiebre, leucocitosis, taquicardia, anemia, ni aumento de la VSG.
S2: Colitis moderada: Criterios intermedios entre leve y grave, siempre con signos de afección sistémica leves.
S3: Colitis grave: Seis o más deposiciones diarias con sangre, fiebre, leucocitosis, taquicardia, anemia y aumento de la VSG, a menudo con signos de afección ("toxicidad") sistémica grave.
4.2. Enfermedad de Crohn
Afirmación 10
La clasificación de Montreal define fenotípicamente esta enfermedad. Incorpora la edad de inicio de la enfermedad, su localización y su comportamiento. Todo lo anterior con el fin de dar pautas de enfoque diagnóstico, manejo y pronóstico.
El enfoque diagnóstico, terapéutico y de pronóstico de la EC se debe basar en los segmentos intestinales comprometidos, la severidad en la afectación de estos y la actividad inflamatoria del paciente (9).
Clasificación de Montreal - Enfermedad de Crohn
Edad de diagnóstico:
A1: Menor de 16 años
A2: Entre 17 y 40 años
A3: Mayor de 40 años.
Localización:
L1: Íleon
L2: Colon
L3: Íleon y colon
L4: Digestivo superior aislado.
Comportamiento:B1: No estenosante, ni penetrante (Inflamatorio)
B2: Estenosante
B3: Penetrante (Fistulizante)
P: Enfermedad perineal.
Afirmación 11
El índice de actividad de la EC (CDAI-Crohn disease activity index), se ha diseñado para medir la eficacia de la terapia médica y por eso es la tabla de puntuación más usada en estudios de investigación. Además es útil para medir la severidad de la enfermedad en la práctica clínica.
El índice de actividad de la EC (CDAI) (16), se ha diseñado para medir la eficacia de la terapia médica, seguimiento clínico y evaluación de la severidad de la enfermedad.
El cálculo del índice puede clasificar la actividad según el valor obtenido, como se enumera a continuación:
1. Respuesta: Disminución 100 puntos en el CDAI
2. Remisión: CDAI < 150 puntos
3. Actividad leve: CDAI 151-219 puntos
4. Actividad moderada: CDAI 220-450 puntos
5. Actividad severa: CDAI > 450.
5. DIAGNOSTICO
5.1. Endoscopia en diagnóstico de enfermedad inflamatoria intestinal
Afirmación 12
Pertinencia de la ileocolonoscopia en la EII en las siguientes condiciones:
1. Evaluar la extensión y la actividad de la entidad.
2. Investigar la falta de respuesta a la terapia.
3. Evaluar pacientes con enfermedad aguda severa. En los casos de CU aguda severa se recomienda únicamente realizar rectosigmoidoscopia. Si hay sospecha de megacolon tóxico o perforación de colon está contraindicado cualquier procedimiento endoscópico.
4. En los casos en los cuales los síntomas sugieren complicaciones o neoplasia.
5. Tamizaje de cáncer colorrectal (CCR) después de 10 años de enfermedad en pacientes con pancolitis o después de 15 años en pacientes con colitis izquierda.
6. Evaluación de la bolsa ileal y la anastomosis ileorrectal.
7. Proveer terapia endoscópica en caso de estenosis, sangrado o pólipos.
8. Debe realizarse ileocolonoscopia antes de estudios de intestino delgado para el diagnóstico de la EC.
9. Evaluación endoscópica en pacientes con presentaciones atípicas y/o que no respondan a la terapia convencional.
La colonoscopia, idealmente con ileoscopia y biopsias segmentarias, es el examen de elección para el enfoque diagnóstico de la EII y en el caso concreto de la CU es fundamental para determinar la extensión y el grado de la severidad de la inflamación mucosa (17) ya que esto nos proporciona los lineamientos para planear el tratamiento y ayuda a definir el pronóstico de la enfermedad.
El compromiso colónico característicamente se inicia en el recto y lo afecta de manera simétrica, circunferencial, confluente y ascendente en dirección proximal (18). Tradicionalmente la inflamación mucosa se puede presentar de tres maneras (19):
1. La mucosa es de apariencia granular con pérdida de la brillantez y de la vasculatura submucosa, congestión, edema, friabilidad, sangrado y secreción mucopurulenta.
2. Erosiones múltiples difusamente distribuidas y úlceras en medio de inflamación mucosa. Encontrar úlceras profundas es un signo de mal pronóstico.
3. Inflamación crónica caracterizada por atrofia mucosa con neovasculatura, telangiectasias, sinequias, pseudopólipos, acartonamiento mucoso y rigidez de las haustras.
En caso de colitis aguda severa es preferible una sigmoidoscopia con baja insuflación, dado el mayor riesgo de perforación, toma de biopsias para determinar la histología y diferir una colonoscopia total (18).
Una colonoscopia de vigilancia se debe realizar a todo paciente que lleve de 8 a 10 años con CU extensa, y repetirse cada 2 años hasta los 20 años de la enfermedad y luego, anualmente. Se deben tomar al menos 33 biopsias en total de los seis segmentos del colon (ciego, colon ascendente, transverso, descendente, sigmoide y recto) para poder alcanzar una sensibilidad de 90%-95%. Se recomienda tomar 4 biopsias aleatorias cada 10 cm, y biopsias dirigidas a lesiones sospechosas (11). El uso de la cromoendoscopia aumenta la sensibilidad en la toma de las biopsias (11). En pacientes con colitis izquierdas o proctitis la vigilancia endoscópica se debe iniciar a los 15 años de la enfermedad (20).
Afirmación 13
Existen diferencias endoscópicas entre EC y CU.
Es importante conocer los hallazgos endoscópicos que permiten diferenciar entre la CU y EC (tabla 2).
Afirmación 14
Existen diferencias endoscópicas entre enfermedades infecciosas intestinales y EII.
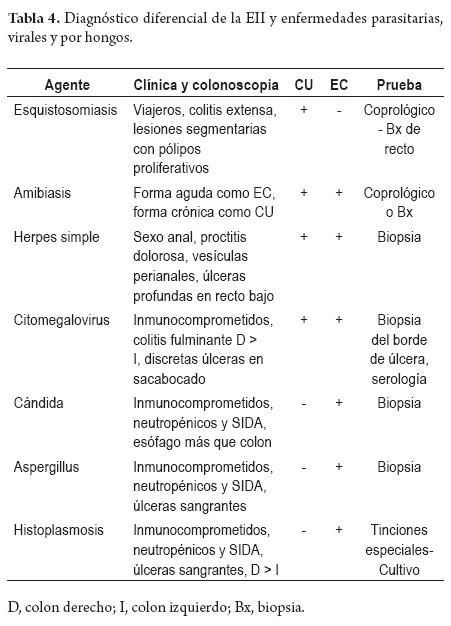
Las enfermedades infecciosas cobran una mayor importancia en nuestro país, como parte del diagnóstico diferencial de EII, teniendo en cuenta nuestra alta prevalencia de enfermedades tropicales. Las tablas 3 y 4 presentan las principales características clínicas y endoscópicas de algunos de los procesos infecciosos, virales, bacterianos y micóticos más comunes.
5.2. Endoscopia en enfermedad de Crohn
Afirmación 15
La evaluación del íleon en el paciente con la sospecha de EC es importante.
Siempre que se sospeche el diagnóstico de EC, se debe hacer una colonoscopia con intubación ileal (21), debido a la alta frecuencia de su compromiso. Endoscópicamente se encuentra mucosa asimétrica con úlceras lineales, serpentiginosas, profundas con afectación transmural, discontinuas espaciadas por mucosa normal (21). El compromiso es segmentario pudiendo acompañarse con estenosis (22).
Afirmación 16
Los estudios endoscópicos en la evaluación de los pacientes con EC son importantes.
La endoscopia digestiva alta y la ileocolonoscopia son una herramienta diagnóstica y terapéutica en la EC.
El diagnóstico se basa en una combinación de presentación clínica, radiología, histología, serología y hallazgos quirúrgicos; la ileocolonoscopia con múltiples biopsias está claramente indicada como el procedimiento de primera línea para el diagnóstico (11).
Afirmación 17
La ileocolonoscopia es importante para evaluar recurrencia postoperatoria de la EC, usando el puntaje endoscópico de Rutgeerts (tabla 5).
La apariencia endoscópica de la anastomosis ileocolónica 6 meses después de la cirugía puede ser utilizada para identificar los pacientes con alto riesgo de reestenosis (23), lo que ayuda a identificar a aquellos que podrían beneficiarse de una terapia más temprana (24).
Los puntajes endoscópicos de 0 a 1 predicen un bajo riesgo de recurrencia de enfermedad sintomática en los años subsiguientes, mientras que puntajes más altos están asociados con un riesgo alto de complicaciones (24). Aunque no existe suficiente evidencia, se cree que una evaluación temprana y un tratamiento apropiado pueden prevenir la recurrencia sintomática y la necesidad de intervenciones quirúrgicas (24).
Afirmación 18
Se debe hacer vigilancia endoscópica para cáncer en pacientes con EC.
Como consecuencia de la inflamación crónica los pacientes con CU y colitis por EC, tienen un riesgo aumentado de carcinoma colorrectal (CCR) (12).
La duración y la extensión de la enfermedad son dos de los más importantes factores que afectan el riego individual de desarrollar CCR y son los principales determinantes de cuándo se debe iniciar el tamizaje (25). El inicio de la colitis por EC es silente y es común un diagnóstico tardío.
La literatura recomienda realizar la primera colonoscopia de vigilancia después de 8 a 10 años de duración de la enfermedad (26). Pacientes con proctitis y proctosigmoiditis no han mostrado riesgo aumentado de CCR, y no se recomienda el tamizaje de rutina (26).
Otro factor importante que ha incrementado el riesgo de CCR es la coexistencia de colangitis esclerosante primaria (CEP), una historia familiar de CCR, y posiblemente el grado de inflamación observado en la biopsia (27).
Afirmación 19
Las diferentes técnicas de tinción endoscópicas se pueden utilizar en el diagnóstico de EC, se deben usar para incrementar la sensibilidad de la colonoscopia de vigilancia para displasia.
Un número de técnicas recientes han sido utilizadas en un intento de incrementar la sensibilidad de las colonoscopias de vigilancia para displasia (28). Una de estas, la cromoendoscopia con azul de metileno (CEAM) ha mostrado ser muy promisoria (29). Existe poca investigación sobre la cromoendoscopia con índigo carmín y la colonoscopia fluorescente.
Desafortunadamente, no existe información que compare estas diferentes modalidades diagnósticas. Finalmente, en el contexto de inflamación activa, los cambios reactivos pueden imitar una displasia, y por esta razón, las colonoscopias de vigilancia se realizarán durante periodos de remisión (29). A pesar de esto, hay algunos puntos en los que no existe certeza respecto a la interpretación de la biopsia conduciendo resultados descritos como indefinidos para la displasia. En este contexto es importante que las biopsias sean revisadas por patólogos expertos en tracto gastrointestinal. Las endoscopias se deben repetir en corto periodos de tiempo (por ejemplo cada 3-6 meses) obteniendo múltiples biopsias del área en cuestión. Idealmente, posterior a una resolución completa de la inflamación (28).
Afirmación 20
El papel de la dilatación de la estenosis sintomática en EC solo se debe considerar si la terapia médica no es efectiva.
Diferentes artículos describen la dilatación con balón como una alternativa a la cirugía para las estenosis de la EC (30). Las contraindicaciones incluyen fístulas internas, estenosis largas y úlceras en el sitio de la estenosis. Por la recurrencia sintomática después de un solo procedimiento, múltiples sesiones pueden ser requeridas (30). La perforación es la complicación más frecuente con una tasa de 0%-11% en la mayoría de series reportadas (30).
Afirmación 21
La videocápsula endoscópica (VCE) es útil en pacientes con sospecha de EC.
Debe realizarse ileocolonoscopia antes de realizar VCE para el diagnóstico de la EC (31). Las imágenes radiológicas multicortes seccionales del intestino delgado deben generalmente preceder la VCE (11). La selección de la imagen radiológica depende de la experiencia y la disponibilidad local. La VCE debe ser reservada para los casos en los cuales la ileocolonoscopia más las imágenes radiológicas del intestino delgado no son diagnósticas, pero la sospecha de EC es alta (32). Una VCE normal tiene un alto valor predictivo negativo para el diagnóstico de EC del intestino delgado activa (31).
Afirmación 22
La VCE es útil para evaluar el compromiso no obstructivo de intestino delgado en EC establecida.
El papel de la VCE en los pacientes con EC establecida debe enfocarse en aquellos con síntomas inexplicados cuando las otras investigaciones no son conclusivas, si esto va a cambiar el manejo del paciente (31). Las imágenes radiológicas tienen que preceder la VCE porque pueden identificar potenciales estenosis obstructivas, enfermedad extraluminal, transmural y distribución anatómica de la enfermedad (33).
Afirmación 23
La VCE puede ser utilizada para evaluar la recurrencia postoperatoria que no esté al alcance de la colonoscopia.
La VCE debe considerarse solamente si la ileocolonoscopia está contraindicada o no es exitosa. La VCE puede identificar lesiones en el intestino delgado que no han sido detectadas por la ileocolonoscopia después de resección ileocolónica (31).
Afirmación 24
La enteroscopia tiene indicación en pacientes con sospecha de EC en quienes la ileocolonoscopia y las imágenes convencionales no han sido conclusivas y se requiere diagnóstico histopatológico.
La enteroscopia asistida por balón (EAB) no debe ser el procedimiento de primera línea en la evaluación de la sospecha de la EC del intestino delgado (34). La decisión de cuál procedimiento (VCE o EAB) debe realizarse primero depende de la naturaleza y la localización de la lesión en el intestino delgado, como también de la experiencia y la disponibilidad local (32).
Afirmación 25
La enteroscopia en EC establecida está indicada cuando se requiere toma de biopsias o procedimientos terapéuticos.
La EAB está indicada cuando la visualización endoscópica y las biopsias son necesarias en áreas del intestino delgado inaccesibles a la endoscopia convencional (11). La EAB tiene la posibilidad de intervención terapéutica como dilatación de las estenosis del intestino delgado en la EC, extracción de cuerpos extraños, y tratamiento de las lesiones sangrantes (35).
5.3. Imágenes diagnósticas
Afirmación 26
El aporte de la imagenología es importante para el diagnóstico, seguimiento, pronóstico y detección de complicaciones.
La disponibilidad de modalidades de imágenes multiplanares como la resonancia magnética e imágenes por tomografía permiten no solo una evaluación completa de la pared intestinal (especialmente del intestino delgado) sino también de estructuras extraluminales (36).
El aporte de estas imágenes es esencial para el diagnóstico inicial, la detección de complicaciones como la presencia de estenosis, fístulas, y sospecha de abscesos (37, 38).
A. Ultrasonografía
Afirmación 27
La ecografía transabdominal tiene utilidad en la evaluación y seguimiento de algunos casos específicos de la EC.
La ecografía transabdominal tiene varias ventajas para la evaluación de la EII, entre estas están su disponibilidad rápida, no utilizar radiación ionizante, permitir una evaluación directa de la morfología (engrosamiento de la pared) y de signos clínicos como es el dolor localizado. En manos expertas, la sensibilidad del ultrasonido en EC ha sido reportada tan alta como 80-90% para compromiso del intestino delgado o para diagnóstico de estenosis (38).
B. Estudios imagenológicos de intestino delgado
Afirmación 28
Los estudios de elección para evaluación del intestino delgado en la EC y estructuras por fuera de este son la enterorresonancia y el entero TAC. Se prefiere la resonancia magnética debido a que no tiene riesgo de radiación.
La resonancia magnética y la tomografía axial computarizada (TAC) complementan imágenes convencionales como el tránsito intestinal, y la TAC ofrece una visión más detallada de la mucosa intestinal, las imágenes multicorte permiten la evaluación completa de la pared intestinal y de las estructuras extraluminales por lo cual han ido reemplazando a las imágenes convencionales, también es utilizada para detectar complicaciones (abscesos, estenosis) por fuera de la pared intestinal especialmente en la EC; y muestra una especificidad superior al 90% para detectar zonas de inflamación mientras que la sensibilidad varía entre el 70-80% ya que alteraciones muy pequeñas de la mucosa no son detectadas (40, 41). La resonancia tiene un rendimiento diagnóstico similar a la TAC con la ventaja de no utilizar radiación ionizante en la evaluación de zonas de estenosis, y determinar el grado de compromiso de la enfermedad (42-44).
En resumen, estas modalidades de imágenes son promisorias para identificar el grado y extensión de la inflamación en el colon y en el intestino delgado, detección de complicaciones, y compromiso de estructuras extraluminales, como nodos linfáticos y grasa mesentérica; adicionalmente, tienen valor clínico para el diagnóstico inicial que involucre el intestino delgado y para captar complicaciones por fuera de este.
6. HISTOPATOLOGIA
Afirmación 29
Existen criterios histopatológicos que sugieren el diagnóstico de CU y EC en el material de biopsia.
Afirmación 30
Existen dificultades para diferenciar la CU de la EC en la evaluación histopatológica.
Los hallazgos histopatológicos más característicos de la CU son la distorsión severa de la arquitectura críptica con ramificación de las criptas, disminución de la densidad de las criptas, superficie irregular con arquitectura vellosa, incremento transmucoso del infiltrado inflamatorio de la lámina propia con linfocitos y plasmocitos, infiltrado inflamatorio linfoplasmocitario basal, aplanamiento de la superficie mucosa, metaplasia de Paneth, e infiltrado inflamatorio polimorfonuclear neutrófilo en el epitelio críptico (11).
La EC se caracteriza principalmente por distorsión discontinua de la arquitectura críptica, inflamación discontinua, criptitis focal, y granulomas epitelioides submucosos o no asociados a criptas (11).
Es difícil la diferenciación histológica entre CU y la EC, e incluso, en algunas ocasiones, nunca es posible diferenciarlas (45).
6.1. Vigilancia de displasia en colitis ulcerativa
Afirmación 31
El número óptimo de muestras para el seguimiento de la CU es de al menos 33 biopsias de los diferentes segmentos del colon, y biopsia de las lesiones visibles.
Afirmación 32
Debe clasificarse el grado de displasia en la EII.
Afirmación 33
La correlación interobservador en el diagnóstico de displasia en CU es aceptable. Se requiere de la evaluación por varios patólogos para confirmarla.
El número ideal de biopsias para el seguimiento de la CU es de al menos 33, con biopsias de las lesiones visibles (46).
La mejor clasificación de displasia en la EII es la siguiente: negativo para displasia, indefinido para displasia, positivo para displasia de bajo grado, y positivo para displasia de alto grado (47).
La correlación interobservador en el diagnóstico de displasia en CU es aceptable (κ = 0,41 a 0,43); la correlaciσn entre los extremos diagnósticos es mejor (negativo para displasia y displasia de alto grado) y menor para las categorías indefinido para displasia y displasia de alto grado (48).
6.2. Colitis indeterminada
Afirmación 34
Debemos conocer las características de la colitis no clasificada (indeterminada).
La colitis indeterminada se diagnostica cuando los hallazgos histopatológicos no favorecen CU o EC. No es una entidad nosológica, sino un diagnóstico temporal que representa la imposibilidad de llegar a un diagnóstico definitivo (49). En este escenario es donde tiene mayor utilidad la determinación de marcadores serológicos (49).
Marcadores serológicos y fecales
Afirmación 35
Los marcadores serológicos tienen una modesta sensibilidad en la EII lo que limita su utilidad como un marcador diagnóstico independiente.
En los pacientes con EII se pueden detectar dos tipos de anticuerpos utilizados como marcadores serológicos: el anticuerpo citoplásmico perinuclear antineutrófilo (pANCA) y los anticuerpos anti Saccharomyces cerevisiae (ASCA) (50, 51). En general, ambos marcadores tienen una modesta sensibilidad en el diagnóstico en EII (40-70%), lo que limita su utilidad como un marcador diagnóstico independiente. Nuevos marcadores de anticuerpos están actualmente disponibles y podrían ser útiles en el diagnóstico en pacientes que tengan una baja probabilidad pretest para EII (52). El papel de los marcadores serológicos en pacientes con colitis indeterminada ha sido estudiado, pero su valor es discutido (53).
Los ASCA se dirigen contra los residuos de manosa del fosfopeptidomanán de la pared celular de la levadura S. Cerevisiae. Los epítopes mayores identificados son la manotetraosa y una manotriosa (50). Estos anticuerpos son detectados con mayor frecuencia en pacientes con EC (39%-70%) y en individuos sanos (20%-25%). Recientemente, se ha identificado a la Cándida albicans como el potencial inmunógeno para el desarrollo de los ASCA (50).
Los anticuerpos contra el citoplasma de los neutrófilos (ANCA) son autoanticuerpos dirigidos contra los gránulos de los neutrófilos. La inmunofluorescencia indirecta muestra tres patrones de tinción: un patrón granular citoplasmático (cANCA), un patrón moteado (sANCA) y un patrón perinuclear (pANCA) (50). Entre el 20%-85% de los pacientes con CU tienen seropositividad para los pANCA (50).
En el 2004, el Colegio Americano de Gastroenterología concluyó que "mientras que en el momento, los pANCA y ASCA no constituyen un paso inicial ni definitivo en el diagnóstico diferencial ni en la toma de decisiones clínicas, pueden ser útiles en aquel paciente en que el cuadro clínico no permite diferenciar entre una colitis ulcerativa y una colitis por Enfermedad de Crohn" (54, 55).
En la actualidad, la principal utilidad de los marcadores serológicos (pANCA y ASCA) se encuentra en la colitis indeterminada, en la cual no es posible diferenciar por otros medios (clínicos, histopatológicos, radiológicos, endoscópicos) entre la CU y la colitis por EC. Sin embargo, no todos los autores están de acuerdo en su utilidad, ni siquiera en dicha indicación (56).
Sin embargo, se debe tener en cuenta que los ASCA pueden ser positivos en la enfermedad celiaca y enfermedad de Behçet con compromiso gastrointestinal y que los pANCA también pueden ser positivos en los pacientes con CEP, hepatitis autoinmune, colitis colágena y colitis eosinofilica incluso hasta en un 40% de los pacientes con EC (57, 58).
Los pANCA y ASCA no deben ser utilizados para el monitoreo de la actividad de la EII, debido a que los títulos de los anticuerpos permanecen relativamente estables durante el curso de la enfermedad, y no se correlacionan con la actividad ni predicen las recaídas (54).
Afirmación 36
La calprotectina en heces tiene un excelente valor predictivo negativo en excluir actividad en la EII.
La calprotectina fecal es una proteína unida al calcio que pertenece a la familia S100 y es derivada predominantemente de neutrófilos y en menor extensión de monocitos y macrófagos reactivos (59). La calprotectina constituye el 5% de la proteína total y el 60% de la proteína citosólica en neutrófilos humanos; tiene propiedades bacteriostáticas y fungistáticas. La calprotectina plasmática ha mostrado un incremento de 5 a 40 veces en condiciones infecciosas e inflamatorias (59). La calprotectina es encontrada en heces, su concentración es similar a 6 veces el valor normal en plasma; y sus niveles marcadamente elevados en heces de pacientes con EII (59). Tiene un excelente valor predictivo negativo en pacientes sintomáticos y su valor predictivo positivo es más bajo pero generalmente mejor que otros marcadores de inflamación utilizados (60, 61).
7. ENFERMEDAD DE CROHN PERIANAL
Afirmación 37
La combinación de dos de los siguientes tres métodos tiene alta sensibilidad y especificidad en el diagnóstico de la EC perianal: Ultrasonido endorrectal, resonancia magnética, y examen bajo anestesia.
7.1. Resonancia magnética (RM). La RM pélvica debe ser el procedimiento inicial para el diagnóstico de fístulas perianales porque es precisa y no invasiva, con una precisión diagnóstica que varía entre el 70 y 100% (62).
7.2. Examen bajo anestesia (EBA). Se considera el estándar de oro en manos de un cirujano con experiencia; además, tiene la ventaja de poder realizar terapia quirúrgica como la incisión y drenaje de abscesos perianales o la colocación de seton de drenaje (63).
7.3. Ultrasonido anorrectal (US). Requiere experiencia, tiene limitaciones técnicas y puede ser difícil o imposible de realizar por complicaciones locales (abscesos o estenosis). Su precisión diagnóstica varía entre el 56 al 100% teniendo en cuenta que es un estudio operador dependiente (64).
7.4. Rectosigmoidoscopia. Teniendo en cuenta que la presencia de inflamación rectosigmoidea concomitante tiene relevancia terapéutica y pronóstica, la rectosigmoidoscopia debe utilizarse de forma rutinaria en la evaluación inicial (64).
8. TRATAMIENTO
8.1 Colitis ulcerativa
Afirmación 38
La extensión y la severidad son los factores más importantes para definir el manejo y evaluar respuesta al tratamiento en CU.
Afirmación 39
La meta en el manejo de estos pacientes es inducir y mantener remisión clínica libre de esteroides, mejorar calidad de vida, en lo posible lograr una remisión endoscópica de la enfermedad con cicatrización de la mucosa y minimizar el riesgo de CCR.
Después de haber confirmado el diagnóstico de CU, el paso siguiente es determinar la extensión y severidad de la enfermedad, siendo estos factores los más importantes para definir el manejo y evaluar respuesta al tratamiento en CU, como lo definió la clasificación de Montreal. Existen varios objetivos en el abordaje terapéutico como son inducir y mantener remisión clínica libre de esteroides, mejorar calidad de vida, en lo posible lograr una remisión endoscópica de la enfermedad, con cicatrización de la mucosa y minimizar el riesgo de CCR (65).
8.1.1. Tratamiento de proctitis ulcerativa
Afirmación 40
Los pacientes con proctitis ulcerativa con actividad leve a moderada deben ser manejados con medicamentos 5 aminosalicílicos (5-ASA) tópicos.
El tratamiento inicial de pacientes con CU con actividad leve a moderada es a base de derivados 5-ASA, (66). Para pacientes con proctitis ulcerativa, la recomendación es usar tratamiento tópico con 5-ASA 1g/día en supositorios y de 1-4 g al día en enemas, el cual ha demostrado ser más efectivo que derivados 5-ASA orales y esteroides tópicos (57). Un metanálisis (67) demostró que los derivados 5-ASA tópicos logran remisión en el 67% de los pacientes con proctitis activa, comparado con solo 11% de respuesta con placebo.
8.1.2. Tratamiento de colitis izquierda y extensa activa
Afirmación 41
Los pacientes con CU izquierda con actividad leve a moderada deben ser manejados con combinación de medicamentos 5-ASA oral con 5-ASA tópico.
La literatura disponible demuestra que la combinación de derivados 5-ASA tópico con 5-ASA oral en las dosis usuales, es más efectiva que cada uno por separado en la inducción de remisión clínica; sin aumentar efectos colaterales (68).
Una revisión sistemática (69) que evaluó la inducción de remisión con 5-ASA en pacientes con CU activa independiente de la extensión concluyó que los medicamentos 5-ASA fueron dos veces superiores a placebo. En cuanto a efectos adversos, no se encontraron diferencias con placebo.
Pacientes con CU izquierda o extensa con actividad leve a moderada que no respondan al tratamiento con derivados 5-ASA deben recibir manejo con esteroides orales (70).
Afirmación 42
A los pacientes refractarios o "dependientes" de esteroides orales, debe ofrecérseles manejo inicial con inmunosupresores tipo azatioprina o mercaptopurina en dosis adecuadas para mantener la remisión.
Los pacientes refractarios a esteroides orales o "dependientes" de esteroides definidos como aquellos que requieran más de 1-2 ciclos de tratamiento con esteroides al año, o incapaces de reducir la dosis de prednisona de 10 mg/día o budesonida 3 mg/día en 3 meses, o que presentan recaída temprana luego de 3 meses de haber suspendido el medicamento, requieren "ahorradores de esteroides" como inmunosupresores (71). Ardizzone (72) y cols en su estudio demostraron que la azatioprina (AZA) es más efectiva que la mesalazina en mantener remisión clínica y endoscópica en pacientes con CU dependiente de esteroides.
Afirmación 43
En caso de no respuesta o intolerancia a la azatioprina, debe considerarse el uso de terapia biológica, descartando infección activa, tuberculosis latente, enfermedad desmielinizante preexistente, neuritis óptica, falla cardíaca congestiva o malignidad reciente.
Se realizaron dos estudios aleatorizados, doble ciego y controlados con placebo, denominados ACT 1 y ACT 2 (Active Ulcerative Colitis Trials) (73), en pacientes con colitis activa moderada o severa, a pesar de manejo convencional con 5-ASA, azatioprina y esteroides. El ACT 1 comparó infliximab 5 mg/kg con infliximab 10 mg/kg, y contra placebo, los cuales se aplicaron en las semanas 0, 2 y 6, y luego cada 8 semanas por 54 semanas. El desenlace primario se evaluó en la semana 8, midiendo la respuesta clínica (definida como un puntaje en la escala de Mayo menor de 3), que fue de 69% vs. 61% vs. 37%, respectivamente (p < 0,001). A la semana 54, la respuesta clínica fue de 45% vs. 44% vs. 20%, respectivamente (p < 0,001). No se encontraron diferencias significativas en la respuesta clínica entre infliximab 5 mg/kg e infliximab 10 mg/kg. En el ACT 2, un estudio prácticamente idéntico, la respuesta clínica a las 30 semanas con dosis de infliximab 5 mg/kg, infliximab 10 mg/kg y placebo fue de 47% vs. 60% vs. 26%, respectivamente (p < 0,001).
Existen estudios recientes encaminados a demostrar la utilidad y seguridad del uso de adalimumab en el tratamiento de primera línea de pacientes con CU refractaria a tratamiento convencional, con actividad moderada a severa. En el estudio de fase III realizado por Reinisch (74) y colaboradores se demuestra superioridad del adalimumab frente al placebo en la semana 8 de seguimiento (18,5 vs. 9,2%). En pacientes que no habían recibido previamente otro anti-TNF, la respuesta clínica fue del 50.4% a las 8 semanas y 30.2% a la semana 52. Se requieren estudios adicionales para recomendar adalimumab como tratamiento anti-TNF como terapia de primera línea en paciente con CU refractaria a tratamiento convencional.
En caso de no respuesta a un primer anti-TNF podría considerarse el uso de un segundo anti-TNF como terapia de rescate y ante la no respuesta se consideraría la realización de una colectomía electiva (75).
Es importante resaltar que antes de iniciar la terapia biológica se deben descartar cuidadosamente infecciones activas y latentes especialmente tuberculosis, enfermedades desmielinizantes, falla cardíaca o malignidad (76).
8.1.3. Tratamiento de colitis ulcerativa activa severa de cualquier extensión
Afirmación 44
Los pacientes con CU severa, mejor definida por los criterios de Truelove y Witts deben hospitalizarse para manejo intensivo.
Las intervenciones en pacientes con CU con actividad severa deben estar dirigidas al control de esta actividad. El manejo debe ofrecerse de manera intrahospitalaria, el abordaje inicial debe incluir la administración de esteroides, y en caso de no respuesta se pueden ofrecer terapias de segunda línea como ciclosporina o terapia biológica (77, 78).
En pacientes con CU aguda severa es preferible realizar rectosigmoidoscopia flexible y no colonoscopia total, por alto riesgo de perforación, preferiblemente dentro de las primeras 24-72 horas de la admisión, con mínima insuflación y siempre con biopsias para descartar infección (77).
Un gran porcentaje de pacientes responde al tratamiento con esteroides; sin embargo, hasta un 8% de aquellos con colitis activa severa que no responden a esteroides desarrollan como complicación megacolon tóxico, con una tasa de mortalidad de alrededor del 19%, la cual es más alta cuando el paciente presenta perforación (41,5%) (79). En el manejo de estos individuos existen dos grandes dilemas, cómo identificar pacientes de alto riesgo para complicaciones y cuándo iniciar terapia de rescate (infliximab o ciclosporina) con el fin de evitar una colectomía (77). A pesar de no existir estudios comparativos entre estos dos medicamentos, en pacientes expuestos previamente a azatioprina, es preferible usar infliximab a ciclosporina. Un estudio escandinavo (80) utilizó infliximab a dosis de 5 mg/kg en el manejo de pacientes con CU severa y lo comparó con placebo, encontrando que 29% de los pacientes que fueron tratados con infliximab requirieron colectomía y el 67% en el grupo placebo (p = 0,017). Un seguimiento de estos pacientes a 3 años mostró que el 50% de los pacientes tratados con infliximab requirieron colectomía comparados con el 76% del grupo con placebo (p: 0,012) (81).
En conclusión, se recomienda iniciar terapia de "rescate" en pacientes con CU severa que no respondan a tratamiento inicial con esteroides intravenosos después de 3 a 5 días de tratamiento; en caso de respuesta parcial al tercer día se podría esperar hasta 7 días con esteroides antes de iniciar terapia de rescate (77).
8.1.4. Mantenimiento de remisión en colitis ulcerativa
Afirmación 45
Todos los pacientes deben recibir terapia de mantenimiento en CU para lograr permanecer en remisión clínica y endoscópica, libre de esteroides.
La meta de la terapia de mantenimiento en CU es lograr remisión clínica y endoscópica, libre de esteroides (65). Los medicamentos 5-ASA oral son de primera línea en la terapia de mantenimiento de pacientes con CU en quienes se logró la inducción de la remisión con 5-ASA o esteroides orales (65). El mantenimiento con 5-ASA tópico es una buena alternativa en pacientes con proctitis ulcerativa. La mínima dosis efectiva para mantenimiento de remisión con 5-ASA oral es 1g/día, sulfasalazina 2-4 g/día y con 5-ASA tópico es 3 gr/semana en dosis divididas (69). Las tiopurinas como azatioprina y mercaptopurina están indicadas en pacientes con recaídas tempranas o frecuentes que ya estén en tratamiento con 5-ASA o que sean intolerantes a estos, y en pacientes dependientes de esteroides (69). En los pacientes en quienes se logró inducción de la remisión con infliximab, se recomienda continuar este medicamento para terapia de mantenimiento; combinar infliximab con azatioprina durante los primeros 6 meses de tratamiento es considerada una estrategia para disminuir la inmunogenicidad. A pesar de falta de estudios a largo plazo, el tratamiento de mantenimiento prolongado con infliximab debe ser considerado si es necesario (75).
8.2. Tratamiento de enfermedad de Crohn
Afirmación 46
El tratamiento de pacientes con EC debe tener en cuenta la actividad, localización y el comportamiento de la enfermedad.
El tratamiento de pacientes con EC debe tener en cuenta la actividad, la localización y el comportamiento de la enfermedad. Es importante tomar decisiones de inicio o cambio de tratamiento de acuerdo a hallazgos objetivos clínicos, endoscópicos, radiológicos o paraclínicos. Adicionalmente, debe realizarse un balance entre el beneficio de cada uno de los medicamentos y los potenciales efectos colaterales que pudieran tener (55).
8.2.1. Tratamiento de enfermedad de Crohn de acuerdo a la localización y la actividad de la enfermedad
8.2.1.1. Enfermedad de Crohn ileocecal con actividad leve
Afirmación 47
La budesonida es el tratamiento de elección en esta condición clínica. La mesalazina no ha demostrado beneficios.
Una revisión sistemática en Cochrane (82) demostró que la budesonida es superior a la mesalazina (RR 1,63) y al placebo (RR 1,96) en el manejo de EC leve, y se prefiere a otros esteroides orales (prednisona y prednisolona) por presentar menos eventos adversos (RR 0,86). La tasa de remisión de budesonida es de 51-60% en 8 a 10 semanas de tratamiento. Un metanálisis (83) con mesalazina de liberación ileal controlada a dosis de 4 g/día en EC ileocecal demostró un beneficio marginal de reducción de solo 18 puntos en el CDAI en 615 pacientes, comparado con placebo. La dosis recomendada de budesonida es de 9 mg al día (84).
8.2.1.2. Enfermedad de Crohn ileocecal con actividad moderada y severa
Afirmación 48
Paciente con EC ileocecal con actividad moderada y severa deben ser tratados inicialmente con esteroides orales sistémico en combinación con un inmunosupresor (azatioprina o mercaptopurina).
Los esteroides orales convencionales (prednisona y prednisolona) son efectivos en la inducción de remisión en pacientes con EC ileocecal con actividad moderada o severa (84). Una revisión sistemática reciente (85) evaluó dos estudios clínicos controlados en donde se compararon esteroides convencionales con placebo en EC activa, cada estudio reportó un efecto estadísticamente significativo a favor de los esteroides. En total 60% de los pacientes lograron remisión de la enfermedad vs. 31% en el grupo placebo.
8.2.1.3. Enfermedad de Crohn colónica
Afirmación 49
En pacientes con EC colónica de acuerdo a su presentación clínica y actividad inflamatoria se diseñara el tratamiento.
Los pacientes con EC colónica con actividad leve deben ser tratados con mesalazina como primera elección. En pacientes con actividad moderada y severa debe iniciarse manejo con esteroides sistémicos, y una vez lograda la remisión deben recibir tratamiento con inmunomoduladores como azatioprina y 6-mercaptopurina y suspender gradualmente los esteroides (86). Pacientes que no responden a los esteroides o con recaídas tempranas a pesar del tratamiento adecuado con inmunosupresor (< 3 meses) y con evidencia objetiva de actividad severa, deben ser manejados con anti-TNF con o sin inmunosupresor (86).
8.2.1.4. Enfermedad de Crohn de intestino delgado extensa
Afirmación 50
Los pacientes con EC de intestino delgado extensa deben tratarse con esteroides sistémicos y/o inmunomoduladores y/o terapia biológica.
Los pacientes con compromiso mayor a 100 cms de intestino delgado son de pobre pronóstico y presentan deterioro nutricional; en este grupo de pacientes se prefiere el tratamiento médico agresivo, temprano, con inmunosupresores y esteroides, y un adecuado soporte nutricional. En algunos casos de pobre pronóstico, debe considerarse manejo temprano con anti-TNF, más aún cuando diferentes estudios han demostrado que el inicio de anti-TNF en forma temprana tiene mejores resultados. En el estudio CHARM (87) con adalimumab, las tasas de remisión clínica en la semana 56, en pacientes con EC de menos de 2 años de evolución fue de 59%, comparado con 41% en pacientes con más de 5 años desde el diagnóstico. Algo similar se demostró en el estudio PRECISE 2 (88) con certolizumab pegilado, donde el mantenimiento de remisión clínica fue de 68,4% en pacientes con diagnóstico de EC de menos de un año del diagnóstico, comparado con 44,3% de pacientes con más de 5 años del diagnóstico.
8.2.1.5. Enfermedad de Crohn esofágica y gastroduodenal
Afirmación 51
La EC esofágica o gastroduodenal debe tratarse inicialmente con inhibidores de bomba de protones asociados a la terapia estándar de inducción o de mantenimiento.
Pacientes con EC de esófago y gastroduodenal son de pobre pronóstico, al ser tan poco frecuentes; no existen estudios controlados y las recomendaciones se basan en serie de casos (89, 90). Ante el mal pronóstico, la terapia con anti-TNF debe considerarse en forma temprana.
8.2.2. Tratamiento de mantenimiento en enfermedad de Crohn
Afirmación 52
Los pacientes con EC deben tener terapia de mantenimiento.
Afirmación 53
Los derivados 5 ASA y los esteroides no están recomendados en el tratamiento de mantenimiento de la EC.
Afirmación 54
La azatioprina está recomendada en el tratamiento de mantenimiento de la EC.
Afirmación 55
En la EC, cuando se logra la inducción de la remisión con terapia biológica, esta debe ser continuada en la terapia de mantenimiento.
Cuando se logra remisión con esteroides sistémicos después del primer episodio en EC, una tiopurina o metotrexate están indicados (13). Los esteroides sistémicos y la budesonida no deben ser utilizados para el mantenimiento de la remisión (86). Es controvertido el uso de 5-ASA como terapia de mantenimiento en la EC. Los pacientes dependientes de esteroides deben ser manejados con inmunosupresores, tiopurinas, metotrexate o terapia anti-TNF (86). Los pacientes en tratamiento inmunosupresor con azatioprina o 6-mercaptopurina que presenten recaídas deben ser evaluados para adherencia al tratamiento y en las dosis adecuadas; la opción de usar anti-TNF en estos pacientes podría ser considerada. Si se logra remisión con anti-TNF, el tratamiento de mantenimiento con este medicamento con o sin azatioprina (si no ha sido utilizado) debe ser contemplado (84). No existe evidencia de terapia de mantenimiento con anti-TNF a largo plazo; sin embargo, esta debe ser sostenida si es necesario.
En una revisión sistemática (85) se demostró que la azatioprina es superior al placebo en la prevención de recaídas en la EC. La terapia biológica con infliximab demostró ser útil para tratamiento de mantenimiento de EC, principalmente en pacientes en los que se utilizó este medicamento para inducción de la remisión. En el estudio ACCENT I (91), con 573 pacientes, los sujetos que respondieron a una dosis inicial de 5 mg/kg de infliximab, se aleatorizaron en tres grupos: 5 mg/kg, 10 mg/kg y placebo, con administración en las semanas 2 y 6, y luego cada 8 semanas por 46 semanas; 58% de los pacientes respondieron a la dosis inicial de 5 mg/kg y a la semana 30 de seguimiento, la respuesta clínica fue de 39% (p: 0,003), 45% (p: 0,0002) y 21%, respectivamente. No se encontraron diferencias significativas entre las dosis de 5 mg/kg y 10 mg/kg. Lo anterior ha sido demostrado también con adalimumab en el estudio CHARM (87) en el que la remisión clínica obtenida fue de 41% en la semana 56 de tratamiento con dosis de 80 mg sc, seguidos de 40 mg sc cada dos semanas.
8.3. Manejo de la enfermedad perianal en enfermedad de Crohn
Afirmación 56
El compromiso perianal es una manifestación frecuente en la EC asociada a una alta morbilidad, y es usual el compromiso en otros sitios del tracto gastrointestinal.
La enfermedad perianal es una manifestación frecuente y recurrente de la EC; tiene una alta morbilidad pero una baja mortalidad, incluye lesiones como la fisura anal (19%), tejidos hemorroidales ulcerados, colgajos cutáneos (37%), úlcera rectal (12%, fístulas perianales (16%), fístulas rectovaginales (3%), estenosis y abscesos perianales; a menudo se acompaña de enfermedad activa en el tracto gastrointestinal proximal (25%) o en el colon (47%) (92). Una pequeña proporción de pacientes con EC pueden persistir teniendo solo compromiso perianal.
Afirmación 57
Existen unos objetivos primarios en el manejo de la EC perianal. 1) Definir si es una fístula simple o compleja. 2) Definir el trayecto anatómico de la fístula. 3) Drenar el material infeccioso. 4) Erradicar el trayecto fistuloso. 5) Prevenir la recurrencia de la fístula.
Las fístulas en la EC se pueden clasificar en simples o complejas. La Asociación Americana de Gastroenterología (93) definió como fístulas simples aquellas que son superficiales o bajas, con orificio externo único, no son dolorosas ni fluctuantes y tienen mayor tasa de cicatrización. Las complejas son altas, con orificios múltiples, con dolor o induración (abscesos), en ocasiones recto-vaginales y asociadas a estenosis. Se relacionan con mayor actividad de la enfermedad y son difíciles de manejar.
8.3.1. Fístula simple
Afirmación 58
En caso de encontrar una fístula simple asintomática no se requiere ningún manejo específico.
En caso de encontrar una fístula simple asintomática no se requiere ningún manejo específico. En caso de que sean sintomáticas se recomienda un abordaje mixto, médico y quirúrgico tal como uso de antibióticos de amplio espectro (ciprofloxacina + metronidazol) junto a uso de seton de drenaje o fistulotomía (63).
8.3.2. Fístula compleja
Afirmación 59
En el manejo de las fístulas complejas los anti-TNF han mostrado efectividad en su cierre.
Los antibióticos solo han demostrado disminuir la actividad inflamatoria y secretoria de la fístula de manera temporal mientras se están administrando; la recaída es la regla una vez se suspenden (94).
Tampoco existen estudios aleatorizados controlados en el uso de AZA/ 6-MP (mercaptopurina) en la tasa de curación de las fístulas perianales por EC como objetivo final. Varios estudios han mostrado que la azatioprina es superior a placebo en el cierre de fístulas en la EC perianal (95). Cabe resaltar que la actividad clínica con estos medicamentos es demorada pero pueden ayudar en el cierre de las fístulas perianales y mantenimiento del mismo.
El infliximab fue el primer agente en demostrar su efectividad en el cierre de las fístulas perianales, como lo demostraron Present y colsen 1999, y el estudio ACCENT II (96-98).
Adalimumab, en el estudio CHARM (87) ha demostrado ser útil para el cierre de fístulas perianales.
9. MEDICAMENTOS EN ENFERMEDAD INFLAMATORIA INTESTINAL
9.1 Corticosteroides
Afirmación 60
El tratamiento con corticosteroides es efectivo en inducir remisión en pacientes con CU.
Los corticosteroides son los medicamentos de elección en el manejo de pacientes con CU con actividad moderada o severa. La prednisona oral induce remisión en el 77% comparado con 48% de los pacientes tratados con sulfasalazina 8 g/día (65). La dosis recomendada es prednisona 40 mg por vía oral, con disminución gradual que se inicia una vez se logra la remisión clínica (65). Los esteroides tópicos son menos efectivos que el tratamiento con 5-ASA tópico en CU distal (65). Una revisión sistemática de 5 estudios controlados con 445 pacientes demostró que los corticosteroides fueron efectivos en inducir remisión en pacientes con CU (99).
Diversos estudios, han encontrado una eficacia limitada de los esteroides en el mantenimiento de la remisión en pacientes con CU, además de sus efectos colaterales con el uso crónico, como son insuficiencia adrenal y osteoporosis (85).
Afirmación 61
La terapia con corticosteroides es efectiva en inducir remisión en EC activa. La terapia con budesonida es efectiva en inducir remisión en EC con actividad leve a moderada; sin embargo, no es efectiva en prevenir recaídas en pacientes en remisión.
Una reciente revisión sistemática (85) encontró una tasa de inducción de remisión de 60% con terapia con corticoides, comparado con 31% con placebo en EC activa. Adicionalmente, en 2 ensayos clínicos con 458 pacientes con EC con compromiso de íleon terminal y/o colon derecho, se encontró una respuesta a budesonida de 45% comparado con 24% con placebo (85). La misma revisión sistemática encontró 6 ensayos clínicos que comparan esteroides convencionales con budesonida en EC activa, la mayoría con compromiso de íleon terminal y/o colon derecho, encontrando en 8-10 semanas de tratamiento una respuesta de 62% vs. 53%, respectivamente. De otra parte, en 5 trabajos clínicos controlados aleatorizados que evaluaron 559 pacientes en prevención de recaída con EC quiescente, se encontró una tasa de recaída con budesonida de 63% comparado con 79% con placebo, en 52 semanas de seguimiento con dosis entre 3-9 mg/día; los eventos adversos asociados a esteroides fueron más frecuentes en el grupo de budesonida (99).
En pacientes con EC con actividad leve a moderada y con compromiso colónico derecho y/o íleon terminal, se prefiere budesonida a dosis de 9 mg/día, como primera elección durante 8 a 16 semanas de tratamiento (99). En caso de fracaso del tratamiento anterior, se debe iniciar prednisona o prednisolona a dosis de 40-60 mg/día; si presentan recaída durante la disminución de prednisona, requiriendo dosis ente 10-30 mg/día, se consideran esteroide-dependientes y deben recibir manejo con inmunosupresores como azatioprina o metotrexate, o terapia biológica con anti-TNF (99). Lo mismo se hace en caso de que presenten recaída temprana durante los primeros 6-12 meses (100).
9.2 Antibióticos en el tratamiento de la enfermedad inflamatoria intestinal
Afirmación 62
A pesar de que el análisis conjunto de las terapias con antibióticos muestra un efecto estadísticamente significativo en la inducción de la remisión y mantenimiento en EC, ninguna clase particular de estos medicamentos puede ser sugerida en la práctica clínica.
Afirmación 63
A pesar de que el análisis conjunto de las terapias con antibióticos muestra un efecto estadísticamente significativo en la inducción de la remisión y mantenimiento en CU, ninguna clase particular de estos medicamentos puede ser sugerida en la práctica clínica.
En las primeras descripciones de EC y CU se pensaba que la etiología probablemente era infecciosa, aunque los primeros investigadores no lograban aislar el microorganismo agresor. Por ejemplo, en EC se han implicado microorganismos tales como Mycobacterium avium Paratuberculosis, Yersinia enterocolítica, Chlamydia trachomatis, listeria, Pseudomonas spp., Escherichia Coli, entre otros. Hay una larga lista similar en CU (101). La evidencia existente para cualquiera de estos agentes infecciosos es pobre, pero la EC y la CU aún se cree que resultan de una reacción inmunológica aberrante a la microbiota intestinal en un individuo susceptible (8). Los antibióticos han sido evaluados tanto en EC como en CU pero los resultados han sido controvertidos.
Está relativamente bien establecido el papel de los antibióticos en el tratamiento de las complicaciones secundarias en la EII, tales como abscesos, sobrecrecimiento bacteriano y pouchitis. Existe alguna evidencia que indica que el metronidazol y la ciprofloxacina tienen usos específicos en la EC perianal. Aunque el análisis global de datos sugiere que el uso de antibióticos en EC y CU tiene algún beneficio tanto en la inducción de la remisión como en el mantenimiento, la heterogeneidad de los pacientes en los estudios, y una gran variedad de antibióticos utilizados, no hace posible que se puede dar una recomendación clara sobre su uso en EII (85).
Afirmación 64
Las terapias con antibióticos son efectivas para reducir el drenaje de las fístulas en EC.
La evidencia de la utilidad del uso de antibióticos en el tratamiento de las fístulas perianales es limitada. Sin embargo, los datos existentes podrían soportar el uso de antibióticos en la fístula perianal activa, principalmente metronidazol o ciprofloxacina (95).
9.3 Probióticos
9.3.1 Probióticos en enfermedad de Crohn
Afirmación 65
Los probióticos no han demostrado beneficio terapéutico en la inducción de la remisión ni en el mantenimiento de la remisión de la EC solos o en combinación con la terapia estándar. Tampoco han reportado beneficio en la reducción de las tasas de recurrencia postoperatoria de los pacientes sometidos a resección quirúrgica previa. A la fecha, este tipo de agentes no tiene ninguna indicación para el tratamiento en la EC.
La hipótesis actual de la etiología de la EII sostiene que ciertos factores medioambientales deben estar presentes en un individuo susceptible a desarrollar una respuesta inmune mucosa no regulada y que esta respuesta es activada por las bacterias presentes en la luz y la pared intestinal (102, 103). Numerosos estudios realizados en humanos y en modelos animales han demostrado que las bacterias entéricas son un factor de crucial importancia para el desarrollo, la prevención y el tratamiento de la inflamación crónica de la mucosa (103).
En los últimos años ha habido un creciente interés en la investigación de probióticos para tratamiento de la EII. Los probióticos son, en esencia, un grupo específico de cepas bacterianas que tienen la propiedad de ejercer un efecto protector en la regulación del sistema inmune mucoso con mínimos riesgos para los seres humanos (104).
Teniendo en cuenta las bases fisiopatológicas de la EII descritas en varios modelos animales y en humanos, los blancos potenciales de los probióticos en donde podrían tener un papel terapéutico incluyen la restitución celular, la recuperación de la función de la barrera intestinal y la modulación de los mecanismos efectores del sistema inmune innato y adaptativo (105).
Existen estudios usando probióticos en inducción de remisión y mantenimiento de remisión en EC (104). Los probióticos empleados en diferentes series incluyeron Saccharomyces boulardii, Lactobacillus jonsonii LA1 y Lactobacillus rhamnosus CG; ninguno de los estudios reportó beneficio terapéutico frente al grupo control (104). Un metanálisis en pacientes con EC confirmó la ineficacia terapéutica de los probióticos en esta patología (106).
En conclusión, no hay evidencia que demuestre alguna utilidad clínica de los probióticos en EC y que favorezca la recomendación de usarlos en inducción de la remisión o en mantenimiento de la misma. Cuando se evaluó, si con el uso de probióticos se producían diferencias en las tasas de recaídas de la enfermedad, con variables clínicas y endoscópicas, tampoco se encontraron diferencias significativas frente a los grupos control (106).
9.3.2. Probióticos en colitis ulcerativa
Afirmación 66
Los probióticos son agentes terapéuticos seguros y bien tolerados y algunos de ellos específicamente el VSL # 3 y E. Coli Nissle 1917 constituyen una alternativa de tratamiento a la terapia estándar en casos leves a moderados de CU.
Existen estudios controlados en CU que evalúan el uso de probióticos; sin embargo, estos son muy heterogéneos en cuanto a selección de pacientes y medición de desenlaces, lo que hace imposible dar una recomendación (107-110). Los trabajos realizados con la E. coli Nissle 1917 han sugerido que en algunos casos puede ser equivalente a la mesalazina en el tratamiento de pacientes con CU en el mantenimiento de la remisión (111). El preparado probiótico VSL # 3 es eficaz como terapia adyuvante a la terapia estándar con derivados 5-ASA o esteroides en inducir la remisión de la CU activa y también en inducir la remisión de pacientes con enfermedad activa leve a moderada (112, 113).
9.3.3 Probióticos en pouchitis
Afirmación 67
La mezcla comercial VSL # 3 ha demostrado eficacia terapéutica y seguridad clínica en la pouchitis en términos de inducción de la remisión y prevención de la enfermedad aguda.
Respecto al uso de probióticos en el paciente con manejo quirúrgico, VSL # 3 ha demostrado ser muy efectiva en el mantenimiento de la remisión en pouchitis, pero se requieren estudios con mayor poder estadístico para confirmar este hallazgo (114, 115). La cepa E. coli Nissle 1917 que ha demostrado efectividad en CU no ha sido estudiada en pacientes con pouchitis (115).
9.4 Medicamentos 5-ASA en enfermedad inflamatoria intestinal
9.4.1. Medicamentos 5-ASA en enfermedad de Crohn
Afirmación 68
La mesalazina no es más efectiva que el placebo en la inducción de la remisión o en el mantenimiento de la EC colónica o ileal.
La mesalazina ha sido utilizada tradicionalmente en el manejo de pacientes con EII tanto para controlar la actividad como para mantener la remisión. A diferencia de la evidencia que soporta el uso de 5-ASA en CU, en la EC no hay datos suficientes que soporten este uso.
No hay evidencia en la literatura que apoye el uso de la mesalazina en tratamientos crónicos para mantener la remisión de la enfermedad. Comparada con placebo no se muestran diferencias significativas en las tasas de recidiva postoperatoria en pacientes con EC localizada, y tampoco existe evidencia que soporte la efectividad de la mesalazina en terapia de mantenimiento de la remisión (84, 116-118).
9.4.2. Medicamentos 5-ASA en colitis ulcerativa
Afirmación 69
La mesalazina es una terapia efectiva en la inducción de la remisión en pacientes con CU activa, y en prevenir y disminuir las recaídas.
Los pacientes con colitis distal leve o moderada pueden ser tratados con mesalazina tópica con o sin mesalazina oral (65). Varios metanálisis de estudios controlados han demostrado que la mesalazina tópica es superior a los aminosalicilatos orales en lograr mejoría clínica en pacientes con colitis distal leve a moderada (119-121). La terapia tópica puede ser administrada en supositorios o enemas. Los supositorios de mesalazina en dosis de 500 mg dos veces al día o 1000 mg una vez al día son efectivos en el tratamiento de la proctitis y mantenimiento de la remisión, mientras que los enemas de mesalazina en dosis de 1 a 4 gramos son capaces de alcanzar extensión proximal como el ángulo esplénico y son efectivos en inducir y mantener remisión de la colitis distal (57). Los enemas de mesalazina en dosis de de 4 gramos han sido más exitosos que los esteroides en inducir remisión como lo muestran dos estudios doble ciego controlados (122-124). Las ventajas de la terapia tópica incluyen generar respuesta más rápida y menor frecuencia de la dosis que la terapia oral, como también menor absorción sistémica.
La combinación de mesalazina oral y enemas de mesalazina pueden ser más efectivos en lograr la mejoría clínica, como también una respuesta más temprana que un solo agente (57).
Cuando la inflamación se extiende proximalmente más allá del colon izquierdo es necesario la terapia oral, la cual puede administrarse sola o en combinación con terapia tópica. Para enfermedad clínicamente leve o moderada pero anatómicamente extensa la terapia de primera línea ha sido tradicionalmente la mesalazina (65). Alrededor del 80% de los pacientes que reciben dosis de 4-6 gramos al día manifiestan completa remisión clínica o mejoría significativa a las 4 semanas y aproximadamente la mitad tiene mejoría endoscópica (57, 65). Una revisión sistemática reciente demostró que los derivados 5-ASA son más efectivos que el placebo en lograr inducción de la remisión (85).
9.5. Inmunosupresores en el tratamiento de la enfermedad inflamatoria intestinal
Afirmación 70
Los inmunosupresores como la azatioprina o 6-mercaptopurina solo tienen indicación en el mantenimiento de la remisión para disminuir la necesidad de esteroides.
Los análogos de las purinas han sido uno de los pilares del tratamiento de la EC y de la CU (125). Varios estudios han demostrado la eficacia de la azatioprina y de la 6-mercaptopurina como agentes para inducir la remisión en la EC (126, 127). Uno de los problemas con el uso de estos medicamentos como inductores de remisión es el tiempo relativamente largo que demora la respuesta, generalmente entre 8 a 12 semanas (85).
En CU, los diferentes estudios han demostrado la efectividad de las tiopurinas principalmente en pacientes que no logran mantener la remisión sin el uso de esteroides (84). El beneficio primario en estos casos ha sido el efecto ahorrador de esteroides. La dosis recomendada de tiopurinas es azatioprina 2-2,5 mg/k/día o mercaptopurina 0,75-1 mg/k/día (57).
Otros inmunomoduladores disponibles son el metrotrexate y los inhibidores de la calcineurina: la ciclosporina A y el tacrolimus. El metrotrexate está indicado en la EC para la inducción y mantenimiento de la remisión, y para el ahorro de corticoides. Está absolutamente contraindicado en el embarazo, y no hay evidencia actual suficiente para apoyar su uso en la CU (85). Los inhibidores de la calcineurina se reservan para circunstancias especiales: la ciclosporina A se usa casi exclusivamente para los casos de CU aguda severa, y el tacrolimus solamente en los pacientes con EC en los que han fallado las otras terapias (128).
9.5.1. Inmunomoduladores en colitis ulcerativa
Afirmación 71
En los pacientes con CU activa, leve a moderada, extensa, las tiopurinas: 6-mercaptopurina y la azatioprina son efectivas en mantener la remisión en los pacientes que no respondan a 5-ASA o que sean dependientes de esteroides.
La principal indicación de las tiopurinas es en CU la prevención de recaídas en pacientes que no logran mantener la remisión de la enfermedad sin el uso de esteroides (65). Su uso como inductor de remisión es limitado debido al inicio lento de su acción, ya que pueden pasar hasta 3 a 6 meses para poder apreciar su óptimo efecto (128).
Los pacientes con CU crónica activa, dependiente de corticoides, deben ser tratados con azatioprina o 6-mercaptopurina a las dosis recomendadas, en un esfuerzo para disminuir o preferiblemente suspender los esteroides (72).
El paciente con CU que sufre una reactivación severa de su enfermedad que requiera tratamiento con corticoide o necesite retratamiento durante el año con otro curso de corticoide, debe ser considerado para la iniciación de terapia con azatioprina o 6-mercaptopurina a las dosis recomendadas, en un esfuerzo para evitar el uso futuro de corticosteroides (57).
9.5.2. Inmunomudoladores en la enfermedad de Crohn
Afirmación 72
La azatioprina y la 6-mercaptopurina a las dosis recomendadas son efectivas para mantener la remisión en los pacientes con EC independientemente de la distribución de la enfermedad.
Afirmación 73
La azatioprina y la 6-mercaptopurina no están indicadas para inducción de la remisión en pacientes con EC activa.
Una revisión sistemática reciente (85) evaluó la eficacia de la azatioprina y la 6-mercaptopurina en la prevención de recaída en pacientes con EC. Se evaluaron dos ensayos clínicos controlados en donde la azatioprina demostró ser más efectiva que el placebo en prevenir recaídas en EC. En la misma revisión se evaluaron otros tres estudios en donde se comparan el tratamiento continuo con azatioprina versus su suspensión que mostraron que las tasas de recaída eran más altas en el grupo que no continuó con la terapia. Por lo tanto, se recomienda el uso de azatioprina o mercaptopurina en la prevención de recaída en pacientes que lograron inducción de la remisión en EC y el tratamiento a largo plazo con corticoides no es deseable. Los pacientes con EC crónica activa, dependiente de corticoides, deben ser tratados con azatioprina o 6-mercaptopurina a las dosis recomendadas en un esfuerzo para disminuir o preferiblemente eliminar el uso de corticoides (125).
9.5.3 Asociación de tiopurinas con terapia biológica
Afirmación 74
En los pacientes con EII (CU o EC) que tienen indicación de tratamiento biológico con infliximab y no con el adalimumab se deben usar inmunomoduladores en conjunto con la terapia biológica.
En la EC, el uso concomitante de tiopurinas reduce la formación de anticuerpos contra el infliximab y por lo tanto aumenta sus niveles séricos. A favor del uso de infliximab junto con azatioprina está el estudio SONIC (129), que evaluó la eficacia de la terapia con infliximab, azatioprina y la combinación de ambas en 508 adultos con EC que no habían recibido previamente terapia inmunosupresora o biológica. El resultado demostró que los pacientes con EC moderada a severa tratados con infliximab + azatioprina tuvieron un mayor porcentaje de remisión clínica libre de corticoides comparados con aquellos que recibieron monoterapia con infliximab o azatioprina.
El uso concomitante a largo plazo de tiopurinas y terapia con agentes anti-TNF debe considerarse cuidadosamente. En los pacientes adolescentes hombres y en ancianos (> 65 años de edad), la terapia combinada con tiopurina + agentes anti-TNF debe utilizarse con precaución debido al riesgo de linfoma.
9.6. Terapia biológica en enfermedad inflamatoria intestinal
En la actualidad disponemos de tres anticuerpos monoclonales antifactor de necrosis tumoral (anti-TNF): infliximab, adalimumab y certolizumab; agentes que han demostrado ser efectivos en el tratamiento de la EII, mejorando la cicatrización de la mucosa con disminución de hospitalizaciones, estancias, morbilidad y cirugía electiva o de urgencia (85).
9.6.1. Tratamiento anti-TNF en enfermedad de Crohn
Afirmación 75
Los agentes biológicos (anti-TNF) están indicados en el tratamiento de la EC luminal moderada a severa y han demostrado eficacia en la inducción y mantenimiento de la remisión en pacientes que no responden a la terapia médica convencional.
El infliximab y el adalimumab están indicados en el tratamiento de la EC luminal moderada a severa y ha mostrado eficacia en la inducción y mantenimiento de la remisión (85). La dosis con mejores respuestas utilizando el CDAI ya fueron mencionadas previamente definiéndose además efectos adversos, seguridad clínica y mantenimiento de remisión (estudios ACCENT I y II, GAIN, CHARM, CLASICC I y II) (87, 91, 96, 131-133).
Afirmación 76
El infliximab es actualmente el tratamiento de elección en EC fistulosa.
El infliximab ha demostrado ser efectivo en el manejo de EC fistulosa, según dos ensayos clínicos: Present y cols y el ACCENT II (91, 96). Además, se ha señalado beneficio en los pacientes que son llevados a cirugía como tratamiento de la EC fistulosa perianal.
9.6.2. Tratamiento con anti-TNF (infliximab) en colitis ulcerativa
Afirmación 77
El uso de terapia biológica (infliximab) ha ganado aceptación para el tratamiento de CU severa refractaria a tratamiento convencional por su eficacia.
El infliximab ha ganado aceptación para el tratamiento de CU severa refractaria al tratamiento convencional por los resultados de dos ensayos clínicos ACT 1 y ACT 2 (73) que evaluaron la eficacia del infliximab para la inducción y mantenimiento de la remisión en pacientes con CU severa (puntaje Mayo ≥ 6 con puntaje endoscópico ≥ 2) a pesar del tratamiento concomitante con corticoesteroides o con AZA o 6-MP (ACT 1) y con los anteriores y 5-ASA (ACT 2). La respuesta clínica fue similar en pacientes refractarios o no a esteroides.
En relación a la remisión clínica (definida como una escala de Mayo ≤ 2 sin ningún subpuntaje ≥ 1 a las 30 semanas (ACT 1 y ACT 2) y a la semana 54 (ACT 1) fue similar para todos los grupos, con una frecuencia de remisión mayor de 2 veces para pacientes tratados con infliximab.
Afirmación 78
Existen indicaciones específicas para el uso de biológicos (infliximab) en EC.
Para el uso de terapia biológica en pacientes con EC existen indicaciones ya establecidas (130):
1. Inducción de respuesta y remisión en pacientes ambulatorios adultos y niños con EC moderada a severa quienes fallan al tratamiento convencional y son tratados concomitantemente con 5-ASA, esteroides o inmunomoduladores.
2. Inducción de cicatrización mucosa.
3. Mantenimiento de respuesta o remisión después de inducción con infliximab.
4. Inducción de respuesta o remisión en adultos con EC refractaria a tratamiento convencional que han sido tratados con 5-ASA, antibióticos, esteroides o inmunosupresores y que presentan fístula perianal activa, fístula enterocutánea o rectovaginal activa.
5. Pacientes hospitalizados con EC severa.
6. Terapia supresora de esteroides.
7. Reduce el riesgo de re-hospitalización y cirugía.
8. Tratamiento de manifestaciones extraintestinales de EC:
- Espondiloartropatía
- Artritis /Artralgia
- Pioderma gangrenoso
- Eritema nodoso
- Uveítis y otras, excepto neuritis óptica.
Afirmación 79
Existen indicaciones específicas para el uso de biológicos (infliximab) en CU.
Para el uso de terapia biológica en pacientes con CU existen indicaciones ya establecidas (130):
1. Inducción de respuesta y remisión en pacientes ambulatorios con CU activa moderada a severa refractarios a tratamiento convencional y que han sido tratados con 5-ASA, esteroides o inmunosupresores.
2. Inducción de la cicatrización mucosa.
3. Mantenimiento de respuesta o remisión después de inducción con infliximab.
4. Pacientes hospitalizados con CU severa.
5. Terapia ahorradora de esteroides.
6. Manifestaciones extraintestinales de CU:
- Espondiloartropatía
- Pioderma gangrenoso.
Afirmación 80
Existen algunas precauciones y contraindicaciones para el uso de terapia biológica en pacientes con EII.
Existen precauciones y contraindicaciones ya establecidas para el uso de terapia biológica en IBD (130):
1. Sospecha de absceso abdominal o perianal confirmado por resonancia magnética.
2. Colitis activa asociada a Clostridium difficile o a infección por citomegalovirus.
3. Falla cardíaca estadio III/IV NYHA.
4. Enfermedad neurológica desmielinizante.
5. Enfermedad hepática crónica.
6. Historia de enfermedad neoplásica o de linfoma.
7. TBC latente o sospecha de TBC activa.
8. Infección por VIH no controlada.
9. Serología positiva para virus hepatitis B.
10. EC fibroestenótica con obstrucción intestinal.
11. Pacientes con lupus eritematoso sistémico en tratamiento.
12. Infección activa.
13. Reacción de hipersensibilidad severa conocida.
14. Precaución en serología negativa para varicela Zoster.
15. Infección urinaria recurrente.
16. Aumento de transaminasas.
Afirmación 81
La dosis recomendada de infliximab para inducción es 5 mg/kg las semanas 0, 2, 6. La dosis para mantenimiento de infliximab es 5 mg/kg a la semana 8 y luego cada 8 semanas.
La inducción de la remisión se realiza con tres dosis de 5 mg/kg a las 0, 2 y 6 semanas; luego se continúa con terapia de mantenimiento 5 mg/kg cada 8 semanas (84). Los predictores de respuesta identificados en el estudio SONIC (129) son PCR alta y signos endoscópicos de actividad severa. Si no hay respuesta primaria al infliximab, se recomienda como estrategia inicial aumentar dosis de 5 a 10 mg/kg y acortar intervalos de administración; si a pesar de esto no hay respuesta se debe usar un segundo biológico.
Afirmación 82
El adalimumab es eficaz en el tratamiento de la EC.
El adalimumab ha demostrado en ensayos clínicos controlados con placebo y en estudios no controlados (CLASSIC-I, GAIN, CHARM y CLASSIC II) (87, 131-133) que es eficaz como tratamiento de inducción y mantenimiento en EC luminal activa moderada a severa.
Afirmación 83
Se recomienda el uso de adalimumab en EC fistulizante.
La EC fistulosa (perianal o enterocutánea) implica una complicación incapacitante y muchas veces refractaria al tratamiento convencional (130).
Adalimumab en los estudios CHARM y CHOICE (87) ha demostrado ser útil para el cierre de fístulas perianales.
Afirmación 84
El adalimumab tiene unas indicaciones específicas para su uso en EC. Las contraindicaciones y precauciones son las mismas descritas para infliximab.
El adalimumab tiene unas indicaciones establecidas para su utilización en EC (130):
1. En pacientes con EC moderada-severa refractarios al tratamiento y asociado con 5- ASA, antibióticos, esteroides o inmunomoduladores.
2. Mantenimiento de respuesta o remisión después de inducción con adalimumab. Pacientes con pérdida de respuesta o intolerancia a infliximab.
3. Inducción de respuesta o remisión en pacientes ambulatorios con fístula perianal activa refractarios a tratamiento convencional y tratados concomitantemente con 5-ASA, antibióticos, esteroides o inmunosupresor.
4. Terapia supresora de esteroides.
5. Reduce el riesgo de re-hospitalización y cirugía.
6. Manifestaciones extraintestinales de EC:
- Espondiloartropatía
- Artritis reactiva
- Pioderma gangrenoso
- Uveítis.
Afirmación 85
La dosis recomendada de adalimumab para inducción es 160 mg subcutáneos en la semana 0, y 80 mg en la semana 2, seguido de una terapia de mantenimiento con una dosis de 40 mg cada 2 semanas.
La dosis recomendada por vía subcutánea para la inducción de la remisión en EC es de 160 mg en semana 0 y de 80 mg en semana 2, seguida por un mantenimiento de remisión con una dosis de 40 mg cada 2 semanas (o cada semana si hay pérdida de respuesta), iniciando en la semana 4 del tratamiento. Evaluar siempre presencia o riesgo de TBC y/o infecciones oportunistas (130).
9.6.3 Seguridad de la terapia biológica
Afirmación 86
Las reacciones a la infusión son las complicaciones más tempranas y frecuentes asociadas a la terapia biológica. Le siguen el aumento del riesgo de infecciones, principalmente infecciones oportunistas y reactivación de tuberculosis. Se ha reportado una asociación no muy clara del uso de la terapia biológica con un aumento de presentación de neoplasias de tipo hematológico, enfermedad neurológica desmielinizante, y enfermedades autoinmunes.
A. Infecciones
Es el efecto adverso más común, las más importantes son las infecciones bacterianas comunes, infecciones oportunistas, virales, reactivación de tuberculosis y las enfermedades inmunoprevenibles. Las infecciones bacterianas más frecuentes son las del tracto respiratorio y urinario, por lo general estas no son graves y son fáciles de tratar, se ha visto que el uso concomitante de esteroides aumenta el riesgo de desarrollar infecciones bacterianas (134).
El riesgo de infecciones oportunistas está aumentado en los pacientes que reciben terapia biológica, pero usualmente, los pacientes no tienen infecciones con compromiso sistémico (76). Es importante tener en cuenta infecciones endémicas a nivel local, principalmente entidades como la histoplasmosis y la coccidiomicosis (134).
Se han reportado reactivaciones de infecciones virales con herpes simplex, herpes zoster y CMV. Se ha presentado reactivación del virus de la hepatitis B en pacientes portadores crónicos y se recomienda evaluación serológica en candidatos a terapia biológica y considerar profilaxis antiviral en pacientes positivos (134).
Se han descrito varios casos de reactivación de tuberculosis (TBC) con terapia biológica. Se recomienda prueba de tuberculina y radiografía de tórax antes de iniciar el tratamiento. Un inconveniente con la prueba de tuberculina en estos pacientes es que pueden existir falsos negativos debido a la anergia cutánea; por lo que existen métodos como el Quantiferon TB Gold que miden principalmente la inmunidad celular y son útiles en la detección de tuberculosis latente en pacientes con anergia cutánea. Se deben diseñar estrategias para prevenir desarrollo de infecciones con el uso de terapia biológica (135) (tabla 6).
B. Inmunogenicidad
El desarrollo de anticuerpos contra infliximab tiene impacto negativo en el manejo clínico. La inmunogenicidad puede ser responsable de las reacciones infusionales tempranas o tardías con el medicamento (134). Las reacciones severas con anafilaxia son muy raras y se han relacionado los niveles séricos de anticuerpos contra infliximab con el tiempo de pérdida de respuesta y reacciones a infusión con infliximab (130). La prevención de la inmunogenicidad con infliximab se logra con un adecuado esquema de inducción y mantenimiento de remisión con infliximab, inmunosupresión concomitante (AZA o 6-MP los primeros 6 meses) y aplicación previa de esteroide a la infusión (hidrocortisona 200 mg IV) (130). La formación de anticuerpos antinucleares (ANAS) se presenta en el 56% pacientes tratados con infliximab y en 19% de los tratados con adalimumab (134). La inducción de ANAS y su relevancia clínica no tienen significado importante y la incidencia de cuadros de "Lupus-like" es baja (135). El desarrollo de manifestaciones clínicas de lupus obliga a la suspensión inmediata del medicamento y a una valoración por reumatología. Se debe conocer el riesgo de cada paciente para el desarrollo de trastornos inmunológicos durante la terapia biológica (135) (tabla 7).
C. Enfermedad neoplásica
El incremento del riesgo para el desarrollo de enfermedad neoplásica es motivo de preocupación para pacientes y médico antes del inicio de la terapia biológica. La EII por sí misma se relaciona con aumento del riesgo para el desarrollo de algunos tipos de neoplasia. El uso de terapia biológica se ha asociado con el aumento de neoplasias hematológicas, principalmente Linfoma No Hodgkin (LNH) (135).
Varios estudios y un metanálisis han mostrado una mayor incidencia de neoplasias hematológicas como LNH en los pacientes que reciben terapia biológica (135). En algunos de estos estudios se observó que los pacientes que reciben tratamiento en combinación con inmunomoduladores como azatioprina son los que tienen mayor asociación con linfoma (135). Se ha reportado también aumento de la incidencia de linfoma hepatoesplénico y de displasia cervical. Sin embargo, la evidencia actual sugiere que la terapia biológica con infliximab no incrementa el riesgo de neoplasia comparado con placebo, pero en presencia de neoplasia previa o alto riego de esta no se recomienda tratamiento con infliximab (135). En la tabla 8 se mencionan algunas recomendaciones para el manejo del riesgo de neoplasia en terapia biológica.
D. Insuficiencia cardíaca congestiva (ICC)
El estudio ATTACH en pacientes con ICC clase funcional III y IV mostró un aumento de mortalidad y tasas de hospitalizaciones en pacientes que recibieron infliximab cuando se comparó con placebo (135). Por lo tanto, no se recomienda el uso de infliximab en pacientes que tienen ICC clase III y IV (134, 135) (tabla 9).
E. Eventos neurológicos adversos
El infliximab y otros agentes anti-TNF alfa se han asociado con el inicio o exacerbación de trastornos neurológicos desmielinizantes como esclerosis múltiple y neuritis óptica (76). Cuando se presentas síntomas neurológicos se debe suspender la terapia biológica (tabla 9).
10. CIRUGIA EN ENFERMEDAD INFLAMATORIA INTESTINAL
10.1. Indicaciones de cirugía electiva y urgente en colitis ulcerativa
Afirmación 87
Las indicaciones más frecuentes para cirugía electiva en CU son: intratabilidad, enfermedad debilitante crónica y riesgo de cáncer.
Falla en el tratamiento médico (Intratabilidad): Entre el 25-30% de los pacientes con CU requerirán cirugía si el tratamiento médico no logra remisión de la enfermedad o se documenta displasia (136). La intratabilidad es una término que no está bien definido en la literatura, incluye pacientes a quienes no se les pueden suspender los corticoesteroides después de 6-9 meses de uso, por reaparición de síntomas con o sin efectos secundarios; persistencia a pesar de tratamiento óptimo de manifestaciones extraintestinales como el pioderma gangrenoso; además, han sido agotadas todas las opciones de manejo médico, las cuales incluyen el uso de inmunosupresores o agentes biológicos o la combinación de estos (136).
La presencia de enfermedad debilitante crónica que deteriore la condición de salud del paciente constituye otra indicación de manejo quirúrgico en el paciente con CU (137).
Riesgo de cáncer: Los pacientes con CU tienen mayor incidencia que la población general de desarrollar cáncer de colon, este riesgo aumenta dependiendo de la extensión de la enfermedad y del tiempo de duración de esta. Los pacientes con proctitis tienen el mismo riesgo que la población general de desarrollar cáncer, mientras que los pacientes con colitis izquierda y pancolitis tienen mayor riesgo. La incidencia en la literatura es muy variable, va desde el 2% al 16% a 20 años y hasta un 30% a 30 años (138, 139); se cree que los factores que más influyen en la progresión de cáncer de colon son la edad de aparición de la enfermedad, su duración y la severidad de la misma, aunque los pacientes con historia familiar y con colangitis esclerosante tienen riesgo mayor (138). En la colonoscopia de vigilancia, las 2 indicaciones absolutas para manejo quirúrgico son la presencia de displasia de alto grado y la aparición de DALM (Displasia Asociada a Lesión o Masa) (140). El riesgo de encontrar carcinoma en el paciente con displasia de alto grado alcanza el 40% y el 3% en pacientes con displasia de bajo grado (141).
Afirmación 88
Las indicaciones más frecuentes para cirugía urgente en CU son: sangrado masivo, colitis y megacolon tóxico.
Sangrado masivo: En el 10% de los casos explica las cirugías de emergencia en CU. Usualmente el sangrado es difuso lo cual limita las posibilidades de terapia endoscopia o de embolización (142). El procedimiento ideal es la colectomía subtotal laparoscópica o convencional dependiendo de la condición del paciente (143).
Colitis tóxica: Es un episodio severo, con SIRS (signos de respuesta inflamatoria sistémica), hipoalbuminemia y dolor abdominal que no responde al tratamiento médico en las primeras 24-48 horas. Estos pacientes deben ser llevados a cirugía en forma temprana para disminuir la morbimortalidad (138).
Megacolon tóxico y perforación: Se presenta entre el 1,6 % y 13% y es el término clínico para la colitis tóxica con dilatación segmentaria o completa de colon, asociado o deterioro generalizado, fiebre alta, dolor abdominal con defensa, taquicardia y leucocitosis. Se considera una variante grave de la colitis tóxica por el riesgo de muerte. La mortalidad quirúrgica es de alrededor del 20% mientras que si hay perforación asciende hasta al 40%. Radiológicamente se visualiza como una dilatación del colon transverso mayor a 6 cm y del derecho mayor de 10 cm, siendo un factor predisponente el uso de opiodes o antidiarreicos en un paciente con CU activa. Su principal complicación es la perforación y la peritonitis (144).
10.2 Manejo quirúrgico urgente en enfermedad de Crohn
Afirmación 89
Las indicaciones para cirugía urgente en EC son: perforación libre, abscesos intrabdominales, fístulas entéricas sintomáticas, hemorragia masiva y megacolon tóxico.
Aunque el manejo quirúrgico de la EC ha cambiado considerablemente durante la última década gracias al advenimiento de la terapia biológica, continúan existiendo unas indicaciones claras para cirugía urgente, son aquellas que amenacen de manera perentoria la vida del paciente (145).
Perforación libre: El 8% de los casos se presentan con perforación libre. El paciente se debe llevar a cirugía y realizarle una resección del segmento perforado e idealmente una derivación proximal (146).
Abscesos intrabdominales: Se presentan entre el 10 y 28%, idealmente se debe intentar el drenaje percutáneo y una vez se controle el proceso infeccioso definir la necesidad de resección del segmento afectado (146).
Fístulas entéricas sintomáticas: En pacientes que presentan fístulas que generen síntomas o que se relacionen con proceso sépticos, se recomienda la resección de sitio fistuloso y rafia primaria de órgano extraintestinal (146).
Hemorragia: El sangrado masivo en la EC es generalmente causado por ulceración ileal; en la mayoría de los casos, se autolimita con las medidas de reanimación. Estos pacientes deben ser llevados a estudios endoscópicos después de lograr la estabilidad hemodinámica. Se describen ulceras gástricas sangrantes en el 5-10% de estos pacientes.
Megacolon tóxico: Se estima que el 6% de los pacientes con EII pueden presentar un cuadro de megacolon tóxico, de estos el 2,3% EC. Esta condición se asocia a colitis tóxica la cual debe sospecharse cuando el paciente presente 6 ó más deposiciones con sangre al día, hemoglobina < 10,5 gr/dl, eritrosedimentación > 30 mm/hr, taquicardia > 90 latidos por minuto, temperatura > 38 °C y leucocitos > 10,500/mm³ (según los criterios Truelove y Witts). La cirugía es el pilar fundamental en el manejo de esta entidad (138).
10.3 Indicaciones de cirugía electiva en pacientes con enfermedad de Crohn
Afirmación 90
Las indicaciones de cirugía electiva en pacientes con EC son limitadas y se reservan para manejo de complicaciones.
La tendencia actual es conservar incluso el intestino comprometido por la enfermedad y solo maniobrar la parte del intestino responsable de los síntomas que llevaron a la intervención (147).
La resección quirúrgica, plastia de la estenosis o el drenaje de abscesos está indicado para tratar las complicaciones o si la enfermedad no responde al manejo médico (148). No obstante, la intervención quirúrgica se requiere en hasta dos terceras partes de los pacientes para tratar la hemorragia, perforación, obstrucción, absceso, displasia o cáncer. Las indicaciones más comunes para la resección quirúrgica son la enfermedad refractaria a la terapia médica o debido a efectos secundarios de los medicamentos (dependencia de esteroides) (149). Recientemente, la técnica laparoscópica en pacientes seleccionados ha reportado ventajas en cuanto a una resolución más rápida del íleo paralítico postoperatorio y en acortar la estancia hospitalaria, sin incrementar las complicaciones al compararla con la cirugía abierta (150, 151).
La plastia de la estenosis ha sido promovida como una alternativa importante a la resección intestinal en el tratamiento de las estenosis fibróticas del intestino y debería intentarse cuando sea posible para evitar el deterioro de la absorción de nutrientes, diarrea secundaria a las sales biliares, esteatorrea, sobrecrecimiento bacteriano y síndrome del intestino corto. Este procedimiento se recomienda cuando la longitud de la estenosis es hasta de 10 cm; sin embargo, se pueden intentar plastias de estenosis más largas, donde la resección podría comprometer la longitud funcional del intestino delgado (148).
Los pacientes con EC pueden desarrollar abscesos abdominales. La presencia de EC luminal activa con un absceso abdominal concomitante preferiblemente debe manejarse con antibióticos, drenaje percutáneo o quirúrgico seguido por resección intestinal tardía si es necesario. No hay estudios controlados para determinar si luego del drenaje siempre se debe seguir una resección intestinal; sin embargo, la mayoría de las series favorece una resección intestinal retardada (152-154).
Existe un uso creciente de la cirugía laparoscópica en pacientes con EC con el objetivo de disminuir la formación de adherencias, el dolor postoperatorio y la estancia hospitalaria mejorando a la vez el resultado cosmético. Queda todavía por establecerse si la resección laparoscópica concede beneficios adicionales al de una cicatriz más corta. Sin embargo, los pacientes suelen preferir los procedimientos mínimamente invasivos. La cirugía video asistida puede no ser apropiada en casos complejos (148).
Afirmación 91
El abordaje de las estenosis y obstrucciones intestinales en la EC incluye procedimientos endoscópicos y quirúrgicos.
La obstrucción intestinal ocurre en el 15% al 50% de los pacientes con EC siendo el sitio más afectado el íleon distal, pero otros como el duodeno en un 5%, y el colon del 5% al 15% (155); puede ser causada por un fenómeno inflamatorio, estrechez fibrótica, por enfermedad crónica o también por un absceso que puede causar efecto de masa. El tratamiento inicial incluye reposo intestinal, líquidos endovenosos, esteroides. La obstrucción casi siempre tiene un proceso inflamatorio asociado; por lo anterior el tratamiento quirúrgico casi nunca se hace en forma inmediata. La obstrucción fibrótica con dilatación preestenótica necesita tratamiento endoscópico con dilatación con balón, colocación de stent o cirugía (156). Otras causas de obstrucción incluyen las adherencias, la impactación y las lesiones malignas. La obstrucción se presenta en el 12 al 18% de los pacientes después de 5 a 20 años de seguimiento. Otros estudios demuestran que la estenosis afecta al 27% de los pacientes después de 10 años de seguimiento (157).
En cirugía se puede hacer resección o bypass; al resecar segmentos de íleon puede haber alteraciones en la absorción de vitaminas A, B 12, D, E, K, y en la absorción de las grasas, e incluso se puede tener un intestino corto por múltiples resecciones intestinales; cuando se hace la resección se debe movilizar todo el intestino enfermo para facilitar la creación de una anastomosis sin tensión y cuando el intestino enfermo haya sido resecado se debe considerar efectuar una anastomosis o una ostomía; en general, la ostomía es preferible en pacientes críticamente enfermos o con peritonitis. La anastomosis debe ser sin tensión ni torsión, tener adecuada suplencia sanguínea, y el defecto mesentérico debe ser cerrado (156). No es necesario dejar márgenes de sección muy largos, con 2 cm es suficiente y además se evita la incidencia de intestino corto (155). La cirugía de bypass ha sido abandonada porque persiste la actividad de la enfermedad en el segmento afectado y por el riesgo de malignidad. El uso del bypass puede ser para mejorar los síntomas de obstrucción y planear una cirugía de resección en el futuro. Se ha comparado las anastomosis con grapadora con las hechas a mano y se ha encontrado menor tasa de recurrencia y de complicaciones en las de sutura mecánica. A nivel de la estrechez con compromiso del colon casi siempre la resección segmentaria es suficiente (155). En casos poco frecuentes con enfermedad muy extensa del colon se necesita colectomía con anastomosis íleo rectal o proctocolectomía (158).
En la obstrucción de origen colónica la dilatación con balón es satisfactoria en el 75% de los casos, y la tercera parte de ellos requiere una nueva dilatación en los siguientes 2 años. Las complicaciones de la dilatación incluyen perforación, sangrado, fiebre y fístula (149). Todas las estrecheces colónicas deben ser biopsiadas y se encuentra cáncer en el 7 al 10%. Se han identificado factores de riesgo que se asocian con una mayor incidencia de cáncer como lo son la edad adulta, la pancolitis y la duración de la enfermedad mayor de 8 años (155). La dilatación endoscópica tiene limitaciones como la dificultad para llegar al sitio de la estrechez y cuando es mayor de 4 cms.
Las indicaciones de las plastias de estenosis son estrecheces fibrosas y cortas, la historia de resecciones anteriores con posibilidad de intestino corto, múltiples estrecheces en un segmento largo de intestino, estrechez sin absceso o fístula. Las contraindicaciones son múltiples zonas de estrechez en un segmento corto de intestino (menos de 20 cms), estrechez muy cercana a un sitio de resección previa, hipoalbuminemia menor de 2 grs/dl y la existencia de absceso, fístula o flegmón; el mayor problema es la existencia de malignidad en el segmento estrecho por lo cual siempre se debe tomar biopsia. La tasa de recurrencia luego de las plastias de estenosis en los pacientes operados es del 28% a 5 años, y la recurrencia en el sitio de la plastia de estenosis es del 5%. La morbilidad del procedimiento quirúrgico es del 22,5% y las complicaciones sépticas (filtración y abscesos) son del 11,3%, obstrucción 4,4% y hemorragia 3,8% (156).
Afirmación 92
Existen factores predictores de recurrencia después de cirugía.
Se estima que entre un 70 y un 90% de los pacientes con EC van a necesitar cirugía en algún momento de la vida, al año de la cirugía van a estar sintomáticos del 20 al 37% y van a tener reintervención el 25 al 35% a 5 años, del 30 al 60% a 10 años y del 40 al 70% a los 15 años (158).
Las causas de recurrencia luego de cirugía aún no están precisadas, pero hay factores que están relacionados: la edad de inicio de la enfermedad, el consumo de cigarrillo, el sitio anatómico, y la extensión del compromiso, la historia familiar de EC, la indicación de cirugía por perforación, resección previa, la longitud del segmento resecado, la técnica de anastomosis, enfermedad residual en los márgenes, presencia de granulomas, transfusión perioperatoria y complicaciones postoperatorias (158).
En el tratamiento quirúrgico se han comparado las anastomosis convencionales término terminales (T-T) con otros tipos de anastomosis. Simillis C (159), en un metanálisis revisa 8 estudios entre 1992 y el 2005 encuentra 661 pacientes con 712 anastomosis 53,8% anastomosis T-T y el 46,2% con otras anastomosis (latero-lateral L-L, término-lateral T-L y latero-terminal L-T), la filtración fue reducida en las otras anastomosis vs. las T-T (OR 4,32 P = 0,02) , en la L-L vs. T-T (OR 4,37 P = 0,02) y aun en anastomosis íleo cólica la T-T tuvo más filtraciones comparada con las otras anastomosis.
La extensión de la resección en caso de compromiso segmentario del colon ha sido revisado recientemente en un metanálisis el cual demuestra que no hubo diferencia entre la resección segmentaria y la colectomía con anastomosis íleo rectal en cuanto a la tasa de recurrencia total, complicaciones y necesidad de ostomía permanente, pero el tiempo de recurrencia fue más prolongado en el grupo de la colectomía total. Se ha sugerido que la colectomía con anastomosis íleo rectal se debe efectuar cuando 2 ó más segmentos del colon estén comprometidos (160).
11. ENFERMEDAD INTESTINAL INFLAMATORIA Y NUTRICION
Afirmación 93
La nutrición ha demostrado ser útil como terapia de soporte en la EII.
La enfermedad tiene un efecto severo en el estado nutricional del paciente y esto hace que la desnutrición sea una manifestación frecuente en la EII (161-163).
En la tabla 10 se resumen las principales condiciones nutricionales y las tasas de presentación en pacientes con EII.
Las causas de desnutrición en los pacientes con EII incluyen entre otras, baja ingesta, mala digestión, mala absorción, aumento de las pérdidas y del requerimiento e interacciones medicamentosas (164). A continuación se recopilan las principales causas de desnutrición en este grupo de pacientes.
11.1. Colitis ulcerativa
Afirmación 94
La anemia está presente en un alto porcentaje de pacientes con CU, especialmente por deficiencia de hierro.
El tratamiento nutricional en la CU se puede considerar una terapia de soporte más que una terapia primaria y en este sentido se deben corregir las deficiencias que se presenten.
Los pacientes con CU presentan una baja densidad mineral ósea elevando el riesgo de osteopenia y osteoporosis. Hay que considerar el tratamiento con calcio, vitamina D e incluso la utilización de bifosfonatos en los pacientes con CU con enfermedad metabólica ósea detectada (165, 166).
La terapia médica nutricional en los pacientes con CU ha utilizado ácidos grasos Omega 3 como suplemento nutricional demostrando que disminuye la actividad de la enfermedad y reduce el requerimiento de esteroides y por lo tanto deberían ser considerados en el manejo de los pacientes con EII (167, 168).
La nutrición como terapia primaria en CU no está indicada (76). No hay suficiente evidencia acerca de que el mejoramiento del estado nutricional junto al reposo intestinal podría llevar a la remisión clínica de la CU y evitar la colectomía.
11.2. Enfermedad de Crohn
Afirmación 95
La desnutrición es una manifestación frecuente en EC.
Los pacientes con EC presentan deficiencia de vitaminas (K, E, D, A) y minerales (cobre, calcio, magnesio, hierro, selenio y zinc) por lo cual se deben suplementar a dosis altas. La desnutrición en la EC se debe a la pérdida de proteínas que puede ser tan alta como 80-90 g/día (169). Se recomienda una dieta de 30 a 35 kcal/kg y 1,5 a 2 g de proteína por kg de peso corporal para pacientes con enfermedad activa. Se debe prescribir suplemento multivitamínico de una a cinco veces la dosis diaria recomendada (RDA).
El reposo intestinal no está recomendado a menos que el paciente presente condiciones clínicas que impidan el uso de la nutrición enteral. La nutrición parenteral (NP) se reserva solo para situaciones donde las complicaciones de la enfermedad contraindiquen el uso de la vía enteral o en la EC ampliamente extendida cuando la ruta oral o enteral no es posible (170). Esta NP se reserva hasta la remisión de los síntomas o la realización de cirugía ya que algunos estudios demuestran que la NP tiene beneficios en pacientes con desnutrición severa que van a ser sometidos a cirugía (171, 172).
12. SITUACIONES ESPECIALES
12.1. Tratamiento de manifestaciones extradigestivas
Afirmación 96
La artropatía periférica responde al tratamiento de la enfermedad intestinal, la axial sigue un curso independiente, la enfermedad ósea metabólica se maneja con profilaxis.
La frecuencia del compromiso extraintestinal es del 21 a 36%, siendo más frecuentes en la EC que en la CU. Esta actividad es paralela a la actividad del compromiso gastrointestinal (173).
Las alteraciones músculo esqueléticas son las manifestaciones extraintestinales más frecuentes. Ellas se pueden dividir en alteraciones reumatológicas y enfermedad metabólica ósea. La artropatía periférica suele responder al manejo médico o quirúrgico de la colitis mientras que cuando se presenta compromiso articular axial, este tiene un curso progresivo independiente del compromiso intestinal (173, 174).
La enfermedad ósea se presenta en 23 a 59% de los pacientes, aun en aquellos que no reciben tratamiento con esteroides, especialmente en pacientes con EC. El tratamiento debe estar dirigido a la prevención de su aparición (175).
Afirmación 97
El pioderma puede responder a medidas locales pero también al manejo primario de la enfermedad.
Las manifestaciones cutáneas pueden aparecer durante el curso de la EEI o incluso precederla. La incidencia de compromiso cutáneo es del 2 al 34% (176). El pioderma gangrenoso es la dermatosis neutrofílica no infecciosa asociada con mayor frecuencia a la EII. Se estima que su prevalencia es de 6 a 12% en CU y del 1 a 2% en EC (177). Se caracteriza por una lesión única o múltiple que inicia como un nódulo que posteriormente se ulcera. Su tratamiento puede ser tópico, pero en la gran mayoría de los casos responde al tratamiento de base de la enfermedad intestinal (177).
Afirmación 98
La epiescleritis es paralela a la actividad de la enfermedad y usualmente responde a su tratamiento. La uveítis puede preceder al compromiso intestinal y ser la primera manifestación de la enfermedad; su curso es independiente de la actividad intestinal y su tratamiento es con esteroides sistémicos para prevenir la progresión y pérdida de la visión.
Al igual que las manifestaciones cutáneas, las manifestaciones oculares también pueden preceder o acompañar el curso de la EII. Con frecuencia son ignoradas o confundidas con alteraciones irrelevantes y tal retraso en el diagnóstico puede desencadenar problemas graves como la ceguera. Las manifestaciones oculares son infrecuentes, presentándose en menos del 10% de los casos y suelen coexistir con manifestaciones cutáneas o articulares (178).
La epiescleritis es la manifestación ocular más frecuente y suele presentarse de forma paralela a la actividad de la enfermedad; usualmente responde al tratamiento de base.
La uveítis puede preceder al compromiso intestinal y ser la primera manifestación de la enfermedad. Es posible encontrarla incluso en periodos de remisión y su curso es independiente de la actividad intestinal. Debe considerarse como una urgencia en el tratamiento del paciente con EEI para prevenir la progresión, con la consecuente pérdida de la visión. Su tratamiento se basa en una combinación de manejo tópico (ciclopléjicos y corticoides) junto con corticoide sistémico para disminuir la actividad inflamatoria (179).
12.2 Tratamiento médico de la EII en el embarazo
Afirmación 99
El uso de medicamentos durante el embarazo debe medirse desde el punto de vista del riesgo-beneficio en cada escenario.
Afirmación 100
El metrotrexate y la talidomida están totalmente contraindicados en el embarazo.
En general, los medicamentos para la EII se consideran de muy bajo riesgo durante la concepción y el embarazo; están completamente contraindicados el metrotrexate y la talidomida por su directa relación con anomalías congénitas (180).
Basados en la evidencia disponible, las pacientes con EII que consideren la concepción y el embarazo deben estar en óptimo estado de salud y en remisión de su enfermedad. El metotrexate y la talidomida deben ser suspendidos 6 meses antes (181).
Los aminosalicilatos AZA, 6-MP y el anti-TNF pueden ser continuados durante la concepción y el embarazo (182).
Debido al efecto antifolínico de la sulfasalazina, esta debe cambiarse por mesalazina durante el embarazo. La paciente estable en tratamiento simultáneo con anti-TNF y AZA, debe suspender la terapia con azatioprina y continuar monoterapia con anti-TNF, durante la concepción y parto dado que esto es menos riesgoso para el feto (180).
Debe evitarse el uso de corticosteroides (183) y antibióticos en el primer trimestre de embarazo para evitar riegos de malformaciones congénitas en este periodo de organogénesis (184). A pesar de esto, si la paciente recae, puede necesitar corticoides.
Si la paciente nunca ha sido expuesta al 6-MP AZA, este no debe ser utilizado por primera vez durante el embarazo, ya que la posibilidad de pancreatitis y leucopenia es impredecible.
El anti-TNF pude ser utilizado por primera vez en el embarazo. El uso del infliximab y adalimumab debe ser minimizado en el tercer trimestre. La doctora Mahadevan (185) utiliza IFM hasta la semana 30 y adalimumab hasta la 32, dada sus altas tasas de transferencia placentaria (186).
Si un anti-TNF requiere iniciarse por primera vez en el embarazo, el certolizumab pegilado podría ser la mejor opción dada su baja transferencia placentaria (187).
Se requieren más estudios para hacer recomendaciones precisas respecto a los medicamentos frecuentemente usados en EII durante el embarazo. Se sugiere seguir la categorización de cada medicamento según la FDA. (tabla 12)
12.3. Enfermedad inflamatoria intestinal en niños y adolescentes
La CU, EC y colitis indeterminada (CI) en el niño y el adolescente tienen particularidades clínicas y psicosociales que las diferencian de las del adulto, y que pueden condicionar enfoques terapéuticos distintos, especialmente por la posible repercusión nutricional y sobre el crecimiento, representando un desafío tanto para el pediatra como para el gastroenterólogo (188). Aunque hay pocos reportes en nuestro medio, se considera que su incidencia ha aumentado en los últimos cinco años (189).
12.3.1. Diferencias clínicas de la EII del niño con el adulto
Afirmación 101
Existen diferencias clínicas entre los pacientes con EII pediátricos y adultos.
Recientemente se han descrito diferencias, que indican una mayor extensión de la enfermedad entre los pacientes con EII de inicio temprano que en el adulto, una evolución más rápida de la EC hacia la estenosis y grado de penetración, su relación con la genética y diferentes manejos terapéuticos entre las dos edades (190-192). En un reciente estudio italiano (193) que comparó las características fenotípicas de la EEI en niños y adultos se demostró en los niños mayor frecuencia de enfermedad perianal y de manifestaciones extraintestinales.
Afirmación 102
El retraso del crecimiento es frecuente en los niños con EII. Es una secuela del diagnóstico tardío o tratamiento subóptimo.
El 5-10% de los niños con CU y el 15-40% de los niños con EC tienen alguna evidencia de daño nutricional. El compromiso nutricional puede anteceder la aparición de otros signos y síntomas. Un 88% de los niños prepuberales con EC pueden tener disminución en la velocidad de crecimiento antes del diagnóstico, y el bajo peso está comprometido en el 87% de los niños con EC y 68% en CU. La estatura baja es frecuente. El 56% de los niños con EC y el 23% de niños con CU, independiente del marcador a utilizar (peso/talla, Z score, velocidad en cm/año) presenta talla baja definida por caída en el percentil de talla > 0,3 desviaciones estándar/año o caída en la velocidad de crecimiento (< 5 cm/año; disminución > 2 cm desde el año precedente en la pubertad) (194, 195).
12.3.2. Diagnóstico
Afirmación 103
El diagnóstico de la CU se realiza con la sospecha clínica, apoyada con los hallazgos macroscópicos de la colonoscopia y las características histológicas de las biopsias, con exámenes de materia fecal negativos para agentes infecciosos.
A. Historia clínica y examen físico
En el interrogatorio es importante tener en cuenta los antecedentes familiares, hábito intestinal, frecuencia, urgencia, consistencia y presencia de moco, sangre o pus en las deposiciones; dolor abdominal especialmente que despierte al niño; síntomas sistémicos o extraintestinales como pérdida de peso, aftas orales, dolores articulares, fiebre, lesiones cutáneas y oculares. El examen físico debe incluir antropometría, estado puberal en la escala de Tanner, signos vitales, identificar presencia de edemas, palpación de masas o presencia de distensión en abdomen, inspección de la zona perianal, identificar fisuras y/o úlceras, fístulas (193-196) (tabla 13).
B. Laboratorio
No existe ninguna prueba específica para el diagnóstico de la EII en niños. Las alteraciones de laboratorio más frecuentes en pacientes pediátricos con EC son: aumento de la velocidad de sedimentación globular (VSG) (87%), leucocitosis > 10.000 células/mm³ (70%), hierro sérico < 50 ug/dL (58%), albuminemia < 3,5 g/dL (54%), hematocrito < 33% (50%). En CU, las alteraciones más frecuentes son el aumento de la VSG (90%), ferropenia (68%), hipoalbuminemia (46%), anemia (38%), leucocitosis (33%) y aumento de aminotransferasas (3%). Se debe realizar coproscópico, coprocultivo y toxinas A y B de Clostridium difficile para descartar diarreas infecciosas: Salmonella, Shigella, Campylobacter, Yersinia, Giardia, Entamoebahistolytica y Cryptosporidium. Sin embargo, la identificación de un patógeno (vg. amebiasis) no excluye el diagnóstico de EII, ya que el primer epidosio de EII puede presentarse después de una infección entérica documentada. Se debería excluir tuberculosis en niños de poblaciones de riesgo (194-196).
La determinación de títulos de anticuerpos anticitoplasma perinuclear de los neutrófilos (p-ANCA) y anticuerpos anti Saccharomyces cerevisiae (ASCA) son marcadores detectados en la EII. Los títulos p-ANCA elevados son más específicos de CU, mientras los títulos significativamente altos de ASCA IgA e IgG son específicos de EC. Su especificidad (84-95%) diferencia la EII de otros procesos, pero la sensibilidad es más baja (55-78%). Un test negativo no excluye la EII. Los anticuerpos anti Saccharomyces cerevisiae positivos en los pacientes con EC indican mayor probabilidad de enfermedad perianal y estenosis ileal que requieren resección (197-202). Otros marcadores como anti-OmpC, una porina de membrana externa de la E. coli, inmunorreactiva a anticuerpos monoclonales p-ANCA; el antígeno acinar pancreático (PAB), y el antígeno bacteriano mucosa colónico son promisorios (197). Marcadores fecales como calprotectina y lactoferrina son liberados por los neutrófilos que han migrado en la pared intestinal y se pueden medir cuantitativamente en muestras de heces. Estos marcadores son utilizados como no invasivos de la inflamación intestinal. Aunque las infecciones pueden causar inflamación y elevar estos marcadores, puede hacerse diagnóstico diferencial con síndrome de intestino irritable (203, 204).
C. Endoscopia
Afirmación 104
Los niños con sospecha de EII deben tener una endoscopia digestiva alta e ileocolonoscopia.
Idealmente, todos los niños con sospecha de EII deberían tener una endoscopia alta y colonoscopia, preferiblemente con exploración del íleon terminal y múltiples biopsias de esófago, estómago, duodeno, íleon, ciego, colon ascendente, colon transverso, descendente, sigmoides y recto para el diagnóstico histológico. Se debe realizar una radiografía de bario de intestino delgado en sospecha de EC cuando la histología no es conclusiva. Se ha encontrado evidencia histológica en el tracto gastrointestinal superior, hasta en el 30% de los casos de EC, incluso en ausencia de síntomas gastrointestinales superiores. A diferencia de los adultos, más del 60-90% de los niños con CU tienen pancolitis, por lo que es aconsejable hacer una colonoscopia completa. En ocasiones, la CU en la edad pediátrica cursa con preservación rectal. La rectosigmoidoscopia sola no tiene indicación, salvo en la CU grave, cuando el riesgo de perforación intestinal es alto, hasta que la condición clínica mejore (194-197) (tabla 14).
D. Histología
Afirmación 105
Los hallazgos histológicos en EII en niños son similares a los de los adultos.
El diagnóstico histológico de la EII en niños es similar al de adultos, con una menor preocupación por la detección de lesiones malignas. El tipo de EII debe estar claramente definido, junto con otros diagnósticos coexistentes o complicaciones y/o el registro de la presencia o ausencia de displasia, de acuerdo a las guías de la Sociedad Británica de Gastroenterología (199, 200).
E. Radiología y otros exámenes
Afirmación 106
Las imágenes radiológicas y de medicina nuclear son útiles en el abordaje diagnóstico de los pacientes pediátricos con EII. Se debe tener en cuenta su indicación para evitar la radiación innecesaria.
Las imágenes deben ser examinadas con un radiólogo experimentado para evitar una exposición innecesaria a las radiaciones ionizantes (201). Se recomienda un foro multidisciplinario (gastroenterólogo, patólogo y radiólogo) para que se tomen conductas apropiadas en la edad pediátrica (194).
Radiografía simple de abdomen. Utilizada para valoración en niños con síntomas severos. En la EC puede revelar la existencia de obstrucción intestinal incompleta con asas intestinales distendidas, niveles hidroaéreos y en la CU dilatación cólica, megacolon tóxico o perforación.
Tránsito intestinal con bario y colon por enema de bario. El tránsito está indicado para valorar la afectación de intestino delgado en EC y puede demostrar engrosamiento de pliegues, estenosis segmentaria con dilatación de asas proximales, fístulas, fisuras, irregularidad mucosa, rigidez, separación de asas por engrosamiento parietal, imagen de empedrado y peristalsis anormal. Es conveniente seriar el íleon terminal con compresión extrínseca.
Enteroclisis. Esta técnica que utiliza contraste parece superior y más sensible que la técnica convencional, pero técnicamente más difícil.
Colon por enema. Se utiliza poco debido a la disponibilidad de la endoscopia y se contraindica en CU en fase activa y riesgo de perforación.
Ultrasonido. En manos expertas es un método sensible y no invasivo, para identificar asas de intestino delgado engrosadas en EC y puede localizar colecciones o líquido libre en el peritoneo (205).
Gammagrafía con leucocitos marcados. Se utilizan leucocitos marcados con tecnecio 99. El depósito del radio isótopo permite poner de manifiesto las zonas con inflamación activa. Es útil para precisar la extensión y gravedad de la inflamación, sobre todo cuando está contraindicada la exploración endoscópica o esta ha sido incompleta. Tiene falsos negativos (enfermedad reciente y uso de esteroides) y positivos (206).
Tomografía computarizada, resonancia magnética, PET scan. Útiles para la valoración del engrosamiento de la pared intestinal, las alteraciones de la densidad de la grasa mesentérica, la presencia y tamaño de nódulos linfáticos, la existencia de fístulas y abscesos y las manifestaciones hepáticas y renales. La resonancia magnética puede utilizarse en lugar del tránsito intestinal empleando un contraste que cause una adecuada distensión intestinal como el polietilenglicol, combinado con glucagón. Requiere disponibilidad y colaboración del paciente (escolar o adolescente). La RM pélvica es un estudio imprescindible en la evaluación de la enfermedad perianal compleja. Hay estudios prometedores con el PET Scan (207-209).
Cápsula endoscópica. No es ampliamente utilizado en los niños en la actualidad, pero es cada vez más valioso en el diagnóstico de la enfermedad del intestino delgado. La cápsula endoscópica no se puede utilizar en presencia de estenosis, ya que puede ser retenida (210).
Laparoscopia. Puede ser útil en determinados pacientes, por ejemplo, si la tuberculosis intestinal es posible (194).
12.3.3. Tratamiento
Afirmación 107
El objetivo del tratamiento de la EII consiste en llevar la enfermedad activa a la remisión, seguida por la prevención de la recaída.
A. Colitis ulcerativa
El tratamiento de la CU depende de la actividad de la enfermedad y su distribución. La actividad se puede determinar mediante un índice de actividad clínica (211, 212).
Afirmación 108
Los pacientes con enfermedad severa requieren manejo en cuidado intensivo y descarte de perforación intestinal.
Si la enfermedad es severa, el paciente debe ser ingresado a cuidado intensivo y tomársele una radiografía abdominal para descartar perforación. Se debe documentar una etiología infecciosa que puede coexistir con enfermedad activa; pero en caso de una enfermedad grave, el tratamiento inmediato con esteroides no debe ser retardado.
Inducción de la remisión al diagnóstico o recaída de colitis ulcerativa leve o izquierda
Afirmación 109Los aminosalicilatos tópicos y orales y los corticoesteroides son útiles en la inducción de la remisión de pacientes pediátricos con CU.
Afirmación 110
Los antibióticos son útiles en presencia de infección o antes de cirugía en CU severa.
La mesalazina tópica, o esteroides, en forma líquida, espuma o supositorios son eficaces en el tratamiento de la CU leve o moderada del lado izquierdo o aislada al recto (1-2 g al día). Sin embargo, la terapia con mesalazina o esteroides tópicos es menos eficaz que una combinación de terapia oral y tópica (69, 194, 213-215).
Se recomienda mesalazina oral (50-100 mg/kg/día, máximo 3-4 g día en 3-4 dosis) o sulfasalazina (40-60-100 mg/kg/día, máximo 3 g/día). La sulfasalazina es particularmente efectiva para CU, CI y artropatía. Se recomienda iniciar a dosis bajas y subir en 6-10 días. Los efectos adversos con sulfasalazina son considerables (10-40%), requiriendo siempre el uso de ácido fólico. Se deben realizar controles semestrales de función renal y hepática (192, 194, 213).
Pueden usarse esteroides orales como prednisolona a dosis de 1-2 mg/kg/día, máximo 40 mg/día, para pacientes en quienes los 5-ASA (± agentes tópicos) son inefectivos (213, 216-219).
Colitis ulcerativa moderada a severa. Se recomienda utilizar prednisolona a dosis de 1-2 mg/kg/día, máximo 40 mg/día. Usar máxima dosis por 2-4 semanas hasta la remisión, con controles clínicos o telefónicos cada 2 semanas, hasta la remisión clínica. Disminuir gradualmente en 4-8 semanas y si el niño recae durante la disminución, considerar regresar a dosis anterior (218).
Colitis aguda severa y/o megacolon tóxico. El paciente debe ser manejado en cuidado intensivo. Tomar radiografía simple de abdomen a diario para monitorizar dilatación de colon y perforación. Líquidos endovenosos, transfusión de glóbulos rojos, si se requiere, y valoración por cirugía pediátrica temprana.
La utilización de corticosteroides intravenosos como hidrocortisona a dosis de 2 mg/kg, 4 veces al día (máx. 100 mg 4 veces/día) o metilprednisolona a dosis de 2 mg/kg/día (máx. 60 mg/día) se recomienda en estos casos. La no respuesta en 72 horas requiere cambio de terapia o colectomía (15, 194).
Utilizar antibióticos endovenosos si se sospecha infección o antes de cirugía: (ampicilina/sulbactam 50 mg/kg o cefotaxime 50 mg/kg o metronidazol 7,5 mg/kg, tres veces al día) (220, 221).
La colectomía temprana debe considerarse si el diámetro del colon transverso es > 5,5 cm y/o ciego > 9 cm (según datos de adultos) y si hay deterioro del paciente.
En pacientes con colitis severa que no respondan a esteroides se puede utilizar ciclosporina endovenosa, (2-4 mg/kg/día con niveles valle de 100-200 ng/ml) como medida temporal para retrasar o evitar la colectomía (222, 223), lo que permite la recuperación, e iniciar un inmunosupresor de segunda línea como tacrolimus. La utilización de infliximab intravenoso se puede considerar antes de colectomía (224).
Mantenimiento de la remisión
Afirmación 111
Los aminosalicilatos son el tratamiento de primera línea en el mantenimiento de la remisión en pacientes pediátricos con CU, en conjunto con tiopurinas.
Los aminosalicilatos están recomendados para el mantenimiento en todos los pacientes. La mesalazina oral, 50-100 mg/kg/día, máximo 3 g/día, debería ser la terapia de mantenimiento de primera línea (control de función hepática y renal cada 6 meses). La sulfasalazina 30-60 mg/kg/día es una alternativa, a pesar de sus efectos colaterales. Es de ayuda en pacientes con artropatía. Los corticoides no han demostrado su papel en el mantenimiento.
La azatioprina (2 mg/kg/día) o 6-mercaptopurina (1-1,25mg/kg/día) debería ser iniciada como terapia de mantenimiento, en pacientes en quienes no se logra el destete de corticoides, recaen en menos de 6 meses, o recaen 2 ó más veces por año, posterior a una adecuada terapia de mantenimiento con 5-ASA. Se debe controlar el hemograma y función hepática cada 3 meses, por supresión de médula ósea o desarrollo de hepatitis autoinmune. En los no respondedores a azatioprina, se deben medir niveles del nucleótido tioguanina para determinar biodisponibilidad o no absorción. Por lo general, se continúan aminosalicilatos con azatioprina por su efecto protector contra el cáncer.
La descontinuación de la azatioprina es controvertida. En general, no se debe interrumpir en momentos clave durante el crecimiento puberal y/o etapa escolar y la mayoría continuará hasta el momento de la transferencia a los médicos de adultos. Este problema debe ser discutido con el paciente y los padres. En adultos se descontinúa a los 4 años, si no hay recaídas (69, 225-230).
B. Enfermedad de Crohn
La actividad de la enfermedad puede ser expresada usando un índice de actividad de enfermedad tal como el índice de actividad de EC pediátrica (231). El riesgo de supresión medular y malignidad debe ser discutido con los padres.
Inducción de la remisión al diagnóstico o recaída de la enfermedad
Afirmación 112En pacientes pediátricos con EC el tratamiento de elección para inducción a la remisión es la alimentación enteral exclusiva o los corticoides orales.
En la mayoría de pacientes, el tratamiento de elección es la alimentación enteral exclusiva o los corticoides orales. Algunos centros han usado azatioprina en casos severos, la cual previene la recaída, pero no es totalmente efectiva sino hasta 3 meses después de iniciada la medicación (232, 233).
Nutrición enteral exclusiva. La nutrición enteral exclusiva por seis semanas es un tratamiento efectivo como terapia de primera línea en EC de intestino delgado y grueso, induciendo remisión en 60-80% de los casos, con la ausencia de la toxicidad de los corticoides y beneficios en mejorar el crecimiento (234, 235). No hay diferencias significativas en la eficacia, entre el uso de fórmulas poliméricas o elementales; sin embargo, las fórmulas poliméricas tienen mejor sabor, aunque se pueden usar por vía nasogástrica o gastrostomía. Muchos niños requieren 120% de las recomendaciones nutricionales de la RDA para la edad y la reintroducción de los alimentos y el destete de la nutrición parenteral debe ser progresivo entre 1-3 semanas (236).
Corticoides. La prednisolona a dosis de 1-2 mg/kg/día (máximo 40 mg/día), máxima de 2-4 semanas hasta lograr la remisión, es una de las terapias de primera línea en EC de intestino delgado y grueso, con controles cada 2 semanas, con reducción progresiva de 4-8 semanas, según respuesta clínica y suplementación con calcio y vitamina D. En caso de gastritis se debe agregar un inhibidor de bomba de protones (236-238).
Otras estrategias para inducción de la remisión. Los antimicrobianos metronidazol (7,5 mg/kg/dosis tres veces al día) ± ciprofloxacina (5 mg/kg/dosis, dos veces al día) pueden ser útiles en el manejo de la enfermedad perianal (194).
Los aminosalicilatos en altas dosis (mesalazina 50-100 mg/kg/día, máximo 3-4 g/día o sulfasalazina 40-60-100 mg/kg/día, máximo 3 g/día) pueden ser efectivos en enfermedad leve. Mesalazina tópica en colitis izquierda, es efectiva en enfermedad leve a moderada. Se deben realizar controles de función hepática y renal cada 6 meses (239, 241).
La budesonida (9 mg/día), es menos efectiva que la prednisolona como primera línea para enfermedad ileocecal, pero tiene menos efectos colaterales (238).
Los corticosteroides endovenosos como la hidrocortisona 2 mg/kg, cuatro veces al día (máximo 100 mg cuatro veces al día) o metilprednisolona 2 mg/kg día (máximo 60 mg/día), pueden ser útiles en pacientes que debutan con enfermedad severa (194).
La azatioprina puede ser iniciada inmediatamente en pacientes con enfermedad severa, pero toma al menos tres meses en ser totalmente efectiva (se deben tomar niveles de tiopurina metiltransferasa) (194, 213).
Debe considerarse la cirugía solo para manejo de complicaciones, posterior a la realización de resonancia magnética para determinar extensión de enfermedad perianal, como abscesos o fístulas. Pacientes con enfermedad severa complicada pueden requerir nutrición parenteral (194, 213).
Enfermedad de Crohn refractaria o sin respuesta
Afirmación 113
En pacientes con EC refractaria o sin respuesta se debe considerar el uso de inmunomoduladores o cirugía. La terapia biológica puede ser otra alternativa.
Se define EC refractaria cuando durante la inducción, incluyendo altas dosis de corticoides endovenosos, ha fallado la inducción de remisión al diagnóstico o durante recaídas subsecuentes. Se define EC refractaria a corticoides en enfermedad activa después de dosis adecuadas (1-2 mg/kg/día, mínimo 20 mg/día) y al menos 2 semanas de tratamiento. Estos pacientes deben ser considerados para inmunomoduladores o terapia biológica, si la cirugía no ha sido considerada aún. Los medicamentos recomendados y sus dosis se describen a continuación:
Azatioprina: (2-2,5 mg/kg/día) o 6-MP (1-1,25 mg/kg/día) (tomando idealmente niveles de tiopurina metiltransferasa). De los pacientes que no toleran azatioprina más del 50% tolerará 6-MP.
Metotrexate: 15 mg/m², una vez por semana, subcutáneo. La remisión ocurre a las 4 semanas, pero la mejoría es evidente a las 16 semanas. La administración parenteral es una ventaja si no hay adherencia a los medicamentos orales, o de otro lado, puede suministrarse metotrexate oral si no hay enfermedad de intestino delgado que interfiera con la absorción (242, 243).
Infliximab: 5 mg/kg/dosis/semana, a las semana 0, 2 y 6 puede ser efectiva en pacientes refractarios o intolerantes a esteroides combinados con inmunoduladores y en quienes la cirugía no es electiva. Debe haber un protocolo, con la duración claramente definida (3 dosis y reevaluación). Antes de iniciar infliximab debe ser excluida la tuberculosis (Rx de tórax, PCR). Antes de comenzar el tratamiento, el paciente y su familia deben ser asesorados sobre los riesgos de malignidad, y obtener el consentimiento por escrito (244).
La cirugía debe considerarse, especialmente para enfermedad ileocecal aislada, estenosis o fístula y para aquellos en que el tratamiento médico ha fallado. En EC la cirugía no es curativa y está dirigida a minimizar el impacto de la enfermedad. Al menos el 30% de los pacientes puede requerir cirugía en los primeros 10 años de la enfermedad y el 70% a 80% aproximadamente será sometido a cirugía en su vida (245, 246).
Adalimumab: 160 mg semana 0, 80 mg semana 2 y continuar con 40 mg cada 14 días. Los corticoesteroides se pueden reducir durante el tratamiento de mantenimiento, de acuerdo con las guías de práctica clínica.
Para algunos pacientes que han experimentado una disminución de su respuesta, puede ser beneficioso un aumento de la dosis a 40 mg semanales.
Para algunos pacientes que no han respondido al tratamiento en la semana 4, puede ser beneficioso continuar con una terapia de mantenimiento hasta la semana 12. La terapia continuada debe ser cuidadosamente reconsiderada en pacientes que no hayan respondido dentro de este periodo de tiempo.
Enfermedad de Crohn en otros sitios
Compromiso de cavidad oral: Se trata con nutrición enteral exclusiva, dieta de exclusión sin benzoato y sin canela, esteroides tópicos y/o esteroides intralesionales. En resistencia, se considera la azatioprina, infliximab y talidomida (244, 246).
Enfermedad gastroduodenal: Inhibidores de bomba de protones.
Enfermedad perianal y fistulizante: Metronidazol a dosis de 7,5 mg/kg/dosis, tres veces al día por al menos 6 semanas y/o ciprofloxacina a dosis de 5 mg/kg/dosis, dos veces al día para enfermedad perianal o azatioprina a dosis de 2-2,5 mg/kg/día o 6-MP (1-1,25 mg/kg/dosis), aunque hay un retardo en el inicio de acción, puede ser un tratamiento efectivo. El infliximab (3 infusiones de 5 mg/kg a las semanas 0, 2 y 6 semanas), debe reservarse a pacientes refractarios a otros tratamientos. Se debe realizar RNM para excluir abscesos y diagnosticar fístula antes de iniciarlo. Como procedimientos quirúrgicos que a veces son necesarios están la fistulotomía, drenaje de abscesos y colocación de una sonda (seton) (244, 246).
Mantenimiento de la remisión
Afirmación 114
No hay utilidad de los esteroides en el mantenimiento de EC en remisión. Para los pacientes que son dependientes de los esteroides debe hacerse un esfuerzo para encontrar otro tratamiento eficaz basado en inmunomoduladores o terapia biológica.
La azatioprina (2,5 mg/kg/día) o 6-MP (1,25 mg/kg/día) debe iniciarse como terapia de mantenimiento en pacientes que recaen en menos de seis meses, dos o más recaídas al año; en todos los pacientes dependientes de esteroides y después de cirugías de fístulas (247). En pacientes que no responden azatioprina puede ser útil, verificar los niveles séricos de nucleótidos de tioguanina para determinar si cumplen las normas de ser o no absorbentes. Aunque hay la tendencia de suspender la azatioprina a los 4 años si no hay recaídas, en adultos, más del 50% recaen en los 3 años posteriores a su suspensión, por lo que dicha conducta debe ser discutida con los padres. No debe ser suspendida durante el crecimiento puberal o época de estudio y muchos la continúan hasta los 18 años y paso a los gastroenterólogos de adultos (247-249).
El metotrexate (15 mg/m²), puede usarse una vez por semana por vía subcutánea, si la azatioprina o 6-mercaptopurina es ineficaz o mal tolerada, con 5 mg de ácido fólico 24 horas después de cada dosis. Se debe controlar valores de leucocitos y pruebas de función hepáticas cada 2 semanas durante las primeras 4 semanas, posteriormente una vez al mes (247).
La mesalazina no ha demostrado ser efectiva como terapia de mantenimiento en EC; sin embargo puede existir algún beneficio si se usa en altas dosis (50-100 mg/kg/día, según tolerancia) y en enfermedad leve (247).
El infliximab puede usarse como terapia de mantenimiento si fue usado para lograr la inducción de la remisión. La dosis de mantenimiento con infliximab es de 5 mg/kg endovenoso cada 8 semanas, y hasta 10 mg/kg si no hay respuesta, siempre descartando sobrecrecimiento bacteriano, sepsis o estenosis. Se debe suspender la inmunosupresión después de 6 meses, por el riesgo de linfoma, que puede o no estar relacionado con azatioprina o 6-MP (247, 250, 251). Evaluar por lo menos anualmente para determinar si el infliximab puede ser interrumpido. Si el paciente desarrolla hipersensibilidad al infliximab, se puede dar antes de su infusión, una dosis de antihistamínico y/o hidrocortisona intravenosos (250, 251).
Se puede considerar adalimumab (160 mg subcutáneo y luego 80 mg a la semana) en pacientes sin tratamiento previo con terapia biológica o en pacientes que respondieron inicialmente a infliximab, con posterior resistencia o intolerancia (247). Se deben evaluar los pacientes endoscópicamente o radiológicamente, antes de iniciar terapia biológica de segunda línea. Existe poca evidencia del beneficio de probióticos, aceite de pescado y terapia con trichuris para mantener la remisión (247, 252).
12.3.4. Seguimiento de la enfermedad inflamatoria
Afirmación 115
El estado nutricional, la osteopenia y los efectos asociados a los medicamentos deben ser monitorizados durante el seguimiento de la EEI en la población pediátrica.
Nutrición y crecimiento. En la CU el tratamiento nutricional es básicamente de soporte, mientras que en la EC sirve como soporte y como tratamiento primario para inducir la remisión. Se debe considerar la nutrición por sonda nasogástrica o gastrostomía si es necesario. Se deben medir el peso, talla y estado puberal de Tanner para determinar el estado nutricional. En la EC, si es necesario se deben dar suplementos o usar nutrición enteral cíclica para mejorar el estado nutricional, con evaluación conjunta con endocrinología (194, 213, 232, 233).
Osteopenia y dolor. La osteopenia existe especialmente en EC al diagnóstico. La densitometría documenta la osteopenia pero no debe ser usada rutinariamente. La suplementación con calcio y vitamina D debe realizarse en déficit nutricional durante el estirón puberal y tratamiento con corticoides, y en osteopenia severa; el manejo debe realizarse en conjunto con endocrinología (253). El dolor puede ser importante en enfermedad pobremente controlada. Puede tener un componente funcional. En algunas ocasiones requiere el manejo con el grupo de dolor y se debe tener precaución con el uso de opioides y riesgo de perforación (194).
Monitoreo y vacunación. Tomar hemograma cada 2 semanas en el primer mes al iniciar azatioprina, mensualmente en los siguientes dos meses, luego cada 3 meses: hemograma, función hepática y renal, amilasa y PCR. Tratar de mantener el recuento de linfocitos entre 1.000 y 1.500 como un indicador de la eficacia del medicamento. Vacunar contra varicela antes de iniciar tratamiento inmunosupresor o en caso de exposición usar inmunoglobulina. No usar vacunas de virus vivos durante la inmunosupresión (194, 213, 232, 233).
13. Recurrencia postoperatoria
13.1 Pouchitis
Afirmación 116
Una de las complicaciones postoperatorias de la CU que requiere colectomía total con reservorio ileal es la pouchitis.
La pouchitis se define como una condición inflamatoria idiopática del reservorio ileal, siendo esta la complicación inflamatoria más frecuente a largo plazo en este grupo de pacientes con una prevalencia del 6 al 50% (254-257).
Se han identificado algunos factores de riesgo para desarrollar pouchitis: indicación de cirugía (displasia), edad temprana al momento de diagnóstico, género masculino, colitis extensa o severa, manifestaciones extradigestivas (compromiso articular), colangitis esclerosante, uso prequirúrgico de esteroides, y uso de AINES (258-260).
Afirmación 117
El PDAI (Pouchitis Desease Activity Index) por su sigla en inglés, se basa en la clínica, la endoscopia y los marcadores histológicos.
Los síntomas son aumento en el número de deposiciones, incontinencia fecal, urgencia fecal, hematoquezia y dolor abdominal como los más frecuentes, ocasionalmente pueden manifestarse con síntomas extraintestinales como artralgias, dolor pélvico y fiebre. Es importante enfatizar que estos síntomas no son patognomónicos de esta condición y que siempre es necesaria una evaluación endoscópica con biopsias (261).
Afirmación 118
La endoscopia es una herramienta útil en el diagnóstico y evaluación en la actividad de la pouchitis.
Los cambios endoscópicos más importantes están dados por friabilidad, pérdida del patrón vascular, edema, granularidad, hemorragia y ulceración de la mucosa. Las úlceras a lo largo de la anastomosis son comunes y por sí solas no son indicativas de pouchitis (262, 263). Se recomienda la toma de biopsias aun con mucosa sana con el fin de realizar diagnóstico diferencial con causas infecciosas o isquémicas, evitando siempre biopsias de la zona de la anastomosis. Existen métodos diagnósticos complementarios que son útiles para establecer complicaciones postoperatorias del pouch (alteraciones estructurales, lesiones neurales) tales como la Rx de pelvis con contraste, manometría anorrectal, prueba de vaciamiento del pouch y resonancia magnética pélvica. Esta última es útil además en establecer la presencia de EC en el reservorio ileal (262, 263).
Afirmación 119
No existe evidencia sólida para establecer recomendaciones respecto al tratamiento de pouchitis.
Tanto la ciprofloxacina como el metronidazol son útiles en el manejo de pouchitis aguda, viéndose un mayor beneficio con la ciprofloxacina al ser comparada con el metronidazol, dado por una menor presencia de eventos adversos con el uso de ciprofloxacina (264). No hay evidencia que sustente el uso de corticoide tópico.
En el tratamiento de pouchitis crónica el VSL3 (probiótico) ha mostrado ser efectivo en la remisión de la pouchitis como se mencionó previamente; si no hay respuesta o complicaciones como fístulas, se ha sugerido uso del infliximab sin existir evidencia sólida al respecto. La falla total de la bolsa ileal, definida como la realización de una ileostomía definitiva o la remoción de la bolsa sucede del 2 al 16% en las diferentes series de la literatura y es causada por sepsis pélvica, disfunción de la misma o EC no diagnosticada en el periodo preoperatorio (265).
13.2. Recurrencia postoperatoria en enfermedad de Crohn
Afirmación 120
La EC tiene una recurrencia postoperatoria relativamente frecuente cuando no se emplea ninguna intervención preventiva.
La mayoría de pacientes con EC que va a cirugía con intención curativa hacen recurrencia postoperatoria (23). Las tasas de recurrencia endoscópica al año y a los 3 años son del 73% y 85% respectivamente (266). El término recurrencia hace referencia a la presencia de lesiones después de la resección quirúrgica, mientras recaída se refiere a la reaparición de síntomas (23).
Existen definiciones clínicas y morfológicas para la recurrencia postoperatoria de la EC. La recurrencia clínica se mide con los índices de actividad de la enfermedad como el CDAI, y la morfológica por medio de imágenes diagnósticas o por endoscopia (23).
Métodos para evaluar la recurrencia postoperatoria
Afirmación 121
La ileocolonoscopia sigue siendo el método de elección para evaluar la recurrencia postoperatoria en la EC.
Una ileocolonoscopia realizada entre los 6 y 12 meses después de la cirugía permite evaluar y ajustar el tratamiento de acuerdo a los hallazgos endoscópicos (267).
Pruebas como la medición fecal de lactoferrina y calprotectina han sido propuestas como métodos de seguimiento. El comportamiento esperable es que los niveles de estas sustancias desciendan luego de los dos primeros meses de cirugía; si persisten elevados existe un riesgo elevado de recurrencia y sugiere la necesidad de modificaciones en el tratamiento (268).
La ultrasonografía de intestino delgado con contraste, en manos expertas, ha mostrado ser una prueba muy específica, con un alto valor predictivo positivo para evaluar la recurrencia postoperatoria en EC (39).
Terapia médica para prevenir la recurrencia postoperatoria
Afirmación 122
La evidencia con el tratamiento farmacológico es limitada; sin embargo, algunos medicamentos como los inmunomoduladores, y de manera más reciente la terapia biológica, parecen tener algún beneficio en la prevención de la recurrencia postoperatoria en la EC.
A. Corticosteroides
Los corticosteroides clásicos no están recomendados como terapia de mantenimiento en la EC o como profilaxis para la recurrencia postoperatoria debido a sus efectos adversos y a su inefectividad. Una revisión sistemática hecha por el grupo Cochrane mostró que ni la prednisolona o la metilprednisolona son efectivas en prevenir recaídas después de la remisión lograda médica o quirúrgicamente (269).
B. Mesalazina
La mesalazina es uno de los medicamentos más estudiados en la profilaxis postoperatoria de la EC; sin embargo, hay gran heterogeneidad en el diseño de los estudios disponibles. Un metanálisis reciente realizado por el grupo de Cochrane donde se comparó el efecto de la mesalazina contra placebo concluyó que en pacientes de bajo riesgo podría prevenir la recurrencia clínica y disminuir la recurrencia de hallazgos endoscópicos severos a los 12 meses (270).
C. Inmunomoduladores
Debido a que los inmunomoduladores son efectivos en mantener la remisión en la EC, es lógico pensar que la azatioprina (AZA) y la 6-mercaptopurina (6-MP) pueden ser efectivas en la prevención de la recurrencia postoperatoria en la EC. Los estudios comparando estas moléculas con mesalazina o con placebo han demostrado que son efectivos en la prevención de la recurrencia postoperatoria tanto clínica como endoscópica, con menores diferencias en la comparación con mesalazina (270).
A pesar de que la evidencia es limitada, se considera que los inmunomoduladores como la azatioprina son la terapia de primera línea en la prevención de la recurrencia postoperatoria de EC en pacientes considerados como de alto riesgo (fumadores, fenotipo B3 según Montreal, y más de una intervención quirúrgica) (270).
D. Antibióticos
Existen dos estudios que evalúan la eficacia de los antibióticos nitroimidazólicos en la prevención de la recurrencia postoperatoria en la EC en los cuales se concluyó que el riesgo relativo de recurrencia endoscópica con hallazgos severos a los 3 meses fue menor con el tratamiento antibiótico. El riesgo de recurrencia clínica a 12 meses también fue menor en el grupo que recibió antibióticos (270). Los efectos adversos más frecuentes fueron relacionados a intolerancia gastrointestinal y reacciones adversas de tipo neurológico (270). Si bien los antibióticos nitroimidazólicos mostraron algún beneficio en disminuir el riesgo de recurrencia, sus efectos adversos hacen que no se puedan recomendar para usar a largo plazo como terapia de prevención (270).
E. Terapia biológica
Es bien conocido que los agentes anti-TNF inducen remisión endoscópica en la EC, y debido a que la recurrencia endoscópica en la EC precede a la recurrencia clínica, es lógico pensar que la terapia biológica con agentes anti-TNF puede ser útil en prevenir la recurrencia endoscópica en la EC (269). Se considera que la evidencia actual no permite hacer ninguna recomendación como prevención de la recurrencia postoperatoria (271).
REFERENCIAS
1. Collins P, Rhodes J. Ulcerative colitis: diagnosis and management. BMJ 2006; 333(7566): 501.
2. Carter MJ, Lobo AJ, Travis SPC. On behalf of the IBD Section of the British Society of Gastroenterology. Guidelines for the management of IBD in adults. Gut 2004; 53(suppl 5): v1-v16.
3. Loftus EV Jr. Clinical epidemiology of inflammatory bowel disease: incidence, prevalence, and environmental influences Gastroenterology 2004; 126: 1504-17.
4. Argüello M, Archila PE, Sierra F, Otero W. Enfermedad inflamatoria intestinal. Rev Colomb Gastroent 1991; 6: 237-72.
5. Yepes I, Carmona R, Díaz F, Marin I. Prevalencia y características demográficas de la enfermedad inflamatoria intestinal en Cartagena, Colombia. Revista Colombiana de Gastroenterología 2010; 25(2).
6. Juliao F, Ruiz M, Florez JF, et al. Fenotipo e historia natural de la enfermedad inflamatoria intestinal en un centro de referencia en Medellín-Colombia. Revista colombiana de Gastroenterología 2010; 23(3).
7. Baumgart DC, Sandborn WJ. Inflammatory Bowel disease: Clinical aspects and established and evolving therapies. The Lancet 2007; 369: 1641-1657.
8. Abraham C, Cho J. Inflammatory bowel desease. N Engl J Med 2009; 361: 2066-78.
9. Silverberg MS, Satsangi J, Ahmad T, et al. toward an integrated clinical, molecular and serological classification of inflammatory bowel disease: report of a working party of the 2005 Montreal World Congress of Gastroenterology. Can J Gastroenterol 2005; 19(Suppl. A): 5-36.
10. Danese S, Fiocchi C. Ulcerative colitis. N Engl J Med 2011; 365(18): 1713-25.
11. Nikolaus S, Schreiber S. Diagnostics of inflammatory Bowel Disease. Gastroenterology 2007; 133: 1670-1689
12. Vatn MH. Natural history and complications of IBD. Curr Gastroenterol Rep 2009; 11(6): 481-7.
13. Lichtenstein GR, Hanauer SB, Sandborn WJ. Management of Crohn's Disease in adults. Am J Gastroenterol advance online publication, 2009; doi: 10.1038/ajg.2008.
14. Colombel JF, Watson AJM, Neurath MF. The 10 remaining mysteries of inflammatory bowel disease. Gut 2008;57:429-433
15. Truelove SC, Witts LJ. Cortisona in ulcerative colitis. Final report on a therapeutic trial. Br Med J 1955; 2: 1041-8.
16. Sandborn WJ, Feagan BG, Hanauer SB, Lochs H, Lofberg R, Modigliani R, Present DH, Rutgeerts P, Scholmerich J, Stange EF, Sutherland LR. Review of Activity Indices and Efficacy Endpoints for Clinical Trials of Medical Therapy in Adults with Crohns Disease. Gastroenterology 2002; 122: 512-530.
17. European evidence based consensus on the diagnosis and management of ulcerative colitis (Definition and diagnosis). Journal of Crohn's and Colitis 2008; 2: 1-23.
18. Higgins PD, Schwartz M, Mapili J, Zimmermann EM. Is endoscopy necessary for the measurement of disease activity in ulcerative colitis? Am J Gastroenterol 2005; 100: 355-61.
19. World Gastroenterology Organization practice guidelines for the diagnosis and management of IBD in 2010. Inflamm Bowel Dis 2010; 16: 112-124.
20. European evidence based consensus on the diagnosis and management of ulcerative colitis (Special situations). Journal of Crohn's and Colitis 2008; 2: 63-92.
21. Castaño R, Puerta J, Álvarez O, et al. Papel de la intubación ileal rutinaria durante la colonoscopia. Rev Col Gastroenterol 2008; 23: 240-9.
22. Anonymous. ASGE guideline: endoscopy in the diagnosis and treatment of inflammatory bowel disease. Gastrointest Endosc Clin N Am 2006; 63: 559-65.
23. Nos P, Domènech E, Postoperative Crohn's disease recurrence: A practical approach. World J Gastroenterol 2008; 14(36): 5540-5548.
24. Rutgeerts P, Geboes K, Vantrappen G, Beyls J, Kerremans R, Hiele M. Predictability of the postoperative course of Crohns disease. Gastroenterology 1990; 99: 956-63.
25. Vleggaar FP, Lutgens MW, Claessen MM. The relevance of surveillance endoscopy in long-lasting inflammatory bowel disease. Aliment Pharmacol Ther 2007; 26 Suppl 2: 47-52.
26. Eaden JA MJ. British Society for Gastroenterology, Association of Coloproctology for Great Britain and Ireland. Guidelines for screening and surveillance of asymptomatic colorectal cancer in patients with inflammatory bowel disease. Gut 2002; 51: V10-2.
27. Basseri RJ, Basseri B, Papadakis KA. Dysplasia and cancer in inflammatory bowel disease. Expert Rev Gastroenterol Hepatol 2011; 5(1): 59-66.
28. Velayos F. Colon cancer surveillance in inflammatory bowel disease patients: current and emerging practices. Expert Rev Gastroenterol Hepatol 2008; 2(6): 817-25.
29. Simpson P, Papadakis KA. Endoscopic evaluation of patients with inflammatory bowel disease. Inflamm Bowel Dis 2008; 14(9): 1287-97.
30. Hirai F, Beppu T, Sou S, Seki T, Yao K, Matsui T. Endoscopic balloon dilatation using double-balloon endoscopy is a useful and safe treatment for small intestinal strictures in Crohn's disease. Dig Endosc 2010; 22(3): 200-4.
31. Fidder HH, Nadler N, Lahav M, et al. The utility of capsule endoscopy in the diagnosis of Crohn's disease based on patient's symptoms. J Clin Gastroenterology. 2007; 41(4): 384-387.
32. Bourreille A, et al. Role of small-bowel endoscopy in IBD: international OMED-ECCO consensus. Endoscopy 2009; 41: 618-637.
33. Moscandrew ME, Loftus EV Jr. Diagnostic advances in inflammatory bowel disease (imaging and laboratory).Curr Gastroenterol Rep 2009; 11(6): 488-95.
34. Murphy SJ, Kornbluth A. Double balloon enteroscopy in Crohns disease: where are we now and where should we go? Inflamm Bowel Dis 2011; 17(1): 485-90.
35. Mensink PB, Aktas H, Zelinkova Z, et al. Impact of double-balloon enteroscopy findings on the management of Crohnsdisease.Scand J Gastroenterol 2010; 45(4): 483-9.
36. Patak M, Froehlich J, Weymarn C. Small Bowel MR Imaging 1.5 versus 3T. Magnetic Resonance Imaging Clinics 2007; 15: 383-393.
37. Horsthuis K, Bipat S, Bennink R, Stoker J. Inflammatory Bowel Disease with US, MR, SCintigraphy, and CT: Metaanalysis of Prospectives Studies. Radiology 2008; 24 (1): 64-79
38. Goetz M, Neurath M. Imaging Techniques in Inflammatory Bowel Disease: recent trends, questions and answers. Gastroentérologie Clinique et Biologique 2009; 33 (3): s174-s182.
39. Dietrich CF. Significance of abdominal ultrasound in inflammatory bowel disease. Dig Dis 2009; 27(4): 482-93.
40. Fiorino G, Bonifacio C, Peyrin-Biroulet L, Minuti F, et al. Prospective comparison of computed tomography enterography and magnetic resonance enterography for assessment of disease activity and complications in ileocolonic Crohns disease. Inflamm Bowel Dis 2011; 17(5): 1073-80
41. Al-Hawary MM, Zimmermann EM. Choosing the right cross-sectional imaging technique: Trading image quality for radiation risk. Inflamm Bowel Dis 2011; 17(5): 1089-91.
42. Lee S, Kim A, Yang S, Chung J, Kim S, Park S, Ha H. Crohn Disease of the Small Bowel: Comparison of CT Enterography, MR Enterography and Small- Bowel Follow- Through as Diagnostic Techniques. Radiology 2009; 251 (3): 751-761.
43. Ziech ML, Bipat S, Roelofs JJ, Nio CY, Mearadji B, van Doorn S, Spijkerboer AM, Stoker J. Retrospective comparison of magnetic resonance imaging features and histopathology in Crohns disease patients. Eur J Radiol 2011.
44. Rimola J, Ordás I, Rodriguez S, García-Bosch O, et al. Magnetic resonance imaging for evaluation of Crohns disease: Validation of parameters of severity and quantitative index of activity. Inflamm Bowel Dis 2011; 17(8): 1759-68.
45. Jenkins D, Balsitis M, Gallivan S, et al. Guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. The British Society of Gastroenterology initiative. J Clin Pathol 1997; 50: 93-105.
46. Brostrom O, Lofberg R, Ost A, Reichard H. Cancer surveillance of patients with longstanding ulcerative colitis: a clinical, endoscopical, and histological study. Gut 1986; 27: 1408-13.
47. Riddell RH, Goldman H, Ransohoff DF, et al. Dysplasia in inflammatory bowel disease: Standardized classification with provisional clinical applications. Hum Pathol 1983; 14: 931-68.
48. Melville DM, Jass JR, Morson BC, et al. Observer study of the grading of dysplasia in ulcerative colitis: comparison with clinical outcome. Hum Pathol 1989; 20: 1008-14.
49. Geboes K, Colombel JF, Greenstein A, Jewell DP, Sandborn WJ, et al. Indeterminate colitis: a review of the concept whats in a name? Inflamm Bowel Dis 2008; 14(6): 850-7.
50. Vermiere S, et al. Auto Antibodies in Inflammatory Bowel Diseases. Gastroenterol Clin N Am 2008; 37: 429-438.
51. Podolsky DK. Inflammatory bowel disease. N Engl J Med 2002; 347-56.
52. Laurent Peyrin-Biroulet et al. IBD Serological Panels: Facts and Perspectives. Inflamm Bowel Dis 2007; 13: 1561-156.
53. Bossuyt X. Serologic Markers in Inflammatory Bowel Disease. Clinical Chemistry 2006; 52: 171-181.
54. Austin G, et al. A Critical Evaluation of Serologic Markers for Inflammatory Bowel Disease. Clin Gastroenterol Hepatol 2007; 5: 545-547.
55. Hanauer SB, Sandborn W. Management of Crohn's disease in adults. Am J Gastroenterol 2001; 96: 635-643.
56. Van Assche G, et al. The second European evidence-based consensus on the diagnosis and management of Crohn's disease: Definitions and diagnosis. Journal of Crohn's and Colitis 2010; 4: 7-27.
57. Kornbluth A, et al. Ulcerative Colitis Practice Guidelines in Adults: American College of Gastroenterology, Practice Parameters Committee. Am J Gastroenterol2010; 105: 501-523.
58. Papp M, et al. Utility of serological markers in inflammatory bowel diseases: Gadget or magic? World J Gastroenterol 2007; 13(14): 2028-2036.
59. Konikoff MR, Denson LA. Role of Fecal Calprotectin as a Biomarker of Intestinal Inflammation in Inflammatory Bowel Disease. Inflamm Bowel Dis 2006; 12: 524-534.
60. Papp M, et al. New Serological Markers for Inflammatory Bowel Disease Are Associated With Earlier Age at Onset, Complicated Disease Behavior, Risk for Surgery, and NOD2/CARD15 Genotype in a Hungarian IBD Cohort Am J Gastroenterol 2008; 103: 665-681.
61. Daperno M, Castiglione F, de Ridder L, Dotan I, Färkkilä M, Florholmen J, Fraser G, Fries W, Hebuterne X, Lakatos PL, Panés J, Rimola J, Louis E. Results of the 2nd part Scientific Workshop of the ECCO (II): Measures and markers of prediction to achieve, detect, and monitor intestinal healing in Inflammatory Bowel Disease. J Crohns Colitis 2011; 5(5): 484-498.
62. Gee MS, Harisinghani MG. MRI in patients with inflammatory bowel disease. J Magn Reson Imaging 2011; 33(3): 527-34.
63. Tozer PJ, Burling D, Gupta A, Phillips RK, Hart AL. Review article: medical, surgical and radiological management of perianal Crohn's fistulas. Aliment Pharmacol Ther 2011; 33(1): 5-22.
64. Lewis RT, Maron DJ. Anorectal Crohns disease. Surg Clin North Am 2010; 90(1): 83-97.
65. Travis SP, Stange EF, Lémann M, Oresland T, Bemelman WA, Chowers Y, Colombel JF, et al. European evidence-based Consensus on the management of ulcerative colitis: Current management. J Crohns Colitis 2008; 2(1): 24-62.
66. Sandborn WB, Hanauer SB. Systematic review: the pharmacokinetics profiles of oral mesalazine formulations and mesalazine prodrugs used in the management of ulcerative colitis. Alim Pharmac Ther 2003; 17: 29-42.
67. Marshall JK, Irvine EJ. Rectal aminosalicylate therapy for distal ulcerative colitis: a meta-analysis. Aliment Pharmacol Ther 1995; 9: 293-300.
68. Safdi M, De Micco M, Sninsky C, et al. A double-blind comparison of oral vs. rectal mesalamine vs. combination therapy in the treatment of distal ulcerative colitis. Am J Gastroenterol 1997; 92: 1867-71.
69. Sutherland L, Mc Donald JK. Oral 5-amonisalicylic acid for maintenance of remission in ulcerative colitis (Review). Cochrane Database of Systematic Reviews 2006; 2: CD000544.
70. Van Assche G, Vermeire S, Rutgeerts P. Management of acute severe ulcerative colitis. Gut 2011; 60: 130-133.
71. Panaccione R, Rutgeerts P, Sandborn WJ, et al. Review article: treatment algorithms to maximize remission and minimize corticosteroid dependence in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008; 28: 674-688.
72. Ardizzone S, Maconi G, Russo A, et al. Randomised controlled trial of azathioprine and 5-ASA for treatment of steroid dependent ulcerative colitis. Gut 2006; 55: 47-53.
73. Rutgeerts P, Sandborn WJ, Feagan BG, et al. Infliximab for induction and maintenance therapy for ulcerative colitis. N Engl J Med 2005; 353: 2462-76.
74. Reinisch W, Sanbornd W, et al. Adalimimab for induction of clinical remission in moderately to severely active ulcerative colitis: results of a randomized controlled trial. Gut 2011; 60: 780-787.
75. Hoentjen F, Sakuraba A, Hanauer S. Update on the management of ulcerative colitis. Curr Gastroenterol Rep 2011; 13(5): 475-85.
76. Van Assche G, Lewis JD, Lichtenstein GR, Loftus EV, Ouyang Q, Panes J, Siegel CA, Sandborn WJ, Travis SP, Colombel JF. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohns and Colitis Organization: Safety. Am J Gastroenterol 2011; 106(9): 1594-602.
77. Hart AL, NG SC. Review article: the optimal medical Management of acute severe ulcerative colitis. Aliment Pharmacol Ther 2010;32:615-627.
78. Moskovitz DN, Van Assche G, Maenhout B, et al. Incidence of colectomy during long-term follow-up after cyclosporine-induced remission of severe ulcerative colitis. Clin Gastroenterol Hepatol 2006; 4: 760-765.
79. Gan SI, Beck PL. A New Look at Toxic Megacolon: An Update and Review of Incidence, Etiology, Pathogenesis, and Management. Am J Gastroenterol 2003; 98: 2363-2371.
80. Järnerot G, Hertervig E, Friis-Liby, et al. Infliximab as rescue therapy in severe to moderately severe ulcerative colitis: a randomized, placebo-controlled study. Gastroenterology 2005; 128: 1805-11.
81. Gustavsson A, Järnerot G, Hertervig E, et al. Clinical trial: colectomy after rescue therapy in ulcerative colitis 3-year follow-up of the Swedish-Danish controlled infliximab study. Aliment Pharmacol Ther 2010; 32: 984-989.
82. Seow CH, Benchimol EI, Griffiths AM, Otley AR, Steinhart AH. Budesonide for induction of remission in Crohns disease.Cochrane Database Syst Rev 2008; 3: CD000296.
83. Hanauer SB, Strömberg U. Oral Pentasa in the treatment of active Crohn's disease: a meta-analysis of double-blind, placebo-controlled trials. Clin Gastroenterol Hepatol 2004; 2: 379-88.
84. Dignass A, Van Assche G, Lindsay JO, Lémann M, Söderholm J, Colombel JF, et al. The second European evidence-based Consensus on the diagnosis and management of Crohn's disease: Current management.J Crohns Colitis 2010; 4(1): 28-62.
85. Talley NJ, Abreu MT, Achkar JP, Bernstein CN, Dubinsky MC, Hanauer SB, Kane SV, Sandborn WJ, Ullman TA, Moayyedi P. An evidence-based systematic review on medical therapies for inflammatory bowel disease.Am J Gastroenterol 2011; 106 Suppl 1: S2-25.
86. Mowat C, Cole A, Windsor A, Ahmad T, Arnott I, Driscoll R, Mitton S, Orchard T, Rutter M, Younge L, Lees C, Ho GT, Satsangi J, Bloom S. Guidelines for the management of inflammatory bowel disease in adults. Gut 2011; 60(5): 571-607.
87. Colombel JF, Sandborn WJ, Rutgeerts P, Enns R, Hanauer SB, Panaccione R, et al. Adalimumab for maintenance of clinical response and remission in patients with Crohn's disease: the CHARM trial. Gastroenterology 2007; 132: 52-65.
88. Schreiber S, Colombel JF, Bloomfield R, et al. Increased Response and Remission Rates in Short-Duration Crohn's Disease with subcutaneous Certolizumab Pegol: An Analysis of PRECiSE 2 Randomized Maintenance Trial Data. Am J Gastroenterol 2010; 105: 1574-1582.
89. Tremaine WJ. Gastroduodenal Crohn's disease: medical management. Inflamm Bowel Dis 2003; 9: 127-8.
90. Kwan LY, Conklin JL, Papadakis KA. Esophageal Crohn's disease treated successfully with adalimumab. Inflamm Bowel Dis 2007; 13: 639-40.
91. Hanauer SB, Feagan BG, Rutgeerts P, et al. Maintenance infliximab for Crohn's disease: the ACCENT I randomised trial. Lancet 2002; 359: 1541-49.
92. Rankin GB, Watts D, Melnyk CS, Kelley ML. National Cooperative Crohn's Disease Study: Extraintestinal manifestations and perianal complications. Gastroenterology 1997; 77: 914-20.
93. Sandborn WJ, Fazio VW, Feagan BG, et al. AGA medical position statement: perianal Crohn disease. Gastroenterol 2003; 125(5): 1508-30.
94. Caprilli R, Gasull MA, Escher JC, et al. European evidence based consensus on the diagnosis and mangement of Crohn's disease: special situations. Gut 2006; 55(Suppl I): i36-i58
95. Vavricka SR, Rogler G. Fistula treatment: The unresolved challenge. Dig Dis 2010; 28(3): 556-564.
96. Present DH, Rutgeerts P, Targan S, et al. Infliximab for the treatment of fistulas in patients with Crohn's disease. N Engl J Med 1999; 340: 1398-405.
97. Sands BE, Anderson FH, Rutgeerts P, et al. Infliximab maintenance therapy for fistulising Crohn's disease. N Engl J Med 2004; 350: 876-85.
98. Sands BE, Blank MA, Patel K, van Deventer SJ; ACCENT II Study. Long-term treatment of rectovaginal fistulas in Crohns disease: response to infliximab in the ACCENT II Study. Clin Gastroenterol Hepatol 2004; 2(10): 912-20.
99. Ford A, Bernstein CN, Khan HJ, et al. Glucorticosteroide therapy in inflammatory bowel disease: systematic review and meta-analysis. Am J Gastroenterol 2011; 106: 590-599.
100. Juliao F. Medical therapy for inflammatory bowel disease. Rev Col Gastro 2007; 22(4): 313-330.
101. Krisner JB. Historical aspects of inflammatory bowel disease. J Clin Gastroenterol 1988; 10: 286-97.
102. Sartor RB. Mechanisms of disease: pathogenesis of Crohns disease and ulcerative colitis. Nat Clin Pract Gastroenterol Hepatol 2006; 3(7): 390-407.
103. Clavel T, Haller D. Bacteria- and host-derived mechanisms to control intestinal epithelial cell homeostasis: implications for chronic inflammation. Inflamm Bowel Dis 2007; 13(9): 1153-64.
104. Prantera C, Scribano ML. Probiotics and Crohns disease. Dig Liver Dis 2002; 34Suppl 2: S66-7.
105. Guslandi M, Mezzi G, Sorghi M, Testoni PA. Saccharomyces boulardii in maintenance treatment of Crohns disease. Dig Dis Sci 2000; 45(7): 1462-4.
106. Rahimi R, Nikfar S, Rahimi F, et al. A meta-analysis on the efficacy of probiotics for maintenance of remission and prevention of clinical and endoscopic relapse in Crohns disease. Dig Dis Sci 2008; 53(9): 2524-31.
107. Rembacken BJ, Snelling AM, Hawkey PM, et al. Non-pathogenic Escherichia coli versus mesalazine for the treatment of ulcerative colitis: a randomised trial. Lancet 1999; 354(9179): 635-9.
108. Kruis W, Schütz E, Fric P, Fixa B, et al. Double-blind comparison of an oral Escherichia coli preparation and mesalazine in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 1997; 11(5): 853-8.
109. Zocco MA, dal Verme LZ, Cremonini F, et al. Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis. Aliment Pharmacol Ther 2006; 23(11): 1567-74.
110. Ishikawa H, Akedo I, Umesaki Y, et al. Randomized controlled trial of the effect of bifidobacteria-fermented milk on ulcerative colitis. J Am Coll Nutr 2003; 22(1): 56-63.
111. Kruis W, Fric P, Pokrotnieks J, et al. Maintaining remission of ulcerative colitis with the probiotic Escherichia coli Nissle 1917 is as effective as with standard mesalazine. Gut 2004; 53(11): 1617-23.
112. Tursi A, Brandimarte G, Papa A, Giglio A, et al. Treatment of relapsing mild-to-moderate ulcerative colitis with theprobiotic VSL#3 as adjunctive to a standard pharmaceutical treatment: a double-blind, randomized, placebo-controlled study. Am J Gastroenterol 2010; 105(10): 2218-27.
113. Sood A, Midha V, Makharia GK, et al. The probiotic preparation, VSL#3 induces remission in patients with mild-to-moderately active ulcerative colitis. Clin Gastroenterol Hepatol 2009; 7(11): 1202-9.
114. Kühbacher T, Ott SJ, Helwig U, Mimura T, et al. Bacterial and fungal microbiota in relation to probiotic therapy (VSL#3) in pouchitis. Gut 2006; 55(6): 833-41.
115. Gionchetti P, Rizzello F, Morselli C, et al. High-dose probiotics for the treatment of active pouchitis. Dis Colon Rectum 2007; 50(12): 2075-82.
116. Prantera C, Cottone M, Pallone F, et al. Mesalamina in the treatment of mild to moderate active Crohn's ileitis: results of a randomized, multicenter trial. Gastroenterology 1999; 116: 521-6.
117. Tremaine WJ, Schroeder KW, Harrison JM et al. A randomized, double-blind placebo-controlled trial of the oral mesalamina (5-ASA) preparation, Asacol, in the treatment of symptomatic Crohn's colitis and ileocolitis. J Clin Gastroenterol 1994; 19: 278-82.
118. Singleton JW, Hanauer SB,Gitnick GL et al. Mesalamine capsules for the treatment of active Crohn's disease: results of a 16-week trial. Pentasa Crohn's Disease Study Group. Gastroenterology 1993; 104: 1293-301.
119. Cohen RD, Woseth DM, Thisted RA, et al. A meta-analysis and overview of the literature on treatment options for left-sided ulcerative colitis and ulcerative proctitis. Am J Gastroenterol 2000: 95; 1263-76.
120. Regueiro M, Loftus EV Jr, Steinhart AH. Medical management of left-sided ulcerative colitis and ulcerative proctitis: critical evaluation of therapeutic trials. Inflamm Bowel Dis 2006; 12: 979-94.
121. Regueiro M,Loftus EV Jr,Steinhart Ah et al. Clinical guidelines for the medical management of left-sided ulcerative colitis and ulcerative proctitis: summary statement. Inflamam Bow Dis 2006; 12: 972-8.
122. Campieri M, Lanfranchi GA, Bazzocchi G et al. Treatment of ulcerative colitis with high-dose 5 aminosalicylic acid enemas. Lancet 1981; 2: 270-1.
123. Topical 5-aminosalicylic acid vs. prednisone in ulcerative proctosigmoiditis. A randomized double-bind multicenter trial.Danish 5-ASA group. Dig Dis Sci 1987; 32: 598-602.
124. Marshal JK, Irvine EJ. Rectal corticosteroids vs. Alternative treatments in ulcerative colitis; a meta-analysis. Gut 1997; 40: 775-81.
125. Panaccione R, et al. Review article: treatment algorithms to maximize remission and minimize corticosteroid dependence in patients with inflammatory bowel disease. Aliment Pharmacol Ther 2008; 28: 674-688.
126. D'Haens G et al. Early combined immunosuppression or conventional management in patients with newly diagnosed Crohn's disease: an open randomised trial. Lancet 2008; 371: 660-67.
127. American Gastroenterological Association Institute Technical Review on Corticosteroids, Immunomodulators, and Infliximab in Inflammatory Bowel Disease. Gastroenterology 2006; 130: 940-987.
128. Kornbluth AA,Salomon P, Sacks HS et al. Meta-analysis of the effectiveness of current drug therapy of ulcerative colitis. J ClinGastroenterol 1993; 16: 215-218.
129. Colombel J et al. Infliximab, Azathioprine, or Combination Therapy for Crohn's Disease. N Engl J Med 2010; 362: 1383-95.
130. DHaens GR, Panaccione R, Higgins PD y cols. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohns and Colitis Organization: when to start, when to stop, which drug to choose, and how to predict response? Am J Gastroenterol 2011; 106(2): 199-212.
131. Hanauer SB, Sandborn WJ, Rutgeerts P, et al. Human anti-tumor necrosis factor monoclonal antibody (adalimumab) in Crohn's disease: the CLASSIC I trial. Gastroenterology 2006; 130: 323-33.
132. Sandborn WJ, Rutgeerts P, Enns R, et al. Adalimumab induction therapy for Crohn disease previously treated with infliximab: a randomized trial. Ann Intern Med 2007; 146: 829-838.
133. Sandborn WJ, Hanauer SB, Rutgeerts P, et al. Adalimumab for maintenance treatment of Crohn's disease: results of the CLASSIC II trial. Gut 2007; 56: 1232-1239.
134. Stallmach A, Hagel S, Bruns T. Adverse effects of biologics used for treating IBD. Best Practice & Research Clinical Gastroenterology 2010; 24: 167-182.
135. de Silva S, Devlin S, Panaccione R. Optimizing the safety of biologic therapy for IBD. Nat Rev Gastroenterol Hepatol 2010; 7(2): 93-101.
136. Almogy G, Sachar DB, et al. Surgery for ulcerative colitis in elderly persons: changes in indications for surgery and outcome over time. Arch Surgery 2001; 136: 1396-1400.
137. Gullberg K, Liljeqvist L. Stapled ileoanal pouches without loop ileostomy: a prospective study in 86 patients. Int J Colorectal Dis 2001; 16: 221-227.
138. Bernstein CN, Fried M, et al. World gastroenterology Organization practice guidelines for the diagnosis and management of IBD in 2010. Inflamm Bowel Dis 2010; 16(1): 112-24.
139. Eaden JA, Abrams KR, et al. The risk of colorectal cancer in ulcerative colitis: a meta-analysis. Gut 2001; 48: 526-35.
140. ItzkowitzSh, Present DH. Consensus conference on colorectal cancer screening and surveillance in inflammatory bowel disease. Inflamm Bowel Dis 2005; 11: 314-21.
141. Herszenyi L, Miheller P, et al. Carcinogenesis in inflammatory bowel disease. Dig Dis 2007; 25: 267-9.
142. Berg DF, Bahadursingh AM, et al. Acute surgical emergencies in inflammatory bowel disease. Am J Surg 2002; 184: 45-51.
143. Hefti MH, Chessin DB, et al. Severity of inflammation as a predictor of colectomy in patients with chronic ulcerative colitis. Dis Colon Rectum 2009; 193-197.
144. Gan SI, Beck PL, et al. A new look at toxic megacolon: an update and review of incidence, etiology, pathogenesis and management. Am J Gastroenterol 2003; 98: 2363-71.
145. Travis SPL, Stange EF, Lémann M, et al. European evidence based consensus on the diagnosis and management of Crohn's disease: current management. Gut 2006; 55(Suppl I): i16-i35.
146. Marrero F, Qadeer MA, Lashner BA. Severe complications of IBD. Med Clin N Am 2008; 92: 671-686.
147. Heuman R, Boeryd B, Bolin T, et al. The influence of disease at the margin of resection on the outcome of Crohn's disease. Br J Surg 1983; 70: 519-21.
148. Gardiner KR, Dasari BV. Operative management of small bowel Crohn's disease. Surg Clin North Am 2007; 87: 587-610.
149. Steele SR. Operative management of Crohn's disease of the colon including anorectal disease. Surg Clin North Am 2007; 87: 611-31.
150. McLeod RS. Surgery for inflammatory bowel diseases. Dig Dis 2003; 21: 168-79.
151. Tilney HS, Constantinides VA, Heriot AG, et al. Comparison of laparoscopic and open ileocecal resection for Crohn's disease: a meta-analysis. Surg Endosc 2006; 20: 1036-44.
152. Gervais DA, Hahn PF, O'Neill MJ, et al. Percutaneous abscess drainage in Crohn disease: technical success and short- and long-term outcomes during 14 years. Radiology 2002; 222: 645-51.
153. Garcia JC, Persky SE, Bonis PA, et al. Abscesses in Crohn's disease: outcome of medical versus surgical treatment. J Clin Gastroenterol 2001; 32: 409-12 .
154. Yamaguchi A, Matsui T, Sakurai T, et al. The clinical characteristics and outcome of intraabdominal abscess in Crohn's disease. J Gastroenterol 2004; 39: 441-8.
155. Hwang JM, Varma MG. Surgery for inflammatory bowel disease. World J Gastroenterol 2008; 14: 2678-2690.
156. Sachar DB. Indications for Surgery in Crohn's Disease. Am J Gastroenterol 2007; 102: S76- S78.
157. Lahat A, Chowers Y. The patient with recurrent obstruction due to Crohn's disease. Best Practice and Research Clinical Gastroenterology 2007; 21: 427-444.
158. Roses RE, Rombeau JL. Recent trends in the surgical management of inflammatory bowel disease. World J Gastroenterol 2008; 14: 408-412.
159. Simillis C, Purkayastha S, Yamamoto T, B S A et al. A meta-analysis comparing conventional end-to end anastomosis vs. other anastomotic configurations after resection in Crohn's disease. Dis Colon Rectum 2007; 50: 1674-1687.
160. Tekkis PP, Purkayastha S, Athanasiou T, Heriot AG, Orchard TR, Nicholls RJ, Darzi AW. A comparison of segmental vs. subtotal colectomy for colonic Crohn's disease: a meta-analysis. Colorectal Dis 2006; 8: 82-90.
161. O'Keefe SJ. Nutrition and gastrointestinal disease. Scand J Gastroenterology Suppl 1996; 220: 52-59.
162. Burke A, Lichtenstein GR, Rombeau JL. Nutrition and ulcerative colitis. Baillieres Pract Res Clin Gastroenterol 1997; 11: 153-74.
163. Mark H DeLegge. Nutrition and Gastrointestinal Disease. Humana Press Inc. 2008.
164. The A.S.P.E.N. Nutrition Support Practice Manual 2nd Edition 2005.
165. Bernstein CN, Leslie WD. Review article: Osteoporosis and inflammatory disease. Aliment Pharmacol Ther 2004; 19: 941-952.
166. Vestergaard P. Bone loss associated with gastrointestinal disease: prevalence and pathogenesis. Eur J Gastroenterol Hepatol 2003; 15: 851-856.
167. Hawthorne AB, Daneshmend TK, Hawkey CJ, et al. Treatment of ulcerative colitis with fish oil supplementation: a prospective 12 month randomized controlled trial. Gut 1992; 33: 9220-928.
168. Aslan A, Triadafilopoulos G. Fish oil fatty acid supplementation in active ulcerative colitis: a double-blind, placebo-controlled, crossover study.Am J Gastro 1992; 87: 432-437.
169. Fischer JE. Inflammatory bowel disease. En Fischer, ed. Total Parenteral Nutrition 2nd ed. Boston: Little, Brown; 1991. p. 239-251.
170. Jorquera Plaza F, EspinelDiez J, Olcoz Goni JL. Inflammatory bowel disease: importance of nutrition today. Nutr Hosp 1997; 12(6): 289-98.
171. Rombeau JL, Barot LR, Williamson CE, Mullen JL. Preoperative total parenteral nutrition and surgical outcome in patients with inflammatory bowel disease. Am J Surg 1982; 143: 139-143.
172. Lashner BA, Evans AA, Hanauer SB. Preoperative total parenteral nutrition for bowel resection in Crohn's disease. Dig Dis Science 1989; 34: 741-746.
173. Arvikar SL, Fisher MC. Inflammatory bowel disease associated arthropathy. Curr Rev Musculoskelet Med 2011.
174. Yüksel I, Ataseven H, Başar O, Köklü S, Ertuğrul I, et al. Peripheral arthritis in the course of inflammatory bowel diseases. Dig Dis Sci 2011; 56(1): 183-7.
175. Etzel JP, Larson MF, Anawalt BD, Collins J, Dominitz JA. Assessment and management of low bone density in inflammatory bowel disease and performance of professional society guidelines Inflamm Bowel Dis 2011; 17(10): 2122-9.
176. Yosipovitch G, Hodak E, Feinmesser M, David M. Cutaneous manifestations of inflammatory bowel disease. JEADV 2000; 14: 349-50.
177. Thomas Apgar J. Newer aspects of inflammatory bowel disease and its cutaneous manifestations: A selective review. Sem Dermatol 1991; 10: 138-47.
178. Cury DB, Moss AC. Ocular manifestations in a community-based cohort of patients with inflammatory bowel disease.Inflamm Bowel Dis 2010; 16(8): 1393-6.
179. Manganelli C, Turco S, Balestrazzi E. Ophthalmological aspects of IBD. Eur Rev Med Pharmacol Sci 2009; Suppl 1: 11-3.
180. Mahadevan U, Cucchiara S, Hyams JS, et al. The London Position Statement of the World Congress of Gastroenterology on Biological Therapy for IBD with the European Crohns and Colitis Organization: pregnancy and pediatrics. Am J Gastroenterol 2011; 106(2): 214-23; quiz 224. Epub 2010 Dec 14.
181. Beaulieu DB, Kane S. Inflammatory bowel disease in pregnancy. World J Gastroenterol 2011; 17(22): 2696-701.
182. Dotan I. CESAME substudy on thiopurines in pregnancy: Is this the baby we were waiting for? Inflamm Bowel Dis. 2011 May 25. doi: 10.1002/ibd.21764.
183. Molnar T, Farkas K, Nagy F, Szepes Z, Wittmann T. Growth retardation in the newborn of ulcerative colitis patients can be the consequence of drug therapy.Aliment Pharmacol Ther 2011; 33.
184. Van Assche G, Dignass A, Reinisch W, et al. The second European evidence-based Consensus on the diagnosis and management of Crohns disease: Special situations. European Crohns and Colitis Organisation (ECCO).J Crohns Colitis 2010; 4(1): 63-101. Epub 2009 Dec 21.
185. Mahadevan U. Pregnancy and inflammatory bowel disease. Med Clin North Am 2010; 94(1): 53-73.
186. Djokanovic N, Klieger-Grossmann C, Pupco A, Koren G. Safety of infliximab use during pregnancy Reprod Toxicol 2011; 32(1): 93-7.
187. Gisbert JP. Safety of immunomodulators and biologics for the treatment of inflammatory bowel disease during pregnancy and breast-feeding.InflammBowel Dis 2010; 16(5): 881-95.
188. Pierdomenico M, Stronati L, Costanzo M, Vitali R, Di Nardo G, Nuti F, et al. New insights into the pathogenesis of inflammatory bowel disease: transcription factors analysis in bioptic tissues from pediatric patients. J Pediatr Gastroenterol Nutr 2011; 52(3): 271-9.
189. Grijalba C, Vera-Chamorro JF, Suárez MA. Colitis ulcerativa (CU) en dos instituciones de Bogotá. Colombia Médica 2005; 36(S1): S71.
190. Van Limbergen J, Russel RK, Drummond HE, et al. Definition of phenotypic characteristics of childhood-onset inflammatory bowel disease. Gastroenterology 2008; 135: 1114-22.
191. Freeman JH. Comparison of longstanding pediatric-onset and adult-onset Crohn's disease. J Paediatr Gastroenterol Nutr 2004; 39: 183-6.
192. Heyman MB, Kirschner BS, Gold BD, et al. Children with early-onset inflammatory bowel disease (IBD): analysis of a pediatric IBD consortium registry. J Pediatr 2005; 146: 35-40.
193. Guariso G, Gasparetto M, VisonàDallaPozza L, DIncà R, Zancan L, Sturniolo G, et al. Inflammatory Bowel Disease Developing in Paediatric and Adult Age. Journal of Pediatric Gastroenterology and Nutrition 2010; 51(6): 698-707.
194. Harris P. Enfermedad inflamatoria intestinal en pediatría. Gastr Latinoam 2007; 18: 299-307.
195. Burnham JM, Shults J, Semeao E, et al. Whole body BMC in pediatric Crohn's disease: independent effects of altered growth, maturation, and body composition. J Bone Miner Res 2004; 19: 1961-1968.
196. Sandhu BK, Fell JM, Beattie RM, Mitton SG, Wilson DC, Jenkins H, et al. Guidelines for the Management of Inflammatory Bowel Disease in Children in the United Kingdom. Journal of Pediatric Gastroenterology and Nutrition 2010; 50: S1-S13.
197. Sabery N, Bass D. Use of serologic markers as a screening tool in inflammatory bowel disease compared with elevated erythrocyte sedimentation rate and anemia. Pediatrics 2007; 119: 193-199.
198. Mack DR, Langton C, Markowitz J, et al. Laboratory values for children with newly diagnosed inflammatory bowel disease. Pediatrics 2007; 119: 1113-1119.
199. Jenkins D, Balsitis M, Gallivan S. et al Guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. The British Society of Gastroenterology Initiative. J Clin Pathol 1997; 5093: 105.
200. Feakins RM. An audit of UK pathologists use of the British Society of Gastroenterology guidelines for the initial biopsy diagnosis of suspected chronic idiopathic inflammatory bowel disease. J Clin Pathol 2007; 60(10): 1178-9.
201. Fuchs Y, Markowitz J, Weinstein T, Kohn N, Choi-Rosen J, Levine J. Pediatric Inflammatory Bowel Disease and Imaging-related Radiation: Are We Increasing the Likelihood of Malignancy? Journal of Pediatric Gastroenterology and Nutrition 2011; 52(3): 280-5.
202. Zholudev A, Zurakowski D, Young W, Leichtner A, Bousvaros A. Serologic testing with ANCA, ASCA, and anti-OmpC in children and young adults with Crohn's disease and ulcerative colitis: diagnostic value and correlation with disease phenotype. Am J Gastroenterol 2004; 99: 2235-2241.
203. Fagerberg UL, Loof L, Lindholm J, Hansson LO, Finkel Y. Fecal calprotectin: a quantitative marker of colonic inflammation in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 45: 414-420.
204. Joishy M, Davies I, Ahmed M, et al. Fecal calprotectin and lactoferrin as noninvasive markers of pediatric inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2009; 48: 48-54.
205. Anupindi S, Darge K. Imaging choices in inflammatory bowel disease. Pediatric Radiology 2009; 39(0): 149-52.
206. Grahnquist L, Chapman S C, Hvidsten S. Evaluation of 99mTc-HMPAO leukocyte scintigraphy in the investigation of pediatric inflammatory bowel disease. J Pediatr 2003; 143: 48-53.
207. Stuart S, Conner T, Ahmed A, Steward M, Maclachlan J, Wylie P, et al. The smaller bowel: imaging the small bowel in paediatric Crohns disease. Postgrad Med J 2011.
208. Berlin L. To Order or Not to Order A CT Examination Because of Radiation Exposure: That Is the Question. Am J Roentgenol 2011; 196(2): W216.
209. Dabritz J, Jasper N, Loeffler M, Weckesser M, Foell D. Noninvasive assessment of pediatric inflammatory bowel disease with (1)F-fluorodeoxyglucose-positron emission tomography and computed tomography. Eur J GastroenterolHepatol 2011; 23(1): 81-9.
210. Di Nardo G, Oliva S, Ferrari F, Riccioni ME, Staiano A, Lombardi G, et al. Usefulness of wireless capsule endoscopy in paediatric inflammatory bowel disease. Dig Liver Dis 2011; 43(3): 220-4.
211. Walmsley RS, Ayres RCS, Pounder RE, et al. A simple clinical colitis index. Gut 1998; 43: 29-32.
212. Turner D, Otley AR, Mack D, et al. Development and evaluation of a Paediatric Ulcerative Colitis Activity Index (PUCAI): a prospective multicentre study. Gastroenterology 2007; 133: 423-32.
213. Wilson D, Thomas A, Croft N, Newby E, Akobeng A, Sawczenko A, et al. Systematic Review of the Evidence Base for the Medical Treatment of Paediatric Inflammatory Bowel Disease. Journal of Pediatric Gastroenterology and Nutrition 2010; 50: S14-S34.
214. Odera G, Giuliani B, Santini B, et al. Topical treatment with 5-aminosalicylic acid (5-ASA) and hydrocortisone enemas in proctocolitis in childhood (double blind study). Rivista Ital Pediatr 1986; 12: 674-8.
215. Lennard-Jones JE, Longmore AJ, Newell AC, et al. An assessment of prednisone, Salazopyrin and topical hydrocortisone hemisuccinate used as outpatient treatment for ulcerative colitis. Gut 1960; 1: 217-22.
216. Truelove SC, Watkinson G, Draper G. Comparison of corticosteroid and SASP therapy in ulcerative colitis. BMJ 1962; 2: 1708-11.
217. Baron JH, Connell AM, Kanaghinis TG, et al. Outpatient treatment of ulcerative colitis: comparison between three doses of oral prednisone. BMJ 1962; 2: 441-3.
218. Hyams J, Markowitz J, Lerer T, et al. The natural history of corticosteroid therapy for ulcerative colitis in children. Clin Gastroenterol Hepatol 2006; 4: 1118-23.
219. Beattie RM, Nicholls SW, Domizio P, et al. Endoscopic assessment of the colonic response to corticosteroids in children with ulcerative colitis. J Pediatr Gastroenterol Nutr 1996; 22: 373-9.
220. Daperno M, Sostegni R, Rocca R, et al. Medical treatment of severe ulcerative colitis. Aliment Pharmacol Ther 2002; 16: 7-12.
221. Chapman RW, Selby WS, Jewell DP. Controlled trial of intravenous metronidazole as an adjunct to corticosteroids in severe ulcerative colitis. Gut 1986; 27: 1210-2.
222. Benkov KJ, Rosh JR, Schwersenz AH, et al. Cyclosporin as an alternative to surgery in children with inflammatory bowel disease. J Pediatr Gastroenterol Nutr 1994; 19: 290-4.
223. Treem WR, Cohen J, Davis PM, et al. Cyclosporine for the treatment of fulminant ulcerative colitis in children. Immediate response, long-term results and impact on surgery. Dis Colon Rectum 1995; 38: 474-9.
224. Russell GH, Katz AJ. Infliximab is effective in acute but not chronic childhood ulcerative colitis. J Pediatr Gastroenterol Nutr 2004; 39: 166-70.
225. Barden L, Lipson A, Pert P, et al. Mesalazine in childhood inflammatory bowel disease. Aliment Pharmacol Ther 1989; 3: 597-603.
226. Tolia V, Massoud N, Klotz U. Oral 5-aminosalicyclic acid in children with colonic chronic inflammatory bowel disease: clinical and pharmacokinetic experience. J Pediatr Gastroenterol Nutr 1989; 8: 333-8.
227. Wiersma H, Escher JC, Dilger K, et al. Pharmacokinetics of mesalazine pellets in children with inflammatory bowel disease. Inflamm Bowel Dis 2004; 10: 626-31.
228. Jewell DP, Truelove SC. Azathioprine in ulcerative colitis: final report on a controlled therapeutic trial. BMJ 1974; 2: 627-30.
229. McGovern DPB, Travis SPL. Thiopurine therapy: when to start and when to stop. Eur J Gastroenterol Hepatol 2003; 15: 219-24.
230. Hawthorne AB, Logan RFA, Hawkey CJ, et al. Randomised controlled trial of azathioprine-withdrawal in ulcerative colitis. BMJ 1992; 305: 20-2.
231. Hyams J, Ferry GD, Mandel FS, et al. Development and validation of a pediatric Crohn's disease activity index. J Pediatr Gastroenterol Nutr 1991; 12: 439-47.
232. Tomomasa T, Kobayashi A, Ushijima K, et al. Guidelines for treatment of ulcerative colitis in children. PediatrInt 2004; 46: 494-6.
233. Working Group of the Japanese Society for Paediatric Gastroenterology, Hepatology and Nutrition. Guidelines for the treatment of Crohn's disease in children. Pediatr Int 2006; 48: 349-52.
234. Ruuska T, Savilahte E, Maki M, et al. Exclusive whole protein enteral diet versus prednisolone in the treatment of acute Crohn's disease in children. J Pediatr Gastroenterol Nutr 1994; 19: 175-80.
235. Heuschkel RB, Menache CC, Megerian JT, et al. Enteral nutrition and corticosteroids in the treatment of acute Crohn's disease in children. J Pediatr Gastroenterol Nutr 2000; 31: 8-15.
236. Kundhal P, Zachos M, Holmes JL, et al. Controlled ileal release budesinide in pediatric Crohn's disease: efficacy and effect on growth. J Pediatr Gastroenterol Nutr 2001; 33: 75-80.
237. Borrelli O, Cordischi L, Cirulli M, et al. Polymeric diet alone versus corticosteroids in the treatment of active pediatric Crohn's disease: a randomized controlled open-label trial. Clin Gastroenterol Hepatol 2006; 4: 744-53.
238. Bar-Meir S, Chowers Y, Lavy A, et al. Budesinide versus prednisolone in the treatment of active Crohn's disease. The Israeli Budesinide study group. Gastroenterology 1998; 115: 835-40.
239. Singleton J. Second trial of mesalamine therapy in the treatment of active Crohn's disease. Gastroenterology 1994; 107: 632-3.
240. D'Agata ID, Vanounou T, Seidman E. Mesalamine in paediatric inflammatory bowel disease: a 10-year experience. Inflamm Bowel Dis 1996; 2: 229-35.
241. Griffiths A, Koletzko S, Sylvester F, et al. Slow-release 5-aminosalicylic acid therapy in children with small intestinal Crohn's disease. J Pediatr Gastroenterol Nutr 1993; 17: 186-92.
242. Uhlen S, Belbouab R, Narebski K, et al. Efficacy of methotrexate in pediatric Crohn's disease: a French multicenter study. Inflamm Bowel Dis 2006; 12: 1053-7.
243. Alfdhli AA, McDonald JW, Feagan BG. Methotrexate for induction of remission in refractory Crohn's disease. Cochrane Database Syst Rev 2003; 1: CD003459.
244. Hyams J, Crandall W, Kugathasan S, et al. Induction and maintenance infliximab therapy for the treatment of moderate-to-severe Crohn's disease in children. Gastroenterology 2007; 132: 863-73.
245. Ba'ath ME, Mahamalat MW, Kapur P, et al. Surgical management of inflammatory bowel disease. Arch Dis Child 2007; 92: 312-6.
246. Pacilli M, Eaton S, Fell JM, Rawat D, Clarke S, Haddad MJ. Surgery in Children with Crohn Disease Refractory to Medical Therapy. Journal of Pediatric Gastroenterology and Nutrition 2011; 52(3): 286-90.
247. Rufo PA, Bousvaros A. Current therapy of inflammatory bowel disease in children. Paediatr Drugs 2006; 8(5): 279-302.
248. Jeshion WC, Larsen KL, Jawad AF, et al. Azathioprine and 6-mercaptopurine for the treatment of perianal Crohn's disease in children. J ClinGastroenterol 2000; 30: 294-8.
249. Lewis JD, Schwartz JS, Lichtenstein GR. Azathioprine for maintenance of remission in Crohn's disease: benefits outweigh the risk of lymphoma. Gastroenterology 2000; 118: 1018-24.
250. Mackey AC, Green L, Liang LC, et al. Hepatosplenic T cell lymphoma associated with infliximab use in young patients treated for inflammatory bowel disease. J Pediatr Gastroenterol Nutr 2007; 44: 265-7.
251. Bousvaros A. Use of immunomodulators and biologic therapies in children with inflammatory bowel disease. Expert Rev Clin Immunol 2010; 6(4): 659-66.
252. Rolfe VE, Fortun PJ, Hawkey CJ, et al. Probiotics for maintenance of remission in Crohn's disease. Cochrane Database Syst Rev 2006; 4: CD004826.
253. Walther F, Fusch C, Radke M, et al. Osteoporosis in pediatric patients suffering from chronic inflammatory bowel disease with and without steroid treatment. J Pediatr Gastroenterol Nutr 2006; 43: 42-51.
254. Mahadevan Uma, Samborn William. Diagnosis and Management of pouchitis. Gastroenterology 2003; 124: 1636-1650.
255. Pemberton JH, Kelly KA, Beart RW Jr, Dozois RR, Wolff BG, Ilstrup DM. Ileal pouch-anal anastomosis for chronic ulcerative colitis: Long-term results. Ann Surg 1987; 206: 504-513.
256. Hoda MH, Collins JF, Knigge K et al. Predictors of Pouchitis after Ilea Pouch-Anal Anastomosis: A Retrospective Review. Disease of the colon and rectum 2008; 51: 554-560.
257. Cheifetz A, Itzkowitz S. The diagnosis and treatment of pouchitis in inflammatory bowel disease. J Clin Gastroenterol 2004; 38: S44-50.
258. Pardi W. Sanborn J. Systematic review: the management of pouchitis. Alimentary Pharmacology & Therapeutics 2006; 23: 1087-1096.
259. Shen B, Fazio V, Remzi F. Risk Factors for Diseases of Ileal Pouch–Anal Anastomosis After Restorative Proctocolectomy for Ulcerative Colitis. Clinical Gastroenterology and Hepatology 2006; 4: 81-89.
260. Fleshner P, Ippoliti A, Dubinsky M, et al. A prospective multivariate analysis of clinical factors associated with pouchitis after ileal pouch anal anastomosis. Clin Gastroenterol Hepatol 2007; 5: 952-58.
261. Shen B, Achkar JP, Lashner B, et al. Endoscopic and Histologic Evaluation Together with Symptom Assessment Are Required to Diagnose Pouchitis. Gastroenterology 2001; 121: 261-267.
262. Di Febo G, Miglioli M, Lauri A, et al. Endoscopic assessment of acute inflammation of the ileal reservoir after restoativeileo-anal anastomosis. Gastrointe Endosc 1990; 36: 6-9.
263. Moskowitz RL, Shepherd NA, Nicholls RJ. An assessment of inflammation in the reservoir after restorative proctocolectomy with ileoanal ileal reservoir. Int J Colorectal Dis 1986; 1: 167-74.
264. Hurst RD, Molinari M, Chung TP, et al. Prospective study of the incidence, timing and treatment of pouchitis in 104 consecutive patients after restorative proctocolectomy. Arch Surg 1996; 131: 497-500.
265. Holubar SD, Cima RR, Sandborn WJ, Pardi DS. Treatment and prevention of pouchitis after ileal pouch-anal anastomosis for chronic ulcerative colitis (Review). The Cochrane Collaboration 2010.
266. Rutgeerts P, Geboes K, Vantrappen G, et al. Predictability of the postoperative course of Crohn's disease. Gastroenterology 1990; 99: 956-63.
267. Sailer J, Peloschek P, Reinisch W, et al. Anastomotic recurrence of Crohn's disease after ileocolic resection: comparison of MR enteroclysis with endoscopy. Eur Radiol 2008; 18: 2512-2521.
268. Lamb CA, Mohiuddin MK, Gicquel J, et al. Faecal calprotectin or lactoferrina can identify postoperative recurrence in Crohn's disease. Br J Surg 2009; 96: 663-674.
269. Blum E, MD, Katz JA. Therapy for Crohn's Disease. Inflamm Bowel Dis 2009; 15: 463-472.
270. Doherty G, Bennett G, Patil S, Cheifetz A, Moss AC. Interventions for prevention of post-operative recurrence of Crohns disease. Cochrane Database of Systematic Reviews 2009, Issue 4.
271. Swoger JM, Regueiro M. Preventive therapy in postoperative Crohn's disease. Current Opinion in Gastroenterology 2010; 26: 337-343.