Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO -
 Accesos
Accesos
Links relacionados
-
 Citado por Google
Citado por Google -
 Similares en
SciELO
Similares en
SciELO -
 Similares en Google
Similares en Google
Compartir
Revista colombiana de Gastroenterología
versión impresa ISSN 0120-9957
Rev Col Gastroenterol vol.27 supl.2 Bogotá dic. 2012
IV. Diagnóstico
Fabio Leonel Gil Parada, MD. (1), Rocío del Pilar López Panqueva, MD. (2)
(1) Gastroenterólogo, Clínica Universitaria Colombia. Bogotá, Colombia
(2) Médica Especialista en Patología; Hospital Universitario Fundación Santa Fe de Bogotá. Profesora Clínica asociada Facultad de Medicina Universidad de Los Andes. Bogotá, Colombia
Para el diagnóstico de la hepatitis viral C (HVC) debemos tener en cuenta varios parámetros. El diagnóstico clínico y bioquímico; el diagnóstico serológico y virológico; y finalmente la evaluación del compromiso hepático.
La hepatitis aguda por el virus C se define por la elevación de la alanino aminotransferasa por encima de 10 veces su valor normal en un individuo sin enfermedad hepática previa u otra causa conocida, la presencia en la primera muestra de suero del ácido ribonucleico (ARN) del virus y desarrollo de anticuerpos, frecuentemente asintomática y no percibida clínicamente. En el caso de la hepatitis C neonatal, por la presencia del ARN del virus en el suero de 1 a 6 meses de nacido típicamente en el contexto de la transmisión maternofilial, es frecuente su resolución espontánea y se debe diferenciar con el seguimiento de la viremia transitoria que puede ocurrir en los primeros 5 días del nacimiento, por lo cual su detección en el cordón umbilical es irrelevante (1).
La infección crónica, por la evidencia de infección viral activa con presencia de ARN del virus de la hepatitis C (VHC) por al menos 6 meses implica lesión hepática. En la infancia tener en cuenta que la inmunoglobulina G (IgG) cruza la placenta, por lo cual el diagnóstico se realiza por la detección del ARN del VHC, y no es aplicable la serología antes de los 18 meses de edad como diagnóstico de la infección (1).
Aunque solamente alrededor de 15% de los casos nuevos que adquieren la infección son sintomáticos, se debe insistir en buscar pacientes recientemente infectados en los grupos de riesgo, por los beneficios e implicaciones del tratamiento antiviral lo más temprano posible para prevenir la progresión y reducción en la carga futura de la enfermedad. Por ejemplo, en la población de pacientes drogadictos que se inyectan, hacer pruebas cada 6 a 12 meses para detectar casos nuevos y reinfección, o como en Estados Unidos (EE.UU.) en la población de pacientes que nacieron entre 1945 a 1965 que deberían tener por lo menos una prueba de detección independiente de los factores de riesgo (1-6).
La presencia de síntomas generales e ictericia se relacionan con el proceso infeccioso o el compromiso hepático, y pueden ocurrir manifestaciones extrahepáticas como la crioglobulinemia, liquen plano, porfiria cutánea tarda, sialoadenitis linfocítica, disfunción cognitiva y glomerulonefritis membranosa. Debido a la ausencia de síntomas en la mayoría de pacientes, como parte de un enfoque preventivo o de detección oportuna debemos aunar esfuerzos durante la realización de una historia clínica completa para detectar pacientes con factores o conductas de riesgo que deben ser orientados en las medidas preventivas y a su vez evaluados con serología para la hepatitis C, entre otras, con el grave inconveniente que aproximadamente 80% de los pacientes positivos son virémicos (1, 7, 8).
El principal factor de riesgo en Colombia como en otros países de Latinoamérica son las transfusiones de sangre y sus derivados, por ejemplo, los pacientes hemofílicos con historia de transfusión (crioprecipitado o sangre total) antes de 1995. El segundo grupo de riesgo son los drogadictos que van en aumento, y se prevé que hacia el futuro pueden ser el principal riesgo de transmisión en nuestro país como en EE.UU. y Europa (9-11), y debemos estar alerta ante la transmisión nosocomial.
Durante el diagnóstico también es muy importante la historia de consumo de alcohol, tener en cuenta la posibilidad de coinfección con otros virus y se deben hacer las pruebas para el virus de la inmunodeficiencia humana y el de la hepatitis B; además se debe hacer el estudio de marcadores de autoinmunidad y metabólicos, para evaluar la presencia de comorbilidad y otros factores de riesgo de enfermedad hepática, por ejemplo la resistencia a la insulina que está presente en 30 a 70% de los pacientes infectados con el VHC y a su vez se relaciona con la obesidad, diabetes e hígado graso (7, 9). También se indica la determinación del polimorfismo genético del huésped en relación con la interleucina 28B (IL28B) en el cromosoma 19 en los pacientes que van a ser tratados, ya que es otro de los factores que predice la respuesta virológica sostenida al interferón pegilado ribavirina y se relaciona con factores étnicos y raciales particularmente en los infectados con el genotipo 1 (7).
ESTUDIOS DE LABORATORIO
Disponemos de dos tipos de estudio para el diagnóstico, la serología para detectar anticuerpos específicos contra el VHC y los estudios moleculares para detectar el ácido nucleico viral, aunque no definen severidad de la enfermedad o pronóstico (8).
Serología como prueba de detección o diagnóstico de la infección por el virus. Los anticuerpos (IgG) detectados en suero o plasma por inmunoensayo enzimático (ELISA o EIA) con una sensibilidad de 97% y especificidad mayor a 99% en las pruebas de tercera generación que se usan en la actualidad. La detección de anticuerpos indica contacto con el virus y no discrimina entre infección aguda, crónica o resuelta. Aunque los anticuerpos pueden permanecer de por vida en los pacientes inmunocompetentes con infección crónica, en los pacientes que se recuperan espontáneamente tienden a desaparecer entre 18 a 20 años. Puede ocurrir un eventual falso positivo en poblaciones con baja prevalencia y falso negativo en caso de inmunosupresión severa como infección por el virus de inmunodeficiencia humana (VIH), pacientes con trasplante de órgano, hipo o agammaglobulinemia o en pacientes en hemodiálisis. De todas maneras, dada la especificidad tan alta de estos anti-cuerpos y con la disponibilidad de los estudios moleculares de ácido nucleico, ha decaído el uso de las pruebas diseñadas inicialmente como confirmatorias relacionadas con el ensayo recombinante por inmunoelectrotransferencia o inmunoblot (RIBA). El estudio de anticuerpos antihepatitis C está indicado como estudio inicial en todos los pacientes adultos con factores o conductas de riesgo asociadas (tabla 1). También existen pruebas rápidas que informan el resultado en 40 minutos, y este debe ser confirmado por la serología si es positivo (1, 2, 8, 9.) A diferencia de la hepatitis B, la inmunoglobulina M puede ser detectada en pacientes con infección por VHC aguda y crónica, por lo cual en este caso no sirve como marcador de la infección aguda y no es de uso clínico (2).
Técnicas moleculares confirman la presencia de infección activa, pueden ser cualitativas para detectar el ARN del VHC y cuantitativas para cuantificarlo. Actualmente, con la disponibilidad de las pruebas basadas en la reacción en cadena de la polimerasa (PCR) y la amplificación mediada por transcripción (TMA) altamente sensibles que detectan de 5-50 unidades internacionales por mililitro (UI/ml)no habría necesidad de pruebas cualitativas, que históricamente se consideraban más sensibles. En la actualidad todas tienen una especificidad mayor a 99% (2,8.) Las pruebas para detectar el ARN del VHC están indicadas en cada uno de los siguientes tipos de pacientes: con serología positiva, con indicación de tratamiento antiviral, con enfermedad hepática inexplicable cuya serología es negativa pero están inmunocomprometidos o sospechosos de una infección por VHC aguda. En 1997, la Organización Mundial de la Salud estableció el estándar internacional para que los reportes de los resultados sean en unidades internacionales y no en copias. Para efectos de seguimiento se recomienda usar la misma prueba de laboratorio antes y durante el tratamiento. En la actualidad están en desarrollo las pruebas que detectan nanopartículas hasta 1 ng/ml (2).
Genotipificación: útil en los estudios epidemiológicos, en el manejo clínico para predecir la probabilidad de respuesta a la terapia antiviral y determinar su duración óptima. Indicada en todas las personas infectadas por el VHC antes de iniciar tratamiento con interferón para planear la dosis, duración de la terapia y estimar la probabilidad de respuesta. De los 6 genotipos principales (y más de 90 subtipos) en que se ha clasificado el VHC el más prevalente en diferentes estudios realizados en Colombia es el genotipo 1 (subtipo 1b) y se estima que este subtipo 1b fue introducido en Bogotá alrededor de 1950 y se diseminó exponencialmente entre 1970 a 1990 probablemente debido a las transfusiones. Este subtipo 1b fue el más prevalente en el reporte de un estudio realizado en las muestras de tejido hepático de los pacientes infectados con enfermedad crónica avanzada, en el grupo de pacientes infectados con historia de transfusión y en 82,8% de las muestras de suero en las que se pudo genotipificar el VHC de pacientes donantes infectados. Los subtipos 1a y 3a más frecuentes en los drogadictos que se inyectan. En EE.UU. refieren que ocasionalmente no se puede realizar el genotipo en la muestra (menos de 5% de los casos), usualmente por bajos niveles de viremia, problemas en el paso de la amplificación de la PCR durante la técnica o extrema variabilidad en los nucleótidos dentro del genoma del VHC. En un estudio colombiano solo se pudo genotipificar en 26,6% y lo asociaron a depuración del virus, baja carga viral o almacenamiento prolongado de la muestra (8, 10-12).
EVALUACIÓN DEL GRADO DE LESIÓN HEPÁTICA
Es importante definir el grado de compromiso hepático para el pronóstico y guiar el tipo de tratamiento. La relevancia clínica está en determinar tanto la actividad necroinflamatoria (grado) como la fibrosis hepática (estadio) con implicación en la terapia antiviral y la detección de cirrosis que indica qué pacientes deben ser evaluados para monitorizar las complicaciones relacionadas con hipertensión portal y carcinoma hepatocelular.
La diferenciación entre aguda y crónica no es fácil, y la adecuada interpretación de las pruebas se debe relacionar en el contexto clínico con la presencia de síntomas o ictericia, historia previa de elevación de aminotransferasas y su duración. El diagnóstico de la hepatitis C aguda es difícil, en primer lugar porque por la misma historia natural de la enfermedad en esta etapa la mayoría de los pacientes son asintomáticos (50 a 90%), más aun en las formas anictéricas, donde las pruebas bioquímicas y marcadores serológicos no diferencian de manera contundente entre la forma aguda o crónica, especialmente si no se documenta la seroconversión, y la biopsia hepática no tiene indicación en esta etapa (7, 13, 14). Después de una exposición aguda a la infección, el ARN del virus puede ser detectado a la semana y los anticuerpos hasta la semana 8 a 12 (2, 8).
La biopsia hepática es el método tradicional para el diagnóstico de fibrosis hepática, aun cuando su utilidad es ampliamente debatida, especialmente por sus potenciales riesgos, variabilidad en la información suministrada y uso que ha disminuido notoriamente en la última década, es relevante por su importancia en el pronóstico. En la hepatitis C crónica la biopsia hepática es útil para tomar decisiones terapéuticas basadas en la estadificación de la enfermedad y para determinar el grado de actividad necroinflamatoria; evalúa el estadio en el cual se encuentra la enfermedad, siendo el punto de partida para determinar el inicio del tratamiento o diferirlo; más aún, teniendo en cuenta el costo, y los potenciales efectos adversos, permite valorar la probabilidad de respuesta a tratamiento y su posterior seguimiento (13, 15).
La biopsia también ayuda a descartar otras formas de enfermedad hepática o condiciones que alteren la historia natural de la enfermedad como por ejemplo esteatohepatitis, asociación con alcohol o hemocromatosis, entre otras; todas relevantes tanto para considerar decisiones terapéuticas como para establecer el comportamiento de la enfermedad (16, 17).
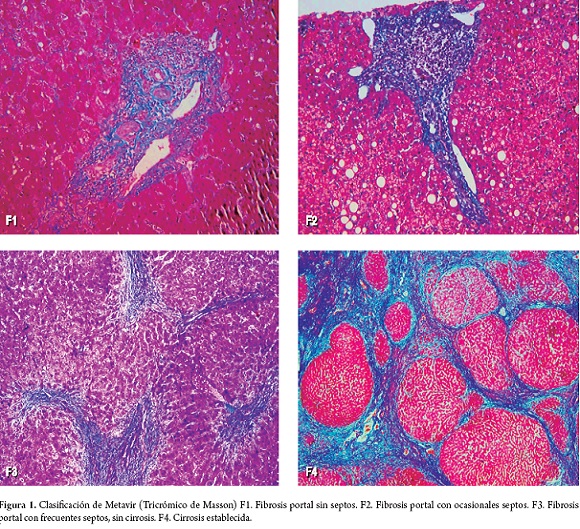
En la evaluación de la biopsia hepática existen varios sistemas de gradación y estadificación, como Scheuer, Batts, Ludwig, Ishak y METAVIR (Figura 1); cualquiera de ellos puede ser utilizado; sin embargo, es claro que todos presentan variabilidad inter e intraobservador y errores de muestreo o tamaño de la muestra, siendo ideal contar con centros de referencia con experiencia en la patología hepática (18, 19). El patrón de daño hepático es común a cualquier etiología de hepatitis crónica, siendo en la HVC el patrón necroinflamatorio, caracterizado por inflamación portal predominantemente de linfocitos, al igual que la hepatitis de interfase o periportal asociada a necrosis o apoptosis hepatocitaria, estos se acompañan de cambios lobulillares como son la inflamación o hepatitis lobulillar con necrosis aislada o confluente, todos estos hallazgos morfológicos se presentan en grados variables de severidad. En la HVC se ha descrito la clásica triada de inflamación nodular por la formación de cúmulos o folículos linfoides, lesión ductal con preservación de la membrana basal, condensaciones citoplasmáticas que semejan cuerpos de Mallory y esteatosis, esta última presente en cerca de 80% de los casos de hepatitis C crónica genotipo 3 y hasta en 50% de otros genotipos. Estos hallazgos no son cambios patognomónicos y deben ser interpretados dentro del contexto clínico adecuado (20). La progresiva activación de las células esteladas y de los miofibroblastos favorece el inicio y progresión de la fibrosis a nivel portal y periportal, con posterior formación de nódulos regenerativos y puentes fibrosos porta-porta, porta-centrales hasta la cirrosis (18, 19).
En muchas publicaciones, el grado de fibrosis o estadio de la enfermedad es considerado un predictor independiente de respuesta al tratamiento, considerando que los pacientes que tienen poca fibrosis responden mejor al tratamiento que aquellos con fibrosis avanzada. Aun cuando es bien sabido que pacientes con niveles elevados de transaminasas pueden tener mayor daño hepático y fibrosis, hasta 25% de pacientes con transaminasas normales tienen fibrosis importante y pueden ser candidatos a terapia antiviral siendo la biopsia un método indicador de progresión de la enfermedad. Otra de las recomendaciones para la biopsia temprana es en pacientes sobre HVC genotipo 1, ya que se sabe que los genotipos 2 y 3 tienen mejor respuesta al tratamiento, y para algunos grupos la biopsia solo sería útil para controlar la progresión de la enfermedad (13). En promedio se necesitan 20 años para llegar hasta la cirrosis y menos de 5% de los pacientes desarrollan hepatocarcinoma en un lapso de 30 años (17). La biopsia hepática no siempre es necesaria para el inicio de un tratamiento, un análisis cuidadoso de cada caso determinará la necesidad de esta y sin importar cuál sea el sistema de gradación utilizado debe establecerse tanto el grado de actividad necroinflamatoria como de la fibrosis presente.
Recientemente, la posibilidad de detectar eficientemente el virus, su genotipo y carga viral, ha disminuido el uso de la biopsia hepática como prueba diagnóstica en la HVC. Como alternativa útil a la biopsia hepática están indicadas las técnicas no invasivas que permiten establecer información respecto a la presencia y extensión de la fibrosis. La fibrosis se puede medir con un enfoque o método biológico que cuantifica biomarcadores en una muestra de suero o basados en un enfoque físico que mide las características físicas del hígado como la elasticidad o rigidez del mismo. Son complementarios y obedecen a planteamientos diferentes.
Marcadores de fibrosis hepática en el suero: son los biomarcadores directos que reflejan el depósito o remoción de la llamada matriz extracelular en el hígado que incluyen entre muchos a glicoproteínas, colágenos y sus inhibidores. Y los llamados marcadores indirectos que indican alteración en la función hepática como los índices relacionados con aminotransferasas, bilirrubinas, protrombina y recuento de plaquetas. El resultado de su combinación se aplica en los estudios más ampliamente usados y validados como el APRI y el Fibrotest, además de otros como Fibrospect II, Hepascore, Fibroindex, y Fibrometer.
Medición de la rigidez hepática: como la fibroelastografía transitoria con ultrasonido (FET Fibroscan, Echosens), elastografía utilizando radiación acústica y resonancia. Hay evidencia de la utilidad de estrategias que combinan la aplicación de dos marcadores séricos, o la elastografía transitoria y marcadores séricos para aumentar la precisión diagnóstica (21).
Las pruebas no invasivas de laboratorio y de radiología son útiles y complementarias en la evaluación de la fibrosis y numerosos estudios validan sus hallazgos (21-24). Para el diagnóstico de fibrosis significativa, el rendimiento de la FET y los biomarcadores séricos (Fibrotest, Fibrometer y Hepascore) son equivalentes y recientemente las guías de España y Francia sobre HVC crónica (25, 26), recomiendan las pruebas no invasivas como primera línea, en la evaluación de fibrosis en estos pacientes. Para el diagnóstico
de cirrosis, la FET parece ser un método más confiable, cuando se compara con los biomarcadores séricos o las pruebas sanguíneas rutinarias (23). Las pruebas no invasivas de laboratorio y de radiología son muy útiles, particularmente en la evaluación de los dos extremos del espectro de la fibrosis (fibrosis mínima y cirrosis.) Con este cambio de paradigma, se ha planteado que podría reducirse el número de biopsias hepáticas en 50%, para el diagnóstico de fibrosis significativa y en 70% para cirrosis (27).
REFERENCIAS
1. Mack CL, Gonzalez-Peralta RP, Gupta N, Leung D, Narkewicz MR, Roberts EA, Rosenthal P, Schwarz KB; North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition. NASPGHAN practice guidelines: Diagnosis and management of hepatitis C infection in infants, children, and adolescents. J Pediatr Gastroenterol Nutr 2012; 54(6): 838-55.
2.Kamili S, Drobeniuc J, Araujo AC, Hayden TM. Laboratory diagnostics for hepatitis C virus infection. Clin Infect Dis 2012; 55 Suppl 1: S43-8.
3. Sacks-Davis R, VAN Gemert C, Bergeri I, Stoove M, Hellard M. Identifying newly acquired cases of hepatitis C using surveillance: a literature review. Epidemiol Infect 2012; 140(11): 1925-34.
3. Smith BD, Morgan RL, Beckett GA, Falck-Ytter Y, Holtzman D, Teo CG, Jewett A,Baack B, Rein DB, Patel N, Alter M, Yartel A, Ward JW; Centers for Disease Control and Prevention. Recommendations for the identification of chronic hepatitis C virus infection among persons born during 1945-1965. MMWR Recomm Rep 2012; 61(RR-4): 1-32.
5. Rein DB, Smith BD, Wittenborn JS, Lesesne SB, Wagner LD, Roblin DW, Patel N, Ward JW, Weinbaum CM. The cost-effectiveness of birth-cohort screening for hepatitis C antibody in U.S. primary care settings. Ann Intern Med 2012; 156(4): 263-70.
6. Ward JW. The epidemiology of chronic hepatitis C and onetime hepatitis C virus testing of persons born during 1945 to 1965 in the United States. Clin Liver Dis 2013; 17(1): 1-11.
7. European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of hepatitis C virus infection. J Hepatol 2011; 55(2): 245-64.
8. Ghany MG, Strader DB, Thomas DL, Seeff LB; American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C: an update. Hepatology 2009; 49(4): 1335-74.
9. Beltrán M, Navas M, De la Hoz F, Muñoz M, Jaramillo S, Estrada C, Cortés L, Arbeláez M, Donado J, Barco G, Luna M, Uribe G, de Maldonado A, Restrepo J, Correa G, Borda P, Rey G, de Neira M, Estrada A, Yepes S, Beltrán O, Pacheco J, Villegas I, Boshell J. Hepatitis C virus seroprevalence in multi-transfused patients in Colombia. J Clin Virol 2005; 34 Suppl 2: S33-8.
di Filippo D, Cortes-Mancera F, Beltran M, Arbeláez MP, Jaramillo S, Restrepo JC, Correa G, Navas MC. Molecular characterization of hepatitis c virus in multi-transfused Colombian patients. Virol J 2012; 9(1): 242.
11. ALEH Latin American Association for the Study of the Liver. Practice Guidelines: Diagnosis, management, and treatment of hepatitis C. Ann Hepatol 2010; 9: 8-26.
12. Mora MV, Romano CM, Gomes-Gouvea MS, Gutiérrez MF, Carrilho FJ, Pinho JR. Molecular characterization, distribution, and dynamics of hepatitis C virus genotypes in blood donors in Colombia. J Med Virol 2010; 82(11): 1889-98.
13. Strader DB, Wright T, Thomas DL, Seeff LB; American Association for the Study of Liver Diseases. Diagnosis, management, and treatment of hepatitis C. Hepatology 2004; 39(4): 1147-71.
14. Blackard JT, Shata MT, Shire NJ, Sherman KE. Acute hepatitis C virus infection: a chronic problem. Hepatology 2008; 47(1): 321-31.
15. Amorim TG, Staub GJ, Lazzarotto C, Silva AP, Manes J, Ferronato M, Shiozawa MB, Narciso-Schiavon JL, DantasCorrea EB, Schiavon L. Validation and comparison of simple noninvasive models for the prediction of liver fibrosis in chronic hepatitis C. Ann Hepatol 2012; 11(6): 855-61.
16. Fiel MI. Pathology of chronic hepatitis B and chronic hepatitis C. Clin Liver Dis 2010; 14(4): 555-75.
17. Dienstag JL. The role of liver biopsy in chronic hepatitis C. Hepatology 2002; 36(5 Suppl. 1): S152-60.
18. Guido M, Mangia A, Faa G; Gruppo Italiano Patologi Apparato Digerente (GIPAD); Societa Italiana di Anatomia Patologica e Citopatologia Diagnostica/International Academy of Pathology, Italian division (SIAPEC/IAP). Chronic viral hepatitis: the histology report. Dig Liver Dis 2011; 43 Suppl 4: S331-43.
19. Lefkowitch JH. Liver biopsy assessment in chronic hepatitis. Arch Med Res 2007; 38(6): 634-43.
20. Asselah T, Rubbia-Brandt L, Marcellin P, Negro F. Steatosis in chronic hepatitis C: why does it really matter? Gut 2006; 55(1): 123-30.
21. Castera L. Noninvasive methods to assess liver disease in patients with hepatitis B or C. Gastroenterology 2012; 142(6): 1293-1302.
22. Myers RP, Ramji A, Bilodeau M, Wong S, Feld JJ. An update on the management of hepatitis C: consensus guidelines from the Canadian Association for the Study of the Liver. Can J Gastroenterol 2012; 26(6): 359-75.
23. Castera L, Pinzani M. Biopsy and non-invasive methods for the diagnosis of liver fibrosis: does it take two to tango? Gut 2010; 59(7): 861-866.
24. Castera L, Vergniol J, Foucher J, et al. Prospective comparison of transient elastography, Fibrotest, APRI and livr biopsy for the assessment of fibrosis in chronic hepatitis C. Gastroenterol 2005; 128: 343-350.
25. Leroy V, Serfaty L, Bourliery M, et al. Protease inhibitorbased triple therapy in chronic hepatitis C: Guidelines by the French association for the study of the liver. Liver International 2012; 1-16.
26. Grupo de expertos. Ministerio de Sanidad. Gobierno de España. Tratamiento de la Hepatitis C crónica. Criterios y recomendaciones generales para el tratamiento con boceprevir y telaprevir en pacientes mono-infectados. 2012.
27. Castera L, Sebastiani G, et al. Prospective comparison of two algorithms combining non-invasive methods for staging liver fibrosis in chronic hepatitis. J Hepatol 2010; 52: 191-8.