Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO -
 Access statistics
Access statistics
Related links
-
 Cited by Google
Cited by Google -
 Similars in
SciELO
Similars in
SciELO -
 Similars in Google
Similars in Google
Share
Revista colombiana de Gastroenterología
Print version ISSN 0120-9957
Rev Col Gastroenterol vol.27 supl.2 Bogotá Dec. 2012
V. Tratamiento
C. Esquemas de tratamiento
Oscar Beltrán Galvis MD. (1), Mónica Tapias, MD. (2), Víctor Idrovo, MD. (3)
(1) Internista, Gastroenterólogo y Hepatólogo. UIS y Universidad Nacional de Colombia. Grupo de Hepatología y Trasplante, Fundación Cardio Infantil. Bogotá, Colombia.
(2) Internista y Hepatóloga. Servicio de Hepatología y Trasplante hepático, Hospital Universitario Fundación Santa Fe de Bogotá. Bogotá, Colombia.
(3) Gastroenterólogo, Hepatólogo Clínico y de Trasplante, Hospital Universitario Fundación Santa Fe de Bogotá. Bogotá, Colombia.
ESQUEMAS DE TRATAMIENTO
Genotipo 1
El objetivo del tratamiento es la erradicación del virus C, determinado por la respuesta virológica sostenida (RVS), definida por RNA viral VHC negativo, 6 meses después de terminado el tratamiento. Los nuevos antivirales de acción directa, boceprevir (BOC) y telaprevir (TPV) han sido aprobados por la FDA (Food and Drug Administration) de Estados Unidos y EMA (European Medicines Agency) de la Comunidad Europea combinados con interferón pegilado y ribavirina para el tratamiento de los pacientes con hepatitis C crónica.
El virus de la hepatitis C posee una enzima que es indispensable para el clivaje de una proteína, y así la posterior activación de la polimerasa. Esta proteasa es la serino proteasa 3/4A (NS53/4A) que al activarse inicia la replicación del RNA del virus C. El BOC y TPV inhiben la replicación viral a través de la inhibición de esta proteína no estructural, inhibiendo la replicación viral tanto en pacientes naive como en pacientes con falla previa de tratamiento (1).
Factores asociados con respuesta al tratamiento
Previo a iniciar el tratamiento, es posible predecir cuáles pacientes son más probable que respondan al tratamiento y cuáles no. En genotipo 1, 67-75% pueden ser curados, 38-46% con terapia dual (Peg interferón más ribavirina), adicionalmente 23-31% con el uso de inhibidores de proteasa (IP), mientras que 25% todavía no responderán a los nuevos tratamientos.
En un futuro, estos factores pueden orientarnos para identificar grupos en quienes puede ser más costo-efectivo tratarlos y no exponer algunos pacientes a eventos adversos, innecesariamente. Igualmente, en la terapia dual, un subgrupo de pacientes con respuesta virológica rápida (negativización de la carga viral VHC a las 4 semanas) podría no ofrecerse un beneficio adicional al agregar un IP (2, 3).
Factores que reducen la posibilidad de RVS, con la terapia triple con IP
Mayores:
- RNA VHC elevado (> 800.000 ui/ml en la mayoría de los estudios)
- Fibrosis avanzada o cirrosis
- Genotipo IL-28 B adverso ( CT/TT)
- En pacientes con falla de tratamiento previo, respondedores nulos
- Al inicio del tratamiento con peginterferón + ribavirina únicamente (Lead-in), una reducción de < 1 log 10 (10 veces) del RNA VHC, después de 4 semanas de tratamiento.
Menores:
- Edad (> 40-45 años)
- Raza (afroamericanos vs. no afroamericano
- índice de masa corporal > 30
- Diabetes mellitus tipo 2
- Genotipo 1 a
- En pacientes con falla de tratamiento previo, respuesta parcial.
MONITOREO DE LA CARGA VIRAL
La respuesta guiada por la terapia (RGT) establece la duración de la terapia de acuerdo a dos factores (tabla 1):
La negativización de la carga viral durante el tratamiento.
Los patrones de respuesta virológica en tratamientos previos con terapia dual (Peg-IFN + ribavirina).
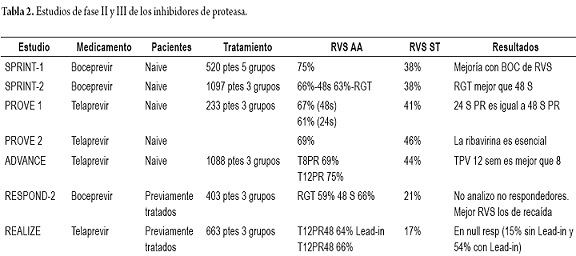
Estudios fase II y III de los inhibidores de proteasas
Se presenta un resumen de los datos clínicos de los estudios de registro para boceprevir y telaprevir, tanto en pacientes naive como en pacientes con falla previa de tratamiento (3) (tabla 2).
Dosis de peginterferón más ribavirina
Hay dos peginterferones para el tratamiento del VHC (peginterferón alfa-2a y peginterferón alfa-2b). Las dosis para las dos preparaciones son:
- Peginterferón alfa-2a: 180 mcg subcutáneo por semana
- Peginterferón alfa-2b: 1,5 mcg/kg subcutáneo por semana.
Para pacientes con genotipo 1, la ribavirina es dosificada de acuerdo al peso y administrada 2 veces por día:
- Para pacientes que reciben peginterferón alfa-2 a, la dosis de ribavirina es 1.000 mg para pacientes con peso de 75 kg y 1.200 mg para pacientes con peso > 75 kg.
- Para pacientes que reciben peginterferón alfa-2b, la dosis de ribavirina es 800 mg para < 65 kg, 1.000 mg para 65-85 kg, 1.200 mg para 85-105 kg y 1.400 mg para > 105 kg.
REGíMENES DE TRATAMIENTO (4, 5)
Terapia triple con telaprevir
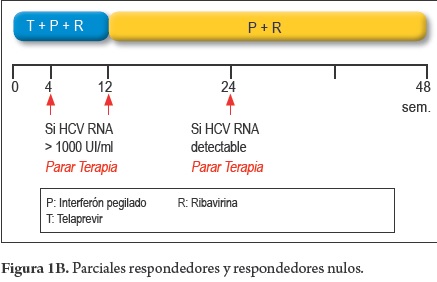
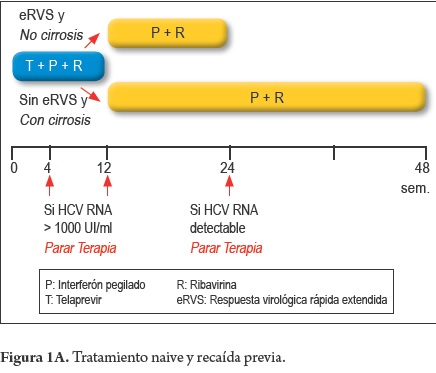
Pacientes nuevos o naive y con recaída (figura 1A)
- Pacientes con cirrosis y RVR e
12 Sem. TPV + PEG-INF + RBV + 12 Sem. PEGâINF + RBV
- Pacientes sin cirrosis sin RVR e
12 Sem TPV + PEG-INF + RBV + 36 Sem PEG-INF + RBV
Previos respondedores parciales y nulos (figura 1B)
12 Sem TPV + PEG-INF + RBV
36 Sem PEG-INF + RBV
Terapia triple con boceprevir
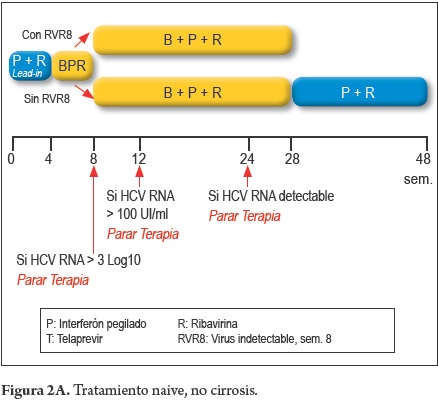
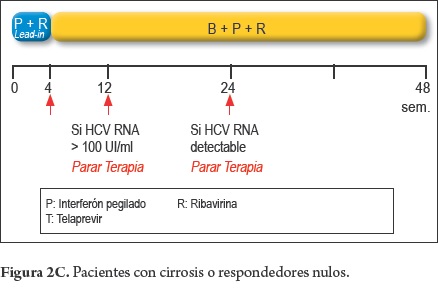
Tratamiento en pacientes naive (figura 2A y 2C)
- Pacientes sin cirrosis con RVR 8 (Respondedor temprano)
4 Sem. PEG-INF+RBV (Lead-in) +24 Sem. BOC + PEG-INF + RBV
- Pacientes sin cirrosis sin RVR8 (Respondedores tardíos)
4 Sem PEG-INF + RBV (Lead-in)+ 24 Sem BOC + PEG-INF + RBV + 20 Sem PEG-INF + RBV
- Pacientes con cirrosis
4 Sem PEG-INF + RBV (Lead-in) + 44 Sem BOC + PEG-INF + RBV
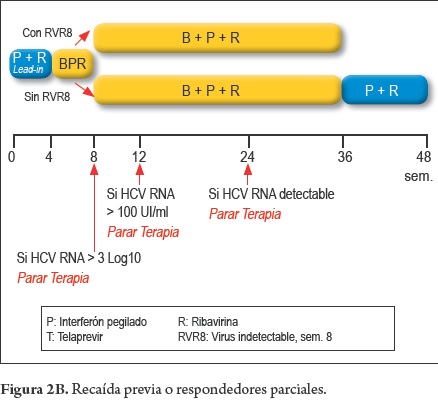
Pacientes con previa recaída o parcial respondedores(figura 2B y 2C)
- Pacientes sin cirrosis con RVR8 (respondedor temprano)
4 Sem PEG-INF + RBV (Lead-in) + 32 Sem BOC + PEG-INF + RBV
- Pacientes sin cirrosis sin RVR8 (respondedor tardío)
4 Sem PEG-INF + RBV (Lead-in)+ 32 Sem BOC + PEG-INF + RBV + 12 Sem. PEG-INF + RBV
- Pacientes con cirrosis
4 Sem PEG-INF + RBV (Lead-in)
44 Sem BOC + PEG-INF + RBV
ALGORITMO DE TRATAMIENTO
De acuerdo a las guías del Ministerio de Salud Español, en todo paciente con hepatitis C crónica, en quien se contemple la posibilidad de un tratamiento antiviral, debe realizarse la siguiente investigación, sistemáticamente (6):
1. Determinación del genotipo del virus y de la carga viral
2. Estimar el grado de fibrosis hepática del paciente a través de:
- Biopsia hepática reciente, aplicando un sistema de puntuación de fibrosis (Metavir, Scheuer u otros).
- Fibroelastografia transitoria, considerando que hay fibrosis significativa (equivalente a F2 o más), a partir de un valor de 7,6 kilopascales.
- The French National Autorithy for Health (HAS) ha validado el uso de otros estudios no invasivos para fibrosis hepática: Fibrotest, Hepascore, Fibrometer (5).
3. Determinar el polimorfismo de la IL 28 B (no disponible en nuestro país).
4. Clasificar a los pacientes con hepatitis C crónica en pacientes naive o con falla al tratamiento con Peg-INF + RBV y tratar de estimar el tipo de respuesta de la cinética viral en el tratamiento previo.
El algoritmo propuesto por el Ministerio Español de Sanidad (6), con algunas modificaciones, se plantea como una guía para el tratamiento de los pacientes con hepatitis C crónica en nuestro país (figura 3).
RECOMENDACIONES SOBRE LOS ESQUEMAS DE TRATAMIENTO CON BOCEPREVIR Y TELAPREVIR (2, 5, 6)
1. Pacientes naive que pueden ser tratados con peginterferón más ribavirina
- Pacientes con genotipo IL28 B homocigotos CC y con fibrosis ⤠F2, la posibilidad de RVS es de 80% con la terapia dual peginterferón más ribavirina. Si no hay RVR a las 4 semanas, debe continuarse con triple terapia, porque con terapia dual, la respuesta desciende a 60%.
- En pacientes con carga viral baja (< 400.000 ui/ml) y fibrosis leve con RVR, un tratamiento con terapia dual por 24 semanas puede lograr RVS en 90% de los casos.
Un estudio retrospectivo Fase II, sugiere que en pacientes con IL28B CC, la terapia acortada con TPV por 12 semanas puede lograr RVS, en vez de 24 semanas. Se necesitan estudios prospectivos con mayor número de pacientes.
2. Terapia triple de corta duración:
- Los estudios con terapia triple, muestran que cuando se logra eRVR (virus C indetectable a las 4 semanas TPV y a las 8 semanas BOC) la posibilidad de RVS es de 90% con la terapia acortada (24 semanas en TPV y 28 semanas en BOC).
- La presencia de severa fibrosis (F3 ó F4), sin embargo, disminuye la posibilidad de RVS con terapia acortada, por tanto, se recomienda en estos casos la terapia por 48 semanas. En el estudio con TPV, en cirrosis, la RVS fue de 61% con terapia acortada y de 92% con 48 semanas. En BOC, en F3 y F4, en pacientes con eRVR, la RVS fue de 75% con 24 semanas y de 92% con 48 semanas.
- En pacientes en TPV con ⤠F2, 8 semanas de tratamiento con TPV tienen la misma RVS que 12 semanas de tratamiento. En presencia de eventos adversos serios, se podría considerar acortar la terapia, sin comprometer la respuesta virológica sostenida.
3. Impacto de la terapia Lead-in:
- La terapia Lead-in puede predecir la respuesta a la terapia triple (sensibilidad al interferón), aunque no reemplaza el perfil de respuesta virológica a un previo tratamiento. Cuando no se conoce el perfil de respuesta previo, en un paciente con falla de tratamiento a la terapia dual, nos orienta sobre la tolerancia a la terapia con peginterferón + ribavirina, especialmente en relación con la toxicidad hematológica.
- En pacientes naive, la terapia Lead-in (4 semanas con peginterferón mas ribavirina, buscando disminuir mas de 10 veces la carga viral -1 log UI/ml) en pacientes con BOC, no aumenta la RVS, pero identifica a aquellos pacientes que pueden requerir un tratamiento acortado de 28 semanas. En pacientes naive con TPV, la terapia Lead-in no ha sido evaluada.
- En pacientes con falla previa al tratamiento con terapia dual, recibiendo BOC, la fase de Lead-in permite identificar a los pacientes que pueden recibir esquema basado en RGT (respuesta guiada por terapia) o en pacientes que son elegibles para tratamiento de duración fija (si no hay lead-in con descenso > 1 log UI/ml), requieren tratamiento por 48 semanas).
- En pacientes con TPV, con falla previa a tratamiento dual, la fase de lead-in no predijo RVS y emergencia de resistencia, pero en pacientes respondedores nulos, la fase de Lead-in fue un factor predictor de RVS (54%) cuando hubo un descenso de > 1 log UI/ml y únicamente de 15% con un lead-in < 1 log UI /ml.
4. Monitoreo viral de la triple terapia:
- El esquema del tratamiento para BOC y TPV depende de los factores predictivos de respuesta (especialmente el grado de fibrosis), si es o no paciente naive y de la cinética viral durante el tratamiento.
- El monitoreo de la eficacia de tratamiento, se basa en la medición repetida de la carga viral del VHC como se muestra en los esquemas de tratamiento. Debe usarse un método sensible, PCR en real-time, con un umbral de cuantificación (25 UI/ml) y un límite de detección < 10 UI/ml.
- Las reglas de parada para TPV y BOC, se deben seguir estrictamente, como está señalado en las figuras 1 y 2. Las guías de la Sociedad francesa de hígado, recientemente propusieron una medición de carga viral adicional a las 2 semanas de iniciado el tratamiento para el esquema con TPV y a las 6 semanas para BOC, para detectar tempranamente el fenómeno de breakthrough (recaída en tratamiento). Esta recomendación está pendiente de evaluación (5).
Una medición adicional de carga viral debería realizarse 4 semanas después de la suspensión del inhibidor de proteasa, para detectar tempranamente un fenómeno de breakthrough.
- Aunque no hay consenso, debería realizarse una medición de la carga viral del VHC mensual, hasta que el paciente sea indetectable.
5. Monitoreo de la adherencia al tratamiento:
- La dosis de BOC es 800 mg cada 7-9 horas (12 cápsulas de 200 mg por día), tomadas con las comidas.
- La dosis recomendada de TPV es 750 mg cada 8 horas (6 cápsulas por día), para ser tomadas con 20 gr de grasa aproximadamente en cada comida.
- La dosis de Los IP no puede ser reducida, porque aumenta la posibilidad de emergencia de cepas resistentes y falla terapéutica.
El estudio OPTIMIZE presentado en el ASSLD en 2012 con 740 pacientes, mostró que el telaprevir se puede dosificar a 1.125 mg (3 cápsulas) cada 12 horas más peginterferón más ribavirina, sin comprometer la RVS. Esta recomendación no ha sido aprobada aún por la FDA (9).
6. Reglas de parada o stopping rules.
Telaprevir
- Parar la terapia triple, si RNA VHC > de 1.000 UI/ml a la semana 4 ó a la semana 12 de tratamiento.
- Parar la terapia, si el RNA VHC es detectable a la semana 24 del tratamiento.
- Parar la terapia, si el RNA VHC siendo previamente negativo, se torna detectable durante el tratamiento.
- Considerar parar la terapia en paciente con cirrosis, respondedores nulos, con Lead-in < 1 log, por tener una posibilidad de RVS menor a 15%.
Boceprevir
- Considerar la terapia en pacientes con cirrosis y Lead-in < 1 log UI/ ml), por la posibilidad de lograr RVS en 13-25%.
- Parar la terapia, si a la semana 8 de tratamiento, la carga viral (RNA VHC) no desciende más de 3 log.
- Parar la terapia, si el RNA VHC es > de 100 UI/ml a la semana 12 de tratamiento.
Parar la terapia, si el RNA VHC es detectable a la semana 24 de tratamiento.
- Parar la terapia, si el RNA VHC, siendo previamente negativo, se torna detectable, durante el tratamiento.
PACIENTES CON GENOTIPO 1 (2-4)
Los datos son limitados con relación al uso de antivirales de acción directa en pacientes con hepatitis C crónica con genotipo diferente del 1. Un estudio con 20 pacientes sugirió eficacia del telaprevir en genotipo 2 pero actualmente ni el BOC ni el TPV deben ser usados en pacientes con genotipo no 1. El tratamiento recomendado es la terapia dual con peginterferón más ribavirina (7).
Peginterferón
- Peginterferón alfa 2a, 180 mcg subcutáneo por semana
- Peg-Interferón alfa 2b, 1,5 mcg/kg subcutáneo por semana.
Ribavirina
Genotipo 2 y 3
Ribavirina 400 mg cada 12 horas (no dar dosis por peso).
Esquema de tratamiento
Duración del tratamiento 24 semanas.
Genotipo 4 (Ribavirina, dosis de acuerdo al peso)
- Peginterferón alfa 2a (ribavirina 1.000 mg < 75 kg, 1.200 mg si > 75 kg
- Peg Interferón alfa 2b (ribavirina 800 mg < 65 kg; 1.000 mg, 75-85 kg; 1.200 mg si 85-105 kg y > 105 kg, 1.400 mg.
Esquema de tratamiento
- Duración de tratamiento, 48 semanas.
- Suspender el tratamiento si no hay descenso de más de 2 log10 RNA VHC, a la semana 12.
- Pacientes con descenso de más de 2 log10 del RNA VHC, si es detectable a la semana 12, debe evaluarse el RNA VHC a la semana 24, si es detectable, suspender el tratamiento.
HEPATITIS C AGUDA
Monoinfeccion
No hay una conducta definida por limitada evidencia. El riesgo de desarrollar infección crónica después de un episodio de hepatitis C aguda es de 80% (8).
Opción 1
Si el paciente desea el tratamiento tempranamente o tiene factores predictores negativos de aclaramiento del virus (genotipo 1, ausencia de IL28 B CC, asintomático, carga viral > 800.000 UI/ml) monoterapia con interferón pegilado alfa 2a o alfa 2b semanal por 24 semanas. RVS 90%.
Opción 2
- Observación por 8 a 12 semanas desde el diagnóstico. Espontáneo aclaramiento 20% y en mujeres jóvenes 50%.
- Si a la semana 12, RNA VHC es indetectable, seguimiento por 1 año con RNA VHC con RNA VHC cada 3 meses. Si hay recaída, tratamiento con peginterferón más ribavirina o terapia triple si es genotipo 1.
- Si a la semana 8 para genotipo 1 o a la semana 12 para genotipo 2, 3, el RNA es detectable, terapia con peginterferón por 12 ó 24 semanas dependiendo del genotipo (1: 24 semanas). El uso de ribavirina no aumenta la respuesta virológica. Algunos expertos recomiendan agregar ribavirina, si hay virus detectable a las 4 semanas de tratamiento.
PD. Agradecimientos por las gráficas al doctor RC Botero y Julián Beltrán.
REFERENCIAS
1. EASL. Clinical practice Guideline. Management of hepatitis C infection. J Hepatol 2011; 55145-64.
2. Ghany MG, Nelson Dr, Strader DB, et al. An update on treatment of Genotype 1 chronic hepatitis C virus infection. 2011 Practice guidelines by American Association for the Study of Liver Disease. Hepatology 2011; 54: 1433-44.
3. Ramachandran P, Fraser A, Agarwal K, et al. UK Consensus guidelines for the use of the protease inhibitors boceprevir and telaprevir in genotype 1 chronic hepatitis C infected patients. Aliment pharmacol ther 2012; 35: 647-662.
4. Moradpour D, Mullhaupt B. Swiss Association for Study of liver. Treatment of chronic hepatitis C genotype 1 with triple therapy comprising telaprevir or boceprevir. The European Journal of Medical Sciences. Swiss Med Wkly 2012; 142: 13516.
5. Leroy V, Serfaty L, Bourliery M, et al Protease inhibitorbased triple therapy in chronic hepatitis C: Guidelines by the French association for the study of the liver. Liver International 2012; 1-16.
6. Grupo de expertos. Ministerio de Sanidad. Gobierno de España. Tratamiento de la hepatitis C crónica. Criterios y recomendaciones generales para el tratamiento con Boceprevir y telaprevir en pacientes Mono-infectados 2012.
7. Chopra S. Antiviral therapy for chronic hepatitis C genotype 2, 3 and 4. 2012 Up to date.
8. Lorenz R. Endres S. Clinical manifestations, diagnosis and treatment of acute hepatitis in adults. 2012 Up to date.
9. Feld J, Nelson D, Zeuzen S. Updates in viral hepatitis from AASLD 2012. 2012 Clinical Care Options, LLC, January 9, 2013.